
中国海洋湖沼学会主办。
文章信息
- 周百灵, 维妙, 李菊, 赵峰, 徐奎栋. 2016.
- ZHOU Bai-Ling, WEI Miao, LI Ju, ZHAO Feng, XU Kui-Dong. 2016.
- 黄海底栖纤毛虫的群落结构与时空变化
- COMMUNITY STRUCTURE AND SPATIOTEMPORAL VARIATION OF BENTHIC CILIATES IN THE YELLOW SEA
- 海洋与湖沼, 47(2): 336-345
- Oceanologia et Limnologia Sinica, 47(2): 336-345.
- http://dx.doi.org/10.11693/hyhz20150400115
-
文章历史
- 收稿日期:2015-04-16
- 改回日期:2015-07-10
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
底栖纤毛虫是底栖微食物网的重要组成部分,将物质和能量从pico-级和nano-级生物传递到小型后生动物(类彦立等,2008)。但由于从泥沙中提取纤毛虫并对其进行定性和定量研究存在技术方面的困难,对于底栖纤毛虫的生态学研究明显滞后于浮游纤毛虫。随着密度梯度离心结合定量蛋白银染色方法的提出(Wickham et al,2000; Xu et al,2010),国际上关于底栖纤毛虫的生态学研究逐渐增加(Hamels et al,2004;2005; Lei et al,2014),但绝大部分关注的是潮间带生境。国内关于底栖纤毛虫的生态学研究并不多(Du et al,2012; 孟昭翠等,2013),仅Meng等(2012)对黄海夏初的底栖纤毛虫进行了报道。
黄海冷水团是黄海的一种独特的水文现象,7-8月为冷水团的鼎盛时期,秋季冷水团衰消(于非等,2006)。目前,尚没有对秋季黄海底栖纤毛虫的报道。本文对2010年7月和11月黄海底栖纤毛虫的丰度、生物量和分布进行研究,为以后进一步的研究提供背景资料。此外,2010年夏季黄海发生了浒苔(Ulva prolifera)暴发,浒苔可以对近岸小型底栖动物产生抑制(吴秀芹等,2010)。本研究也试图探寻浒苔对底栖纤毛虫及底栖生境的影响。
1 材料与方法 1.1 调查海域和样品采集本研究于2010年7月10-17日(夏季)和2010年11月20-30日(秋季)分别搭载“科学三号”考察船对黄海海域(31.5°-39°N,119.5°-125°E)的沉积物进行了采样。7月的航次成功获得28个站位底栖纤毛虫和环境因子样品,11月航次成功获得30个站位的样品(图 1)。
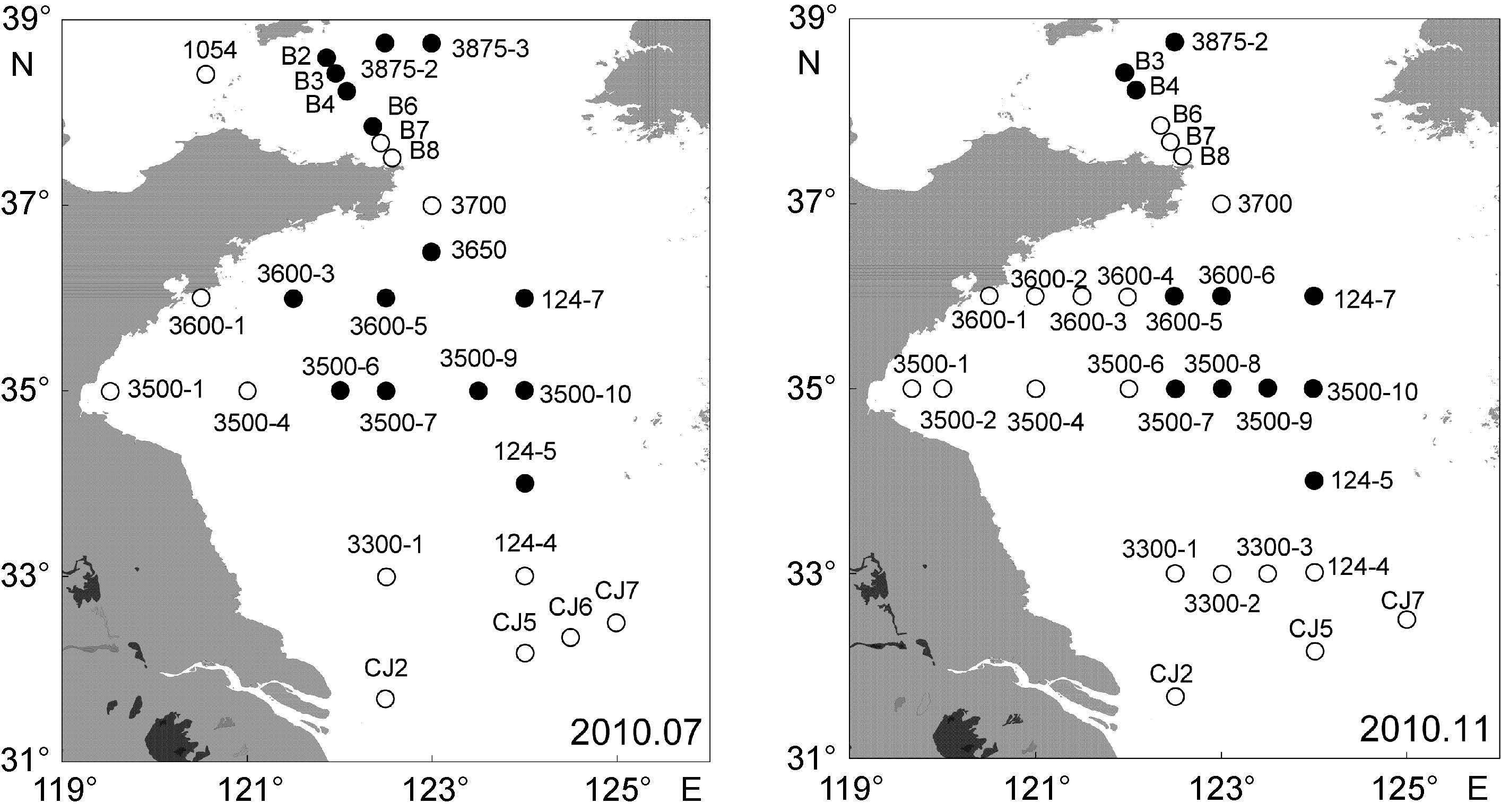 |
| 图 1 2010年7月和11月采样站位图 Fig. 1 Sampling stations in July and November 2010 |
在每一站位用0.1m2改进型Gray-Ohara箱式采泥器采集3箱未扰动沉积物样品,使用注射器改造的采样管(内径为1.6cm)随机采集4个5cm长芯样,每2个芯样按0-2cm、2-5cm分层合并分别移入50mL离心管中,加入用过滤海水(滤膜孔径0.22μm)配制的2%冷戊二醛至40mL进行固定。从离心管中各取20mL按照分层合并共计40mL,4℃避光保存用于纤毛虫分析。另外,用相同方式再采集芯样4个,相应分层合并后,分别装入封口袋,于-20℃冷冻保存,用于沉积物粒度、叶绿素a、脱镁叶绿素a和有机质测定。
1.2 样品及环境因子分析方法水深、底层水温度和盐度数据由随船温盐深测定仪(CTD)现场测定。使用Cilas(940L)型激光粒度仪测定沉积物粒度。使用Turner II荧光光度计测定叶绿素a和脱镁叶绿素a含量。使用元素分析仪Vario Macro Cube(Elementar,Germany)测定有机碳含量,有机碳含量乘以系数1.724得到有机质含量(Laird et al,1994)。
使用Ludox-QPS染色方法分析沉积物中的纤毛虫(Xu et al,2010),主要步骤为: Ludox密度梯度离心提取,定量蛋白银染色(QPS),制片,镜检,对纤毛虫进行鉴定和计数。生物量通过生物体积换算法和相应转换系数进行计算(类彦立等,2011)。依据有关文献及镜检中对纤毛虫食物泡的观察,将纤毛虫分为四种食性: 藻食性,菌食性,肉食性和杂食性。使用Jaccard相似系数分析群落间的相似性,计算公式为: J=c/(a+b-c),J为相似系数,a、b、c分别为a地物种数、b地物种数和a、b两地共有物种数; J值在0-0.25为极不相似,在0.25-0.5为中等不相似,在0.5-0.75为中等相似,在0.75-1为极为相似(马克平等,1995)。
1.3 数据统计分析使用Surfer 11绘制站位图、环境因子和纤毛虫多样性分布图,使用ArcGIS绘制纤毛虫类群和食性分布图,使用Excel绘制条形图。使用SPSS 19.0统计软件进行T检验,并对纤毛虫丰度、生物量、多样性指数和环境因子进行相关分析。因生物量数据较丰度数据更能代表纤毛虫在生态系统中的作用,故使用PRIMER 6软件包中的CLUSTER分析各研究站位纤毛虫生物量的等级聚类; 使用ANOSIM分析纤毛虫生物量季节和海域间的差异; 使用DIVERSE计算纤毛虫物种数、Margalef多样性指数和香农-威纳指数。为权衡稀有种和优势种,原始数据经过lg(x+1)转化处理。
2 结果 2.1 底栖环境因子两个航次采样站位的水深均由近岸到离岸海域逐渐加深,7月航次平均水深为(48.2±17.6)m,水深范围为21.5-81.5m,11月航次平均水深为(47.1±18.9)m,范围为19.0-80.7m。两个月份底层水温均随着离岸距离增加而降低。7月温度为(11.0±4.6)℃,变化范围为4.6-22.1℃。通过温度(<12℃)、盐度(>32)和水深(>40m)三个环境因子的界定(翁学传等,1988),7月位于黄海冷水团中的站位有15个(图 1),平均水温为(7.6±2.0)℃,位于冷水团外的站位的平均温度为(15.0±3.6)℃。北黄海平均温度为(8.5±4.0)℃,明显低于南黄海[(12.2±4.5)℃]。11月平均水温[(13.4±2.9)℃]高于7月,冷水团依然存在,但已缩减为11个站位(图 1),其平均温度为(10.1±0.8)℃,冷水团外围站位的平均水温为(15.3±1.7)℃。南黄海平均温度高于北黄海,分别为(13.7±3.2)℃和(12.0±1.1)℃。底层水的盐度随着水深增加而增加。7月在长江入海口海域,沿长江冲淡水的流向方向可以看到明显的盐度降低。7月平均盐度(32.2±0.7)比11月的平均值(32.0±0.8)略高,两个月份冷水团平均盐度均高于外围平均盐度(图 2)。
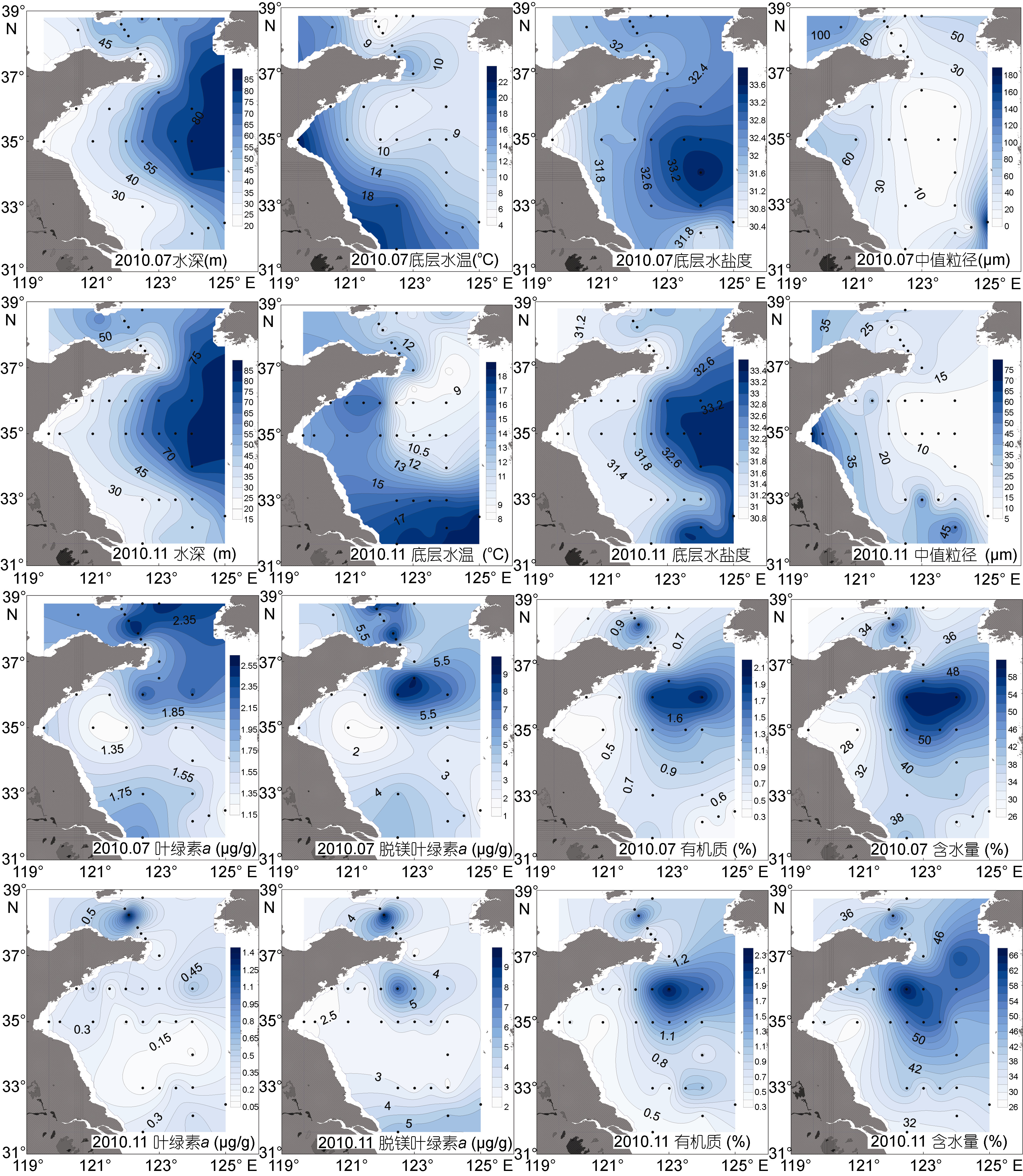 |
| 图 2 2010 年 7 月和 11 月黄海底栖环境因子分布图 Fig. 2 Distributions of benthic environmental factors in the Yellow Sea in July and November 2010 |
沉积物类型多为粉砂,7月中值粒径为(35.2± 40.6)μm,变化范围为4.8-185.3μm,南黄海中心有低值区域,南黄海近岸海域中值粒径略高。11月中值粒径平均值较7月低,为(21.5±16.2)μm,但南黄海近岸和长江口海域的中值粒径明显高于离岸海域。沉积物中叶绿素a和脱镁叶绿素a含量随着深度增加逐渐降低。7月0-5cm沉积物中叶绿素a含量为(0.80±0.41)μg/g,北黄海和威海附近海域叶绿素a含量较高。11月叶绿素a含量[(0.33±0.25)μg/g]明显低于7月,北黄海叶绿素a含量较高。0-5cm沉积物中脱镁叶绿素a含量同样是7月[(4.64±2.43)μg/g]高于11月[(3.83±1.80)μg/g]。脱镁叶绿素a含量的分布特点与叶绿素a含量的分布基本一致,而且两者两个月份均是北黄海的平均值高于南黄海,冷水团的平均值高于外围海域。沉积物中有机质含量随深度变化不明显。0-2cm沉积物中,有机质含量在南北黄海冷水团中心各有一个高值区域。7月有机质含量平均值[(0.88±0.49)%]较11月[(0.94±0.51)%]略低,两个季节均是冷水团海域平均有机质含量明显高于外围海域。沉积物含水量无明显的垂直分布,两个月份含水量均与有机质有相近的分布规律。0-5cm沉积物中,7月平均含水量[(39.59±9.87)%]略低于11月[(42.91± 10.39)%]。两个月份均是南黄海平均含水量高于北黄海,冷水团平均含水量高于外围海域(图 2)。
T检验结果表明,两个月份间,底层水温度和叶绿素a含量有极显著差异(P<0.01)。7月,底层水温、叶绿素a和脱镁叶绿素a含量在南、北黄海间有显著差异(P<0.05); 除叶绿素a和脱镁叶绿素a含量外,其余环境因子在冷水团内外均有显著差异(P<0.05)。11月,各环境因子在南、北黄海间均无显著差异; 除叶绿素a和脱镁叶绿素a含量外,其余环境因子在冷水团内外均有极显著差异(P<0.01)。
2.2 底栖纤毛虫的丰度和生物量在表层5cm沉积物中,7月纤毛虫丰度为(2±3)cell/cm3,生物量为(0.04±0.06)μgC/cm3。北黄海、南黄海近岸和长江口外海域纤毛虫丰度和生物量较高,南黄海离岸站位均较低(图 3)。北黄海平均丰度为(1±1)cell/cm3,生物量为(0.043±0.051)μgC/cm3。南黄海丰度[(3±4)cell/cm3]明显较北黄海高,但生物量[(0.036±0.070)μgC/cm3]低于北黄海。冷水团海域纤毛虫的丰度和生物量[(1±0.5)cell/cm3和(0.02±0.02)μgC/cm3]均明显低于外围海域[(4±4)cell/cm3和(0.06±0.09)μgC/cm3]。纤毛虫丰度最高值出现在位于CJ断面的CJ6站位,其丰度为12cell/cm3; 124-5和3500-6站位未检获纤毛虫。纤毛虫生物量最高值出现在位于海州湾的3500-1站位,其生物量为0.31μgC/cm3。
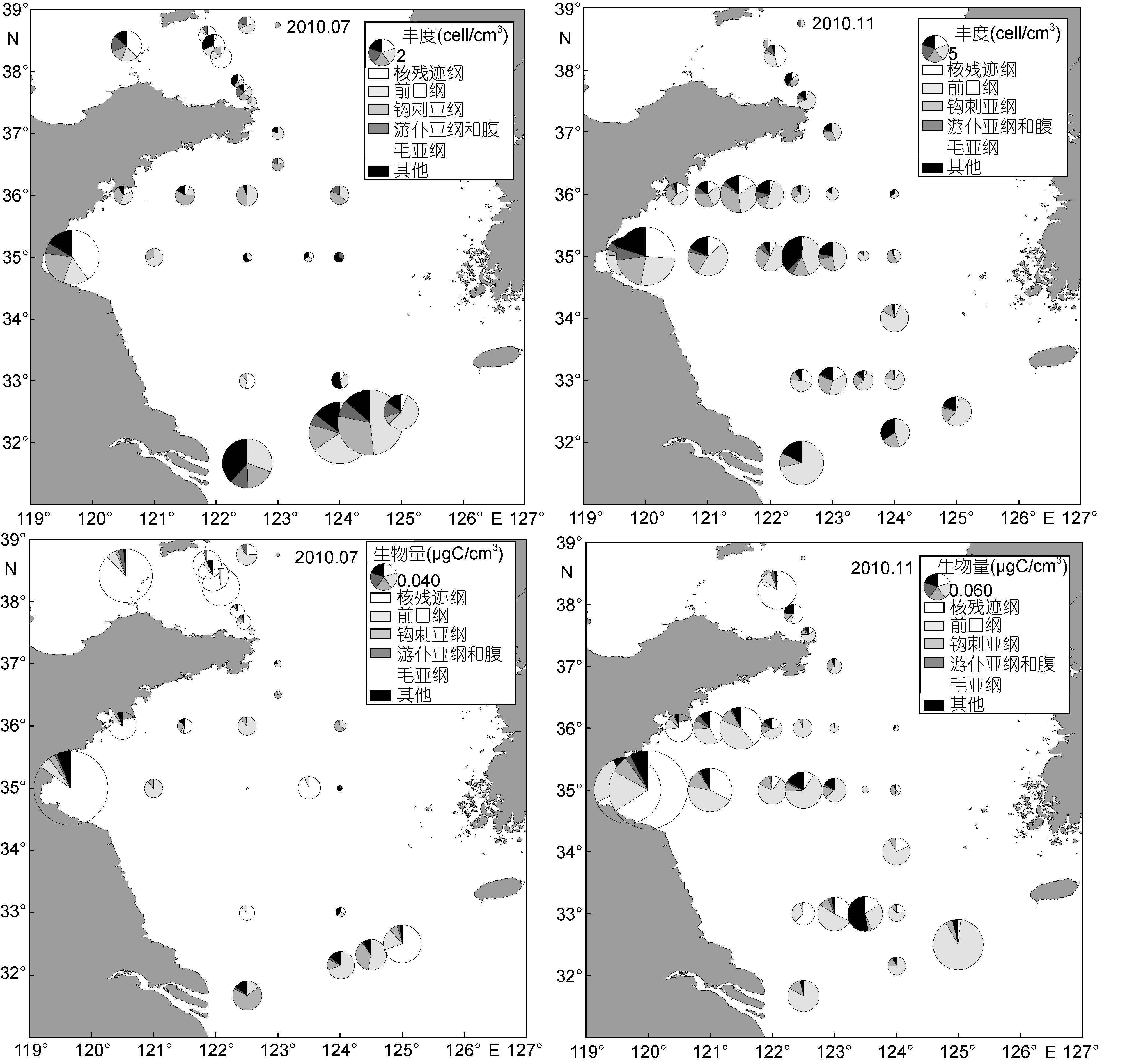 |
| 图 3 2010 年 7 月和 11 月黄海底栖纤毛虫丰度、生物量和类群组成分布图 Fig. 3 The abundance, biomass and group composition of benthic ciliates in the Yellow Sea in July and November 2010 |
11月,纤毛虫平均丰度为(5±5)cell/cm3,生物量为(0.08±0.11)μgC/cm3,纤毛虫丰度和生物量均高于7月。北黄海中心站位纤毛虫丰度和生物量较高。南黄海近岸站位的丰度和生物量较高,且向外海随水深增大呈减少的趋势。在CJ断面,纤毛虫丰度向外海有降低的趋势,但离岸最远的CJ7站位纤毛虫生物量最高(图 3)。北黄海平均丰度为(1±1)cell/cm3,生物量为(0.03±0.05)μgC/cm3。南黄海丰度[(6±5)cell/cm3]和生物量[(0.10±0.12)μgC/cm3]均高于北黄海。冷水团海域纤毛虫的丰度和生物量[(3±3)cell/cm3和(0.04± 0.04)μgC/cm3]均明显低于外围海域[(6±6)cells/cm3和(0.11±0.13)μgC/cm3]。纤毛虫丰度和生物量的最高值均出现在位于海州湾的3500-2站位,分别为24cells/cm3和0.51μgC/cm3。位于北黄海威海附近海域的B7站位未检获纤毛虫。
除7月北黄海底栖纤毛虫生物量高于11月北黄海的平均生物量,7月南北黄海、冷水团内外纤毛虫的平均丰度和生物量均低于11月。经T检验,两个月份间纤毛虫丰度和生物量均有显著差异(P<0.05)。7月南北黄海间纤毛虫丰度和生物量均无显著差异。7月冷水团外围海域纤毛虫丰度和生物量均显著高于冷水团内的丰度和生物量(P<0.05)。11月南黄海纤毛虫丰度和生物量均显著高于北黄海(P<0.05),冷水团内外丰度和生物量均无显著差异。
在0-5cm沉积物中,纤毛虫有明显的垂直分布,随着深度增加,丰度和生物量均降低。7月在数量上有87%的纤毛虫分布在0-2cm,13%分布在2-5cm。0-2cm中,纤毛虫的平均丰度为(4±7)cell/cm3,生物量为(0.08±0.15)μgC/cm3。2-5cm的丰度为(0.5± 0.7)cell/cm3,生物量为(0.01±0.02)μgC/cm3。11月纤毛虫略向下迁移,数量上有84%分布在0-2cm分层,16%分布在2-5cm分层。11月0-2cm沉积物中纤毛虫平均丰度为(11±10)cell/cm3,生物量为(0.16± 0.18)μgC/cm3。2-5cm的丰度为(1±2)cell/cm3,生物量为(0.03±0.07)μgC/cm3。
2.3 底栖纤毛虫群落结构和物种多样性7月共检获纤毛虫45属、99种,隶属于13个大类群(纲/亚纲水平)。其中,北黄海检获45种,南黄海81种,共有种为27种,南、北黄海的Jaccard相似系数为0.27,属中等不相似但接近于极不相似; 冷水团有44种,外围海域77种,共有种为22种,冷水团内外的Jaccard相似系数为0.22,属极不相似。钩刺亚纲(Haptoria)种类数最多,有26种,然后依次是核残迹纲(Karyorelictea,18种)、前口纲(Prostomatea,17种)和盾纤亚纲(Scuticociliatia,10种)。7月核残迹类生物量所占比例最高,达到67.91%。该种类个体较大,丰度所占比例为第三位(13.65%)。丰度所占比例前两位的为前口类(40.04%)和钩刺类(20.78%),其生物量分别排在第二位和第三位,分别占总生物量的16.29%和8.87%(图 4)。
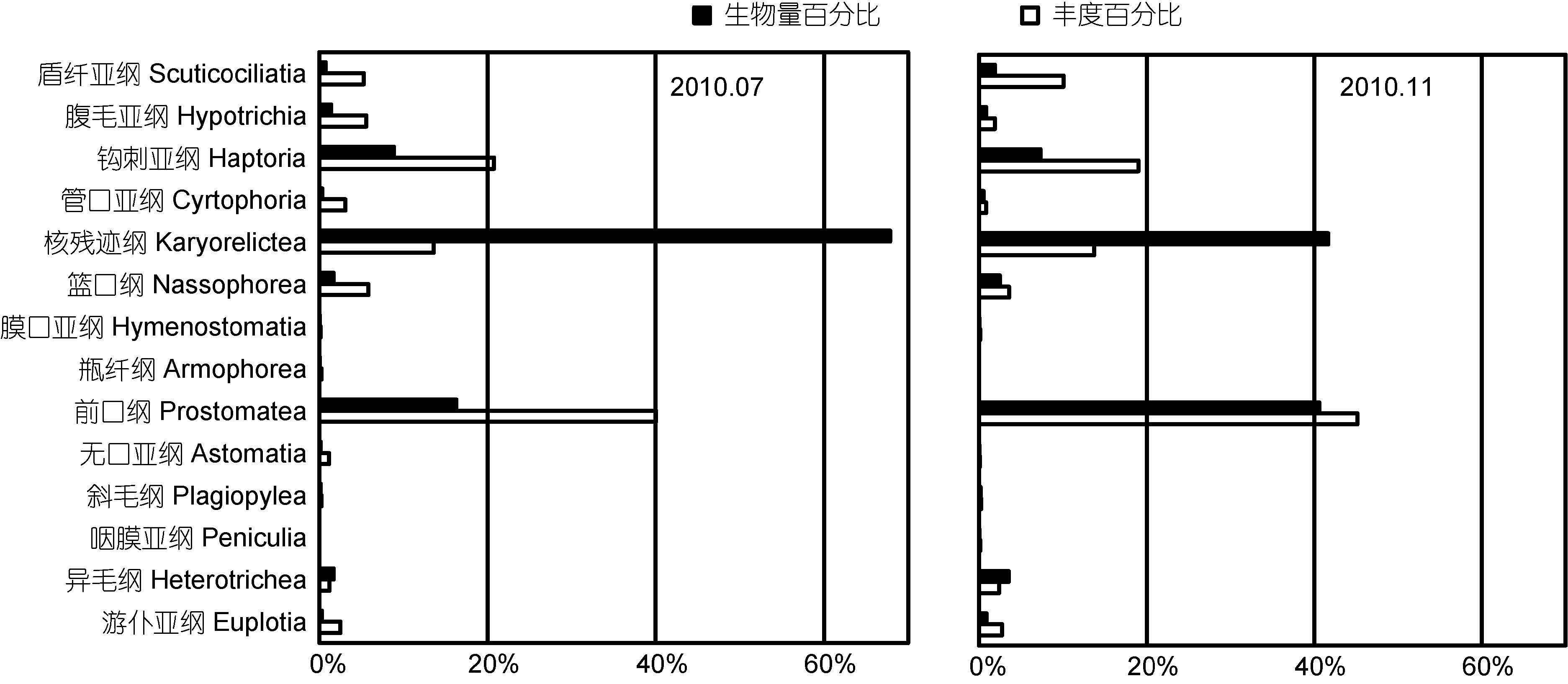 |
| 图 4 2010 年 7 月和 11 月纤毛虫各类群丰度和生物量百分比 Fig. 4 The proportions of ciliate groups in abundance and biomass in July and November 2010 |
11月共检获纤毛虫54属、156种,隶属于13个纲/亚纲。两个月份间的Jaccard相似系数为0.48,属于中等不相似。北黄海32种,南黄海154种,共有种为30种,南、北黄海的Jaccard相似系数为0.19,属极不相似; 冷水团57种,外围海域147种,共有种48种,冷水团内外的Jaccard相似系数为0.31,属中等不相似。种类数最多的是钩刺亚纲(47种),然后依次是前口纲(39种)、核残迹纲(22种)、盾纤亚纲(11种)和腹毛亚纲(Hypotrichia,10种)。丰度和生物量前三位的类群与7月一致,前口类丰度和生物量所占比例较7月增加,分别为45.20%和40.62%。核残迹类生物量比例(41.67%)较7月降低,丰度比例(13.73%)与7月的接近。钩刺类丰度(19.00%)和生物量比例(7.28%)较7月略降低(图 4)。
根据7月纤毛虫生物量数据,Cluster聚类分析没有得到有显著差异的分组,ANOSIM检验发现南北黄海和冷水团内外纤毛虫群落结构均无显著差异。根据11月纤毛虫生物量数据,Cluster聚类分析将11月站位分为6个组(SIMPROF test: P<0.01),B3、B7、3600-1站位各为一组,CJ断面三个站位一组,冷水团中心站位为一组,其余站位为一组。最后一组中,近岸站位和冷水团外缘站位分别聚在一起,形成有显著差异的两个亚组(SIMPROF test: P<0.01)。ANOSIM检验发现,南北黄海间纤毛虫群落结构有显著差异(R=0.467,P=0.002),冷水团内外无显著差异。
7月每个站位底栖纤毛虫的物种数为7±7,最高值出现在位于海州湾的3500-1站位,有36种,而124-5和3500-6站位未检获纤毛虫。南黄海近岸和长江口海域物种数较高,南黄海中心海域较低。11月每个站位纤毛虫物种数的平均值明显高于7月,为17±16,呈由近岸到离岸海域物种数逐渐降低的趋势; 最高值出现在同样位于海州湾的3500-2站位,达83种,B7站位未检获纤毛虫。Margalef多样性指数的分布格局与物种数一致。7月纤毛虫Margalef多样性指数为2.68±1.34,最高值出现在物种数最高的3500-1站位(7.74),最低值出现在位于南黄海中心的3500-7站位(1.44)。11月较7月的Margalef指数增高,为4.40±2.74,最高值同样出现在11月物种数最多的3500-2站位(14.66),最低值出现在124-7站位(0.91)。7月纤毛虫香农-威纳指数为1.57±0.77,最高值出现在物种数最多的3500-1站位(3.33),124-5、3500-6和3875-3站位指数值均为0; 南黄海中心海域香农-威纳指数较低。11月纤毛虫香农-威纳指数平均值(2.11±0.91)高于7月,与物种数一致的是3500-2站位有最高值(3.99),B7站位为0; 由近岸到离岸海域香农-威纳指数逐渐降低(图 5)。
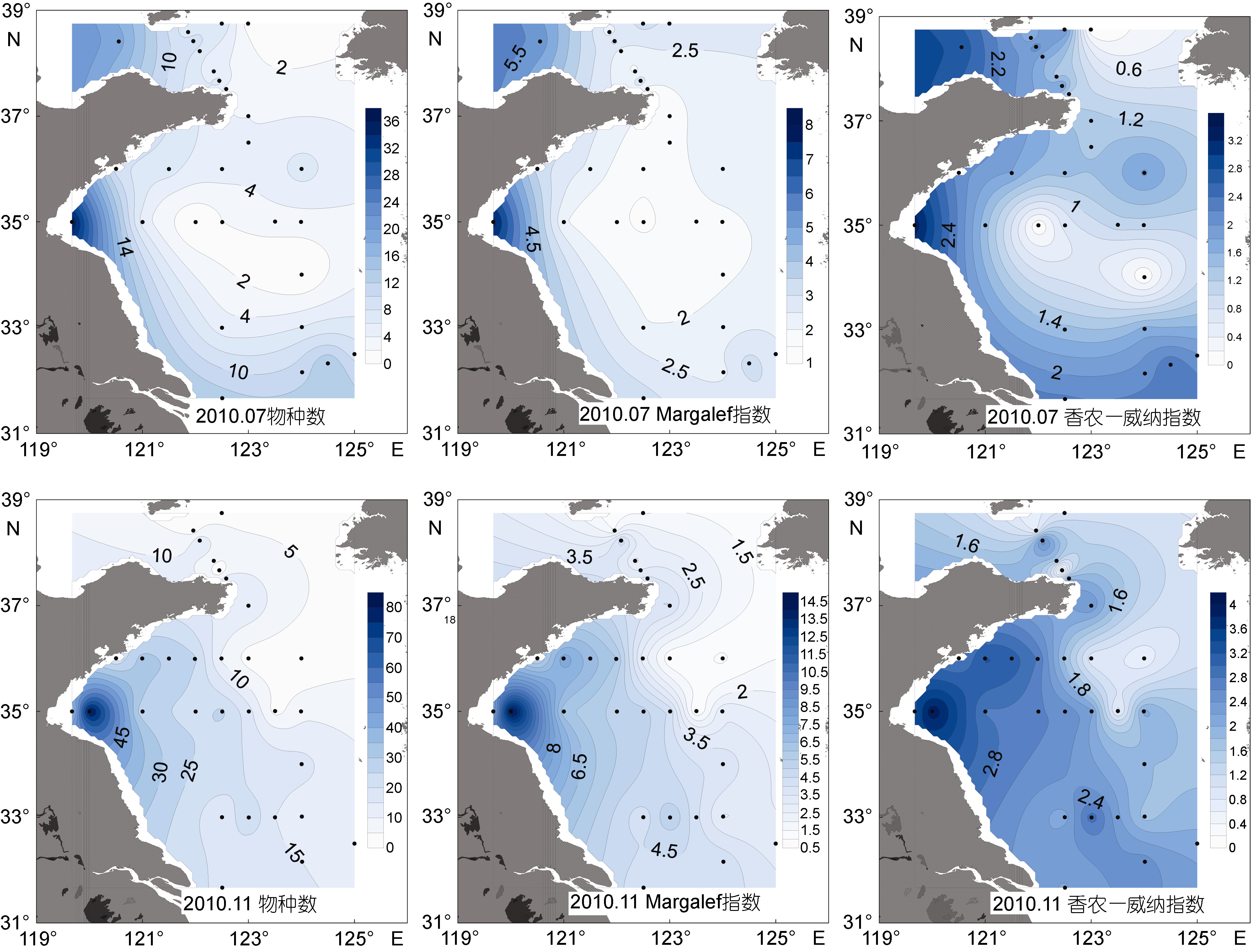 |
| 图 5 2010 年7 月和11 月黄海底栖纤毛虫的物种数、Margalef 指数和香农-威纳指数 Fig. 5 The species number, and Margalef and Shannon-Wiener indices of the benthic ciliates in the Yellow Sea in July and November 2010 |
经T检验,11月纤毛虫物种数和Margalef指数显著高于7月(P<0.01)。7月南北黄海间纤毛虫物种数、Margalef和香农-威纳指数均无显著差异; 三者在冷水团均显著低于外围海域(P<0.05)。11月南黄海纤毛虫物种数极显著高于北黄海(P<0.01); 冷水团内的Margalef指数极显著低于外围海域(P<0.01)。
2.4 底栖纤毛虫的摄食功能群7月检获肉食性纤毛虫53种,菌食性28种,藻食性8种,杂食性10种。11月检获肉食性纤毛虫91种,菌食性43种,藻食性11种,杂食性11种。两个月份肉食性纤毛虫丰度和生物量占纤毛虫全部丰度和生物量的比例均最高,主要包括钩刺类、裸口虫(Holophrya spp.)和某些核残迹类。在0-5cm沉积物中,7月肉食性纤毛虫丰度占全部纤毛虫丰度的62.00%,生物量占80.04%。11月肉食性纤毛虫丰度比例(69.55%)较7月增加,而生物量比例(73.02%)降低。丰度和生物量比例排在第二位的是菌食性纤毛虫,主要包括中圆虫(Metacystis spp.),游仆虫(Euplotes spp.)和盾纤类。7月丰度和生物量比例分别为26.93%和15.41%,11月丰度比例(22.73%)较7月降低,而生物量比例(19.71%)增加。藻食性纤毛虫主要包括管口类(Cyrtophoria)和篮口类(Nassophorea)的某些种类。7月藻食性纤毛虫丰度比例为6.13%,生物量比例为1.96%; 11月分别为3.98%和4.69%。7月杂食性纤毛虫丰度比例为4.94%,生物量比例为2.59%; 11月分别为3.74%和2.58%。肉食性纤毛虫在大部分站位所占比例最高,但菌食性纤毛虫生物量所占比例在11月明显增加(图 6)。两个月份肉食性纤毛虫生物量所占比例在北黄海均高于南黄海,7月肉食性纤毛虫生物量比例在冷水团高于外围海域,而11月则外围海域较高。菌食性纤毛虫生物量比例在南北黄海和冷水团内外的变化与肉食性相反。
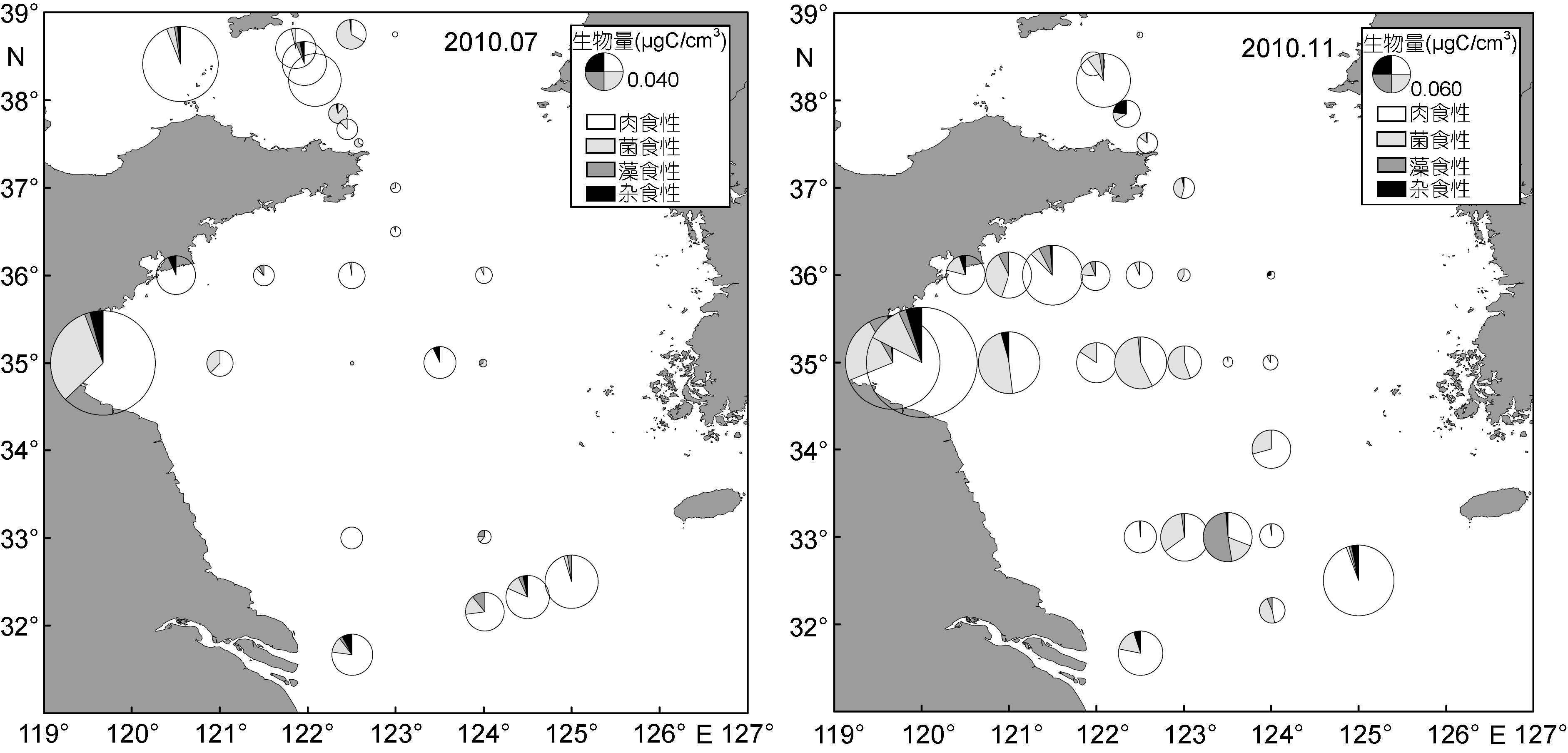 |
| 图 6 2010 年 7 月和 11 月黄海底栖纤毛虫摄食功能群生物量及分布 Fig. 6 The biomass and distribution of four feeding types of benthic ciliates in the Yellow Sea in July and November 2010 |
Spearman相关分析表明,7月,纤毛虫生物量和物种数均与水深和与底层水盐度显著负相关(P<0.05),香农-威纳指数与水深负相关(P<0.05),丰度与底层水盐度显著负相关(P<0.05)。物种数、Margalef和香农-威纳指数与丰度和生物量显著正相关(P<0.05)。
11月,纤毛虫丰度、生物量、物种数、Margalef和香农-威纳指数均与底层水温度显著正相关(P<0.05),物种数、Margalef和香农-威纳指数与水深和底层水盐度显著负相关(P<0.05),纤毛虫丰度、生物量、物种数、Margalef和香农-威纳指数均与有机质含量显著负相关(P<0.05),丰度、Margalef和香农-威纳指数均与中值粒径显著正相关(P<0.05),Margalef指数和含水量负相关(P<0.05),物种数、Margalef和香农-威纳指数均与脱镁叶绿素a含量显著负相关(P<0.05)。物种数、Margalef和香农-威纳指数与丰度和生物量极显著正相关(P<0.01)。
3 讨论 3.1 黄海夏季底栖纤毛虫的现存量、分布与群落结构本研究于2010年7月采获的黄海底栖纤毛虫的丰度(2cell/cm3)明显低于Meng等(2012)对2007年6月黄海底栖纤毛虫的报道(33cell/cm3)。造成丰度和生物量过低的原因可能是,采集到的大部分沉积物样品在处理和分析前已在4℃冰箱中避光保存了三年久,存放时间过长可能导致固定液戊二醛的固定效力下降,从而造成对底栖纤毛虫现存量的低估(孟昭翠等,2010)。戊二醛是目前用于底栖纤毛虫研究最为广泛的固定液,有关其固定效能和存放时间对纤毛虫定量的影响仍需做进一步研究。尽管此次获得的数据不易与其它研究数据进行比较,但仍可在一定程度上显示底栖纤毛虫在该时段的相对空间分布。
通常,夏季南黄海的纤毛虫丰度和生物量明显低于北黄海,而在2010年7月南黄海的纤毛虫生物量仅略低于北黄海,但纤毛虫的丰度高于北黄海,表明一些纤毛虫机会种数量增加。而且,南黄海丰度高于北黄海主要是因为近岸和长江口站位丰度较高,但离岸站位纤毛虫丰度极低,这与2007年6月纤毛虫在南黄海近岸和中心海域数量较多不同。本研究夏季取样期间,南黄海出现了严重的浒苔暴发,浒苔在近海大量堆积。浒苔的死亡和降解可以促进沉积物中碎屑食物网的发展(Bohórquez et al,2013),可能从而通过级联效应促进了近岸站位纤毛虫的生长。
除了现存量明显降低,2010年7月纤毛虫物种数、Margalef和香农-威纳指数均较2007年6月降低。这三者的降低很可能是因为纤毛虫现存量低所致,这一点可从7月的物种数、Margalef和香农-威纳指数与丰度和生物量极显著正相关关系可以看出。2007年6月南黄海纤毛虫多样性指数均低于北黄海,但在2010年7月,南黄海纤毛虫物种数高于北黄海; 2007年6月多样性指数在南黄海南部海域较高,而在2010年7月,纤毛虫物种数、Margalef和香农-威纳指数均在南黄海近岸海域较高而离岸海域较低,这与纤毛虫现存量的分布是一致的。
对纤毛虫主要类群来说,2007年6月前口类是最优势的类群,生物量比例为58%,远高于生物量比例排在第二位的核残迹类(18%)。而在2010年7月,核残迹类生物量所占比例最高,达到67.91%; 前口类生物量仅占16.29%。核残迹类个体普遍较大,可能较其他类群能经受住更长时间的存放,故而核残迹类生物量比例增高。
3.2 黄海秋季底栖纤毛虫的现存量、分布与群落结构至今尚无关于黄海秋季底栖纤毛虫的报道。本研究显示: 11月纤毛虫丰度和生物量在南黄海随水深增加而减少,但在离岸海域仍数量较多; 冷水团内外丰度和生物量均无显著差异,而南黄海的纤毛虫丰度和生物量均显著高于北黄海。相关分析显示11月纤毛虫丰度、生物量、物种数、Margalef和香农-威纳指数与底层水温度显著正相关。相关研究也表明温度是影响原生动物丰度、生物量和群落结构的重要环境因子(Dietrich et al,2000; Hamels et al,2005; Du et al,2012)。2010年11月南黄海底层水温(13.7℃)高于北黄海的底层水温(12.0℃),在南黄海随水深增加底层水温逐渐降低,这与纤毛虫现存量、物种数、Margalef和香农-威纳指数的变化是一致的。除了温度,纤毛虫丰度、Margalef和香农-威纳指数与中值粒径也显著正相关, 沉积物颗粒越大,颗粒间空隙越大,可能越有利于纤毛虫的运动和生长(Azovsky et al,2005; Meng et al,2012)。
在黄海随着水深增加,底层水温、沉积物中值粒径逐渐降低,底层水盐度、有机质含量和含水量逐渐增大,使冷水团具有低温、高盐、沉积物颗粒细、有机质含量和含水量高的特征。沉积物的上述特征可能是黄海环流造成的(苏纪兰等,1995),环流使有机质在冷水团汇集; 环流区水动力较弱,使沉积物颗粒细、含水量高(王中波等,2004)。11月沉积物的平均中值粒径(21.5μm)明显低于7月(35.2μm),可能是浒苔的暴发的后续效应,造成沉积物中的粉砂-粘土含量增加(Bolam et al,2000; 吴秀芹等,2010)。纤毛虫的丰度、生物量和多样性与上述因子均相关,虽然ANOSIM分析发现冷水团内外纤毛虫群落结构没有显著差异,但CLUSTER分析中冷水团中心站位聚为一组,近岸站位和冷水团外缘站位分别聚为有显著差异的两个亚组,表明冷水团对底栖纤毛虫的群落结构和分布有一定的影响,而且是上述多个环境因子共同影响了底栖纤毛虫的群落结构和分布。
Jaccard相似系数反映了群落的相似性,与群落的物种组成密切相关。无论是在相似性等级之间还是在同一相似性等级内,相似系数值越大,则群落就越相似(许嫚等,2014)。两个月份间的Jaccard相似系数高于各个月份南北黄海和冷水团内外的Jaccard相似系数,表明黄海底栖纤毛虫的物种组成在季节间的差异可能小于海域之间的差异。这与底栖纤毛虫生境的变化是一致的。虽然两个月份沉积物环境因子数值上有变化,但分布规律大体一致,T检验结果也表明两个月份间仅底层水温度和叶绿素a含量有极显著差异,表明底栖纤毛虫的生境在两个月份间变化不大,较为稳定。而在冷水团内外,除叶绿素a和脱镁叶绿素a含量外,其余环境因子均有显著差异,表明冷水团内外底栖纤毛虫的生境差别较大。虽然南、北黄海间所测环境因子差异不大,但南、北黄海在纬度、海底地形及水文条件等方面(辛明等,2013)可能会对底栖纤毛虫群落结构产生影响,还需更多的研究。
 2016, Vol. 47
2016, Vol. 47


