
中国海洋湖沼学会主办。
文章信息
- 张艳苹, 王中铎, 郭昱嵩, 刘丽, 刘楚吾. 2016.
- ZHANG Yan-Ping, WANG Zhong-Duo, GUO Yu-Song, LIU Li, LIU Chu-Wu. 2016.
- 红鳍笛鲷(Lutjnaus erythropterus)酪氨酸酶相关蛋白1基因克隆及表达分析
- MOLECULAR CLONING AND EXPRESSION OF TYRP1 GENE IN LUTJANUS ERYTHEROPTERUS
- 海洋与湖沼, 47(2): 390-399
- Oceanologia et Limnologia Sinica, 47(2): 390-399.
- http://dx.doi.org/10.11693/hyhz20160200039
-
文章历史
- 收稿日期:2016-02-24
- 改回日期:2016-03-13
2. 湖南师范大学生命科学学院 长沙 410000;
1. Fisheries College,Guangdong Ocean University,Zhanjiang 524088,China;
2. College of Life Science,Hunan Normal University,Changsha 410000,China
2. ${affiliationVo.addressStrEn};
1. ${affiliationVo.addressStrEn};
2. ${affiliationVo.addressStrEn}
黑色是动物中分布最广泛的颜色,在光吸收、光保护和体色构成上具有重要作用(Lin et al,2007)。颜色深浅变化主要是由黑色素细胞内合成的黑素体分布种类及数量差异引起的(Kuriyama et al,2006; Leclercq et al,2010)。酪氨酸酶基因家族基因编码的酪氨酸酶及酪氨酸酶相关蛋白是催化酪氨酸酶生成黑色素的关键酶。在脊椎动物中,该基因家族成员包括酪氨酸酶基因(TYR基因)、酪氨酸酶相关蛋白1基因(TYRP1)和酪氨酸酶相关蛋白2基因(TYRP2基因)( del Marmol et al,1996)。它们的序列具有高度一致性,共同作用于黑色素细胞,调节黑素生成的种类和数量(Nordlund et al,2006)。作为酪氨酸酶基因家族基因的一员,TYRP1虽然在结构上与TYR和TYRP2基因类似,但因其功能具有物种特异性,具体功能目前尚无定论(Sarangarajan et al,2001; Braasch et al,2009)。普遍认可的是TYRP1可能起着起稳定TYR基因的功能的作用,同时也参与维持黑素体超微结构和影响黑色素细胞生长及死亡(Sarangarajan et al,2000; Kobayashi et al,2007; 高莉等,2010)。在小鼠中,TYRP1基因突变可能导致小鼠棕色毛发的出现,在人类中,TYRP1基因特定位点突变是人类OCA3(oculocutaneous albinism type 3)发生的主要原因(Boissy et al,1996; Zhang et al,2011; Kamaraj et al,2013)。在硬骨鱼中,TYRP1基因的主要功能也是参与黑色素生成,如在斑马鱼和青鱂中,TYRP1主要在眼睛和皮肤等黑素生成部位表达(Braasch et al,2009)。
由于鱼类特有的基因组复制现象,酪氨酸酶基因家族基因在硬骨鱼中发生了基因扩张现象。但复制基因的保留方式存在种间差异,例如斑马鱼(Danio rerio)中仅有一个TYRa,2个TYRP1基因; 而青鳉(Oryzias latipes)中TYR和TYRP1的两个复制基因都存在; 青斑河豚(Tetraodon nigroviridis)中有两个TYR和一个TYRP1a基因(Camacho-Hübner et al,2002; Braasch et al,2007)。 红鳍笛鲷(Lutjanus erythropterus)是我国南海重要的经济鱼类,主要分布在印度洋和西太平洋海域,属于底栖珊瑚礁鱼类,体色鲜艳,通体鲜红色,又称红鱼,仅尾柄部具有鞍马状黑色斑块(Guo et al,2007; Zhang et al,2015)。属于比较理想的研究笛鲷属鱼类体色进化的代表物种。
本研究以红鳍笛鲷皮肤转录组数据为对象,利用生物信息学方法,鉴定红鳍笛鲷酪氨酸酶相关蛋白1基因,从分子水平解析红鳍笛鲷TYRP1基因的基本结构和组织表达。
1 材料与方法 1.1 材料实验用鱼购自广东省湛江市霞山区东风市场,体重(300±10)g,体长(27±1)cm,实验室暂养3d后取样,暂养条件: 水温(26±2)℃,光暗周期14h : 10h。采用MS-222将实验鱼麻醉后快速取样,样品由液氮速冻后,置于-80℃保存。克隆材料为红鳍笛鲷黑色皮肤部位,qRT-PCR的实验材料为红鳍笛鲷成体的黑色皮肤、红色皮肤、脑、肉和眼睛5个组织的总RNA,每个基因个体重复6次。
1.2 主要试剂MS-222购自Sigma公司; M-MLV RTase cDNA Synthesisi Kit购于Promega公司; Trizol购于Invitrogen公司; RACE试剂盒(clontech)和Maxima SYBR Green qPCR分别购自Roche和Thermo公司,其它试剂均为国产分析纯试剂。
1.3 RACE获得目的基因全长序列根据红鳍笛鲷转录组数据库中注释为TYRP1的unigene序列设计引物获得目的基因中间片段,再采用RACE技术,设计基因特异性引物进行5'cDNA和3'cDNA末端的克隆。5'RACE和3'RACE 的操作按照clontech的SMARTTM RACE cDNA Amplification Kit说明书进行,将获得的目的片段分离纯化并连接到pMD18-T载体上,然后再转化到JM109感受态细胞中,通过菌落PCR挑选阳性克隆并送上海生工进行测序,将测序后的序列与已知的片段进行拼接获得目的基因的cDNA全长。所用特异性引物见表 1。
| 基因 | 引物序列(5'—3') | 用途 |
| TYRP1a-5-outer | GGTGGAGTAGTAGGGCGGCGTGTCA | 5'RACE |
| TYRP1a-5-inner | CAGATTGTTCCCAGCGTGTCGTAGTCC | 5'RACE |
| TYRP1a-3-outer | GTCACAACAGGGGCTACAACATGGT | 3'RACE |
| TYRP1a-3-inner | GTGCGCCGTGCGCGCCAGGTCTTAC | 3'RACE |
| TYRP1b-5-outer | TCCCCTGCTGCCCCTGTAGGAGATG | 5'RACE |
| TYRP1b-5-inner | GAGACCCACTCGCCACATGCTCTGA | 5'RACE |
| TYRP1b-3-outer | CCCCACCTTACTACTCCACCTCCTCTGA | 3'RACE |
| TYRP1b-3-inner | GCCTCCTGTCACCAATGCTGAGATGTT | 3'RACE |
| Tyrp1a-qPCR-F | CCGATCCGTTTCTTTAAC | 荧光定量 |
| Tyrp1a-qPCR-R | CCTCACAACATTAACTCTC | 荧光定量 |
| Tyrp1b-qPCR-F | CTAAGAGGACCATTCAC | 荧光定量 |
| Tyrp1b-qPCR-F | CTGACGGAGTAATAGTG | 荧光定量 |
| β-actin-F | GCCTTCCTTCATTGGTA | 内参基因 |
| β-actin-R | GCTGTGATCTCCTTCTG | 内参基因 |
用DNAMAN软件将测序获得的结果进行拼接,得到TYRP1基因的全长cDNA序列。编码框及非编码区的预测利用NCBI在线网站ORF finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)来预测。分子量和等电点在Expasy网站(http://web.expasy.org/compute_pi/)进行分析,蛋白质结构域利用SMART软件(http://smart.embl-heidelberg.de/)在线分析。同时,利用ClustalW2软件将TYRP1与其它已知物种同源基因进行比对分析。使用MEGA 5.0软件,以邻位相连法(neighbor-joining)构建系统进化树。
1.5 荧光定量PCR法检测目的基因在红鳍笛鲷不同组织的差异表达利用Beacon Designer软件分别在其编码区范围内设计荧光定量PCR所需的特异性引物,内参为β-actin。引物均由上海生工生物工程技术服务有限公司合成,采用ULTRAPAGE纯化方式。取红鳍笛鲷黑色皮肤、红色皮肤、眼、脑和肉5个组织,提取总RNA后反转录得到cDNA模板进行荧光定量PCR。每个基因设置3个技术重复和6个实验重复。实验数据以红鳍笛鲷肌肉组织作为对照,排除每3个重复中Ct值有较大差异的数据,采用2-△△Ct法计算目的基因在各组织的相对表达量,数据分析选用SPSS 21.0进行显著性差异分析,当P<0.05时为显著差异。
2 结果 2.1 TYRP1在红鳍笛鲷皮肤中存在情况查找红鳍笛鲷转录组数据中注释为TYRP1基因的unigene序列,同时下载尼罗罗非鱼(Oreochromis niloticus)TYRP1a(ENSONIP00000009562)和TYRP1b(ENSONIP00000011122)序列对转录组数据进行本地blast,结果两两验证确定红鳍笛鲷中存在TYRP1的两个拷贝基因。
2.2 TYRP1基因核苷酸序列分析将测序获得的5'上游及3'下游序列与中间片段利用DNAman软件进行拼接,分别获得TYRP1a和TYRP1b序列的cDNA全长。由图 1可知,TYRP1a序列全长3178bp,其中开放阅读框(ORF)区长1566bp,编码521个氨基酸,5'端235bp,3'端1377bp,预测其分子量58.4kDa,等电点为5.38; 由图 2可知,TYRP1b基因cDNA全长1871bp,其中ORF区长1656bp,编码551个氨基酸,5'端89bp,3'端126bp。
 |
| 图 1 红鳍笛鲷TYRP1a基因序列分析 Fig. 1 Analysis on the sequence of TYRP1a gene |
 |
| 图 2 红鳍笛鲷TYRP1b基因序列分析 Fig. 2 Analysis on sequence of TYRP1b gene |
利用Expasy在线软件预测TYRP1a蛋白的分子量58.4kDa,等电点为5.38; TYRP1b蛋白分子量为61.7kDa,等电点为5.56。同时采用Clustalx软件对红鳍笛鲷与其它脊椎动物的TYRP1氨基酸序列进行多序列比对。如图 3所示,发现红鳍笛鲷TYRP1氨基酸序列与其它脊椎动物的同源序列具有较高的保守性,其中酪氨酸酶基因家族典型的酪氨酸酶金属离子结合位点和大量的半胱氨酸残基位点在脊椎动物中是高度保守的。使用SMART软件对红鳍笛鲷两个TYRP1进行蛋白质序列分析,发现分别在172—407和196—431位存在酪氨酸酶基因家族典型的酪氨酸酶结构域(图 4)。采用MEGA5.0对红鳍笛鲷TYRP1基因与其它硬骨鱼类、青蛙、家鸡、人和小鼠等10种脊椎动物的进化关系进行分析(图 5),结果显示,红鳍笛鲷与尼罗罗非鱼和棘鱼的亲缘关系较近。同时还发现,对于含有两个TYRP1基因复制子的硬骨鱼类来讲,TYRP1基因的两个复制子分别与直系同源基因聚在一起,而后两个旁系同源体聚在一起,最后与青蛙、鸡、人与小鼠等只有一个TYRP1基因的脊椎动物聚在一起,说明TYRP1基因的复制是发生在硬骨鱼类特有的基因组复制事件中。
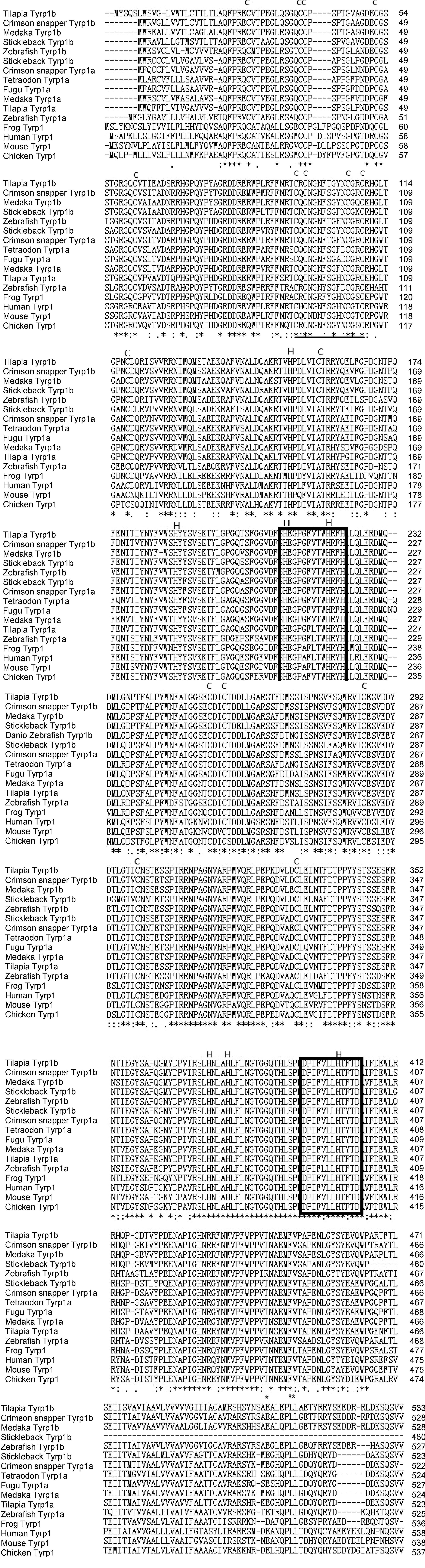 |
| 图 3 TYRP1氨基酸序列与其它脊椎动物氨基酸序列比对 Fig. 3 Multi-alignment of TYRP1 of other vertebrates |
 |
| 图 4 SMART软件预测的TYRP1a(左)和TYRP1b(右)蛋白质结构域 Fig. 4 Analysis of TYRP1a(left)and TYRP1b(right)protein structure with SMART software |
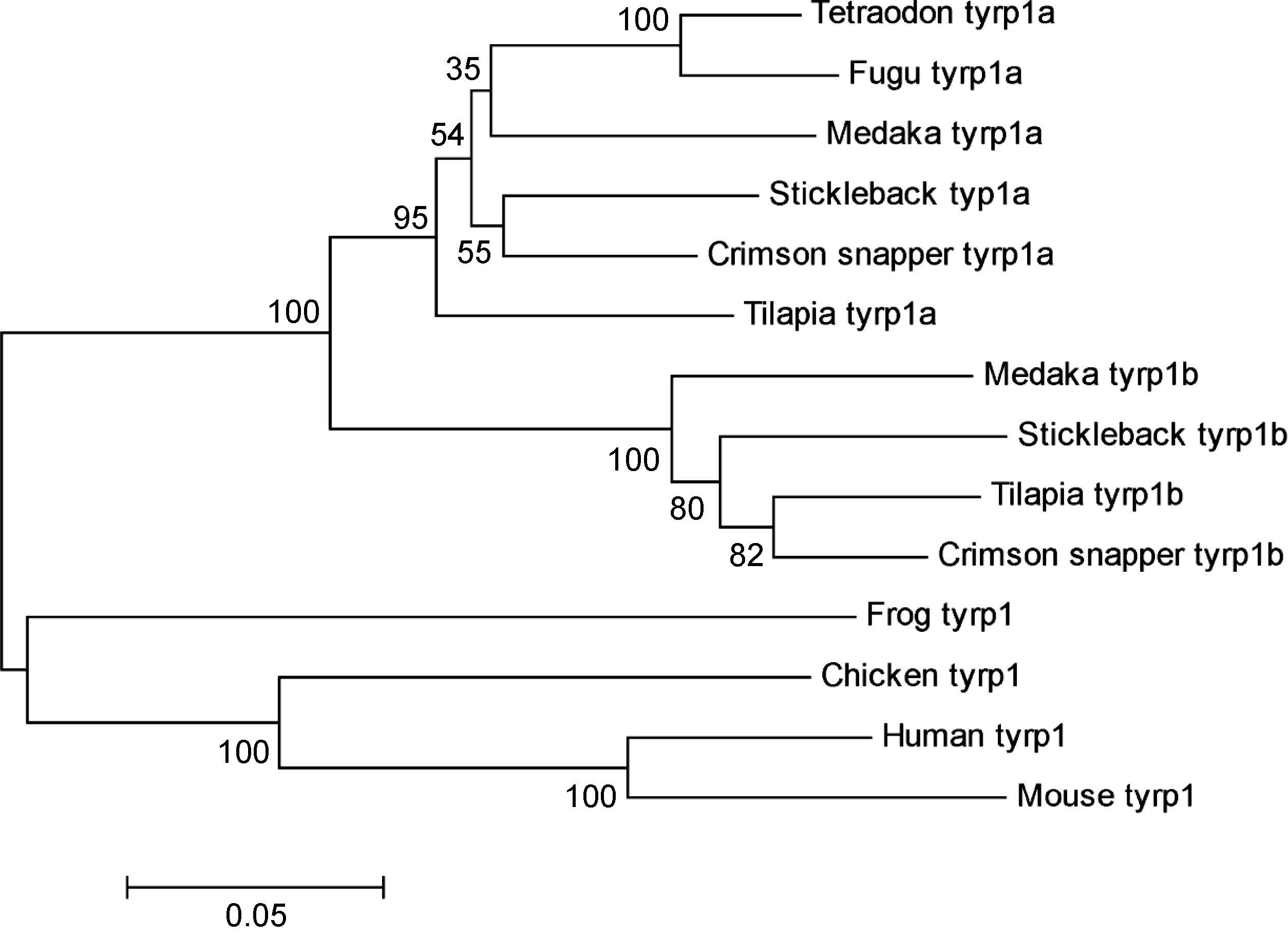 |
| 图 5 基于TYRP1氨基酸序列的系统进化树 Fig. 5 The Neighbor-Joining(NJ)phylogenetic tree constructed based on TYRP1 amino acid sequences |
采用荧光定量PCR检测了红鳍笛鲷TYRP1a和TYRP1b基因在黑色皮肤、红色皮肤、眼睛、肌肉和脑中的表达,见图 6。结果显示,TYRP1a和TYRP1b基因都在眼睛部位显示出最高表达量。不同的是,TYRP1a在除眼睛外的其它部位表达量都较低,而TYRP1b在黑色皮肤部位也显示较高表达。此外,比较两个基因在同一部位的表达量时,发现TYRP1b在眼睛、黑色皮肤和红色皮肤等黑色素生成部位的表达量都高于TYRP1a基因; 而在脑和肌肉中,两个基因都表现出微弱表达。
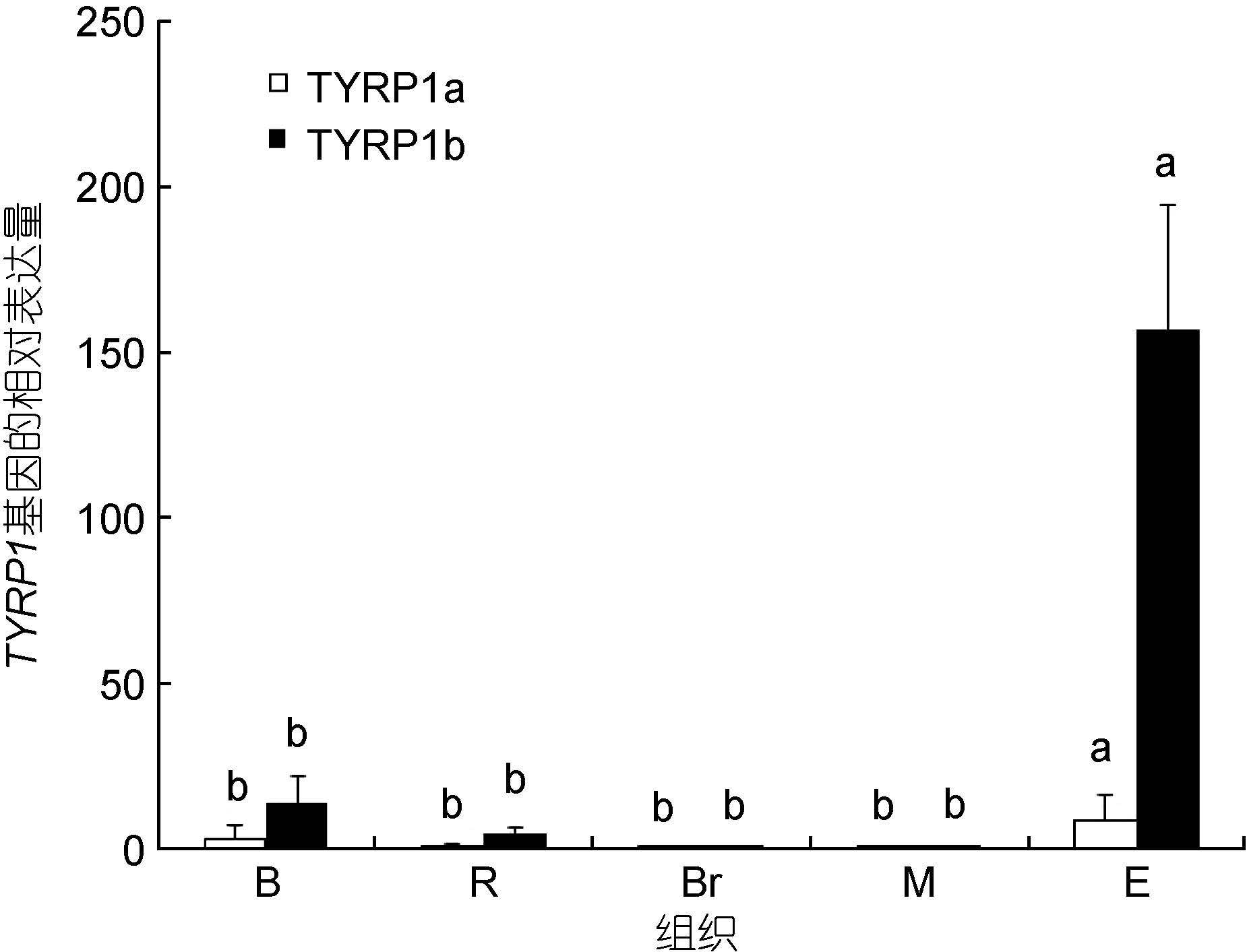 |
| 图 6 TYRP1基因在红鳍笛鲷不同组织中的表达分布 Fig. 6 Expression patterns of TYRP1 gene in different tissues of L. erythropters |
大约4.5亿年前,硬骨鱼祖先与四足动物分化后又经历了其特有的基因组复制,许多基因在人类、鸟类及四足动物中仅有一个拷贝,而在鱼类中存在两个不同的直系同源/旁系同源基因(Yamanoue et al,2006)。Braasch等(2007)通过对五种常见硬骨鱼的体色基因统计分析发现,黑色素合成通路中约3/4的基因在硬骨鱼中存在2个拷贝。本研究通过将红鳍笛鲷转录组数据中注释为TYRP1的unigene序列与尼罗罗非鱼两个TYRP1基因的本地blast结果两两验证,确定红鳍笛鲷中含有TYRP1a和TYRP1b两个基因,并得到其unigene序列,应用RACE技术克隆获得两个基因的cDNA序列全长。软件分析发现红鳍笛鲷TYRP1a和TYRP1b基因都含有具有典型的酪氨酸酶结构域(Tyrosinase)。序列同源性比对分析发现TYRP1a和TYRP1b基因在脊椎动物中具有较高的保守性,尤其对于与酪氨酸基因家族基因典型酶活性有关的位点(del del Marmolet al,1996; Camacho-Hübneret al,2002),如多个半胱氨酸残基、6个组氨酸残基、高度疏水的跨膜区、C端由亮氨酸和酪氨酸残基组成的胞质尾,在脊椎动物中是高度保守的。其中一个半胱氨酸富集区含有EGF-motif(epidermal-growth factor)位点,该位点在蛋白质-蛋白质相互作用中起重要作用(Jackson,1994)。6个组氨酸残基构成2个各包含3个组氨酸残基的铜离子结合位点,该位点对于维持酪氨酸酶的酶活性起基本作用(Furumura et al,1998)。红鳍笛鲷TYRP1a和TYRP1b氨基酸序列分别在469—491和493—515为高度疏水的跨膜结构域。研究发现该结构与其后的C端胞质尾共同协作确保将TYRP1蛋白转运到黑素体并与黑素体特有的膜结构结合(Jimbow et al,2000)。以上信息表明,在分子水平,红鳍笛鲷两个TYRP1基因之间及与其它物种的蛋白具有很高的同源性。
为了进一步研究TYRP1a和TYRP1b基因在红鳍笛鲷中的功能,采用荧光定量PCR技术对TYRP1a和TYRP1b基因在红鳍笛鲷不同组织的表达进行了检测。结果发现,TYRP1a和TYRP1b基因均在眼睛部位显示出最高表达。同时,TYRP1b在黑色皮肤和红色皮肤中也有一定表达,且黑色皮肤部位表达高于红色皮肤。已有研究报道TYRP1基因在多种动物中都参与了黑色素的合成,高莉等(2008)发现TYRP1基因在黑色素含量高的棕色羊驼毛皮中的表达量高于白色羊驼中; 黑色家兔皮肤组织中TYRP1基因的平均表达水平显著高于白色家兔(朱亮等,2013); 在鱼类中,Braasch等(2009)通过原位杂交实验发现: 斑马鱼中,TYRP1b在黑色素生成部位如眼睛、皮肤和鳍条中均有表达; 青鳉中,TYRP1a和TYRP1b基因在眼睛中都有表达。眼睛和黑色皮肤是红鳍笛鲷中黑色素含量最高的部位,据此推测TYRP1a和TYRP1b在红鳍笛鲷也具有参与黑色素的合成有关的功能。
荧光定量PCR结果同时显示,在红鳍笛鲷中,TYRP1b在眼睛和黑色皮肤等部位的表达量明显高于TYRP1a,表明红鳍笛鲷中TYRP1a与黑色素合成的功能较弱。推测或许与两个TYRP1基因的差异进化有关。诸多研究发现经过基因组复制后的两个旁系同源体的差异进化是导致鱼类物种进化和多样性的重要原因(Meyer et al,1999; Klüver et al,2005; Jovelin et al,2007; Ohno,2013)。通过对硬骨鱼复制基因的进化研究发现,复制后的基因一般有三种进化模式: 去功能化,亚功能化和新功能化(Lynch et al,2004,Hahn,2009)。青鱂中MIFT2基因相比于MITF1基因功能逐渐减弱,趋向于去功能化或新功能化(Li et al,2013); 南极鱼(Antarctic zoarcid fish)中唾液酸合成酶基因(SAS)的一个基因进化出与抗冻有关的新功能(Deng et al,2010)。关于红鳍笛鲷中复制基因的进化模式仍需进一步研究。
本实验成功克隆了红鳍笛鲷TYRP1a和TYRP1b两个基因的cDNA全长,通过在红鳍笛鲷不同部位表达量的分析,确定TYRP1b在红鳍笛鲷中具有更广泛的表达,且在眼睛和皮肤等黑色素生成部位有更高的表达量,该结果可以为继续深入研究红鳍笛鲷体色相关基因在基因复制后的功能进化提供理论基础。
 2016, Vol. 47
2016, Vol. 47


