
中国海洋湖沼学会主办。
文章信息
- 李斌, 陈亚男, 齐占会, 白艳艳, 徐东, 马元庆, 张娟, 李焕军, 孙珊, 何鑫, 张昀昌. 2016.
- LI Bin, CHEN Ya-Nan, QI Zhan-Hui, BAI Yan-Yan, XU Dong, MA Yuan-Qing, ZHANG Juan, LI Huan-Jun, SUN Shan, HE Xin, ZHANG Yun-Chang. 2016.
- 无机砷As(V)对牟氏角毛藻(Chaetoceros mulleri)生长、叶绿素a含量及抗氧化活力的影响
- EFFECTS OF AS(V) EXPOSURE ON GROWTH, CHLOROPHYLL-A CONTENT AND ANTIOXIDANT ACTIVITY OF CHAETOCEROS MULLERI
- 海洋与湖沼, 47(2): 455-459
- Oceanologia et Limnologia Sinica, 47(2): 455-459.
- http://dx.doi.org/10.11693/hyhz20151000261
-
文章历史
- 收稿日期:2015-10-12
- 改回日期:2016-01-24
2. 上海海洋大学水产与生命学院 上海 201306;
3. 中国水产科学研究院南海水产研究所渔业生态环境重点实验室 广州 510300;
4. 中国水产科学研究院黄海水产研究所 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Guangdong Provincial Key Laboratory of Fishery Ecology Environment, South China Sea Fisheries Research Institute of Chinese Academy of Fishery Sciences, Guangzhou 510300, China;
4. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
随着工农业的快速发展,砷及其化合物的广泛应用导致微量砷在水体、空气及土壤中均有发现; 因其较高毒性而被美国环保局(USEPA)列为水源地优先控制污染物(Rahman et al,2012)。砷是一种较常见且持久性的污染物,在水体中的停留时间可达50年(Klein,1975),在海洋环境中的复杂生物地球化学过程决定了其理化形态、生物利用度和毒性效应等(Smedley et al,2002; Karadjova et al,2008)。人类活动所产生的砷随河流或降水入海,海水中无机砷主要以五价砷酸盐As(V)形式存在(赵艳芳等,2009),因此,As(V)在生态系统中的生物富集、转化及其毒理效应成为研究热点。
海洋微藻作为海洋态系统的初级生产者,对于许多毒物比鱼类、甲壳类更为敏感,在水污染生物监测中具有十分重要的作用(Ma et al,2002; 梁英等,2009)。砷对藻类的毒性作用也开展了相关研究,已开展的研究主要集中在绿藻、蓝藻等对砷的生物富集和转化、生长抑制和代谢机理等(洪华生等,1991; Karadjova et al,2008; 龚艳等,2011; 樊香绒等,2013),而对硅藻的相关研究则极少。牟氏角毛藻(Chaetoceros mulleri)属小型海洋浮游硅藻,是我国沿海许多港湾的优势硅藻种群,也是对虾和贝类等经济动物天然的优质饵料; 其对环境变化的快速响应能力,是研究海洋环境变化的重要生物指标(王艳等,2010)。本文以牟氏角毛藻为试验材料,研究了无机砷As(V)对其磷酸盐吸收、叶绿素a含量、生长速率及其抗氧化活性等的影响,初步探讨了As(V)对海洋浮游硅藻营养盐吸收、生长生理及毒性作用,以期为阐明As(V)对水产养殖安全的影响及其海洋硅藻的生物生态效应提供一定依据。
1 材料与方法 1.1 实验试剂与材料牟氏角毛藻(Chaetoceros mulleri)藻种由山东省海洋资源与环境研究院藻类种质库提供。在实验室用f/2培养基进行扩大培养,取对数生长期藻细胞进行暴露试验。海水取自烟台开发区自然海井水,经沉淀、0.45μm滤膜过滤和煮沸消毒,冷却后备用。f/2培养液按照文献方法(陈明耀,1995)配制。As(V)贮存液为砷酸根溶液标准物质(GBW08667)[(0.233± 0.005)μmol/g Na3AsO4),购自中国计量科学研究院。
1.2 方法与步骤 1.2.1 培养方法和试验设计培养液采用f/2营养盐配方,在指数生长期接种。暴露试验中,As(V)添加浓度梯度按等比间隔设为0、6.0、12.0、24.0、48.0和120.0μg/L(分别记为Ctr和V1—V5,其实测浓度分别为0、7.3、10.2、23.9、45.2和114.0μg/L)。培养温度(19.7±0.8)°C,光照强度3000 lx,光暗周期12:12。每组实验同时设3个平行样。用于微藻培养的5 L三角瓶预先用1 moL/L的盐酸浸泡24h,消毒海水冲洗干净后待用。
分别在0、2、3、5、7、14和21d取样,测定水中磷酸盐含量、藻细胞密度和叶绿素a含量,并在2d时取藻细胞测定其GSH含量与谷胱甘肽还原酶活性,用于分析As(V)暴露对牟氏角毛藻营养盐吸收能力、生长速度、光合作用及其抗氧化活性的影响。
1.2.2 测定方法用Lugol碘液固定微藻样品,血球计数板计数; 磷酸盐(PO4-P)、叶绿素a(chl-a)含量测定均参照《海洋监测规范》(GB17378-2007)方法进行; 还原型谷胱甘肽(GSH)含量测定按张宗申等(2001)的方法进行测定,以DTNB显色,在412nm波长下检测; 谷胱甘肽还原酶(GR)活性测定参照Foyer和Halliwell的方法(Foyer et al,1976)。利用日立U-2900型紫外可见分光光度计测定吸光值。
1.2.3 数据处理所有数据均为3次重复的平均值,采用SPSS17.0统计分析软件对数据进行方差分析、回归分析和差异显著性分析(One-way ANOVA,Tukey)。
2 结果与分析 2.1 对牟氏角毛藻培养水体中磷酸盐含量的影响由表 1可知,第3天时对照组水体中磷酸盐含量比2d时显著降低(P<0.01),之后1周内变化不明显(P>0.01); 第14天时,比7d时明显减小(P<0.01),但至试验结束时降低不显著(P>0.01)。而V2和V5组磷酸盐含量变化与对照相似,且随时间降低的趋势更明显,在2d时均显著低于其初始值。表明,在与适当浓度As(V)共存条件下,会促进牟氏角毛藻对磷酸盐的吸收速度。而V1、V3和V4三组均在实验过程中出现磷酸盐含量升高的现象,且随着As(V)暴露浓度的升高出现的时间越晚,三组分别在2、14和21d时显著升高。各组水体中磷酸盐含量与时间均呈显著负相关关系,V5组相关系数和回归方程的斜率最高,而V3组均最低。表明,试验条件下适当浓度As(V)暴露会促进牟氏角毛藻对磷酸盐的吸收速度,而较低暴露浓度时则反之。
| 实验组 | 暴露时间(d) | 回归方程(y: 磷酸盐含量; x: 时间。n=21) | ||||||
| 0 | 2 | 3 | 5 | 7 | 14 | 21 | ||
| Ctr | 176.03 | 169.11 | 153.89 | 142.82 | 145.59 | 67.93 | 57.13 | y=-6.20x+176.4(R2=0.93,P=-0.97) |
| V1 | 203.71 | 232.77 | 223.08 | 225.85 | 216.16 | 154.05 | 119.52 | y=-5.24x+235.4(R2=0.83,P=-0.91) |
| V2 | 138.67 | 93.00 | 80.54 | 69.47 | 63.94 | 17.92 | 15.53 | y=-5.21x+107.1(R2=0.82,P=-0.91) |
| V3 | 162.19 | 135.90 | 124.83 | 115.14 | 109.60 | 124.88 | 36.33 | y=-4.47x+148.7(R2=0.73,P=-0.86) |
| V4 | 192.64 | 189.87 | 181.57 | 176.03 | 180.18 | 51.26 | 108.43 | y=-5.81x+197.4(R2=0.65,P=-0.81) |
| V5 | 178.80 | 159.42 | 148.35 | 137.28 | 137.28 | 56.81 | 30.78 | y=-7.26x+175.1(R2=0.83,P=-0.98) |
由图 1可知,未进行As(V)暴露处理时,第1周牟氏角毛藻密度增加缓慢,之后的两周则增长较快,21d时达到最高值63×104ind./mL,明显高于试验初始值(P<0.01)。而所有暴露处理组在2d或3d时即显著高于各初始值(P<0.05),藻细胞密度在3—5d时均有所降低,且降低的程度具有随着As(V)暴露浓度升高而增加的趋势。整个试验期间,V2组藻细胞密度均高于其它组,且14d时为最大值71×104ind./mL,明显高于其它组(P<0.05)。表明,As(V)暴露初期牟氏角毛藻细胞分裂加快,但随之出现较大波动,长期高浓度暴露对藻细胞繁殖具有一定的抑制作用。
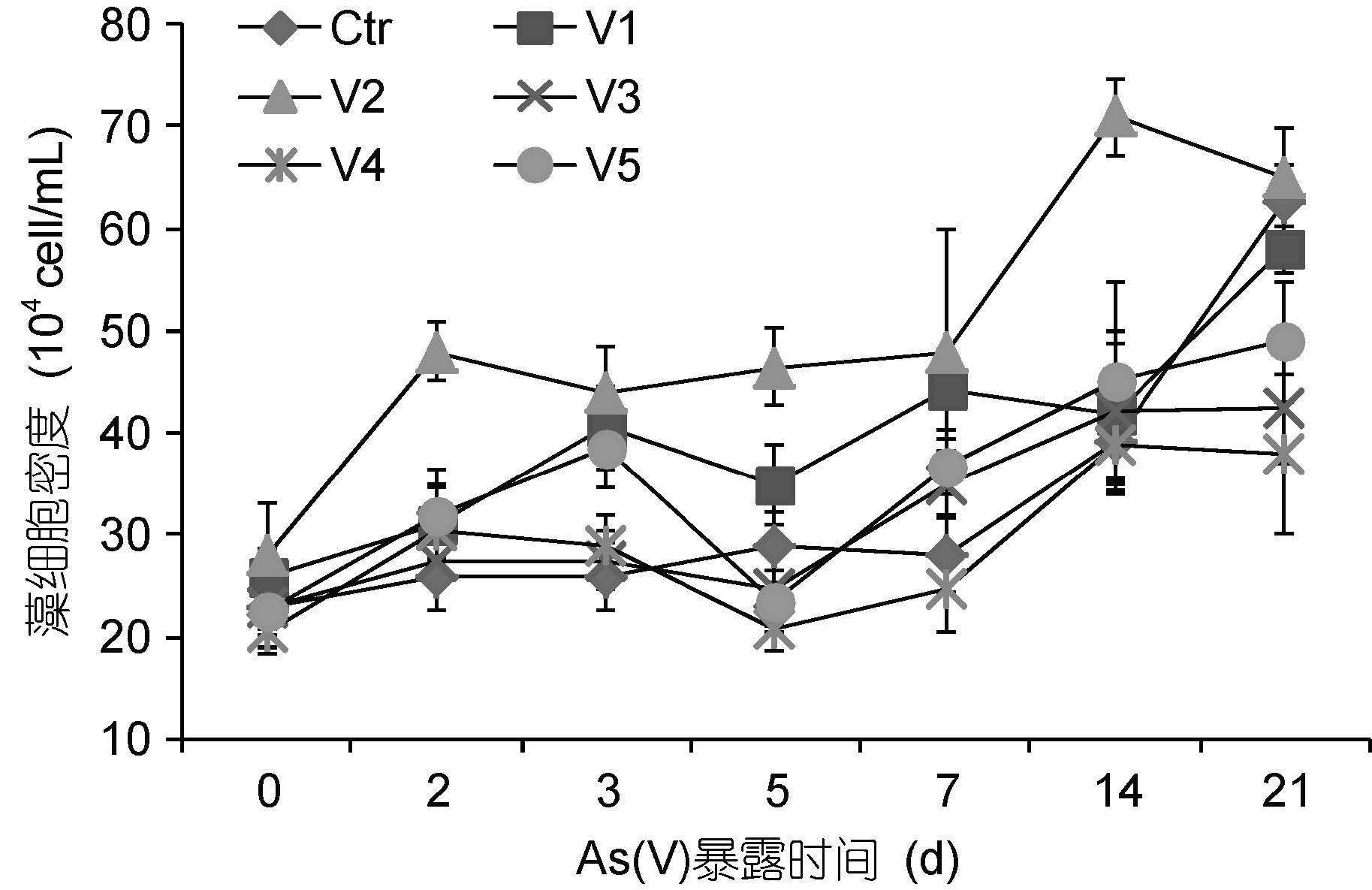 |
| 图 1 As(V)暴露条件下藻细胞密度的变化 Fig. 1 Effect of As(V)exposure on C. mulleri cell density |
As(V)暴露条件下牟氏角毛藻细胞叶绿素a含量随时间的变化分析表明,2d时各组均显著降低,且均显著低于对照(图 2),其中V4组降低最明显,由114.13μg/108cell降至23.64μg/108cell; 3 d时仅V2、V4组较之前明显升高(P<0.01),其它组变化均不大(P>0.01); 与初始值相比,5d时除对照变化不明显外,V5组显著升高(达102.16μg/108cell),而其它处理组却仍明显低于其初始值。之后,对照呈逐渐降低趋势,而处理组中除V1呈波动性变化外,其它各组均呈先降低后升高的趋势; 三个低浓度组在7 d时出现低值,而两个高浓度组均在14 d时出现低值。21 d时,除V1组外各处理组均明显高于对照(50.63μg/108cell),其中V3组(87.22μg/108cell)最高,V5组次之(P<0.01)。结果表明,在As(V)暴露初期藻细胞叶绿素a合成明显受到抑制,而长期暴露时藻细胞会产生适应性,且适当浓度的As(V)会促进藻细胞叶绿素a合成。
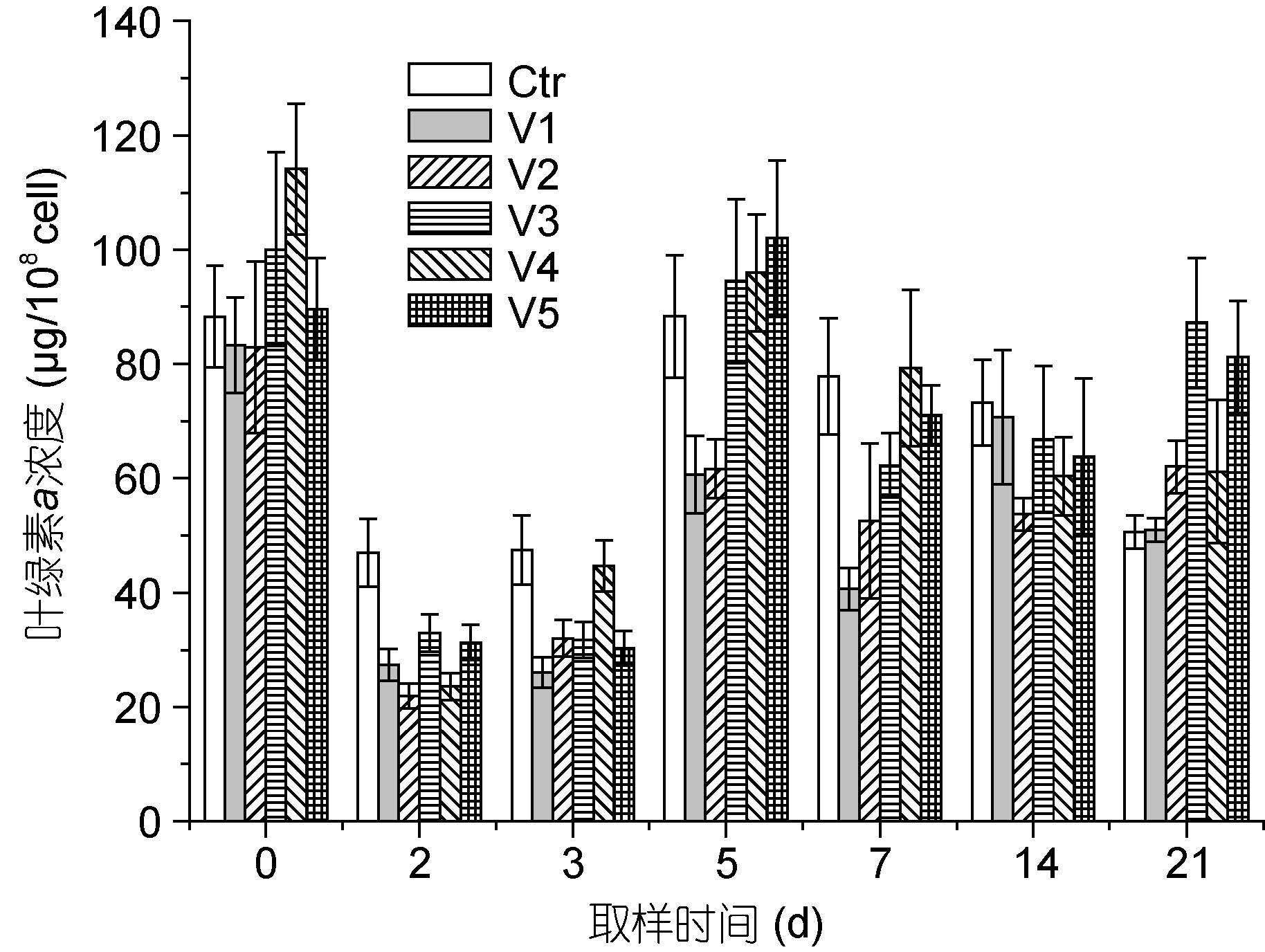 |
| 图 2 As(V)暴露条件下藻细胞叶绿素a含量的变化 Fig. 2 Effect of As(V)exposure on Chl-a content in C. mulleri |
图 3显示,在As(V)暴露48 h时,牟氏角毛藻细胞GSH含量分析结果发现,处理组GSH含量均明显低于对照(3.23μg/108cell)(P<0.01),且随着As(V)暴露浓度的升高呈先升高后逐渐降低的趋势; 其中,V2组(1.91μg/108cell)为各处理组中的最高值(P<0.01),V5组最低,但与V4组差异不明显。结果表明,As(V)暴露对藻细胞GSH含量具有显著的抑制作用; 但在低浓度范围的As(V)暴露对GSH含量的抑制作用随着As(V)浓度的升高而减弱,而暴露浓度超过一定限值时则反之。
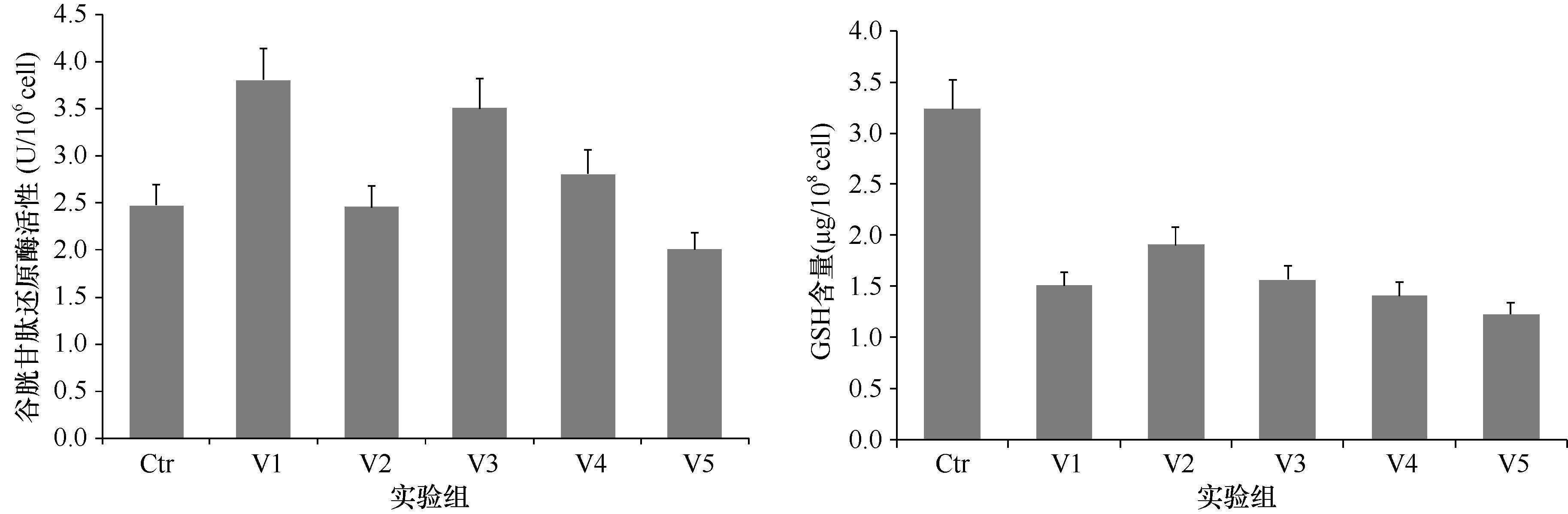 |
| 图 3 As(V)暴露条件下藻细胞GSH含量与谷胱甘肽还原酶活性的变化 Fig. 3 Effects of As(V)exposure on GSH content and glutathione reductase activity in C. mulleri |
As(V)暴露条件下,藻细胞谷胱甘肽还原酶活性基本呈随着As(V)浓度升高而降低的趋势。其中,V1组谷胱甘肽还原酶活性(3.80U/106cell)最高,明显高于对照(2.47U/106cell),但与V3差异不显著; V5明显低于对照,仅为2.01U/106cell,其它两个处理组与对照差异不明显。较低浓度的As(V)暴露会诱导谷胱甘肽还原酶活性升高,而As(V)暴露浓度过高时则抑制了谷胱甘肽还原酶酶活性。
3 讨论 3.1 As(V)胁迫对牟氏角毛藻培养水体中磷酸盐含量的影响砷与磷同处元素周期表的第V主族,因此砷酸盐与磷酸盐具有许多相似的化学性质。As(V)与磷酸盐在生物吸收过程中存在明显竞争,少磷条件下淡水浮游植物细胞合成更多的磷/iAsv转运体而增加对iAsv的吸收(Zhao et al,2009); As(V)与细胞的结合常数也远远低于无磷条件(龚艳等,2009)。本研究表明,在长期共存条件下,适当浓度As(V)会促进牟氏角毛
藻对磷酸盐的吸收速度,而较低暴露浓度时则反之(表 1)。适当浓度As(V)可能促进了磷/iAsv转运体合成而又尚未对磷酸盐吸收形成明显抑制,从而增加表现为磷酸盐的吸收速度升高。As(V)暴露条件下,不同供磷、氮及有机质水平时牟氏角毛藻等海洋硅藻的营养盐吸收及砷富集动力学有待进一步研究,海洋微藻细胞对的砷的转运、转化的生化、分子机理研究也有待加强。
3.2 As(V)胁迫对牟氏角毛藻生长、色素合成的影响及其机理研究砷对微藻生长率的影响因藻种不同而有差异,As(V)对三角褐指藻的毒性作用随磷酸盐浓度降低受到抑制,而对叉边金藻的毒性作用不受磷酸盐浓度影响。本结果发现,所有处理组藻细胞密度在整个试验期间均呈波动性增长趋势,第3—5天时均有所降低,之后又出现恢复生长的现象(图 1)。这表明,适当浓度As(V)会促进牟氏角毛藻生长,但高浓度、长期暴露对藻细胞繁殖具有一定的抑制作用,这与肖虹滨等(1995)和龚艳等(2009)的结果一致。而As(V)对不同微藻的毒性作用会因藻种、磷酸盐含量不同而有所差异,其机理仍需进一步证实。本研究发现,在As(V)暴露初期牟氏角毛藻细胞叶绿素a含量显著低于对照,而长期暴露时一定浓度的As(V)会促进藻细胞叶绿素a合成(图 2),这与龚艳等(2011)的结果一致。无机砷对微囊藻叶绿素a含量的影响与砷形态有关,As(Ⅲ)长期暴露对微囊藻的光合作用有抑制效应(龚艳等,2011); 暴露于As(Ⅲ)48h时,铜绿微囊藻(Microcystis aeruginosa)细胞中叶绿素a合成明显受到抑制,且受抑制程度比类胡萝卜素更显著(Wang et al,2012)。因此,As(Ⅲ)暴露对牟氏角毛藻细胞色素合成及光合作用的影响及其机理研究有待开展。
3.3 As(V)胁迫对牟氏角毛藻细胞抗氧化活性的影响及其解毒机制GSH及植物鳌合肽(PCs)类物质在植物的解毒过程中具有重要作用(Esterbauer et al,1978),但其解毒效果随着毒性物质种类、暴露浓度、暴露时间等不同而发生变化(田丹等,2010)。砷可以刺激大叶井口边草中GSH 的产生,并通过络合作用与砷形成As-GSH; 植物体内As(V)向As(Ⅲ)的转化也可能与GSH类物质有关(黄泽春等,2003)。本研究发现,As(V)暴露对牟氏角毛藻GSH含量具有显著的抑制作用; 但在低浓度范围的As(V)暴露对GSH含量的抑制作用随着As(V)浓度的升高而减弱(图 3右),而高浓度的As(V)暴露可能会对牟氏角毛藻细胞造成氧化损伤,但损伤程度随暴露时间的变化则有待进一步证实。较低浓度的As(V)暴露会诱导谷胱甘肽还原酶活性升高(图 3左),但As(V)暴露浓度过高时导致牟氏角毛藻细胞损伤,而抑制了谷胱甘肽还原酶基因的表达或其酶分子活性,其具体机理有待进一步探究。综上所述,有关海洋浮游植物、大型藻类等的砷富集、转化和解毒机制研究亟待加强,这对近海砷污染的生物生态效应及其生物修复具有重要意义。
 2016, Vol. 47
2016, Vol. 47


