
中国海洋湖沼学会主办。
文章信息
- 宁加佳, 杜飞雁, 王雪辉, 王亮根, 谷阳光, 李亚芳. 2016.
- NING Jia-Jia, DU Fei-Yan, WANG Xue-Hui, WANG Liang-Gen, GU Yang-Guang, LI Ya-Fang. 2016.
- 南沙群岛西南部陆架区底层鱼类营养结构研究
- THE TROPHIC STRUCTURE OF DEMERSAL FISH SPECIES IN SOUTHWESTERN CONTINENTAL SHELF OF NANSHA ISLANDS, SOUTH CHINA SEA
- 海洋与湖沼, 47(2): 468-475
- Oceanologia et Limnologia Sinica, 47(2): 468-475.
- http://dx.doi.org/10.11693/hyhz20151100282
-
文章历史
- 收稿日期:2015-11-13
- 改回日期:2016-01-03
生物群落结构特征的定量分析是比较生物群落是否发生演替的重要基础,在生态学研究中具有非常重要的作用。传统的研究方法主要根据基本指数如物种组成、丰富度及丰度衡量生物群落的结构特征。但是在不同时空尺度上的物种和功能群是不断发生变化的,尤其是对于动物群落来说(Sheaves,2006; Heino,2009),而这些变化并不表明群落的稳定性发生改变。
因此,可以利用能最终反映能量流动过程的食物网分析,对群落结构特征进行描述(Lindeman,1942; Bersier et al,2002; Kaartinen et al,2012)。食物网历来都是生态学研究的热点,实际上食物网主要表现为物种和物种之间的营养关系(Paine,1980; Polis et al,1996)。营养关系是群落内生物数量变动的重要调节因素,其变动直接影响种群和群落的结构和动态。
认清动物的食性是理解其营养关系的第一步,但是想要定量的收集它们的食物信息相当困难。过去定量研究的手段主要通过胃含物分析法进行,但此方法在食物辨认、反映食物的吸收和估算营养级等方面还存在着一些不足(Bitterlich et al,1984; Michener et al,1994; Gu et al,1996)。随着技术的发展,稳定同位素分析方法已经成为研究食物网营养结构的重要手段之一(Fry,2006),该方法可提供物种时空变化整合过程中长期积累的营养数据,能准确便捷地反映各种生物的营养信息(Michener et al,1994)。碳稳定同位素比值(δ13C)常用于判断生物间的营养关系(DeNiro et al,1978; Fry et al,1984),氮稳定同位素比值(δ15N)能计算消费者在食物网中的营养位置(Cabana et al,1996; Vander Zanden et al,1999)。此外,Layman等(2007a)根据生态形态学研究中的物种形态特征二维表示法,提出了基于δ13C—δ15N量化的营养结构的群落范围指标,这些指标不仅可以量化食物网的营养多样性程度和冗余程度,而且还能用于描述物种水平的生态位宽度和重叠度,评价每个物种在食物网中的营养生态位及其作用。近年来,该方法已广泛应用于环境变化及生物干扰等因素对水生食物网影响的研究中(Layman et al,2007b; Delong et al,2011; Jackson et al,2012)。
目前国内南海区域相关的生态学研究多侧重于生物群落多样性及其结构特征的季节和空间变化等方面,而关于营养结构的研究十分欠缺,仅有的报道所采用的方法为胃含物分析法(张月平,2005)和模型法(陈作志等,2010),在应用稳定同位素方法示踪生态系统能流途径和分析食物网营养结构等方面的研究鲜有报道(杨国欢等,2013)。为此,本研究利用碳氮稳定同位素技术探讨南沙群岛西南部陆架区底层鱼类的碳和氮稳定同位素组成特征,分析底层鱼类的营养位置,评析食物网的营养层次、冗余程度及生态位宽幅等,以期在丰富生态学研究内容的同时,为南沙群岛西南部陆架区渔业资源的科学管理和持续利用提供理论依据。
1 材料与方法 1.1 样品采集与处理鱼类样品采自2013年9月在南沙群岛西南部陆架区(图 1)进行的底层单拖网调查,网具规格为128.00m×92.26m(48.90m),网衣全长92.26m,网口周长128.00m,浮纲长48.90m,沉纲长59.40m,网口目大300mm,网囊目大50mm,拖网时间为1h,航速3节。样品带回实验室分类鉴定和个体全长测定后,进行稳定同位素样品采集。鱼类取其背部白色肌肉作为分析样品。浮游动物桡足类采用大型浮游生物网(网孔直径为505μm)由水底至水表垂直采集,用孔径为0.7μm玻璃纤维滤膜(Whatman GF/F)抽滤过的海水清养2h使其排除消化道内含物,再用蒸馏水将其洗净后取整体作为分析样品。将以上稳定同位素样品在60°C下烘48h至恒重,用研钵将样品研磨成粉末,放入干燥器中保存待测。
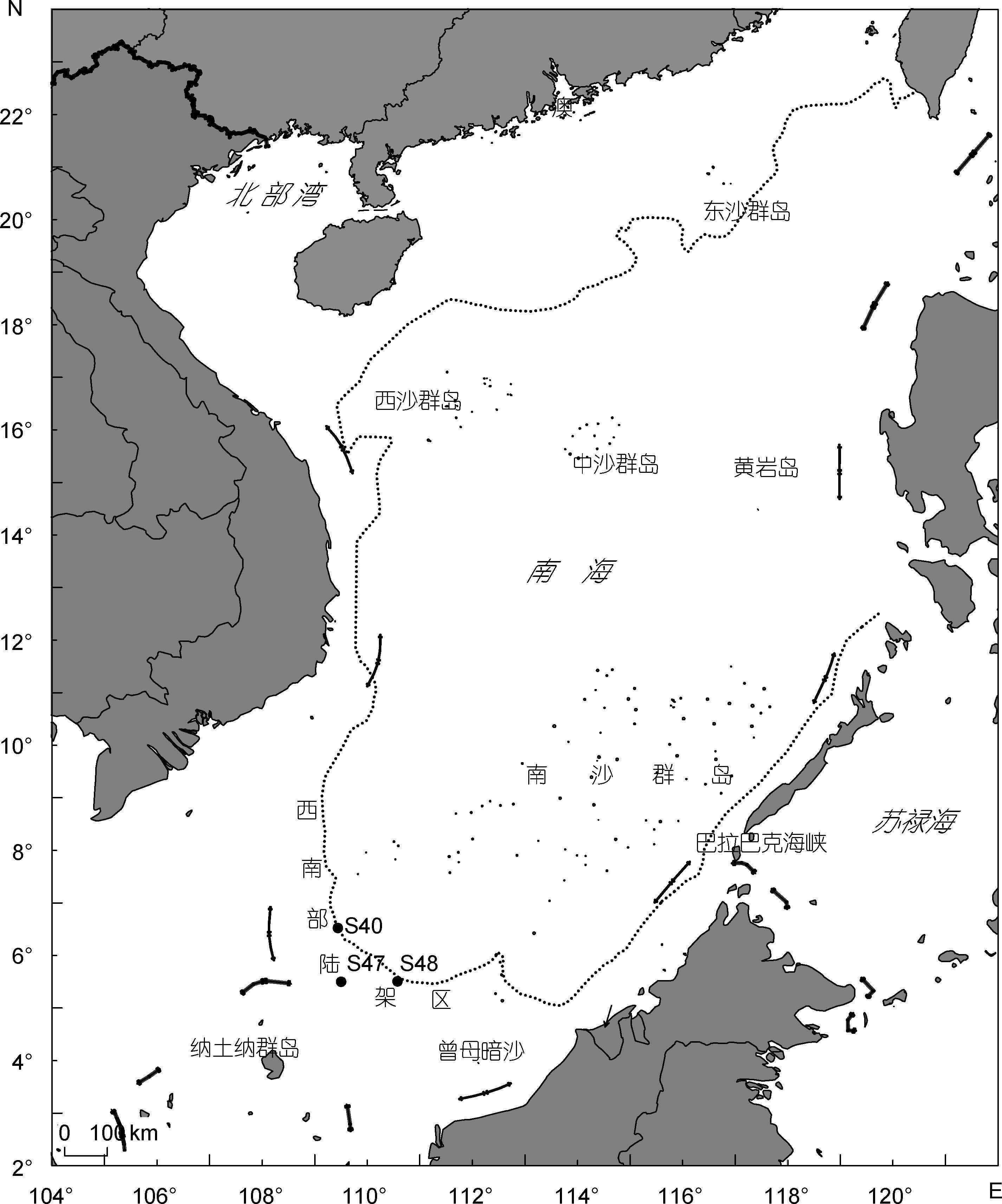 |
| 图 1 南沙群岛西南部陆架区地理位置和采样站位示意图 Fig. 1 Map of the southwestern continental shelf of Nansha Islands and location of sampling stations |
样品的稳定同位素比值在中国农业科学院农业环境稳定同位素实验室进行测定。所用仪器为Vario PYRO Cube型元素分析仪和Isoprime—100型稳定同位素比值分析仪,获得的稳定同位素比值用δ表示:
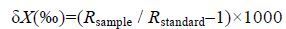
其中,X=13C或15N; R=13C/12C或15N/14N; Rsample为样品的同位素比值,Rstandard为标准物质的同位素比值。碳和氮同位素标准样品分别采用VPDB(拟箭石)和大气氮,为保证实验结果的准确性和仪器的稳定性,每测试12个样品穿插一个标样进行校正。样品δ13C和δ15N值分析精度为±0.2‰。
1.3 数据处理与分析鱼类的营养位置(TP)通过如下公式计算:
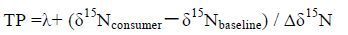
式中,δ15Nbaseline为基线生物的δ15N值(即λ=1时,δ15Nbaseline为生产者δ15N,而λ=2时,δ15Nbaseline为初级消费者δ15N值),本研究用浮游动物桡足类的δ15N值为δ15Nbaseline。δ15Nconsumer为鱼类的δ15N值,Δδ15N为营养级传递过程中δ15N的富集值,每营养级的平均值约为3.4‰(Post,2 002)。
另外,以δ13C和δ15N为横及纵坐标,绘制不同鱼类种类的δ13C—δ15N值的双位图,并以此计算了基于稳定同位素量化的营养结构的群落范围指标(Community-wide metrics)(Cornwell et al,2006; Layman et al,2007a,2007b),该指标包括如下六个参数:
(1) δ13C的范围(CR): 具有最高δ13C和最低δ13C值的两个物种之间的δ13C值距离(δ13C最高值-δ13C最低值)。
(2) δ15N的范围(NR): 具有最高δ15N和最低δ15N值的两个物种之间的δ15N值距离(δ15N最高值-δ15N最低值)。
(3) 总面积(TA): 由所有物种在δ13C—δ15N双位图上组成的多边形面积。
(4) 到重心的平均距离(CD): 每一个物种到δ13C—δ15N双位图重心的平均欧氏距离,此重心是食物网中所有物种的δ13C和δ15N的平均值。
(5) 平均最近相邻距离(NND): δ13C—δ15N双位图内每个物种与其最近的相邻物种的平均欧氏距离。
(6) 最近相邻距离的标准偏差(SDNND): δ13C— δ15N双位图上每个物种与其最近相邻物种欧氏距离标准偏差的平均值。
以上各参数计算方法参考Layman等(2007a)。
2 结果 2.1 鱼类的种类组成调查期间共采集鱼类24种,隶属于8 目 20 科22 属,分别为鲈形目9科9属9种,鲀形目2科2属2种,鲉形目2科3属3种,鲽形目1科1属1种,鮟鱇目3科3属3种,灯笼鱼目1科2属3种,鼠鲨目1科1属2种及鳐形目1科1属1种。
鱼类的全长范围为5.6—336cm,除带鱼(Trichiurus haumela)、斑鳐(Raja kanojei)、狐形长尾鲨(Alopias vulpinus)和浅海长尾鲨(Alopias pelagicus)外,其它鱼类的全长均小于30cm(表 1)。
| 代码 | 种类 | 全长范围(cm) | 全长(cm) | δ13C值(‰) | δ15N值(‰) | 样本量(n) |
| 1 | 弓背鳄齿鱼Champsodon atridorsalis | 8.9—9.6 | 9.2±0.4 | -19.2±0.1 | 7.9±0.1 | 3 |
| 2 | 绿鳍鱼Cheilidonichthys kumu | 7.6—12.3 | 9.6±2.4 | -19.5±0.2 | 8.4±0.5 | 3 |
| 3 | 颌圆鲹Decapterus lajang | 16.1—20.4 | 17.9±2.2 | -19.2±0.5 | 8.5±0.4 | 3 |
| 4 | 绿鳍马面鲀Navodon septentrionalis | 22.4 | 22.4 | -19.8 | 8.5 | 1 |
| 5 | 日本红娘鱼Lepidotrigla japonica | 12.9 | 12.9 | -19.5 | 8.7 | 1 |
| 6 | 斑鳐Raja kanojei | 44.5—71 | 57.7±13.3 | -18.4±0.2 | 8.7±0.3 | 3 |
| 7 | 尾斑鲬状鱼Bembrops caudimacula | 7.2—8.9 | 8.2±0.9 | -19.3±0.2 | 9.2±0.2 | 3 |
| 8 | 大鳞拟棘鲆Citharoides macrolepidotus | 13.6 | 13.6 | -18.9 | 9.3 | 1 |
| 9 | 条尾鲱鲤Upeneus bensasi | 10.5—11.2 | 10.7±0.4 | -20.0±0.3 | 9.4±0.3 | 3 |
| 10 | 勒氏蓑鲉Pterois russelli | 5.6—15.3 | 10.5±6.9 | -20.1±1.8 | 9.4±1.2 | 2 |
| 11 | 瓦氏软鱼Malakichthys wakiyai | 6.6—7.6 | 7.1±0.5 | -19.7±0.1 | 9.6±0.2 | 3 |
| 12 | 棘茄鱼Halieutaea stellata | 5.7 | 5.7 | -19.0 | 9.6 | 1 |
| 13 | 鳞首方头鱼Cubiceps squamiceps | 15.0—19.0 | 16.8±2.0 | -20.4±0.4 | 9.7±0.6 | 3 |
| 14 | 带鱼Trichiurus haumela | 43.1—48.2 | 45.7±3.6 | -19.6±0.1 | 9.8 | 2 |
| 15 | 白点宽吻鲀Amblyrhynchotus honcheni | 6.6—14.2 | 10.1±3.8 | -19.4±0.4 | 9.9±1.2 | 3 |
| 16 | 叉斑狗母鱼Synodus macrops | 11.4—24.7 | 15.9±7.6 | -19.2±0.6 | 9.9±0.2 | 3 |
| 17 | 短蛇鲭Rexea prometheoides | 19.4—25.1 | 22.3±4.0 | -18.9±0.4 | 10.0±0.9 | 2 |
| 18 | 长蛇鲻Saurida elongata | 12.5—19.1 | 15.9±3.3 | -18.8±0.2 | 10.2±0.3 | 3 |
| 19 | 多齿蛇鲻Saurida tumbil | 13.5—16.0 | 14.5±1.3 | -18.7±0.3 | 10.2±0.3 | 3 |
| 20 | 单棘躄鱼Chaunax fimbriatus | 10.7—14.5 | 12.3±2.0 | -18.7±0.1 | 10.2±0.2 | 3 |
| 21 | 黑鮟鱇Lophiomus setigerus | 13.9—23.1 | 18.9±4.6 | -18.3±0.2 | 10.8±0.3 | 3 |
| 22 | 短尾大眼鲷Priacanthus macracanthus | 9.5—22.4 | 17.1±6.8 | -18.9±0.2 | 10.9±0.7 | 3 |
| 23 | 狐形长尾鲨Alopias vulpinus | 102—301 | 202±141 | -17.4±0.3 | 11.1±0.5 | 2 |
| 24 | 浅海长尾鲨Alopias pelagicus | 138—336 | 237±140 | -17.0±0.1 | 12.2±0.4 | 2 |
稳定同位素结果显示,南沙群岛西南部陆架区底层鱼类的平均δ13C值在-20.4‰(鳞首方头鱼C. squamiceps)—-17.0‰(浅海长尾鲨A. pelagicus)之间,均值为(-19.1±0.8)‰; δ15N的均值范围为7.9‰(弓背鳄齿鱼C. atridorsalis)—12.2‰(浅海长尾鲨A. pelagicus),均值为(9.7±1.0)‰(表 1)。
2.3 鱼类群落的营养结构根据δ13C—δ15N值的双位图(图 2),得出基于稳定同位素量化的营养结构的群落范围指标: CR和NR值分别为3.4和4.3,TA值约为5.8,CD值为1.0,NND及SDNND值分别为0.37和0.43。
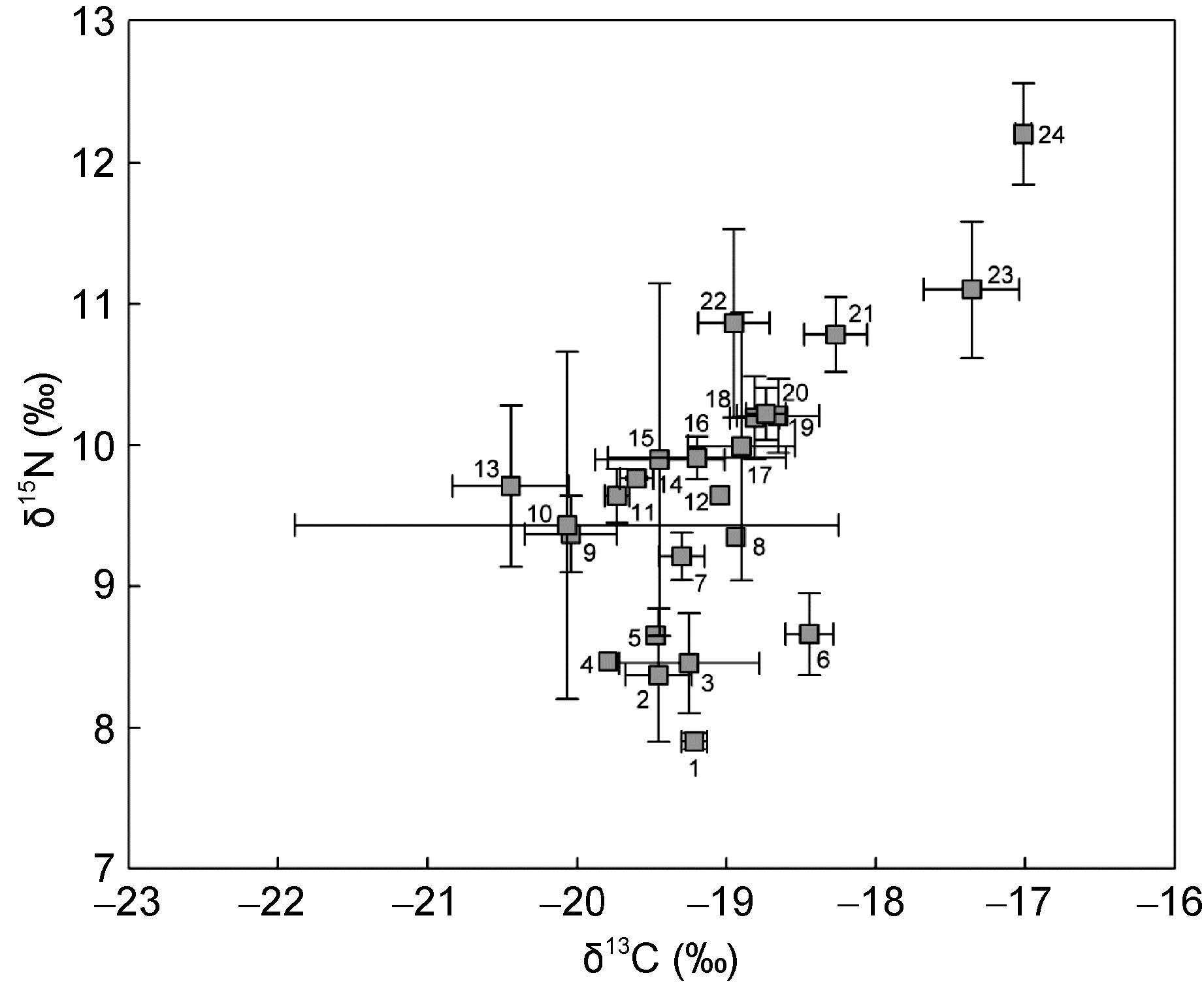 |
| 图 2 鱼类的δ13C和δ15N值的双位图 Fig. 2 Stable isotope biplots of δ13C and δ15N values of the demersal fish species |
此外,通过δ15N值及营养位置的计算公式得出,南沙群岛西南部陆架区底层鱼类的平均营养位置为3.58±0.29,弓背鳄齿鱼(C. atridorsalis)的最低,为3.06±0.02; 浅海长尾鲨(A. pelagicus)的最高,为4.33±0.11。除狐形长尾鲨(A. vulpinus)和浅海长尾鲨(A. pelagicus)的营养位置高于4.0外,其余22种鱼类均集中在3.0— 4.0之间(图 3)。
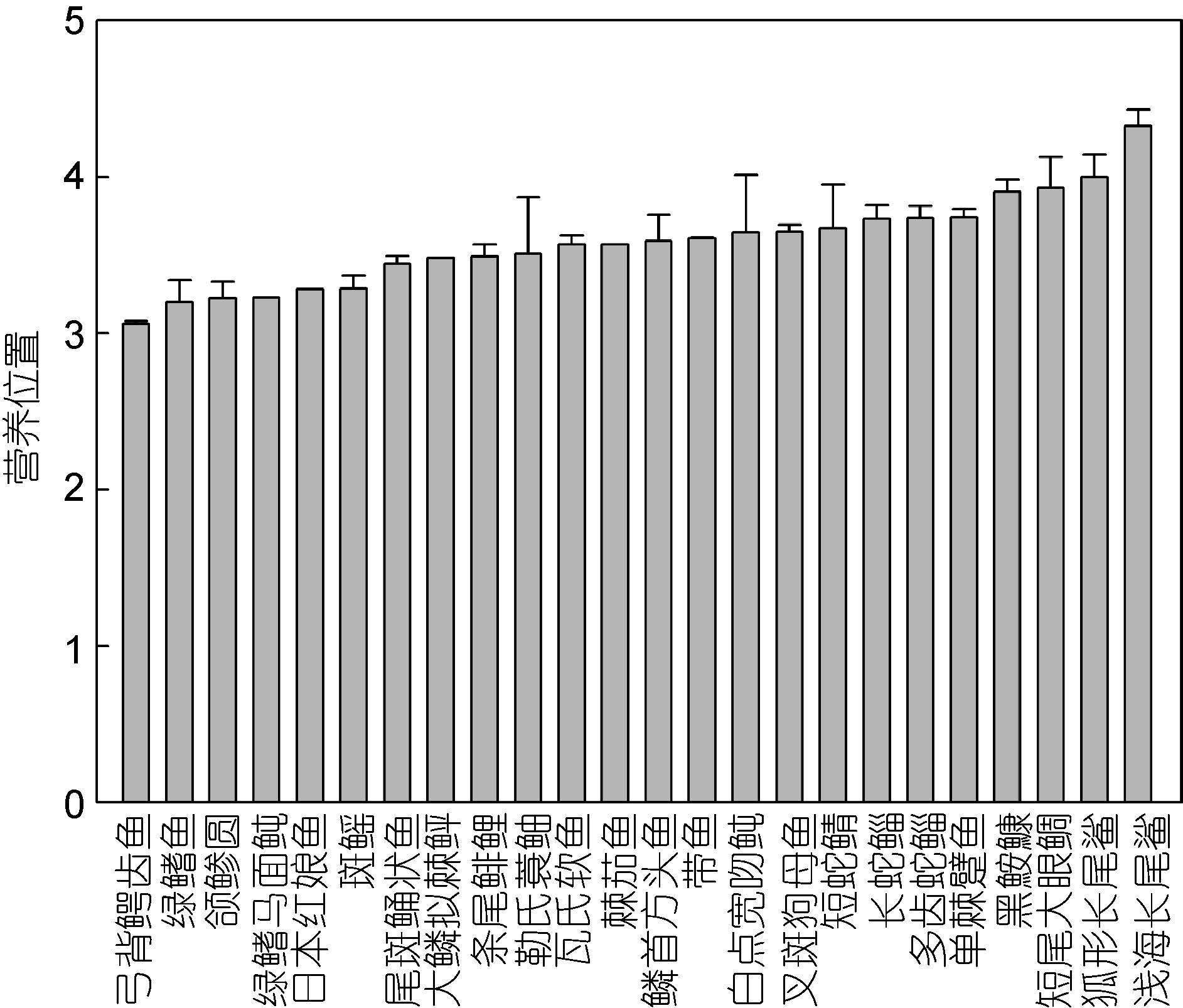 |
| 图 3 鱼类的平均营养位置 Fig. 3 Mean trophic positions(±SD)of the demersal fish species |
近二十多年来,南沙群岛西南部陆架区底拖网作业成为我国南沙群岛海域渔业的重要组成部分(陈丕茂,2003; 陈国宝等,2005; 黄梓荣,2005)。长期的生产和渔业资源调查资料表明,该海域主要渔获种类有20多种,其中以蛇鲻属(Saulida)、大眼鲷属(Priacanthus)等底层鱼类为主(钟智辉等,2005),与本研究所获取的样本种类类似。随着捕捞强度的增大,该海域的渔获率和渔获质量已有所下降,鱼类种类呈现小型化、低龄化趋势,渔业资源结构发生了变化(陈丕茂,2003)。在开发利用的同时,合理的保护已成为渔业资源可持续发展的重要前提。因此,利用科学有效的方法评估鱼类生物群落的食物网结构和营养关系是持续利用和科学保护渔业资源的重要基础。
3.1 南沙群岛西南部陆架区鱼类群落的营养结构特征本研究结果显示,南沙群岛西南部陆架区底层鱼类群落的CR值为3.4,远低于澳大利亚莫顿湾的9.0及美国红树林生境的11.2(Melville et al,2005; Vaslet et al,2012)。CR值表征食物网中初始食源的多样性特征,CR值越低,表明食物网中的初始食源越少,反之则越多(Layman et al,2007a)。澳大利亚莫顿湾和美国红树林生境均位于沿岸海域,初始食源丰富多样,有红树植物、海草、底栖藻类和浮游植物等,该区域鱼类及其饵料生物的食源选择性大,是这些海域鱼类食物网营养结构具有较高CR值的主要原因数字编号代表鱼类: 1=弓背鳄齿鱼、2=绿鳍鱼、3=颌圆鲹、4=绿鳍马面鲀、5=日本红娘鱼、6=斑鳐、7=尾斑鲬状鱼、8=大鳞拟棘鲆、9=条尾鲱鲤、10=勒氏蓑鲉、11=瓦氏软鱼、12=棘茄鱼、13 =鳞首方头鱼、14=带鱼、15=白点宽吻鲀、16=叉斑狗母鱼、17=短蛇鲭、18=长蛇鲻、19=多齿蛇鲻、20=单棘躄鱼、21=黑鮟鱇、22=短尾大眼鲷、23=狐形长尾鲨和24=浅海长尾鲨 (Melville et al,2005)。同时多样化的初始食源也为鱼类食物网营养生态位的多样化提供了物质基础。而南沙群岛西南部陆架区远离大陆,而且水深较深,除浮游植物外,没有发现大型藻类和陆源输入的初始食源。与加泰罗尼亚海域和坎伯兰海峡的鱼类营养结构研究结果一致(Fanelli et al,2011; McMeans et al,2013),初始食源单一,是导致南沙群岛西南部陆架区底层鱼类群落CR值较低的主要原因。
NR值代表食物网的垂直结构,NR值越高表示食物网中消费者占有更多的营养层次,也意味着食物链长度越长(Layman et al,2007a)。南沙群岛西南部陆架区底层鱼类群落的NR值为4.3,即鱼类群落的δ15N差值为4.3‰,由于δ15N值在营养级传递过程中每营养级的平均值约为3.4‰(Post,2002),由此换算成营养层次为1.3个营养层次,而鱼类的营养级通常在2.0—5.0之间(Pauly et al,2005),为3个营养层次,因此表明鱼类食物网的营养层次较少,其与鱼类的营养位置跨度仅为1.27这一计算结果是相吻合的。Al-Habsi等(2008)对西阿拉伯海及Nilsen等(2008)对挪威南峡湾鱼类营养结构的研究中也有类似报道。但是,南沙群岛西南部陆架区食物网中消费者最高营养位置为浅海长尾鲨的4.33±0.11,也即是该海域的食物链长度,却高于西阿拉伯海及挪威南峡湾(Al-Habsi et al,2008; Nilsen et al,2008)。Pimm(1982)认为,初级生产力较高的区域,能量可以维持并传递给更高营养级的生物。因此,南沙群岛西南部陆架区因受温跃层阻隔及长期性内波现象的影响,底层营养盐丰富、有较高的生产力,饵料生物生物量高(杜飞雁等,2014; 中国科学院南沙综合科学考察队等,1996),致使该海域食物链长度较阿拉伯海和挪威南峡湾长。
TA和CD值分别代表食物网营养级多样性的总程度和平均程度(Layman et al,2007a)。通过计算,南沙群岛西南部陆架区底层鱼类群落的TA和CD值分别为5.8和1.0,均低于Murdoch等(2013)及Schmidt等(2009)对水域生态系统鱼类群落的研究结果,表明该海域底层鱼类食物网营养级多样性的总程度和平均程度均较低。TA值在一定程度上与CR和NR值相关(Layman et al,2007a),因此CR和NR值影响了TA值的高低。CR和NR值主要受人为因素的影响,如人工填海所造成的栖息地破坏能降低食物网初始食源的多样性程度,使得CR值降低; 过度捕捞导致鱼类营养级降低(Pauly et al,1998),造成NR值降低。陈丕茂(2003)和黄梓荣(2005)认为,过度捕捞使得南沙群岛西南部陆架区大型捕食者缺乏,导致系统的捕食压力降低,结果小型鱼类容易在系统内占据优势地位,使得渔获物的平均营养级下降(Pauly et al,1998)。由于南沙群岛西南部陆架区不存在栖息地破坏,因此底层鱼类食物网营养级多样性的总程度和平均程度较低主要应与该海域捕捞强度较大有关。
NND和SDNND值反映了食物网营养冗余度的高低。当食物网中具有相似生态营养级的物种占多数时,NND值较低,而此时食物网营养冗余程度较高,群落中不同种类之间的营养生态位比较均匀,宽幅较小。与之类似,较低的SDNND值意味着营养级分布更均匀,营养冗余程度较高(Layman et al,2007a)。南沙群岛西南部陆架区底层鱼类群落NND和SDNND值仅分别为0.37和0.43,远低于河口及滨海生境(Abrantes et al,2014; Sabeel et al,2015),说明该海域底层鱼类食物网的营养冗余程度较上述两个海域的高。由营养位置的计算结果可知,本研究所获取的鱼类均为肉食性鱼类,而且很多种类食性相近(杨纪明,2001; 张月平,2005)。其中,除狐形长尾鲨和浅海长尾鲨为三级消费者外,其余22种鱼类的营养位置均集中在3.0— 4.0之间。此外,还存在一些同类相食的种类,如多齿蛇鲻和带鱼等(颜云榕等,2010,2012)。表明南沙群岛西南部陆架区底层鱼类不同种类之间的营养生态位宽幅较小,重叠程度较高,食物竞争激烈。
3.2 基于鱼类群落营养结构特征的渔业管理建议在δ13C和δ15N值所围成的双位图中,位于不规则多边形顶点的浅海长尾鲨和狐形长尾鲨作为顶级捕食者,其δ13C和δ15N值均大于其它鱼类,在整个营养框架中具有重要的作用。如果这两种鱼类在食物网中缺失,将导致度量参数CR、NR和TA值降低,也就是说鱼类食物网的营养多样性总程度会下降,从而影响整个食物网的营养结构(Layman et al,2007a)。与之不同,如果多齿蛇鲻(δ13C=(-18.7±0.3)‰,δ15N =(10.2±0.3)‰)缺失将不会导致CR、NR和TA值发生变化,因为长蛇鲻(δ13C=(-18.8±0.2)‰,δ15N =(10.2± 0.3)‰)和单棘躄鱼(δ13C=(-18.7±0.1)‰,δ15N =(10.2± 0.2)‰)的营养生态位与多齿蛇鲻的很相似,它们相当于冗余种类。它们当中某一种类的缺失不会影响食物网的营养多样性总程度,也不会引起生态系统内其它物种的缺失,同时对整个群落和生态系统的结构和功能不会造成太大的影响。与此类似的还有条尾鲱鲤和勒氏蓑鲉以及瓦氏软鱼和带鱼。因此,根据以上分析,在对南沙群岛西南部陆架区渔业资源进行开发利用时,可根据目标鱼种在该海域生态系统营养结构中的实际位置和作用,确定相应可捕量,加大对关键物种和功能群的保护力度。如在南沙群岛西南部陆架区应禁止捕捞浅海长尾鲨和狐形长尾鲨等高营养等级鱼类,而对多齿蛇鲻、条尾鲱鲤和带鱼等冗余种类可进行适度捕捞,以维持鱼类群落营养结构的完整性,在渔业资源合理开发和持续利用的同时,有效的保护海洋生态系统的安全发展。
4 结论本文利用稳定同位素方法初步分析了南沙群岛西南部陆架区底层鱼类的营养结构,结果表明: 该海域鱼类以肉食性为主,初始食源较为单一; 鱼类食物网营养层次较少,营养级多样性的总程度和平均程度均较低,营养冗余程度较高,不同种类之间的营养生态位幅宽较小,重叠程度较高。此外,在对该海域渔业资源进行开发利用时,应禁止捕捞浅海长尾鲨和狐形长尾鲨这类在南沙群岛西南部陆架区底层鱼类群落营养结构中起着重要作用的种类,而一些冗余种类(如多齿蛇鲻、条尾鲱鲤和带鱼等)可以适度捕捞,以维持底层鱼类群落营养结构的完整性,确保海洋生态系统的安全发展。
 2016, Vol. 47
2016, Vol. 47


