
中国海洋湖沼学会主办。
文章信息
- 李晶晶, 李云, 刘红, 戴习林, 蒋飞, 丁福江. 2016.
- LI Jing-Jing, LI Yun, LIU Hong, DAI Xi-Lin, JIANG Fei, DING Fu-Jiang. 2016.
- 感染溶藻弧菌及白斑综合症病毒后凡纳滨对虾不同组织的Toll样受体基因表达变化研究
- THE EXPRESSION OF TOLL-LIKE RECEPTORS IN DIFFERENT TISSUES OF LITOPENAEUS VANNAMEI AFTER CHALLENGES WITH WHITE SPOT SYNDROME VIRUS AND VIBRIO ALGINOLYTICUS
- 海洋与湖沼, 47(2): 476-483
- Oceanologia et Limnologia Sinica, 47(2): 476-483.
- http://dx.doi.org/10.11693/hyhz20151000276
-
文章历史
- 收稿日期:2015-10-28
- 改回日期:2016-01-12
2. 上海申漕特种水产开发公司 上海 201516
2. Shencao Special Aquatic Product Development Company, Shanghai 201516, China
凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾,因其具有出肉率高、抗逆性强、生长快、繁殖期长、耐高密度及低盐度养殖、便于活虾运输等优点(王兴强等,2004),已成为我国重要的经济养殖虾类,与罗氏沼虾和斑节对虾并称为世界三大养殖虾类。自我国凡纳滨对虾人工育苗技术成功突破以来,已在全国范围内进行了大规模的人工养殖。但是近年来随着养殖规模的不断扩大,养殖强度的增加以及养殖环境的恶化,特别是各类病毒及细菌性疾病的频繁暴发,导致养殖产量骤降,经济损失十分严重。所以急需通过生物学手段,研究虾体自身免疫调控,从而寻找到有效提高虾体免疫力及抗病力的方法,运用到凡纳滨对虾的人工养殖中。
与脊椎动物不同,无脊椎动物不具备获得性免疫系统,只具有依靠体液和细胞免疫的先天性免疫系统。Toll样受体是进化中比较保守的一个受体家族,是参与天然免疫的主要模式识别受体(Pattern recognition receptor,PRR)之一。Toll样受体能识别细菌、真菌、病毒及寄生虫的多种病原相关分子模式 PAMP(pathogen associated molecular pattern)(包括脂类、脂蛋白、蛋白质、聚糖和核苷酸),也能识别体内的代谢产物或组织细胞损伤、坏死时释放或分泌的分子,激活天然免疫系统来抵抗病原微生物的入侵,是连接先天性免疫和获得性免疫的桥梁(Kawai et al,2011; O’Neill et al,2013)。特定的Toll样受体能识别PAMP,激活MyD88(髓样分化因子88)依赖性和非MyD88依赖性细胞信号通路,触发炎性细胞因子和Ⅰ型干扰素的释放来进行宿主防御,诱导机体免疫系统对病原微生物进行清除( 罗兵等,2011)。近年来,关于甲壳动物Toll样受体基因的研究也逐渐增多,其中多种虾类的Toll样受体基因相继被克隆,例如: 斑节对虾(Arts et al,2007)、凡纳滨对虾(Yang et al,2007)、日本囊对虾(Mekata et al,2008)、中国明对虾(Yang et al,2008)等。而越来越多的报道证明在虾类存在多种不同类型的Toll样受体基因,其中日本囊对虾已报道2种Toll样受体基因(Mekata et al,2008),凡纳滨对虾中已发现3种不同类型Toll样受体基因(Yang et al,2007; Wang et al,2012)。Wang等(2012)研究发现,白斑综合症病毒感染可以引起凡纳滨对虾鳃部LvToll1、LvToll2和LvToll3基因的表达显著升高; 而感染溶藻弧菌(Vibrio alginolyticus)只能引起鳃中LvToll1基因的表达显著升高。与之相反,多种病原相关分子模式均可以引起日本囊对虾血淋巴Toll2基因的表达量的显著提高(Mekata et al,2008)。所以推测虾类不同类型的Toll样受体基因可能具有不同的免疫调控功能。但由于之前对于病原体感染所引起的虾类Toll样受体基因表达变化的相关研究主要集中于单一组织(Yang et al,2008; Wang et al,2012),所以关于不同类型Toll样受体在不同组织参与免疫调控机理以及生理功能差异还有待进一步研究。
本文比较和分析了目前所知的几种凡纳滨对虾Toll样受体基因在虾体感染不同病原微生物后不同免疫组织中的表达变化差异。同时比较了短期和长期感染情况下,不同组织中几种Toll样受体的表达变化情况,并初步探讨了不同类型Toll样受体基因参与先天免疫调控的机理,为进一步研究凡纳滨对虾的免疫调控机制和不同类型Toll样受体的具体生理功能差异提供一定的理论基础。
1 材料与方法 1.1 实验材料凡纳滨对虾采自上海申漕特种水产开发公司,体长(12 ± 0.8)cm,体重(10.8 ± 0.6)g。选取体格健壮,规格大致相同的实验用虾分养于多个水族缸里。实验开始前,随机抽取实验用虾进行白斑综合症病毒和溶藻弧菌感染检测,以确保实验用虾不存在病原体感染。养殖期间保持自然光照,水温(26 ± 1)°C,盐度30 ± 0.5,pH值8.0 ± 0.2,24h保持人工通气和循环过滤海水。感染实验前实验用虾驯养1周,使其适应实验环境。
1.2 方法 1.2.1 溶藻弧菌(Vibrio alginolyticus)菌悬液的制备参考刘志刚等(2012)制备方法将经液体石蜡保藏法保存的溶藻弧菌菌种接种于牛肉膏蛋白胨液体培养基上(蛋白胨0.5g,牛肉膏0.3g,酵母粉0.1g,NaCl2g,去离子水100mL,pH调至7.2左右)活化后,再经TCBS培养基活化一次,37°C培养24h,然后挑取长势良好的溶藻弧菌菌落接种到牛肉膏蛋白胨培养基中,放置于恒温振荡培养箱。在28°C,200r/min条件下富集培养24h后,在4°C,4000r/min条件下离心10mi n,将上清液弃去,采用无菌生理盐水洗涤沉淀2次。利用细菌平板计数法,按要求稀释成浓度为2.4×106 CFU/mL的菌悬液,于4°C冰箱中保存备用。
1.2.2 白斑综合症病毒(WhiteSpot Syndrome Virus,WSSV)病毒的制备 WSSV病毒精提液病毒粒子由上海海洋大学食品学院王永杰教授处提供,原浓度1×108 copy/μL,-80°C保存,使用之前将病毒液在冰上解冻,用预冷的无菌生理盐水将浓度稀释为103 copy/μL。
1.2.3 感染试验随机挑选健康规格一致的虾体作为实验用虾,平均体重为11.45g。将实验用虾分为两组,采用为肌肉注射法进行致病微生物感染。其中一组注射0.2mL浓度为2.4×106 CFU/mL的溶藻弧菌; 另一组注射0.2mL浓度为103copies/μL的白斑综合症病毒,每组分三个平行组,每个平行组为30尾虾。分别于注射后0、1、3、6、9、12、24h收集各组组织样品。注射14d后,收集存活个体血淋巴及鳃组织样品。各组织样品于-80°C冰箱中保存,以用于后续实验各目的基因表达量的测定。
1.2.4 总RNA的提取将冻存的组织样品取出,匀浆后,按照TRIzol® reagent试剂盒操作说明提取总RNA。采用核酸蛋白测定仪测定所提RNA样品的OD260及OD280值,以确定RNA的浓度,并用OD260/OD280的比值判断其纯度。0.8%琼脂糖凝胶电泳检测RNA质量。
1.2.5 反转录及引物设计按照TaKaRa PrimeScript® RT reagent Kit With gDNA Eraser(Perfect Real Time)试剂盒操作说明,将之前所提取的总RNA反转录获得cDNA。反转录产物于-20°C保存备用。根据本实验之前所克隆的凡纳滨对虾Toll样受体基因片段序列(叶旻玉等,2008)以及目前已报道的几种凡纳滨对虾Toll样受体基因(GenBank序列号: JN180638,JN180637)和18S基因的序列(NCBI GenBank序列号: EU920969)设计特异性引物(表 1)。
| 引物 | 序列 |
| T1F | GCTAATCTGACCATTCCCTA |
| T1R | TCTCGTCCAACTCGCTCT |
| T2F | CATGCCTGCAGGACTGTTTA |
| T2R | GGCCTGAGGGTAAGGTCTTC |
| T3F | TCGTACAACCAGCTGACGAG |
| T3R | ATACTTCAGGTGGGCCACAG |
| 18S F | CCTCGGTTCTATTTTGTCGGTTT |
| 18S R | GCAGATGCTTTCGCAGTAGGT |
使用ABI PRISM® 7900 Sequence Detection System仪器,参照SYBR®Green Realtime PCR Master Mix试剂盒说明对实验各组样品的Toll样受体基因、18S基因cDNA进行定量测定。ABI PRISM® 7900 Sequence Detection System的具体反应程序设计为:
95°C预变性20s,95°C变性3s,60°C退火30s,72°C延伸30s,共40个循环。最后进行融解曲线分析,以确定PCR产物质量。
1.3 数据统计与分析Real-time PCR分析中,采用 2-DDt计算法对各组样品所测基因进行定量分析。最后采用目的基因与内参基因18S的比值来表示目的基因的相对定量结果。所有数据采用平均值±标准差(means ± SD)表示。采用SPSS 18.0 统计软件来分析数据,用Duncan's multiple range test来检验统计差异,当P<0.05认为差异显著。
2 结果 2.1 凡纳滨对虾不同类型Toll样受体基因的组织表达情况通过real-time PCR法检测发现三种Toll样受体基因在所测各组织中均有表达。Toll1基因在肌肉、血淋巴、心脏和鳃均有较高表达,其中心脏表达量最高; Toll2基因在血淋巴、心脏和鳃均有较高表达,其中在鳃表达量最高; Toll3基因在鳃和心脏有较高表达,其中在鳃表达量最高(图 1)。
 |
| 图 1 凡纳滨对虾3种Toll样受体基因在不同组织表达情况 Fig. 1 The expressions of 3 Toll mRNA in different tissues of white shrimp |
感染实验结果表明: 在溶藻弧菌感染后1h,实验用虾血淋巴3种Toll样受体基因mRNA水平均显著提高(P<0.05),分别为感染前水平的4.51倍、2.34倍和3.17倍(图 2)。感染6h后Toll2 mRNA水平达到最高值,为感染前水平的12.89倍,且明显高于Toll1和Toll3 mRNA水平。感染后12h后Toll1和Toll3 mRNA水平均达到最高值,分别为感染前水平的12.62倍和6.68倍,其中Toll1 mRNA水平显著高于其它2种受体。感染后24h后3种Toll样受体基因mRNA水平均下降,分别为感染前水平的3.86倍、4.31倍和2.98倍,仍明显高于感染前水平(P<0.05),且Toll2 mRNA水平显著高于其它2种Toll样受体基因。
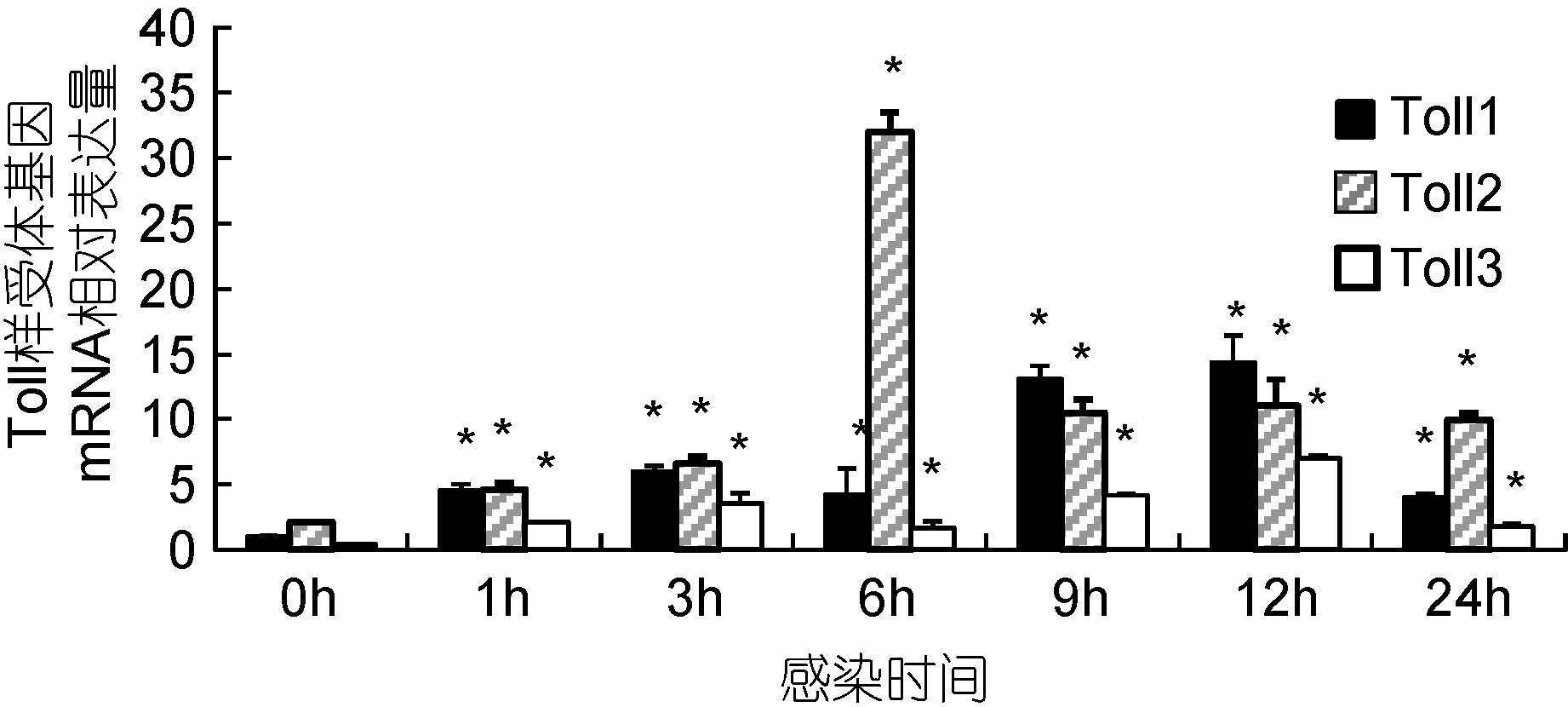 |
| 图 2 溶藻弧菌感染后凡纳滨对虾血淋巴Toll样受体基因表达变化情况 Fig. 2 Changes of three Toll mRNA levels at the haemolymph of white shrimp after injection of V. alginolyticus Data are represented as means±SEM(n=35). |
在溶藻弧菌感染后1h,实验用虾鳃中Toll1和Toll2 mRNA水平均提高,分别为感染前水平的1.22倍和1.35倍,但相对于感染前水平差异不显著(P>0.05),其中Toll1 mRNA水平显著高于其它2种受体(图 3)。感染3h后Toll1 mRNA水平达到最高值,为感染前水平的2.78倍,明显高于感染前水平(P<0.05)。感染后12h后Toll3 mRNA水平达到最高值,为感染前水平的5.85倍,明显高于感染前水平(P<0.05)。感染后24h,Toll1和Toll2 mRNA水平分别为感染前水平的1.12倍和1.45倍,且差异不显著(P>0.05),而Toll3 mRNA水平显著高于感染前水平,为感染前水平的4.61倍,且显著高于Toll1和Toll2 mRNA水平(P<0.05)。在溶藻弧菌感染24h内,凡纳滨对虾鳃的Toll2 mRNA水平相对感染前水平均无显著升高(P>0.05)。
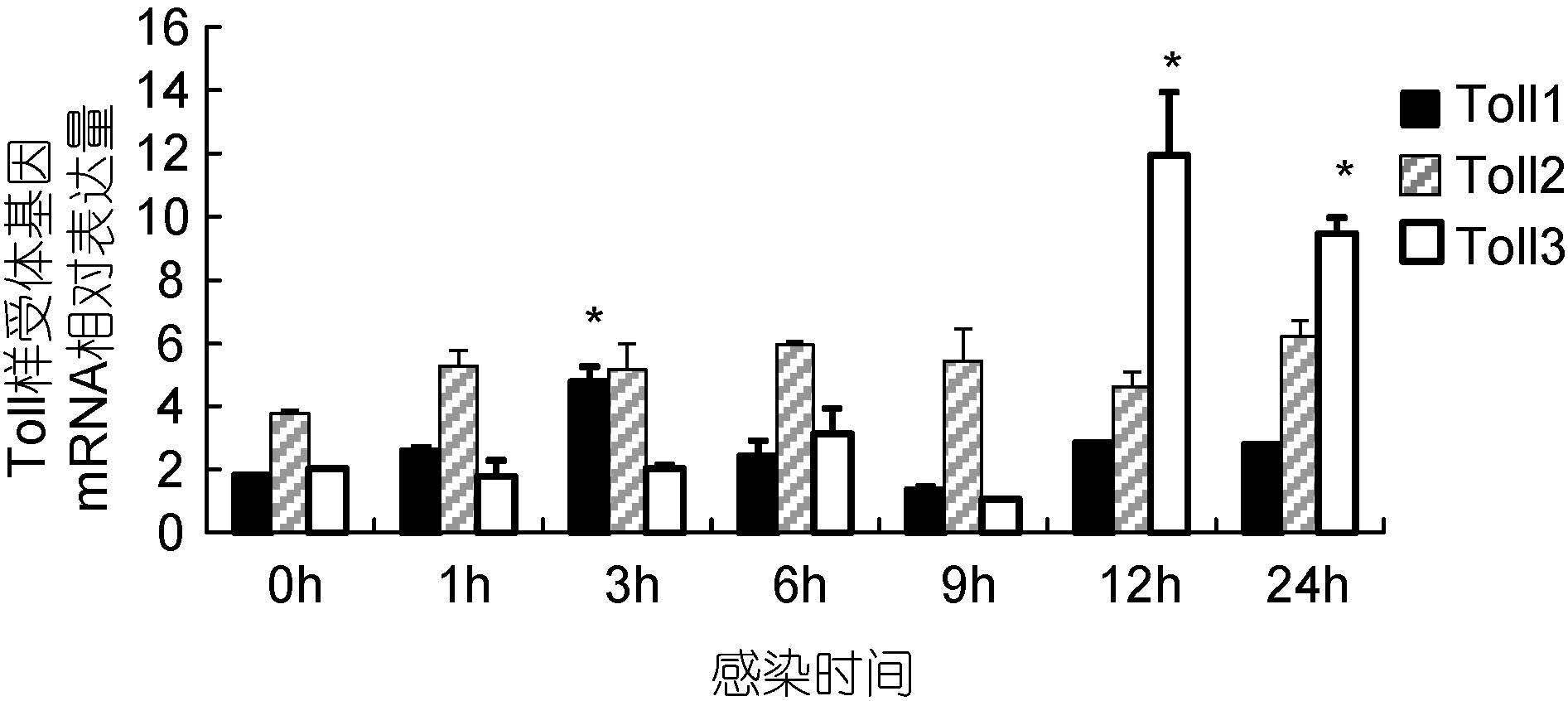 |
| 图 3 溶藻弧菌感染后凡纳滨对虾鳃Toll样受体基因表达变化情况 Fig. 3 Changes of three Toll mRNA levels at the gill of white shrimp after injection of V. alginolyticus |
感染实验结果表明: 在WSSV感染后1h,实验用虾血淋巴3种Toll样受体基因mRNA水平相对于感染前均无显著提高。感染3h后3种Toll样受体基因mRNA水平均显著提高(P<0.05),分别为感染前水平的9.10倍、11.43倍和8.72倍,其中Toll2 mRNA水平明显高于其它2种Toll基因(图 4)。感染6h后3种Toll mRNA水平均达到最高值,分别为感染前水平的13.27倍、34.56倍和9.31倍,其中Toll2 mRNA水平仍明显高于其它2种Toll基因mRNA水平(P<0.05)。感染后9h后3种Toll mRNA水平均明显下降,其中Toll1 mRNA水平为感染前的2.62倍,仍明显高于感染前水平(P<0.05),且明显高于其它2种Toll基因mRNA水平(P<0.05)。感染后12h,3种Toll mRNA水平分别为感染前水平的2.21倍、3.75倍和4.19倍,均显著高于感染前水平(P<0.05),其中Toll2 mRNA水平显著高于其它2种Toll基因。感染后24h,Toll1 mRNA水平为感染前的2.48倍,显著高于感染前水平(P<0.05),Toll2和Toll3 mRNA水平分别为感染前水平的1.25倍和1.39倍,与感染前水平差异不显著(P>0.05)。
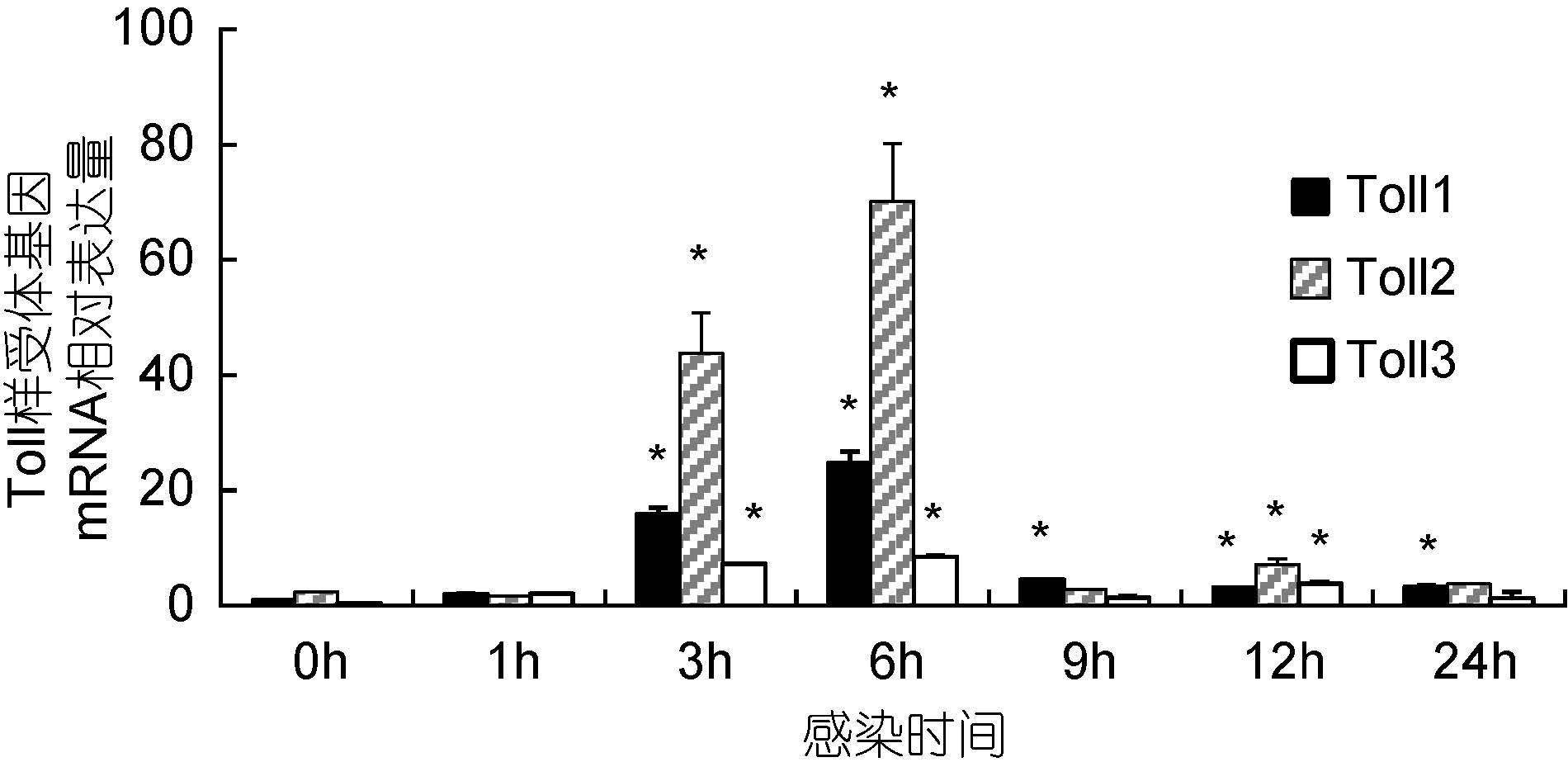 |
| 图 4 WSSV感染后凡纳滨对虾血淋巴Toll样受体基因表达变化情况 Fig. 4 Changes of three Toll mRNA levels at the haemolymph of white shrimp after injection of WSSV |
WSSV感染后1h,实验用虾鳃3种Toll样受体基因mRNA水平相对于感染前均无显著提高(P>0.05),其中Toll2 mRNA水平显著高于其它2种基因(图 5)。感染3h后3种Toll样受体基因mRNA水平均显著提高(P<0.05),分别为感染前水平的7.12倍、5.89倍和6.18倍,其中Toll2 mRNA水平最高,Toll1次之。感染6h后3种Toll mRNA水平均达到最高值,分别为感染前水平的11.02倍、5.91倍和7.65倍,其中Toll3 mRNA水平明显低于其它2种基因,而Toll1与Toll2 mRNA水平之间差异不显著(P>0.05)。感染后9h后3种Toll mRNA水平均明显下降,分别为感染前水平的2.39倍、0.86倍和1.51倍,其中Toll1 mRNA水平明显高于感染前水平和其它2种基因(P<0.05)。感染后12h,Toll1与Toll3基因表达量明显提高(P<0.05),分别为感染前水平的4.36倍和3.85倍,明显高于感染前水平,其中Toll1 mRNA水平最高,Toll3次之。感染24h后,3种Toll mRNA水平分别为感染前水平的1.07倍、0.73倍和1.38倍,与感染前水平差异不显著(P>0.05)。
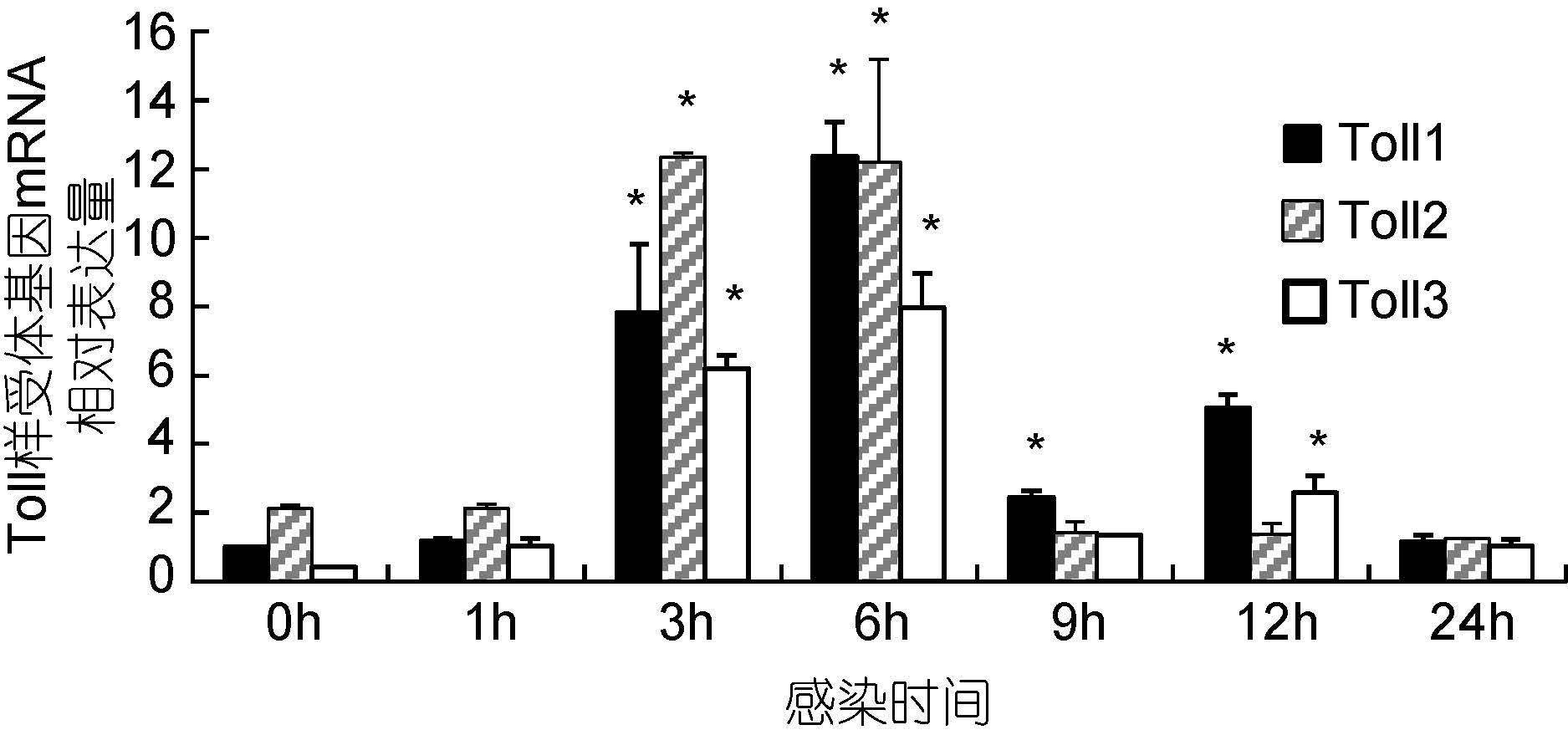 |
| 图 5 WSSV感染后凡纳滨对虾鳃Toll样受体基因表达变化情况 Fig. 5 Changes of three Toll mRNA levels at the gill of white shrimp after injection of WSSV |
感染溶藻弧菌14d后,试验用虾存活率为25.56%。采用Real-time PCR技术对存活个体的血淋巴及鳃部样品进行检测。存活个体血淋巴3种Toll mRNA水平均显著高于对照组(P<0.05),分别为感染前水平的16.88倍、18.79倍和3.07倍,其中Toll2 mRNA水平明显高于其它2种基因(P<0.05),Toll3 mRNA水平最低; 鳃部3种Toll mRNA水平均显著高于对照组(P<0.05),分别为感染前水平的17.34倍、6.04倍和6.76倍,其中Toll1 mRNA水平明显高于其它2种基因(P<0.05),而Toll3 mRNA水平最低(图 6)。
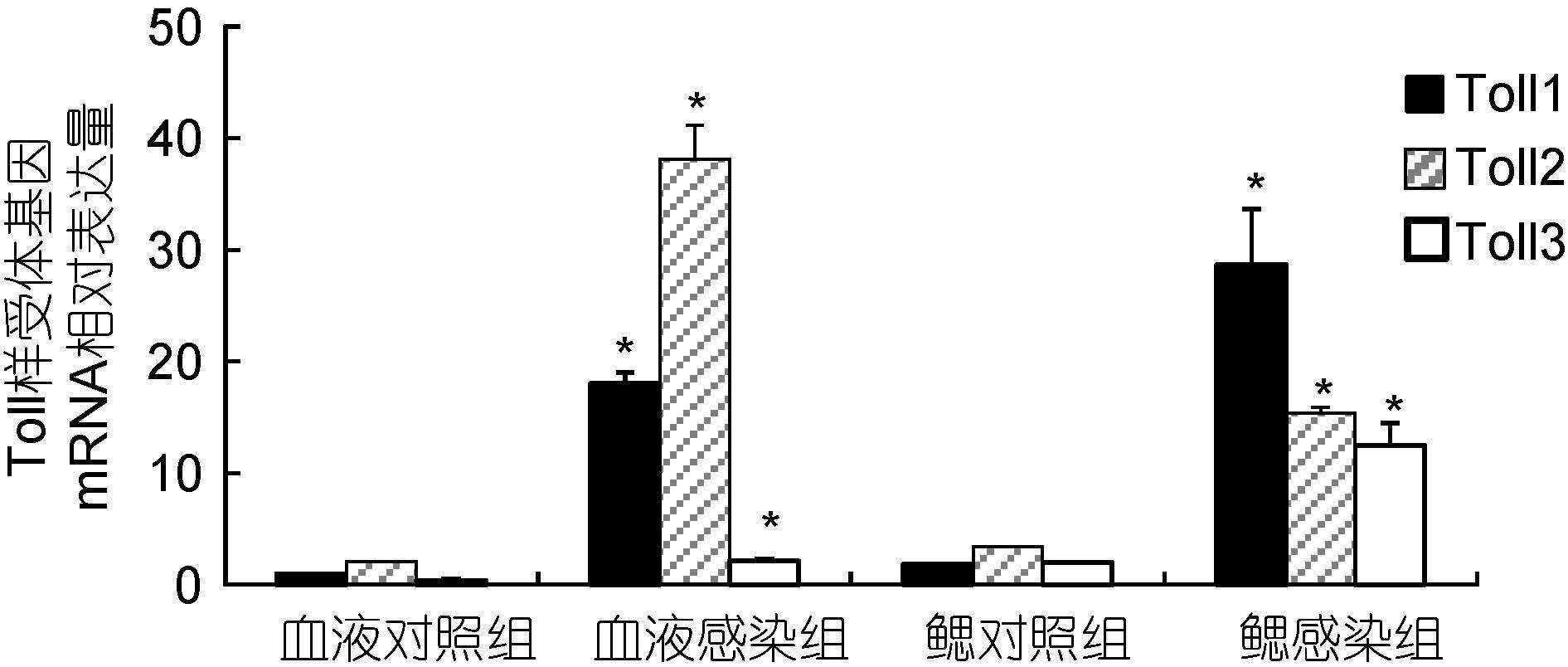 |
| 图 6 溶藻弧菌感染14d后凡纳滨对虾Toll样受体基因表达变化情况 Fig. 6 Changes of three Toll mRNA levels of white shrimp 14 days after injection of V. alginolyticus |
感染WSSV 14d后,试验用虾存活率为11.67%。存活个体血淋巴3种Toll mRNA水平均显著高于对照组(P<0.05),分别为感染前水平的105.15倍、36.13倍和18.46倍,其中Toll1 mRNA水平最高,明显高于其它2种基因(P<0.05),Toll3 mRNA水平最低; 鳃部3种Toll mRNA水平均显著高于对照组(P<0.05),分别为感染前水平的7.21倍、17.76倍和2.82倍,其中Toll2 mRNA水平最高,明显高于其它2种基因(P<0.05),Toll3 mRNA水平最低(图 7)。
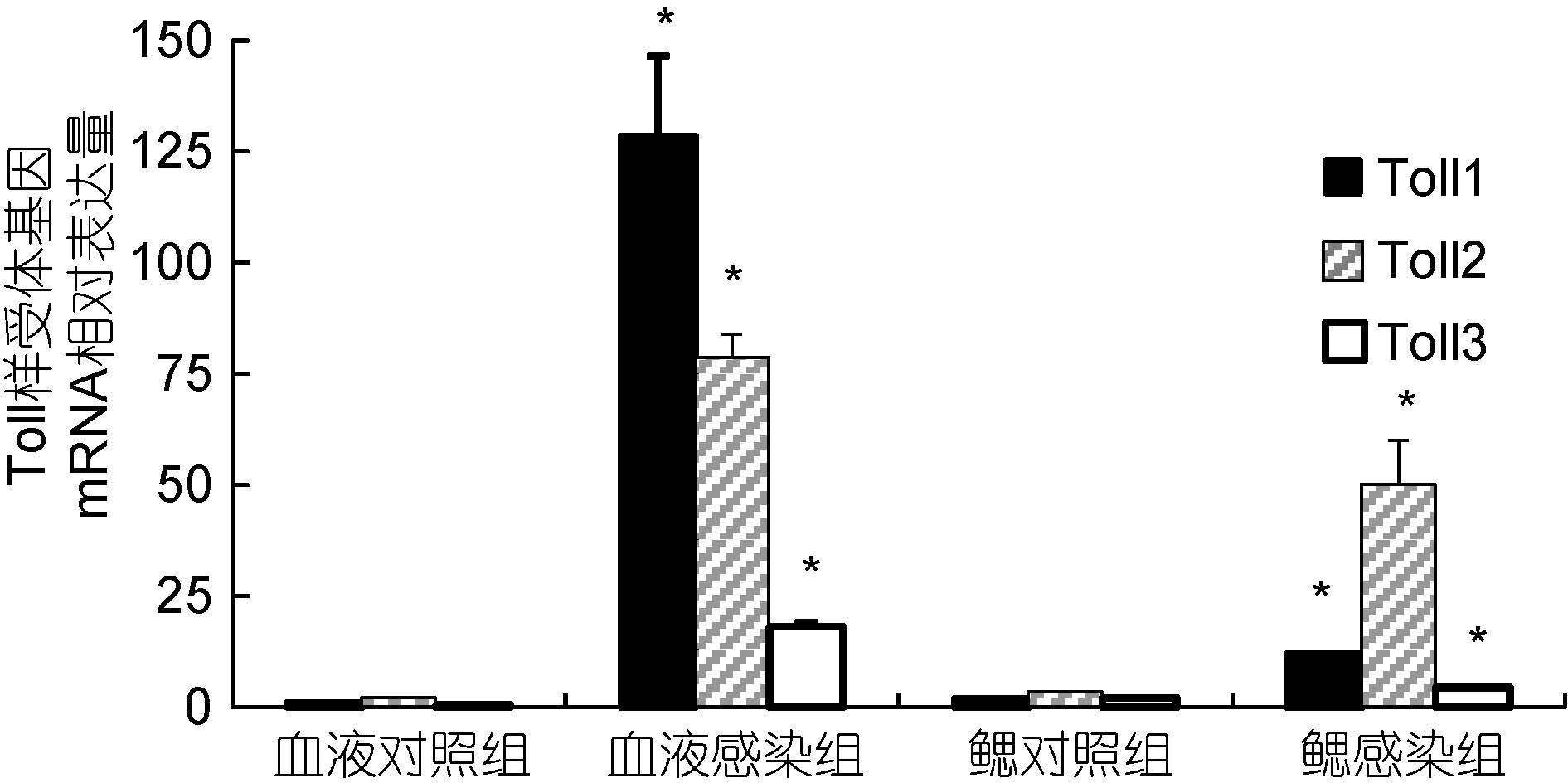 |
| 图 7 WSSV感染14d后凡纳滨对虾Toll样受体基因表达变化情况 Fig. 7 Changes of three Toll mRNA levels of white shrimp 14 days after injection of WSSV |
本研究发现凡纳滨对虾三种Toll样受体基因在各组织中均有表达。其中Toll1基因在肌肉,血淋巴,心脏和鳃均有较高表达,且心脏表达量最高; Toll2基 因在血淋巴,心脏和鳃均有较高表达,其中在鳃表达量最高; Toll3基因在鳃和心脏有较高表达,其中在鳃表达量最高。这与Yang等(2008)在中国明对虾,Wang等(2012)在凡纳滨对虾的研究报道相一致。鳃与血淋巴是甲壳动物受到致病微生物感染的主要组织和器官(Johansson et al,2000),也是机体进行先天性免疫的主要部位。因此,Toll样受体基因在鳃和血淋巴的高表达,将有利于Toll样受体基因识别相关病原体,介导先天性免疫反应,从而抵抗病原微生物的感染。
本研究还发现,人工感染WSSV后6h内,凡纳滨对虾鳃部和血淋巴中3种不同类型的Toll 样受体mRNA水平均显著提高,且均达到各自表达量的峰值。随后3种Toll 样受体mRNA水平逐渐下降,在人工感染WSSV 24h后,除血淋巴Toll1 mRNA水平仍显著高于对照组水平,其余两种Toll样受体基因 mRNA水平均回落到感染前水平,这与Wang等(2012)的研究结果相一致。同时有研究报道,poly I:C和咪喹莫特(Imiquimod)可以明显提高日本囊对虾Toll样受体基因的表达量,从而显著提高虾体感染WSSV后的存活率(Kono et al,2015)。由此推测凡纳滨对虾Toll样受体基因可能参与WSSV感染所引起的免疫调控。甲壳动物在外源病原微生物感染以后,缺乏一套像脊椎动物一样完善的后天性免疫系统(获得性免疫系统),而主要依靠先天性免疫系统抵御病毒和细菌等病原微生物入侵。先天性免疫系统的激活,主要是通过自身的模式识别受体(Pattern recognition receptor,PRR)与病毒和细菌上存在的病原相关分子模式(Pathogen-associated molecular pattern,PAMP)特异性结合来实现(Akira et al,2006)。Toll样受体就是一种重要的先天性免疫模式识别受体(PRR)。因此当WSSV感染虾体后,凡纳滨对虾Toll样受体基因在病毒感染的主要部位鳃和血淋巴中大量表达,通过识别相关的病原相关分子模式,激活相关下游信号转导,从而参与虾体的先天性免疫调控。
与之前的病毒感染实验结果不同,在人工感染溶藻弧菌3h后,凡纳滨对虾鳃部Toll1 mRNA水平显著提高,但Toll2 mRNA水平并无显著性提高,Toll3 mRNA水平直到感染后12h才开始有显著提高,这与Yang等(2008)在中国明对虾以及Wang等(2012)在凡纳滨对虾的研究成果相似。同时有研究发现,通过RNAi技术介导Toll1基因沉默后会明显提高凡纳滨对虾Vibrio harveyi感染后的死亡率(Wang et al,2010)。因此说明Toll1在凡纳滨对虾细菌感染所引起的免疫调控中发挥着重要作用。但随后通过对溶藻弧菌感染虾体的血淋巴中Toll样受体基因的表达情况研究发现,3种Toll样受体基因mRNA水平在感染后均有显著提高,其中Toll2 mRNA水平在感染后6h达到最高值,且明显高于其它2种Toll基因,而Toll1和Toll3 mRNA水平在感染后12h达到最高值,这与Wang等(2012)在凡纳滨对虾中的研究结果有所不同。Wang等(2012)的研究发现溶藻弧菌感染只能引起凡纳滨对虾鳃部Toll1基因的表达显著升高,而Toll2与Toll3基因的表达并无显著变化。我们推测造成结果差异的主要原因可能是不同类型的Toll样受体基因参与虾体免疫调控的主要部位有所不同。血淋巴细胞是甲壳动物免疫系统中十分重要的组成部分,其细胞免疫主要是通过血细胞。由于甲壳动物不具有抗体介导的后天获得性免疫,所以其体液免疫也主要通过血淋巴中的一些相关酶(如溶菌酶、酚氧化酶、碱性磷酸酶、酸性磷酸酶和超氧化物歧化酶等)以及免疫相关因子(如抗菌肽、凝集素、溶血素等)等来实现(刘靖华等,2001),例如: 凡纳滨对虾在感染弧菌后,其血淋巴中Toll样受体基因和溶菌酶基因的表达均会显著上调(Burge et al,2007; Wang et al,2010),Toll样受体基因可能通过介导下游信号传导,从而促进血淋巴中溶菌酶基因的表达,最终参与体液免疫调控。溶菌酶通过水解构成细菌细胞壁成分的多糖胞壁质中的N-乙酰葡萄糖胺与 N-乙酰胞壁酸之间的β-1,4-糖苷键,从而使细菌因渗透压不平衡而破裂,达到防御外源致病细菌的侵害(徐海圣等,2001)。同时有研究发现,凡纳滨对虾Toll2基因具有明显增强相关抗菌肽基因启动子活性的作用(Wang et al,2012)。除此之外,β-葡聚糖,脂多糖以及肽聚糖均可以显著提高日本囊对虾以及中华绒螯蟹血淋巴中Toll2基因的表达量(Mekata et al,2008; Yu et al,2013),而β-葡聚糖,脂多糖以及肽聚糖正是先天性免疫系统中各种致病细菌主要的病原相关分子模式(O’Neill,2004; Akira et al,2006)。因此在凡纳滨对虾的免疫系统中,Toll2基因极有可能通过提高在血淋巴中的表达,从而参与由细菌所引起的免疫调控。所以本研究推测在外源细菌感染以后,凡纳滨对虾血淋巴以及鳃中Toll1与Toll3基因表达量明显升高,从而介导下游信号转导,参与虾体的先天性免疫。而Toll2基因虽然在鳃中表达量没有显著提高,而是通过提高在血淋巴中的表达量,从而增加对相关病原相关分子模式的识别,刺激相关免疫因子或酶的表达,最终共同参与病原细菌感染所引起的免疫调控。但是关于不同类型Toll样受体基因在凡纳滨对虾先天性免疫调控中的具体生理功能和调控机制的差异还有待进一步的研究。
除此之外,本研究还通过对感染WSSV或溶藻弧菌14d后的存活个体的Toll样受体基因表达情况检测发现,在感染WSSV或溶藻弧菌14d后的存活个体的鳃部和血淋巴中3种Toll mRNA水平均显著高于对照组,其中感染WSSV个体血淋巴中Toll1 mRNA水平最高,鳃部Toll2 mRNA水平最高; 感染溶藻弧菌个体中,血淋巴的Toll2 mRNA表达水平最高,而在鳃部以Toll1 mRNA的表达水平为最高,以上结果与之前凡纳滨对虾感染WSSV或溶藻弧菌后短期内Toll样受体基因的表达情况有所不同。在致病细菌或病毒感染的早期,凡纳滨对虾Toll样受体基因表达水平在短时间内迅速升高,从而启动先天性免疫。但在达到一定峰值后,由于Toll信号转导通路中的多种负向调控因子的负反馈作用(Liew et al,2005),从而导致Toll样受体基因表达水平在短时间内(24h内)又恢复到感染前水平。但是在长期感染过程中,可能由于较高浓度的病原微生物的持续刺激,生物体只有在主要感染部位(鳃与血淋巴)不断保持较高的Toll样受体基因表达水平,从而将免疫水平维持在一个较高的水平,才可以抵抗病毒或细菌的不断侵害,这也可能是感染WSSV或溶藻弧菌14d后,虾体血淋巴及鳃中各种Toll样受体基因表达水平均显著高于对照组的主要原因。
4 结论本研究首次比较了凡纳滨对虾在短期或长期感染不同病原微生物情况下,不同免疫组织中几种Toll样受体基因的表达变化情况,并分析了不同类型Toll样受体基因参与先天免疫调控的机理,推测凡纳滨对虾已知的三种Toll样受体可能参与病毒或弧菌所引起的不同组织的免疫调控,为进一步研究凡纳滨对虾的先天免疫调控机理以及不同类型Toll样受体的具体生理功能差异提供理论基础。
 2016, Vol. 47
2016, Vol. 47


