
中国海洋湖沼学会主办。
文章信息
- 王明, 郭馨, 唐学玺, 臧宇, 闫文杰, 周斌. 2016.
- WANG Ming, GUO Xin, TANG Xue-Xi, ZANG Yu, YAN Wen-Jie, ZHOU Bin. 2016.
- 大叶藻种子萌发环境条件研究
- OPTIMAL CONDITION FOR SEED GERMINATION OF ZOSTERA MARINA
- 海洋与湖沼, 47(3): 540-548
- Oceanologia et Limnologia Sinica, 47(3): 540-548.
- http://dx.doi.org/10.11693/hyhz20151100285
-
文章历史
- 收稿日期:2015-11-13
- 改回日期:2016-01-04
2. 厦门大学环境与生态学院 厦门 361102
2. Collage of Environment and Ecology, Xiamen University, Xiamen 361102, China
海草(Seagrasses)是一种生长于热带和温带浅海水域的单子叶种子植物,能在海水中完成开花、结果和萌发等生理过程(Fourqurean et al,2012)。海草床(Seagrass bed)生态系统具有一系列重要的服务功能价值,成为全球海洋生物多样性保护的焦点(郑凤英等,2013)。大叶藻(Zostera marina)是北半球分布最广泛的海草类群,是重要的海洋环境健康指示生物(Krause-Jensen et al,2005),其单位面积叶片N含量与生物量的比值也是指示水体早期富养化的污染指标(Lee et al,2004)。大叶藻在我国分布十分广泛,主要分布于辽宁、河北、山东等省份的沿海水域(范航清,2009),是黄渤海海草分布区的优势种(郑凤英等,2013)。20世纪以来,由于自然和人为因素的影响,大叶藻海草床在世界范围内出现严重退化,且最近几十年退化速率加快(Costello et al,2011)。叶春江等(2002)的研究指出过去的30—50年期间我国山东近岸大叶藻分布面积减少了80%以上。大叶藻海草床的退化消失将直接导致生物栖息生境丧失、生物多样性锐减以及生物地球化学过程失衡,加剧近岸生态系统的不稳定性或脆弱性(王伟伟等,2013),因此大叶藻海草床的保护与修复备受关注(Orth et al,2010; Delefosse et al,2012; Li et al,2013)。
海草床的修复方法主要有生境恢复法、成体移植法和种子法,各有利弊(Orth et al,2010; Reynolds et al,2012; Li et al,2013)。种子法因其成本低、维持种群遗传多样性、对供体草床干扰小等特点,得到了重视与发展。目前,海草种子的收集、保存、播种和幼苗发育被公认为是一种具有生态学意义的恢复实践(Kendrick et al,2012; Reynolds et al,2012)。虽然海草种子是一种具有高生态适应性和经济可行性的大尺度恢复材料,但其产量不稳定,具有明显的时空变化(Orth et al,2006)。传统种子法将大叶藻种子直接投放到修复海域,由于受到营养盐、温度、盐度、pH等环境因素的制约,以及湍流扰动和沉积物破坏等因素的影响,自然条件下大叶藻种子的萌发率非常低,仅为5%—15%(Ke et al,2006; Jarvis et al,2008)。为了提高修复效果,我们对种子法进行改进,预先在实验室条件下进行种子萌发,再将萌发的种子投放到修复海域。
自20世纪80年代起,对海草种子萌发的关注在于大叶藻科、丝粉藻科和水鳖科。萌发实验测定的因素包括温度、盐度、基质类型、光照、营养盐、激素和埋藏深度等。研究显示盐度(Conacher et al,1994)、温度(Hay et al,2008; Jarvis et al,2008)、光照(Lal et al,1993)及溶解氧(Brenchley et al,1998)是影响海草种子萌发的关键因素,而盐度通常被认为是最重要的单一因子(Orth et al,2000)。之前的研究多集中在单一或常规环境条件对种子萌发的作用,而自然条件下海草种子通常受多种因素的交互作用或某些非常规因素的影响。为了保证大叶藻种子在实验室条件下的萌发效果,有必要深入研究影响种子萌发的环境因素,并寻找可以有效促进种子萌发的处理方式。基于上述目的,本研究着眼于影响种子萌发的四个环境因素——温度、盐度、pH以及营养盐浓度,在实验室可控条件下利用正交实验探索影响大叶藻种子萌发的最主要因素并确定较适宜的萌发条件,并在此基础上比较了多种处理方式(不同光照、UV-B辐射、低温层积和划破种皮)对大叶藻种子萌发的作用。
1 材料与方法 1.1 大叶藻种子的采集及保存2014年7—8月,大叶藻种子直接采集于山东省荣成市俚岛湾(122.586°E,37.246°N),自然条件下生长成熟的大叶藻生殖枝。种子运抵实验室后,用滤网处理种子去除杂质和贝类等。选用长椭圆形、黑褐色、坚硬饱满的种子,在25°C、盐度30、自然光、连续充气条件下暂存两周至萌发实验开始。
1.2 种子活力测定根据ISTA种子检验规程(ISTA,1996),采用四唑(TTC,1.0%)染色法测定种子活力。随机选取50粒种子置于35°C温水中浸泡2d后去皮,35°C条件下用四唑溶液染色12h,根据种胚的着色部位及程度,按照国际种子检验标准鉴定种子活力。
1.3 种子萌发条件的正交实验选择温度、盐度、pH以及N/P营养盐浓度四种环境单因素,设计四因素三水平正交实验,N/P由NaNO3、NaH2PO4和Na2HPO4提供(表 1)。实验分为9个处理组(表 2),每组种子数量为50粒。以90 mm培养皿作为培养容器,置于光照培养箱内,光周期为12:12,日光灯照度为~3000lx,培养方法为浸泡培养法(Hootsmans et al,1987)。种子的实验室培养基质为采集于青岛汇泉湾近岸的灭菌过滤海水(121°C,20min),通过蒸馏水稀释得到不同 盐度水平,每个培养皿海水用量为30mL,每两天更换一次,初始ph由稀盐酸调节。每日记录萌发种子的数量并计算累积萌发率。根据结果筛选出9个处理组中最佳的条件组合,用于后续实验。
| 水平 | 因素 | |||
| 盐度 | N/P浓度(mol/L) | 初始pH | 温度(°C) | |
| 1 | 12 | 240/15 | 8.10 | 10 |
| 2 | 18 | 480/30 | 7.50 | 15 |
| 3 | 24 | 960/60 | 6.20 | 20 |
| 编号 | 因素 | 累计萌 发率% | |||
| 盐度 | N/P浓度(mol/L) | 初始pH | 温度(°C) | ||
| 1 | 12 | 240/15 | 8.10 | 10 | 80.83 |
| 2 | 12 | 480/30 | 7.50 | 15 | 75.00 |
| 3 | 12 | 960/60 | 6.20 | 20 | 90.83 |
| 4 | 18 | 240/15 | 7.50 | 20 | 56.67 |
| 5 | 18 | 480/30 | 6.20 | 10 | 63.33 |
| 6 | 18 | 960/60 | 8.10 | 15 | 52.50 |
| 7 | 24 | 240/15 | 6.20 | 15 | 37.50 |
| 8 | 24 | 480/30 | 8.10 | 20 | 30.83 |
| 9 | 24 | 960/60 | 7.50 | 10 | 44.17 |
| K1 | 82.22 | 58.33 | 54.72 | 62.78 | |
| K2 | 57.50 | 56.39 | 58.61 | 55.00 | |
| K3 | 37.50 | 62.50 | 63.89 | 59.44 | |
| R | 44.72 | 6.11 | 9.17 | 7.78 | |
| 注: K1—K3表示各因素水平下累计萌发率的平均值; R表示极差 | |||||
同样采用浸泡培养法,每个培养皿内加入30mL培养液和50粒种子,培养液的盐度、N/P浓度、初始pH及培养温度按正交实验法得出的最优条件设置,每天观察、记录种子萌发情况,每两天更换一次培养液。
1.4.1 光质类型及比例对种子萌发的影响实验使用波长为635nm的红色灯管、波长为460nm的蓝色灯管以及白色灯管各3支,实验中将两种颜色的灯管分别悬于培养箱两层水培层架的顶部,另外开启培养箱自带光源,光周期为12:12,照度~3000lx。设置白光灯(W),红光(R),蓝光(B),红蓝组合光1(R:B=1:1),红蓝组合光2(R:B=1:2),红蓝组合光3(R:B=2:1)和黑暗(D)共7个处理组,每组设置3个平行。红蓝组合光比例由两种光质的照射时长决定。
1.4.2 UV-B辐射对种子萌发的影响以UV-B辐射的等比强度设置4个实验组,每组设置3个平行,光周期为12:12,光周期内每日替代照射UV-B(~600lx)时长分别为0h,2h,4h,8h,其余时间置于光照培养箱内。
1.4.3 低温层积对种子萌发的影响实验种子在萌发实验前首先转入4°C冰箱预处理10d之后取出,按照正交实验中的最佳条件组合进行萌发实验。以无低温层积预处理的种子为对照组,每个处理设置3个平行。所有实验用种子置于光照培养箱内,光暗周期为12:12,照度~3000lx。
1.4.4 划破种皮对种子萌发的影响将种子外种皮割破,以解剖刀在种子的子叶端、沿纵纹划破种皮,开口约占纵纹长度的1/3(Taylor,1957),避免伤害胚。对照组则保留完整种,每个处理设置3个平行。所有实验用种子置于光照培养箱内,光周期为12:12,照度~3000lx。
1.5 种子萌发的判定标准大叶藻种子萌发的判断依据为种子的子叶(内含种胚)端的种皮发生涨裂且弯曲的U形棒状子叶发生伸直并突出破裂的种皮(Harrison,1991)。
1.6 数据处理与分析萌发率为各处理组中萌发种子粒数占总粒数的百分数,平均萌发时间(MGT)为:

其中,Nn为观察到的种子开始萌发的天数,n为天数,Gn为第n天观察到的种子萌发数(Ranal,2006)。
利用SPSS 16.0对数据进行极差分析、方差分析。显著性水平设定为α=0.05,利用SigmaPlot 12.5作图。
2 结果与分析 2.1 种子活力测定四唑染色结果显示保存的种子有活力的比例为(91±3.1)%。
2.2 种子萌发的最优环境条件经过8周的萌发实验获得各条件下种子的最终萌发率,结果如表 2所示。由各因素极差大小可知,R盐度>R初始pH>R温度>RN/P浓度,表明4种不同因素对大叶藻种子萌发的影响大小的次序为: 盐度>初始pH>温度>N/P浓度。其中,R盐度(44.72)最大,即盐度对种子萌发率的影响最显著,因此盐度为主要因素且萌发率最大值出现在第1水平。依次类推,N/P浓度、初始pH、温度因素的种子萌发率最大值分别出现在第3水平、第3水平和第1水平。因此,在本实验范围内,大叶藻种子萌发的较适宜条件为盐度12、N/P浓度960/60μmol/L、初始pH 6.20和温度10°C,此时大叶藻种子萌发率最高。
2.3 光质类型及比例对种子萌发的影响在优化后的浸泡培养条件下,比较了不同的光照条对大叶藻种子萌发的影响。培养8周,黑暗条件下大叶藻种子萌发率最大,为(92±4.8)%,而其他光照条件下种子萌发率无显著差异(P>0.05)(图 1)。红光条件下种子萌发速度较快,至第四周萌发基本停止; 蓝光条件下种子萌发速度较慢,但在实验过程中不断进行(图 1)。通过多重比较的LSD方法统计检验黑暗条件与其他条件下种子的萌发率差异,发现黑暗条件与其他条件间的大叶藻种子萌发率影响均存在显著差异(P<0.05,表 3)。
 |
| 图 1 不同光质类型及比例下种子的萌发率 Fig. 1 Germination rate of Z. marina seeds in different types of lighting |
| 因变量 | 方差齐性 | 光质类型(I) | 光质类型(J) | 均值差(I-J) |
| 萌发率 | 0.096>0.05 | 黑暗 | 红光 | 23.33000 |
| 蓝光 | 17.77667 | |||
| 红︰蓝=1︰1 | 21.10667 | |||
| 红︰蓝=1︰2 | 21.11000 | |||
| 红︰蓝=2︰1 | 21.11000 | |||
| 白光 | 20.22000 |
无UV-B辐射时大叶藻种子的萌发率较低,在一定强度范围内(每日经UV-B ~600lx连续照射8h),种子萌发率随着UV-B辐射时长而升高,每日8 h时萌发率可达(93±5.2)%(图 2)。由单因素方差分析可知,不同UV-B辐射时长下大叶藻种子萌发率存在显著差异(P<0.05),且经UV-B辐射的处理组在第8周仍有萌发趋势,而对照组种子的萌发则趋于停止。LSD多重比较结果显示: 白光与8h和2h与8h间的种子萌发率均存在显著差异(P<0.05),说明UV-B辐射可以有效提高种子萌发率(表 4)。
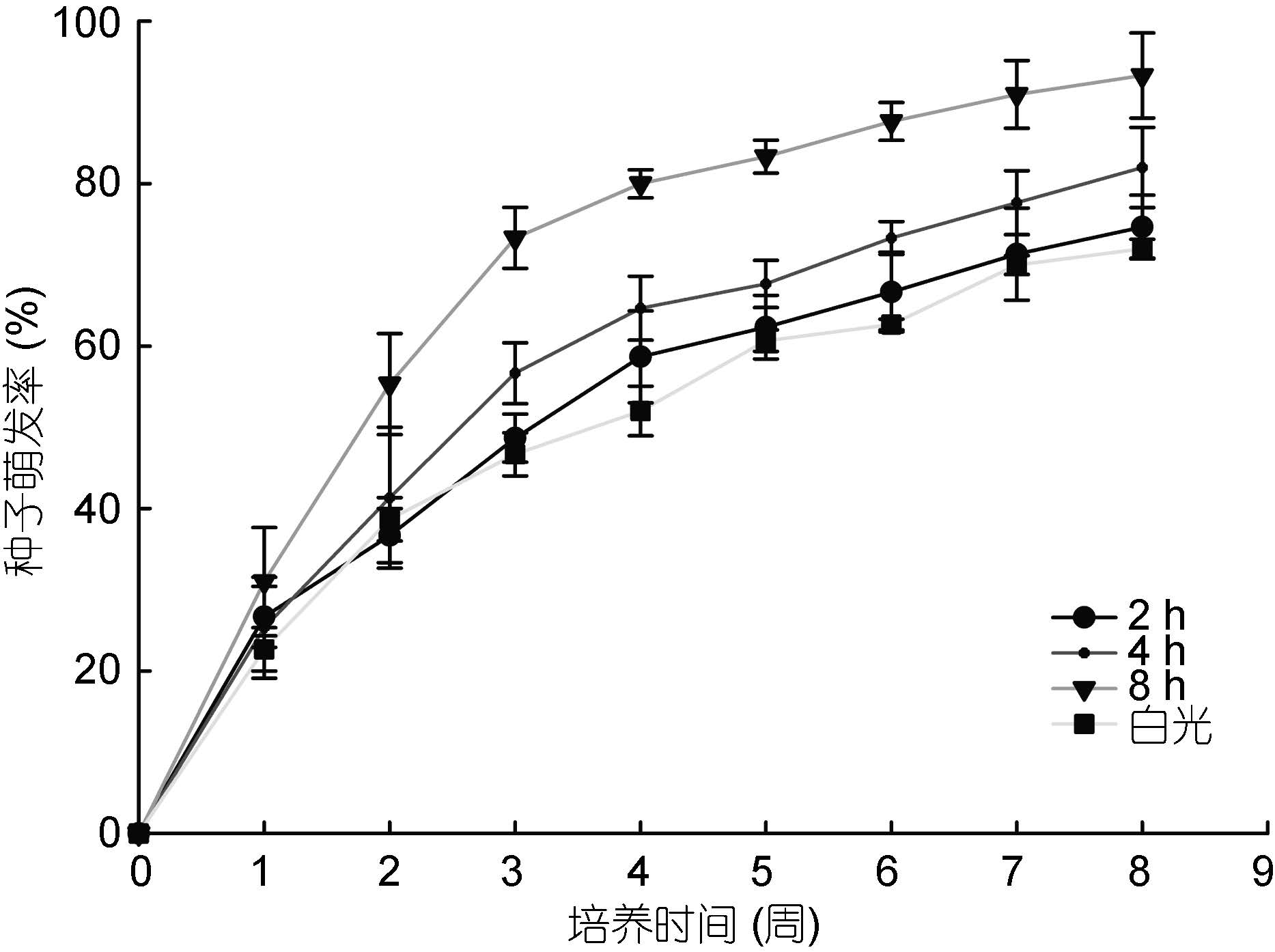 |
| 图 2 UV-B辐射下藻种子的萌发率 Fig. 2 Rate of seed germination in different duration of daily UV-B radiation |
| 因变量 | 方差齐性 | 辐射 时长(I) | 辐射 时长(J) | 均值差 (I-J) | 显著性 |
| 萌发率 | 0.228>0.05 | 2h | 4h | -7.77333 | 0.215 |
| 8h | -18.88667 | 0.011 | |||
| 白光 | 2.44667 | 0.683 | |||
| 8 h | 2h | 18.88667 | 0.011 | ||
| 4h | 11.11333 | 0.091 | |||
| 白光 | 21.33333 | 0.006 | |||
| 白光 | 2h | -2.44667 | 0.683 | ||
| 4h | -10.22 | 0.115 | |||
| 8h | -21.33333 | 0.006 |
划破种皮处理组的大叶藻种子萌发率最高,达(91±2.1)%,且萌发速度快,第2周就已达到萌发率最大值(图 3)。低温层积对种子萌发也有一定的促进作用,萌发率在第8周达到(83±3.6)%且仍有上升趋势(图 3)。单因素方差分析表明低温层积对种子萌发具有显著影响(P<0.05),而划破种皮对种子萌发具有极显著影响(P<0.01)。
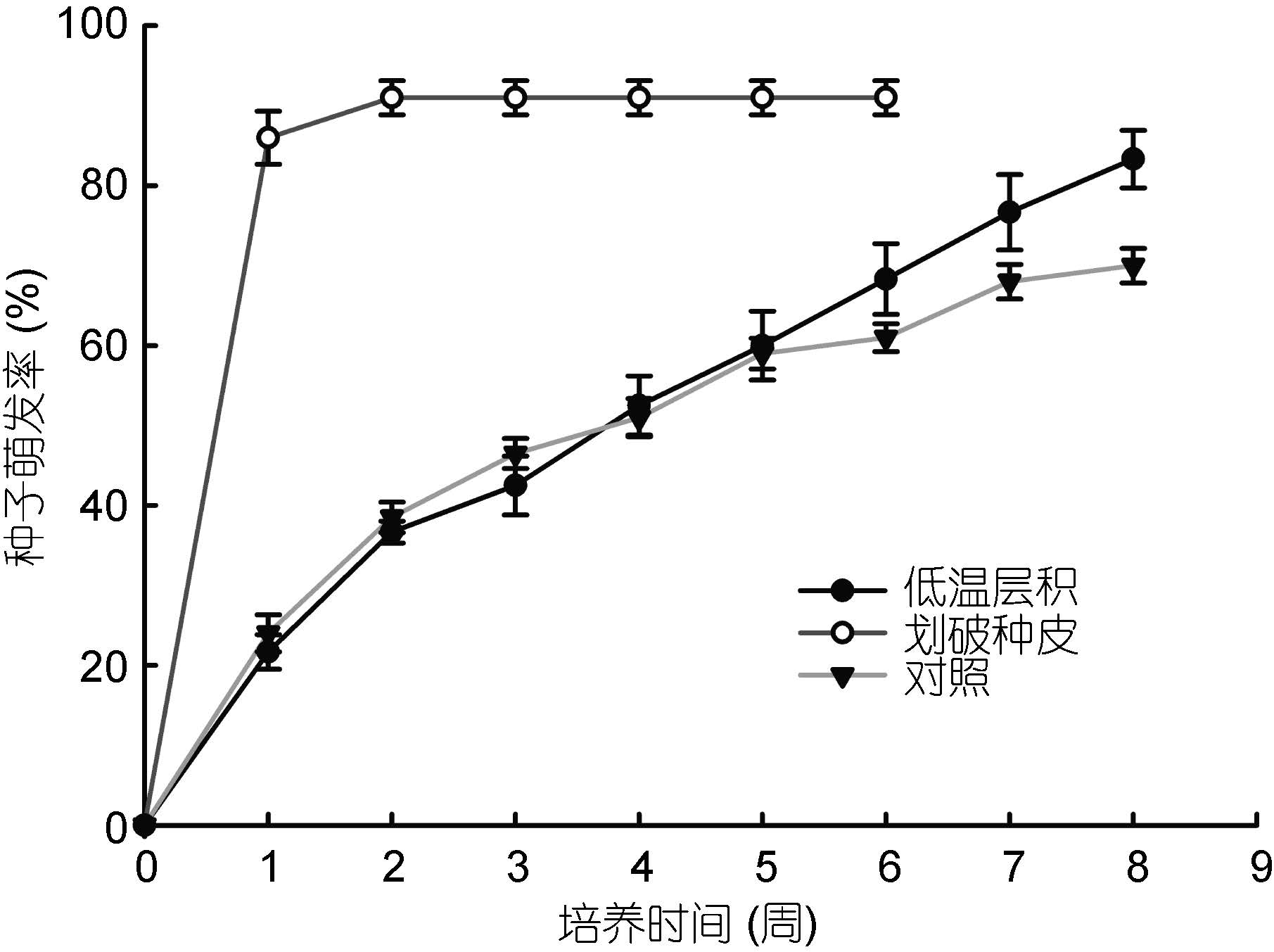 |
| 图 3 低温层积及划破种皮时种子的萌发率 Fig. 3 Rate of seed germination under cold stratification and scarification of seed coat |
不同时长的UV-B辐射和不同类型及比例的光质对大叶藻种子的平均萌发时间基本无影响; 而划破种皮可以大大缩短种子平均萌发时间,为(7.7±0.07)天; 低温层积预处理促进了种子萌发,使得种子平均萌发时间缩短为(26.78±0.07)天(图 4)。
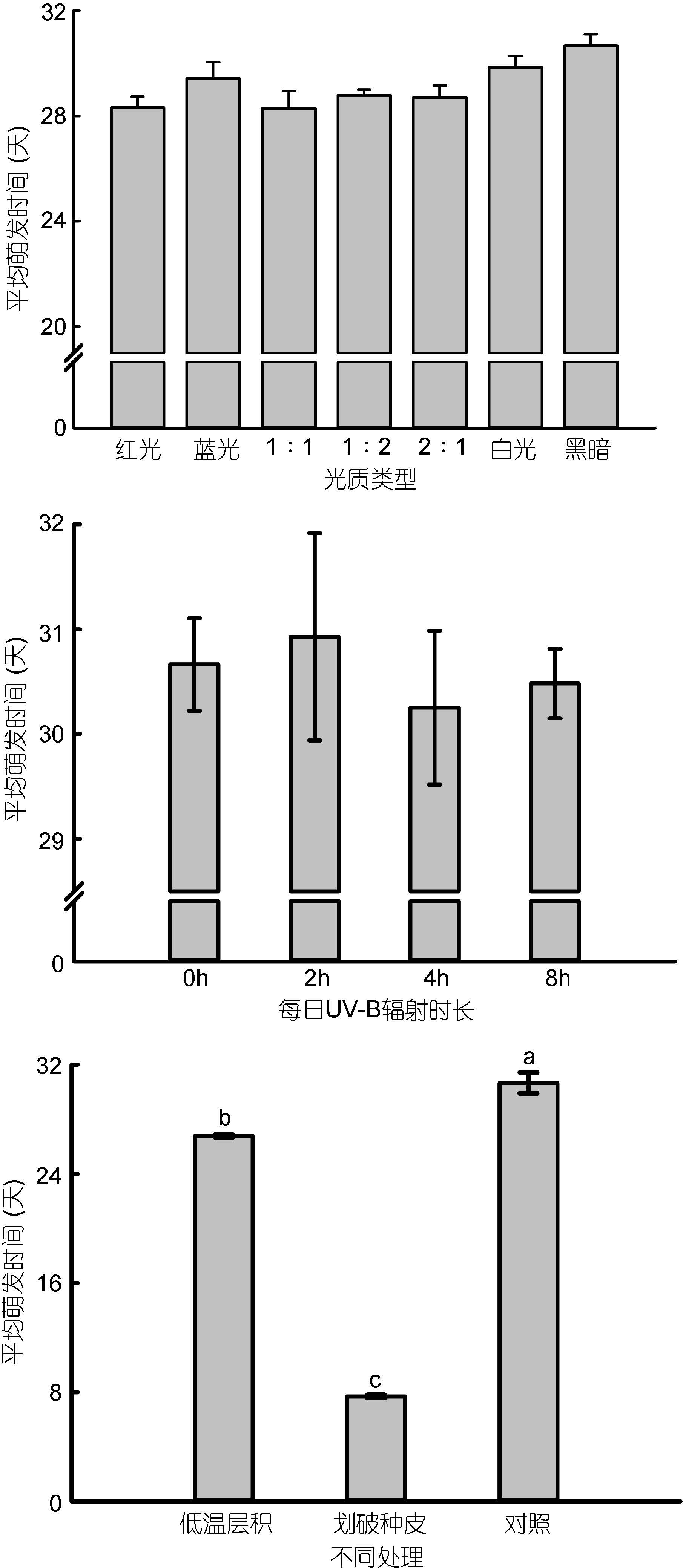 |
| 图 4 不同条件下大叶藻种子的平均萌发时间 Fig. 4 Mean germination time(MGT)of seed under different light conditions |
在种间和种内对比的基础上,通常认为降低盐度能够促进海草种子的萌发(Kahn et al,2005; Koch et al,2010; Fernández-Torquemada et al,2013),原因是盐度降低可能干预淀粉的分解代谢导致种皮提早开裂(Sugiura et al,2009),或者促进种子萌发前的水分吸收(Probert et al,1999)。在恢复实践中常通过提高盐度来抑制存储种子的萌发(Ailstock et al,2006)。本实验中3个盐度范围均低于自然海区的正常盐度,之前的研究显示种子萌发率与盐度表现出极明显的相关性,即随着盐度的升高种子萌发率显著降低。虽然盐度降低能够促进种子萌发,但有研究表明低盐度会对大叶藻幼苗产生不利影响,降低光合作用效率和生长速率(Tanner et al,2010)。因此,对大叶藻种子萌发条件的优化方案还应该结合后续的幼苗生长状况进行综合分析。
有学者认为温度是非休眠种子萌发最主要的影响因素(Probert et al,1999)。尽管Hootsmans等(1987)和Harrison(1991)指出大叶藻种子的萌发受到10— 30°C的高温促进(或不存在影响),更多的观察结果表明高温能够抑制萌发。Abe等(2008)发现大叶藻种子萌发的最适温度为10—15°C,且最大萌发率出现在10°C。本实验选出的各处理组中最佳的条件中温度为10°C,但种子萌发率并没有随着温度的升高而降低,表明温度对大叶藻种子萌发率的作用还受其他条件制约。也有研究认为大叶藻种子萌发的最适水温与当地的最低水温有关(Orth et al,1983; Pan et al,2011); 相反地Loquès等(1990)的研究显示温度对诺氏大叶藻萌发的作用很小。基于上述研究,我们认为海草种子的萌发可能存在一个与海草所处生境内温度的季节性变化密切相关的阈值,在这个可能的阈值范围内,种子萌发具有最适温度并存在种间差异。
目前对大型海藻及某些淡水水生植物的氮磷响应机制有较多研究,而关于氮磷对大叶藻及其他海草影响的研究鲜有报道。有关研究发现,氮是大型海藻生长的主要限制因子(Fong et al,2004),而在部分海域磷也是限制海藻生长的主要因子(郭卫东等,1998)。许多大型海藻都能够适应营养盐的变动,在外界营养盐丰富时其最大吸收速率远远大于维持最大生长速率所需要的氮,从而积累丰富的营养库以备营养盐不足(Mcglathery et al,1996)。同样地,程丽巍(2010)的研究中,氮磷加富均能够显著促进龙须菜和石莼生长。本研究设置了240/15、480/30以及960/ 60mol/L三个浓度,各处理组中最佳的条件中氮、磷营养盐浓度为960/60mol/L,但种子萌发率并没有随氮、磷浓度升高,说明在本研究区域内氮、磷并非大叶藻种子萌发的限制性因素。
pH是影响植物种子萌发和幼苗生长的关键环境因子之一(Rivard,1989; Arts et al,1990),随着酸雨增加及土壤盐碱化,近年来有关pH对陆生植物种子萌发的影响的研究已有大量报道。有研究表明,在高pH条件下环境中易形成HCO3-等离子,抑制种子萌发与幼苗生长(马红媛等,2007),中性偏酸的条件则可以促进种子萌发(李焰焰等,2005; 黄婷等,2007; 何海洋等,2013)。本实验的结果表明大叶藻种子具有较广泛的pH适应范围,不同pH能够影响种子萌发,pH为6.20的条件更有利于种子萌发。
3.2 不同光质类型及比例对种子萌发的影响本研究表明,不同光质类型及比例对大叶藻种子萌发无明显影响。黑暗条件可以提高大叶藻种子的萌发率,说明大叶藻种子萌发过程可能不需要光照,在无光条件下萌发更加显著。众多物理、化学和生物因素影响大叶藻存活、生长和繁殖并可能影响其群落动态,光照是影响大叶藻生长和存活最重要的因素(Dennison,1987; Olesen et al,1993)。Pons等(1992)认为光照通过光敏色素的活动影响种子萌发,而Karssen等(1990)认为导致萌发的过程能够在质膜蛋白与活性光敏色素结合时发生,并得出光照能够促进多种植物种子萌发的结论。但对水生植物川蔓藻(Strazisar et al,2013)和蓖齿眼子菜(高健等,2006)的研究却发现光照并不能促进其种子的萌发,这与本实验中黑暗条件可以提高大叶藻种子的萌发率的结论一致。
本研究发现光照条件虽然不利于提高种子的萌发率,但在短期内采用红光照射却可在一定程度上加快种子萌发速度,缩短平均萌发时间,说明大叶藻种子萌发过程受到光质条件的影响。光质是影响陆生种子植物生长的重要因素。李雯琳等(2013)发现红光能够提高不同品种叶用莴苣种子的发芽活力,蓝光则能够提高种子的活力指数。而在王维荣等(1991)的研究中红光和绿光对黄瓜种子萌发则表现出完全抑制效应。上述研究结果说明在萌发阶段,不同种类的植物种子对不同光质的表现有显著差异,可能是植物适应生境长期进化的结果。
大叶藻主要生长在潮间带和潮下带的浅海区域,与陆生高等植物的生态位具有很大差异,因此现有的与陆生高等植物种子萌发的研究可能并不适用于海草类群。海洋环境与陆生环境差异明显: 例如红光和远红光在海水中衰减明显,但陆生高等植物的研究却显示红光和远红光对种子萌发具有促进作用。虽然本研究结果表明蓝光与红光对大叶藻种子萌发率的影响无显著差异,但是可以发现,蓝光处理组的种子萌发作用较红光处理组更具有潜力,在第8周实验结束时仍然有萌发上升趋势,而红光处理组在第4周左右已达到萌发最大值。且蓝光处理组培养出的幼苗较红光处理组长势更好,两种光质组合处理时蓝光比例越大幼苗生长状况越好,红光比例大的处理组幼苗生长受到抑制。在海洋环境中,光线在透过海水时,红光被吸收最多而蓝光最少,后者在海水中具有更强的穿透力。实验结果一定程度上支持了我们的推断,即在大叶藻进化过程中,可能形成了更适合海洋环境的萌发与生长策略,因而对蓝光更加敏感,能够更好地利用蓝光进行萌发和光合作用。
另外,本研究结果中光质类型影响不显著的原因可能是受实验条件的设置与实验设备的限制,比如优化后的条件组合可能对种子在萌发上对于光质的适应造成影响,以至于一定程度上掩盖了其在自然海水条件下对于光质的适应。今后的研究中可进一步进行极端化处理,增加单一光质光源照射强度和时间以排除其他光质的影响,并应进一步探索大叶藻种子萌发对光质的内在适应机制(如光敏色素的成分及比例),从根本上认识光质对种子萌发的影响。
3.3 UV-B辐射对种子萌发的影响本研究结果表明,一定强度的UV-B辐射有利于大叶藻种子萌发。可能的原因: 一是紫外线具有杀菌消毒作用,能够抑制或杀死影响大叶藻种子萌发的微生物,这些微生物可能会释放某些化学物质对种子产生不利影响,也可能与大叶藻争夺生存空间、营养物质、氧气等资源; 二是一定强度的紫外线可以促进大叶藻种子的萌发。但这一结论并不具有一致性: 针对陆生植物的研究表明紫外线辐射对种子萌发有抑制作用(胡正华等,2005),或对种子萌发影响不显著(方媛等,2010)。而陈南凯等(1995)报道紫外灯照射种子能提高发芽力,促进种子成熟且有明显的增产效果。郭彦等(2011)的研究结果同样表明照射10h和20h紫外线的水稻种子发芽率均高于对照组的不经过紫外线照射的种子。本实验结果显示,在一定范围内随着UV-B照射时长增加,大叶藻种子萌发率升高。实验结束时,种子仍有明显的萌发趋势。本实验在一定程度上支持了紫外线辐射能促进种子萌发的观点,然而紫外线辐射促进大叶藻种子及其他种子萌发的作用机理还有待进一步研究。
3.4 划破种皮及低温层积预处理对种子萌发的影响多数海草的种子具有坚硬种皮且具休眠期,这有利于海草种群在高度动态性的生境中的长期存在(Orth et al,2000)。但种皮的机械作用和休眠期使种子萌发受到限制。Loquès等(1990)的研究证明了种皮在萌发启动上的重要作用,认为种皮形成了一种可能阻止水分进入和/或降低胚与环境间的气体交换的屏障。Conacher等(1994)的研究表明低盐度下切割种皮能够促进摩羯大叶藻种子快速萌发,可能是通过种子膨胀或突破外皮,也可能通过促进水合作用和呼吸作用直接启动胚的发育。由文辉等(1995)对3种沉水植物(菹草,大茨藻和苦草)种子萌发的研究表明,种皮破裂后发芽率和萌发速率均升高。陈开宁等(2005)研究沉水植物时也发现类似现象,去除蓖齿眼子菜的种皮可将最终发芽率从6%以下提高到60%左右。本实验的结果同样表明划破种皮可以显著提高种子萌发率,且大大缩短平均萌发时间。
本实验对大叶藻种子进行了10天的低温层积处理,萌发率提高了19.07%,平均萌发时间缩短了3.88天。国外学者开展了大量关于大叶藻种子休眠的研究,但所得结论并不一致。Churchill(1983)的研究表明大叶藻种子不存在休眠且低温(<15°C)是诱导萌发的主要因素。Orth等(1983)进一步的研究表明大叶藻种子不存在原初休眠而种子释放与萌发之间是由高温诱导的休眠期,但Hootsmans等(1987)在荷兰西南部的Zandkreek的研究并未发现该物种存在温度强迫性休眠的证据。法国胡安湾的诺氏大叶藻种群(Loquès et al,1990)和结状丝粉藻种群也存在类似现象(Caye et al,1992)。大叶藻种子的生理休眠可以在高温和低温层积时破除(Harrison,1991),处于打破休眠的理想条件下时种子的萌发时间更短(Kettenring et al,2007; Vandelook et al,2008)。低温层积处理时间的长短对种子萌发率的影响有待进一步研究。
4 结论本实验优化得到大叶藻种子萌发的相对适宜为盐度12、N/P浓度960/60mol/L、初始pH 6.20和温度10°C。不同光质类型及比例对大叶藻种子萌发不具显著性作用,但无光条件下的大叶藻种子具有较高的萌发率92%。UV-B辐射、划破种皮和低温层积处理均可显著提高大叶藻种子的萌发率并缩短平均萌发时间。
 2016, Vol. 47
2016, Vol. 47

