
中国海洋湖沼学会主办。
文章信息
- 徐金涛, 庞敏, 马新, 毛雪薇, 吴振兴, 陈洪举, 王燕, 张学雷. 2016.
- XU Jin-Tao, PANG Min, MA Xin, MAO Xue-Wei, WU Zhen-Xing, CHEN Hong-Ju, WANG Yan, ZHANG Xue-Lei. 2016.
- CO2加富对塔玛亚历山大藻叶绿素荧光参数及产毒的影响
- CARBON DIOXIDE ENRICHMENT AFFECTS CHLOROPHYLL FLUORESCENCE AND TOXIN PRODUCTION OF ALEXANDRIUM TAMARENSE
- 海洋与湖沼, 47(3): 557-563
- Oceanologia et Limnologia Sinica, 47(3): 557-563.
- http://dx.doi.org/10.11693/hyhz20150500145
-
文章历史
- 收稿日期:2015-05-20
- 改回日期:2015-10-02
2. 国家海洋局第一海洋研究所海洋生态研究中心 青岛 266061;
3. 中国海洋大学环境科学与工程学院 青岛 266100;
4. 山东出入境检验检疫局检验检疫技术中心 青岛 266002
2. Marine Ecology Research Center, First Institute of Oceanography, SOA, Qingdao 266061, China;
3. College of Environmental and Engineering, Ocean University of China, Qingdao 266100 China;
4. Technique Center of Shandong Exit-Entry Inspection and Quarantine Bureau of China, Qingdao 266002, China
海洋作为全球最大的碳库,能不断吸收大气中持续升高的CO2,从而导致海水pH值下降(酸度增加),该过程即海洋酸化(石莉等,2011)。海洋酸化导致海水碳酸盐系统发生变化,直接影响依赖于海水化学环境的海洋生物,从而威胁整个海洋生态系统和海洋经济(唐启升等,2013)。近年来,赤潮频频暴发,其中有毒有害赤潮所占比例也逐年增长(中国海洋灾害公报1999—2013),海洋酸化的加剧与赤潮密切相关(Chen et al,2014),而有毒赤潮藻类能否出现光合作用的相关响应、能否改变其毒素组成以适应海洋酸化的加剧均已成为海洋生态学家新的关注点(Falkowski,2012;Scarlett et al,2013)。
塔玛亚历山大藻是我国近海常见有毒赤潮藻种,自北向南均有分布,并曾引发过赤潮(郭皓,2004)。它是主要进行光合自养的甲藻(Cabrerizo et al,2014),并能产生麻痹性贝毒(paralytic shellfish toxins,PSTs)积累在滤食性的双壳贝类体内,威胁消费者健康(Asakawa et al,2005)。近年来,国内外在塔玛亚历山大藻的形态结构与分类(齐雨藻等,1994)、生长环境影响因素(颜天等,2002)、种间竞争机制(由希华等,2006)、分子生物学鉴定(Destombe et al,1992)等方面开展研究并取得重要进展。研究表明,CO2是塔玛亚历山大藻光合作用的主要底物和所产PSTs中嘌呤环及R4基团上C的主要来源,海洋环境中CO2浓度的升高对非钙化的塔玛亚历山大藻生长会产生一定的促进作用(Eberlein et al,2014)。目前通过模拟大气中CO2浓度升高,采用活体叶绿素荧光诱导技术(pulse- amplitude-modulation,PAM),根据叶绿素荧光参数变化来研究该藻种光合作用的响应,以及采用高效液相色谱(high performance liquid chromatography,HPLC)技术分析其产毒特征均尚未见报道。
本文选用自养有毒甲藻——塔玛亚历山大藻为研究对象,模拟大气中CO2浓度升高,采用PAM技术检测叶绿素荧光动力学参数的变化,以分析环境中CO2加富对塔玛亚历山大藻光合作用的影响,同时采用HPLC技术分析CO2加富条件下塔玛亚历山大藻所产毒素,以期为研究海洋浮游微藻对海洋酸化的响应提供基础资料和依据。
1 材料与方法 1.1 藻种及其培养条件实验用塔玛亚历山大藻种来自国家海洋局第一海洋研究所种质室。海水取自青岛近岸,0.45μm醋酸纤维膜过滤,高温高压(121°C,1.2×105Pa)灭菌后,冷却至室温; 培养液选用f/2营养盐配方。藻悬液置于国家海洋局第一海洋研究所人工气候培养室培养,温度(20±1)°C,光照强度120μmol/(m2∙s),光周期12:12,pH为8.0±0.1,对数生长期接种。
1.2 实验组和对照组的设定对数生长期的藻液接种到装有1500mL海水的2L三角烧瓶中,采用一次性培养的方法,实验组(加富组)通含1000×10-6 CO2(IPCC预计本世纪末达到的大气CO2浓度)(石莉等,2011)的过滤空气; 对照组通含370×10-6 CO2的过滤空气,通气玻璃管距液面一定距离,气体流量控制在300mL/min。每组实验设置3个平行。每隔2天于下午14:00进行取样,进 行各参数的测定,共取样10次。
1.3 细胞密度、叶绿素含量及叶绿素荧光参数的测定叶绿素含量、叶绿素荧光参数采用脉冲-振幅-调制叶绿素荧光仪(Phyto-PAM,ED,Walz,Effeltrich,Germany)进行测定。取经过20min暗适应的藻液3mL于测量皿中,打开调制测量光,待读数稳定时,打开饱和脉冲,可测得光系统Ⅱ(PSⅡ)最大叶绿素荧光Fm和初始最小叶绿素荧光F0,此时的Y即为Fv/Fm,其中Fv= Fm-F0。F0的弱检测光强为1μmol/(m2∙s),Fm的脉冲饱和光强为1064μmol/(m2∙s),持续20ms,每组样品测定3次。
利用调制叶绿素荧光技术,在每一光合有效辐射(PAR)强度下适应很短的时间,得出的典型光响应曲线称为快速光曲线(Rapid Light Curve,RLC)。RLC测定时,设定的光强梯度为16、32、64、264、464、664、864、1064、1264、1464μmol/(m2∙s),光适应时间为10s,测量结束后,利用仪器自带的Eilers-Peeters模型进行拟合,拟合后得到rETRmax、α、Ik三个光合作用过程中的重要参数。rETRmax相当于最大光合速率Pm、α反映对光的利用效率(捕光能力),Ik反映了样品对强光的耐受能力。
1.4 毒素的收集与测定塔玛亚历山大藻是典型的产PSTs藻株,毒素的收集与测定方法参照文献(陈建华,2013)。将实验组和对照组在第19天取样完成后剩余的每瓶藻液分别过滤到玻璃纤维膜(GF/C,Φ0=47mm,0.45μm)上,随即将滤膜剪碎,放入离心管中,加入3mL HAc(0.05M)溶液,在冰浴中用超声波破碎仪(功率200W,处置20s后静置40s,重复5次)击碎藻细胞; 静置提取10min后6976g离心5min,吸取上清液用水性滤头(ANPEL,SCAA-102,13mm,0.22μm)过滤至样品瓶中,用于毒素的液相色谱仪分析。分析中使用的毒素标准(GTX1-4,dcGTX2、3,GTX5,C1、2,STX,NEO,dcSTX,dcNEO)均购自加拿大国家海洋生物研究所(National Research Council,NRC),检测方法参照Diener等(2006)所建立的梯度洗脱方法进行。
1.5 数据统计与分析运用SPSS for windows 16.0和Origin8.5进行统计分析和绘图。首先对数据进行正态性和方差齐性检验,然后采用配对数据T检验(Paried T-Test)分析实验组和对照组之间的差异显著性,再采用One-Way ANOVA分析培养时间对实验组和对照组荧光参数Fv/Fm、rETRmax、α、Ik是否具有显著影响。上述统计分析差异的置信度水平设为0.05(显著)和0.01(极显著)。
2 结果 2.1 CO2加富对塔玛亚历山大藻PSⅡ最大光化学量子产量Fv/Fm的影响如图 1,在培养时间内,实验组的Fv/Fm均显著高于对照组(除第17天外)。结果说明,CO2加富对Fv/Fm具有极显著影响(P<0.01),能促进塔玛亚历山大藻PSII最大光化学量子产量,提高其最大光能转换效率,在后期CO2加富会起到抑制作用。
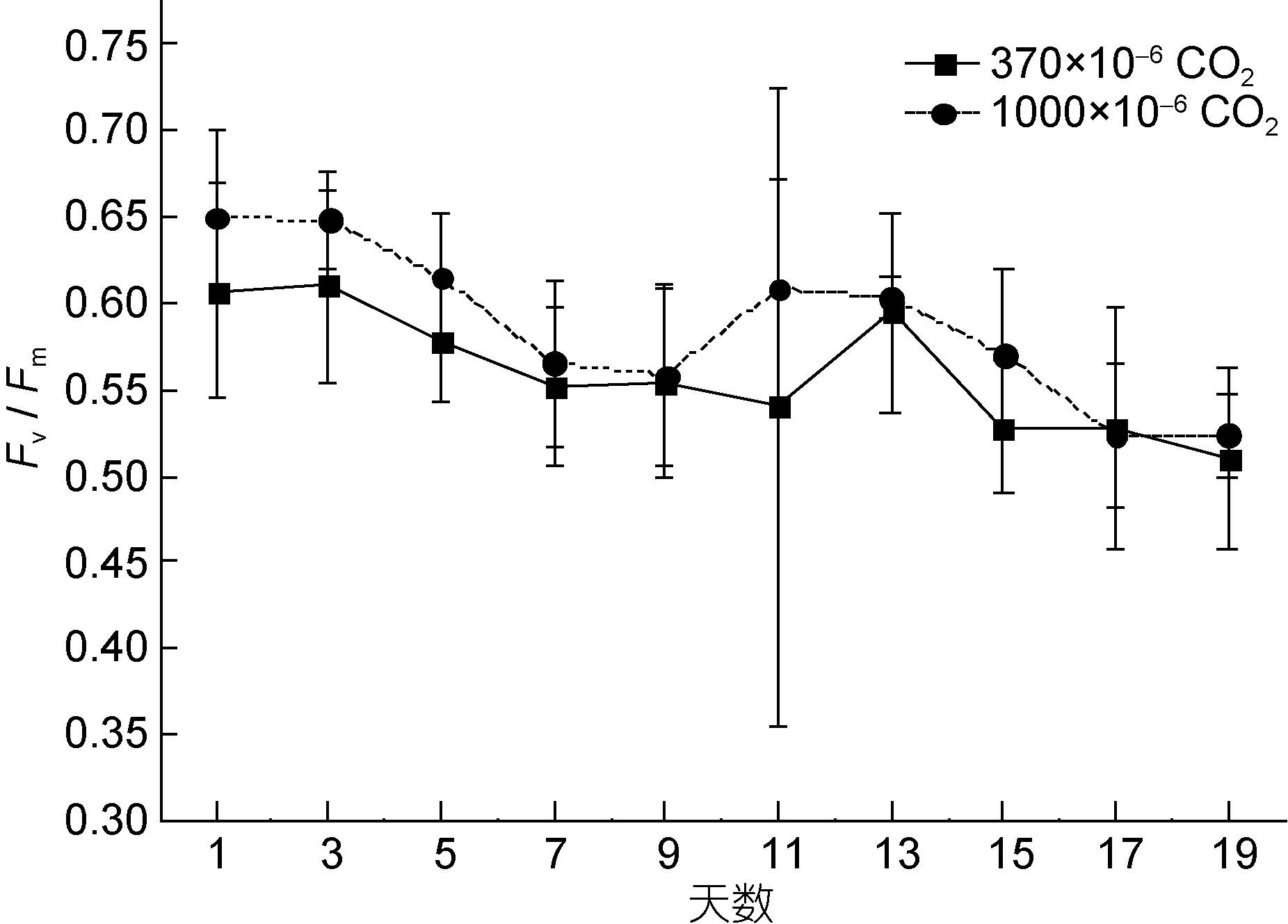 |
| 图 1 实验组和对照组的Fv/Fm随培养时间的变化 Fig. 1 Variation in Fv/Fm of the experimental and control group vs. culturing time |
此外,培养时间对实验组和对照组Fv/Fm均有显著影响(P<0.05),实验组和对照组的Fv/Fm均随着培养时间而降低,对照组的变化范围是0.51—0.60,实验组的变化范围是0.52—0.65。这说明随着培养时间PSII的最大光化学量子产量会降低。同时,Fv/Fm还是藻类生理状态的重要指标,对甲藻而言,未受生理胁迫的Fv/Fm一般稳定在0.65左右(Kolber et al,1988)。因此,此结果还说明随着作用时间的增长,实验组和对照组的塔玛亚历山大藻均受到一定程度的抑制。
2.2 CO2加富对快速光曲线的影响如图 2a,实验组rETRmax前13天显著高于对照组(P<0.05),第15、17天开始显著低于对照组(P<0.05)。结果说明,CO2加富对rETRmax有显著影响(P<0.05),在培养前期,CO2加富能促进塔玛亚历山大藻的相对最大电子传递效率(即最大光合速率),培养15天后,CO2加富却抑制塔玛亚历山大藻的相对最大电子传递效率; 然而对Ik和α影响不显著(P>0.05),说明CO2加富对塔玛亚历山大藻的光能 利用效率及耐受强光的能力影响不显著(如图 2b、c)。
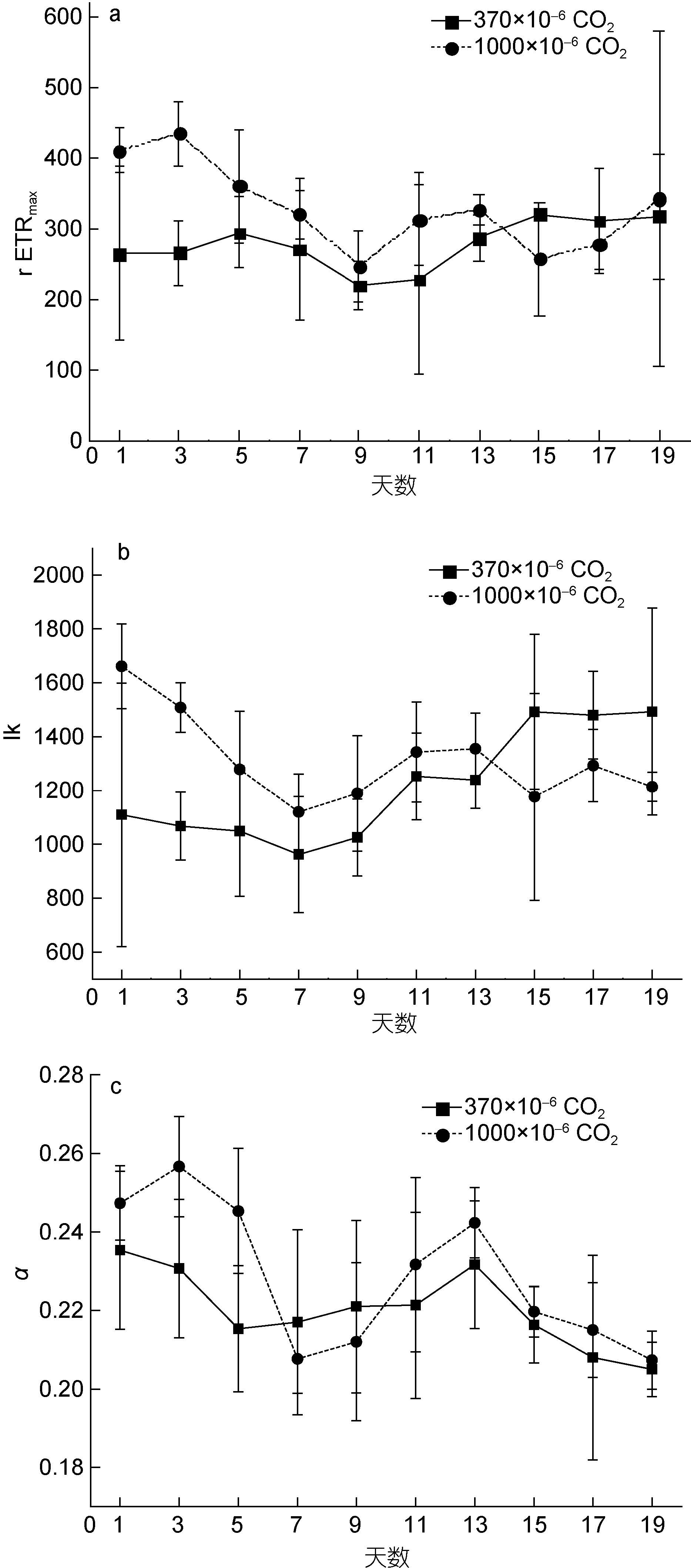 |
| 图 2 实验组和对照组的快速光曲线拟合参数rETRmax、Ik、α随培养时间的变化 Fig. 2 Variations of rETRmax,Ik,and α of the experimental and control group vs. culturing time |
对于任一组,培养时间对rETRmax、Ik均有显著影响(P<0.05),而对α没有显著影响(P>0.05)。随着培养时间增长,实验组的rETRmax均先下降后上升,最后保持稳定,变化范围是257.6—434.8,对照组的rETRmax则保持稳定,变化范围是219.5—317.7; 实验组的Ik均随呈下降趋势,变化范围是1119.7—1661,对照组的Ik均逐渐上升,变化范围是961.5—1492.5。结果说明,塔玛亚历山大藻的最大光合速率在CO2未加富时基本保持稳定,而在CO2加富时则呈现随培养时间增长而下降趋势; 耐受强光的能力在CO2未加富时呈上升趋势,在CO2加富时呈现下降趋势。
2.3 CO2加富对塔玛亚历山大藻产毒的影响如图 3所示,实验组和对照组均检出PSTs毒素,其中占优势的是GTX1、GTX4、C1及C2毒素,实验组GTX1、GTX4、C1及C2毒素分别占毒素总量的10.5%、3.7%、77.3%、7.0%,对照组GTX1、GTX4、C1及C2毒素则分别占毒素总量的4.0%、3.4%、81.6%、7.5%,毒素C1含量均远超过该组内其余三种毒素含量; 毒素GTX1、GTX4的含量实验组显著高于对照组,毒素C1、C2的含量对照组显著高于实验组(P<0.05)。结果说明,本实验所选用塔玛亚历山大藻株主要是产氨基甲酸酯类和N-磺酰氨甲酰基类两类毒素,并且N-磺酰氨甲酰基类毒素占绝对优势; CO2加富促使氨基甲酸酯类毒素产量提高,而导致N-磺酰氨甲酰基类毒素产量下降。
 |
| 图 3 实验组和对照组的PSTs含量比较 Fig. 3 Concentration of PSTs component extracted from the experimental and control group |
甲藻是浮游藻类的重要成员,对环境因子的变化极为敏感。为了适应环境CO2浓度的升高,有毒甲藻生长及产毒特征也将发生一系列响应性的变化。
本研究发现,CO2加富能促进塔玛亚历山大藻PSII最大光化学量子产量(图 1)和最大相对电子传递效率(图 2),这可能是由于CO2作为光合作用的底物,在CO2加富条件下塔玛亚历山大藻启动了自身CO2浓缩机制(CO2 concentrating mechanisms,CCMs)提高了1,5—二磷酸核酮糖羧化酶(RuBP)的活性,增强了CO2的固定能力,而RuBP加氧酶的活性受到抑制,降低了光呼吸,同时CO2加富能相对提高光系统上蛋白的活性及其合成效率,从而提高光合作用活性(张道允等,2007)。此外,塔玛亚历山大藻自身也会有一定的适应机制,在CO2底物浓度提高而光照强度不变的条件下,塔玛亚历山大藻通过提高对光能的利用效率(初始斜率α),和耐受强光的能力(半饱和光强Ik),来提高光合速率(Cabrerizo et al,2014)。
光系统Ⅱ(PSⅡ)的最大光化学量子产率Fv/Fm反映了藻类进行光合作用的最大潜力,同时也是反映藻类生理状况的重要指标。已有研究表明,当微藻受到光照、温度、盐度、营养盐等环境因子胁迫时,Fv/Fm显著降低(梁英等,2007)。在本研究中,随着培养时间增长实验组和对照组的Fv/Fm均呈现出下降趋势,这与前人的研究结果(梁英等,2007; Napoléon et al,2013)是一致的。Ik反映藻类耐受强光的能力,在RLC中为Pm与α之比,本研究中CO2加富对Ik影响不显著但耐受强光能力表现出随培养时间减弱的趋势,这可能是由于PSⅡ积累过剩的光能而破坏反应中心(Sage et al,1989),并与丁柳丽等(2014)对大型绿藻石莼(Ulva lactica)的研究一致。
叶绿素a是海洋浮游植物中除蓝藻以外均含有的特征色素,一般用其含量来表示浮游植物的生物量,本研究中利用Photo-PAM在一定的调制频率下测定活体叶绿素荧光值,通过与Fv/Fm、rETRmax、Ik、α相关性分析发现,对照组chl a含量与Fv/Fm呈现显著负相关(如图 4a),与rETRmax、Ik、α相关性不显著(图未列出),实验组chl a含量与Fv/Fm、rETRmax、Ik、α呈现(极)显著负相关(如图 4b—e),这说明随着培养时间的增长,藻类生长从对数期逐渐进入平台期,由于生长空间和营养条件的限制,塔玛亚历山大藻的生长逐渐受到环境胁迫,CO2的加富效应不再明显,最大光化学量子产量Fv/Fm等叶绿素荧光参数均呈现降低趋势。
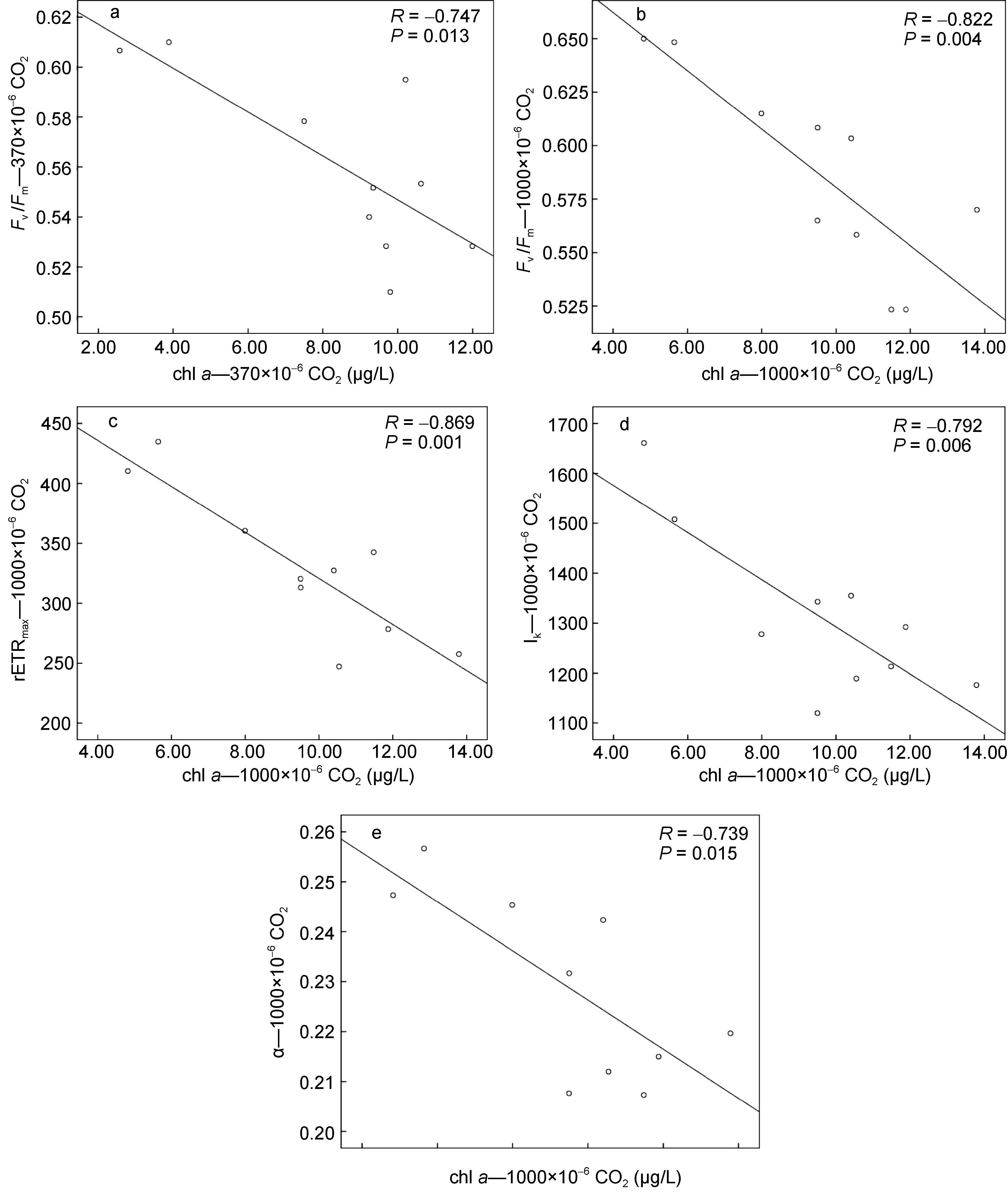 |
| 图 4 对照组chl a与Fv/Fm及实验组chl a与Fv/Fm、rETRmax、Ik、α相关性分析 Fig. 4 Correlation analysis between chlorophyll a and Fv/Fm in the control group and between chlorophyll a and Fv/Fm,rETRmax,Ik or α in the experimental group |
此外,PSTs毒素是含有两个胍基的三环化合物(图 5),碳元素是其结构中不可缺少的部分(于仁诚等,1998),CO2的加富必将对其产量造成影响。根据基团相似性可将PSTs毒素分为五类: 一是氨基甲酸酯类毒素,包括石房蛤毒素(saxitoxin,STX)、新石房蛤毒素(neosaxitoxin,NEO)、漆沟藻毒素1-4(gongautoxin1-4,GTX1-4); 二是N-磺酰氨甲酰基类毒素,包括石房蛤毒素5、6(GTX5、6)、N-磺酰氨甲酰基毒素1-4(C1-4); 三是脱氨甲酰基类毒素,包括脱氨甲酰基石房蛤毒素(Decarbamoyl saxitoxin,dcSTX)、脱氨甲酰基新石房蛤毒素(Decarbamoyl neosaxitoxin,dcNEO)、脱氨甲酰基漆沟藻毒素1-4(Decarbamoyl gongautoxin1-4,dcGTX1-4); 四是脱氧脱氨甲酰基类毒素,包括脱氧脱氨甲酰基石房蛤毒素(Deoxydecarbamoyl saxitoxin,doSTX)、脱氧脱氨甲酰基漆沟藻毒素2、3(Deoxydecarbamoyl gongautoxin2、3,doGTX2、3); 五是N-羟基类衍生物,包括N-羟基石房蛤毒素(N-hydroxycarbamoyl saxitoxin,HySTX)、N-羟基新石房蛤毒素(N-hydroxycarbamoyl neossaxitoxin,HyNeo)。不同地域生长的塔玛亚历山大藻株产生的PSTs种类差异很大(Anderson et al,1996; 林燕棠等,1999),在本研究所用塔玛亚历山大藻主要分离自渤海,所产毒素主要由GTX1、GTX4、C1及C2毒素组成,实验组和对照组中其总和均超过97%,其中C1占绝对优势,CO2加富并未改变毒素C1含量的优势地位,但是CO2加富促使氨基甲酸酯类毒素(GTX1、GTX4)产量提高,而导致N-磺酰氨甲酰基类毒素(C1、C2)产量下降。这可能是由于CO2加富导致藻细胞N-磺酰氨甲酰基类毒素(C1、C2)向氨基甲酸酯类毒素(GTX1、GTX4)转化,从而对其整体毒性造成影响,但由于塔玛亚历山大藻产毒还受到诸如营养盐、温度、盐度等多种环境因子的影响,CO2加富的影响还需进一步探讨。
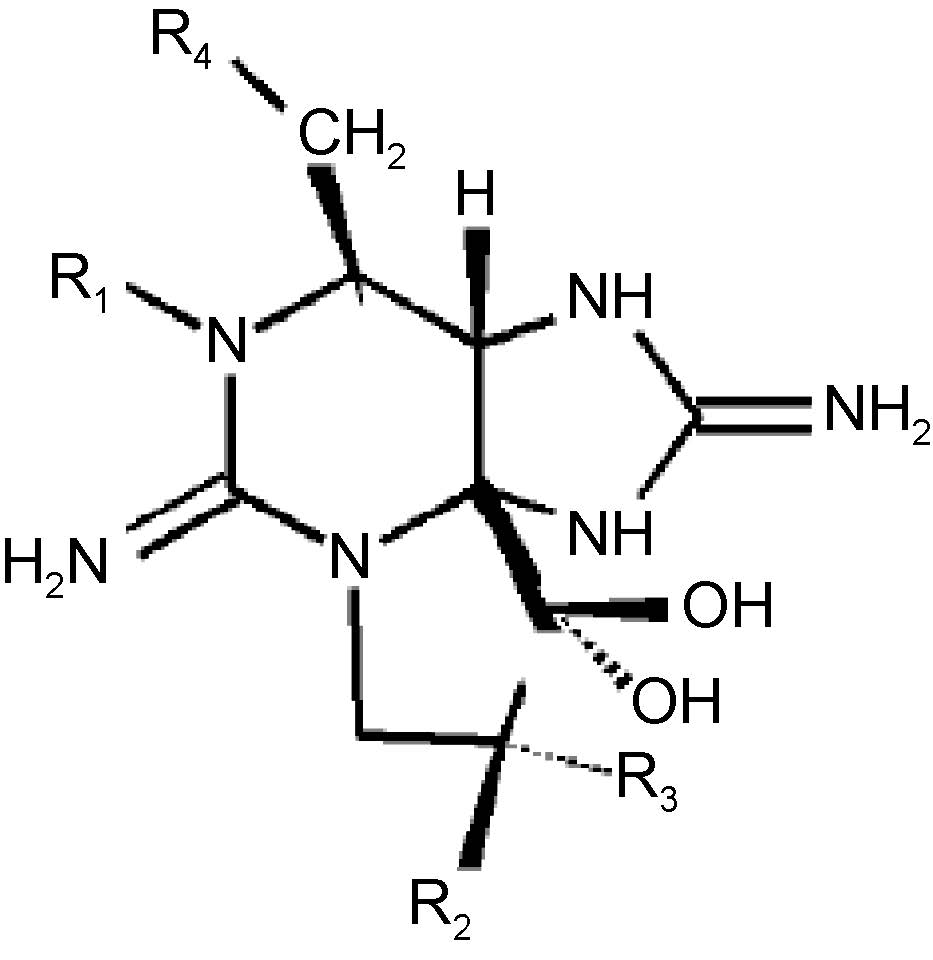 |
| 图 5 麻痹性贝毒的结构式(Baden,1983) Fig. 5 The structure of paralytic shellfish poisoning(Baden,1983) |
塔玛亚历山大藻作为有毒赤潮甲藻的典型成员,在特定环境条件下,其叶绿素荧光参数及产毒均对CO2加富会作出响应,具体表现在能提高其最大光能转换效率、相对最大电子传递效率以及促使产毒素发生转化,能为研究海洋浮游微藻对海洋酸化的响应提供基础资料和依据。
 2016, Vol. 47
2016, Vol. 47


