中国海洋湖沼学会主办。
文章信息
- 邓益琴, 赵晶晶, 刘松林, 赵哲, 陈偿. 2016.
- DENG Yi-Qin, ZHAO Jing-Jing, LIU Song-Lin, ZHAO Zhe, CHEN Chang. 2016.
- Hfq对溶藻弧菌(Vibrio alginolyticus)毒力的调控分析
- ROLE OF Hfq IN VIRULENCE REGULATION OF VIBRIO ALGINOLYTICUS
- 海洋与湖沼, 47(3): 604-611
- Oceanologia et Limnologia Sinica, 47(3): 604-611.
- http://dx.doi.org/10.11693/hyhz20160100022
-
文章历史
- 收稿日期:2016-01-29
- 改回日期:2016-03-30
2. 中国科学院南海海洋研究所 广东省应用海洋生物学重点实验室 广州 510301;
3. 中国科学院南海海洋研究所 西沙、南沙深海海洋环境观测研究站 广州 510301;
4. 中国科学院大学 北京 100049
2. Guangdong Provincial Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China;
3. Xisha/Nansha Ocean Oberservation and Research Station, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
溶藻弧菌(Vibrio alginolyticus)是海洋环境中普遍存在的革兰氏阴性菌。它是海水养殖中最常见和危害最严重的细菌性病原之一(Campanelli et al,2008; 赖迎迢等,2014),其引起的“弧菌病”的发病率在近些年呈现逐渐上升趋势(Newton et al,2012)。同时,溶藻弧菌也是人类的机会致病菌,可通过食源途径引起人类患病(Feingold et al,2004; Austin 2010)。其致病性与相关致病因子的表达调控密切相关,因此深入研究溶藻弧菌的分子致病机理,对溶藻弧菌病害暴发的防控非常重要。
分子伴侣Hfq在细菌环境适应过程以及毒力等多种生命活动中具有重要调控作用(Sousa et al,2010; Berghoff et al,2011; Cui et al,2013)。因此,hfq基因的缺失通常引起细菌许多表型变化(Cui et al,2013; Arce-Rodríguez et al,2015)。如副溶血弧菌中hfq缺失导致菌株超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性下调,从而抗氧化能力增强(Su et al,2010); 致病菌铜绿假单胞菌(Pseudomonas aeruginosa)在缺失hfq基因后,不但影响到生长速度和环境适应因子σS的表达量,而且与致病力相关的颤搐(twitching)、涌动(swarming)的能力也大为下降,各种毒素如弹性蛋白酶、过氧化氢酶的合成甚至下降80%以上(Sonnleitner et al,2006)。但Hfq蛋白在不同细菌中的调控作用不同,如Hfq作为协助sRNAs的分子伴侣,参与细菌群体感应(quorum sensing,QS)系统的调控,在霍乱弧菌中,QS系统控制着毒力、生物膜合成、蛋白酶分泌等(Nielsen et al,2006; Joelsson et al,2007); 而在鳗弧菌中,QS系统负责调控生物膜合成、丝氨酸合成、色素的产生及EmpA金属蛋白酶的合成(Weber et al,2008)。但是,目前通过研究Hfq对溶藻弧菌生物学特性的影响来分析其毒力的系统性研究还较少。
本研究以溶藻弧菌ZJ-T为研究对象,探讨hfq基因对溶藻弧菌运动、生物膜形成、铁代谢、胞外蛋白酶分泌等与毒力相关生理生化过程,进而研究Hfq对其毒力的调控作用,从而揭示Hfq在溶藻弧菌疾病暴发中的作用,同时也为控制溶藻弧菌病害的暴发提供新的思路和防治靶标。
1 材料与方法 1.1 材料 1.1.1 菌株实验所用菌株: 溶藻弧菌野生株ZJ-T,hfq突变株Δhfq-T,hfq回补株hfq+-T及大肠杆菌DH5α见表 1。
| Strain | Genotypes | Source |
| Vibrio alginolyticus | ||
| ZJ-T | Apr; translucent/smooth variant of wild strain ZJ51(Xie et al,2005); isolated from diseased grouper fish off the Southern China coast | (Chen et al,2009) |
| ∆hfq-T | Apr; ZJ-T carrying an in-frame deletion of hfq gene | This study |
| hfq+-T | Apr,Cmr; ∆hfq-T complemented with intact hfq gene | This study |
| Escherichia coli | ||
| DH5α | F-φ80lacZ∆M15∆(lacZYA-argF)U169 endA1 recA1hsdR17(rk-,mk+)supE44λ- thi-1 gyrA96 relA1 phoA | This lab |
| Apr: 氨苄青霉素抗性; Cmr: 氯霉素抗性 | ||
NaCl、葡萄糖、MgSO4、结 晶紫等生化试剂购自广州威佳公司。脱脂奶粉、2-2’-联吡啶购至生工生物工程上海股份有限公司。小牛血清购至Gibco公司。
1.1.3 主要培养基TSB(Tryptic Soy Broth)培养基购自BD公司。LB(Luria-Bertani)/ LBS(3% NaCl)培养基的组分蛋白胨、酵母粉和琼脂粉购自广东环凯公司。DEME培养基购至Gibco公司。
1.1.4 实验用细胞和石斑鱼试验用小鼠成肌细胞系C2C12细胞由本研究所“海洋生物技术与遗传学科组”赵密博士提供。实验用石斑鱼(Epinephelus awoara)购至海口水产市场,每尾15—20g,在室内实验室2m3水箱内暂养1周后用于实验。
1.2 方法 1.2.1 游动性和涌动性测定将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基,于30°C 200r/min振摇培养过夜; 调整培养液浓度至相同吸光度(OD600nm=1.0),取5 μL平行三次点样到0.3%琼脂半固体LBS平板测试其游动性,同时取5μL平行三次点样到1.5%琼脂固体LBS平板测试其涌动性,分别30°C静置培养16h和24h,测量菌斑直径。
1.2.2 生物膜形成实验将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基,于30°C 200r/min振摇培养过夜。按1mL/孔用量于24孔培养板中加入BF培养基(Biofilm growth medium)。调整培养液浓度至相同吸光度(OD600nm=1.0),同一菌株平行三次分别将10 μL调试菌液加到1 mL BF培养基,30°C静置培养。每2h间隔取样,利用结晶紫染色法定量测定生物膜生成量OD590nm。结晶紫染色法操作参见Chen等(2009)。
1.2.3 限铁环境下生长能力测试将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基,于30°C200r/min振摇培养过夜。调整培养液浓度至相同吸光度(OD600=5.0),同时10倍倍比稀释各菌株菌液至最高稀释倍数为106,然后将倍比稀释菌液依次取5μL平行三次点样到TSB平板以及TSB添加120μmol/L2-2’-联吡啶平板上,30°C静置培养24h,观察细菌生长情况。
1.2.4 细菌胞外蛋白酶活性检测将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基,于30°C 200r/min振摇培养过夜; 调整培养液浓度至相同吸光度(OD600nm=5.0),取5μL平行三次点样到LBS添加1%脱脂奶粉平板上。30°C静置培养24h,测量蛋白分解圈直径以及克隆直径。
1.2.5 细胞感染实验C2C12细胞在37°C下培养于DEME添加10%小牛血清培养液中。将单个克隆的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T分别接种至LBS液体培养基,于30°C 200r/min振摇至对数期。同时,
接种没有细胞毒性的大肠杆菌DH5α单克隆至LB液体培养基,于37°C 200r/min振摇至对数期作为阴性对照。室温下,4000g 3min离心收集细菌,细菌沉淀用无血清DEME培养液洗涤两次后以感染复数MOI =100的量加入到单层C2C12细胞中。分别在感染0.5、1.0、2.0以及3.0h后,于显微镜下观察细胞形态变化。
1.2.6 石斑鱼致死性实验石斑鱼每组5尾,分别于5L的容器中25—28°C条件下饲养,定期喂食。细菌于LBS液体培养基上培养过夜,用灭菌的生理盐水洗脱,并稀释成不同浓度的菌体悬液。分别取100 μL不同浓度的溶藻弧菌ZJ-T、Δhfq-T和hfq+-T菌液腹腔注射石斑鱼,对照注射等体积的生理盐水。注射的石斑鱼相同条件下饲养一周,记录死亡数,计算半数致死量(LD50)。
1.2.7 数据处理与分析所有试验重复三次以上,使用统计分析软件IBM SPSS Statistics 19进行单因素方差LDS分析,P<0.05被认为显著差异。
2 结果与分析 2.1 Hfq对溶藻弧菌运动性的调控在0.3%琼脂半固体LBS平板及1.5%琼脂固体LBS平板上,hfq缺失均造成溶藻弧菌运动能力极显著下降(P<0.001); 在hfq+-T中,运动能力的缺失得到回补(图 1A,1B)。以上结果表明,hfq基因正调控溶藻弧菌的运动性。
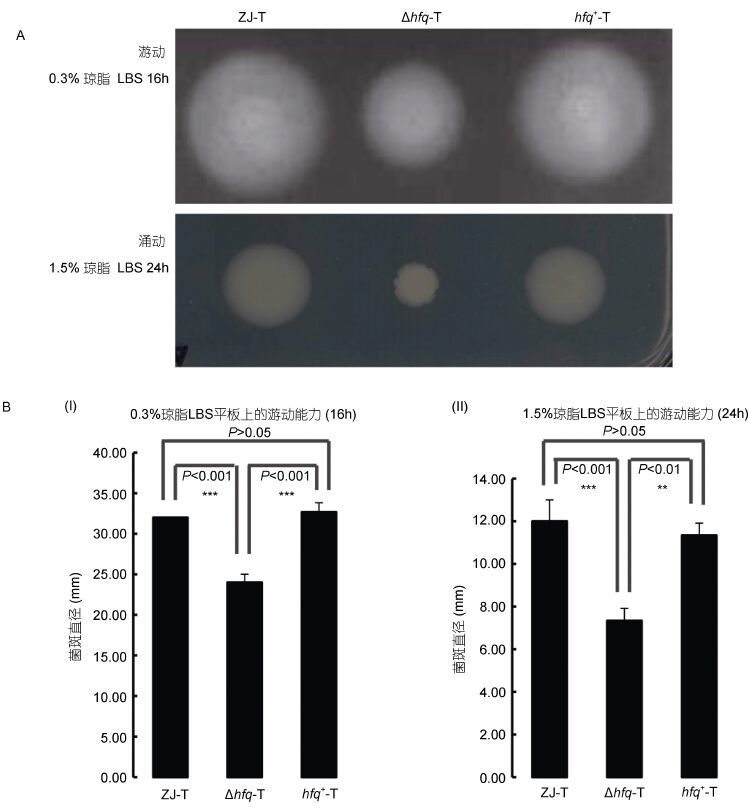 |
| 图 1 溶藻弧菌ZJ-T、Δhfq-T和hfq+-T在0.3%和1.5%琼脂LBS平板上的运动性(A)及统计分析(B) Fig. 1 Motility of ZJ-T,Δhfq-T and hfq+-T on 0.3% and 1.5% LBS agar plates(A)and statistical analysis(B) |
在细菌生物膜形成的动态曲线中,可见hfq缺失后并不影响生物膜成熟的时间,仍可在BF培养基中,30°C静置培养6 h后到达顶峰,且hfq的缺失并没有对成熟期生物膜的密度造成影响,但其前期的合成速度明显下降,而后期的解离速度上升(图 2)。以上结果说明,hfq基因同时调控溶藻弧菌生物膜的形成和解离。
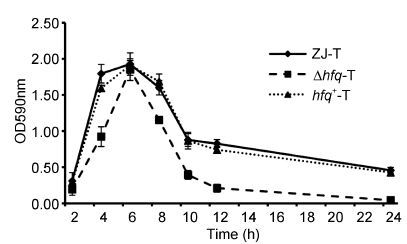 |
| 图 2 溶藻弧菌ZJ-T、Δhfq-T和hfq+-T细胞生物膜形成动力学曲线 Fig. 2 Kinetic biofilm formation of ZJ-T,Δhfq-T and hfq+-T |
摄铁系统和胞外蛋白酶是溶藻弧菌两个重要致病因子。从图 3中可以看出,hfq缺失后,细菌在铁离子螯合剂2-2’-联吡啶存在情况下生长有所减弱,说明hfq的缺失,减弱溶藻弧菌的摄铁能力; 此外从图 4中看出,hfq缺失后,溶藻弧菌胞外蛋白酶的分泌显著增加(P<0.01)。
 |
| 图 3 溶藻弧菌ZJ-T、Δhfq-T和hfq+-T在TSB以及TSB添加120μmol/L 2-2′-联吡啶平板上的生长情况 Fig. 3 Growth ability of ZJ-T,Dhfq-T and hfq+-T on TSB agar plate and TSB agar plate supplemented with 120μmol/L 2,2′-Bipyridyl |
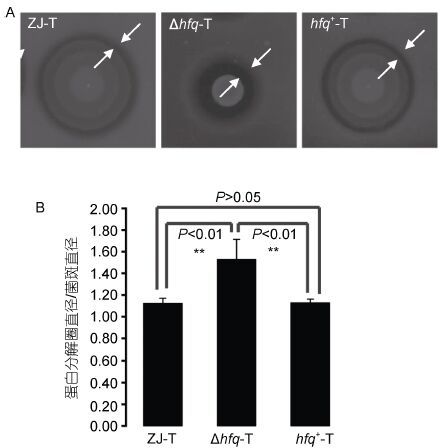 |
| 图 4 溶藻弧菌ZJ-T、Δhfq-T和hfq+-T在LBS+1%脱脂奶粉平板上胞外蛋白酶的分泌(A)以及统计分析(B) Fig. 4 The extracellular protease activities of ZJ-T,∆hfq-T and hfq+-T on LBS agar plates containing 1% skimmed milk(A)and statistical analysis(B) |
经野生菌株ZJ-T(图 5e—h,)和回补菌株hfq+-T(图 5m—p,)感染的细胞,在感染1.0h后即出现细胞变圆脱落; 并且随着感染时间延长,变圆脱落的细胞逐渐增加。而hfq缺失后,随着感染时间延长,细胞变圆脱落现象几乎不发生(图 5,i—l),与阴性对照组DH5α(图 5,a—d)表现一致。
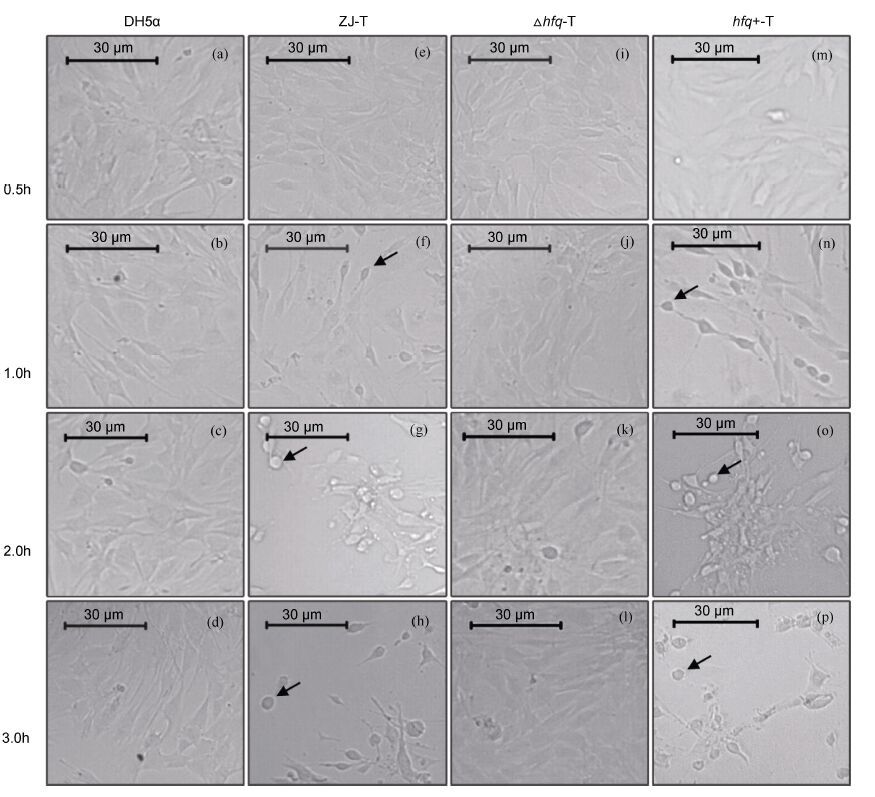 |
| 图 5 Hfq正调控溶藻弧菌对C2C12的细胞毒性 Fig. 5 Hfq positively regulated the cytotoxicity to C2C12 in V. alginolyticus |
以上结果说明,Hfq正调控溶藻弧菌的细胞毒性。
2.5 石斑鱼致死性实验为测定hfq突变后对溶藻弧菌毒力的影响,用注射石斑鱼的方法对其进行动物毒力实验。结果显示(表 2),hfq缺失后造成溶藻弧菌毒力丧失,半数致死量LD50达到2.8×109 CFU,相比野生株和回补株提高了3个数量级。
| Groups | Dose(CFU/fish) | No. of fish | No. of dead fish | Mortality(%) | LD50(CFU/fish) |
| ZJ-T | 3.3×107 6.5×106 3.3×106 6.5×105 | 5 5 5 5 | 5 4 3 0 | 100.00 80.00 60.00 0.00 | 2.3×106 |
| △hfq-T | 3.1×109 1.6×109 6.2×108 3.1×108 | 5 5 5 5 | 3 0 0 0 | 60.00 0.00 0.00 0.00 | 2.8×109 |
| hfq+-T | 1.8×107 9.0×106 9.0×105 1.8×105 | 5 5 5 5 | 5 5 1 0 | 100.00 100.00 20.00 0.00 | 2.4×106 |
| Sterile saline | 100 μL | 5 | 0 | 0.00 | — |
hfq缺失使得溶藻弧菌游动能力和涌动能力都显著下降(P<0.001)(图 1A,1B),这与致肾盂肾炎大肠埃希菌(Uropathogenic Escherichia coli)、鼠伤寒沙门菌(Salmonella typhimurium)和铜绿假单胞菌(Pseudomonas aeruginosa)中研究结果类似(Sonnleitner et al,2003; Sittka et al,2007; Kulesus et al,2008)。hfq缺失株很可能改变了溶藻弧菌鞭毛的生长(Liu et al,2011)。生物膜的形成在hfq缺失的情况下减弱(图 2),这与霍乱弧菌(Vibrio cholerae)以及嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)的结果相似(Chao et al,2010; Roscetto et al,2012)。但与卡他莫拉菌(Moraxella catarrhalis)和恶臭假单胞菌(Pseudomonas putida)中的研究结果相悖(Attia et al,2008; Chao et al,2010)。这是因为细菌的生物膜形成模式多样,参与因子也各有不同 (Davey et al,2000),如大肠杆菌需要鞭毛的游动、I型菌毛及外膜蛋白Ag43参与前期的附着,而胞外多糖参与成熟; 在绿脓杆菌中初期附着即需要鞭毛、脂多糖(LPS)及外膜蛋白,在生物膜成熟阶段,则需要胞间通讯信号分子高丝氨酸类脂(acyl-HSLs,AHLs)及海藻酸钠(Alginate)的参与。因此,这里Hfq很可能通过改变溶藻弧菌运动能力,从而参与调控了前期的细胞附着过程。而成熟过程还可能受到分泌的胞外多糖、外膜蛋白以及各种信号分子的影响。
细胞毒性实验和石斑鱼感染实验都表明hfq缺失后,溶藻弧菌毒力显著下降甚至消失(图 5,表 2)。溶藻弧菌的主要毒力因子包括摄铁系统、粘附素、胞外产物、生物膜等(滕勇勇等,2014; Wyckoff et al,2015)。本研究发现,hfq缺失株在限铁环境上生长减弱(图 3),因此,Hfq可能通过辅助相关sRNAs从而调控铁代谢相关基因的表达(Mellin et al,2010; Deng et al,2012),达到调控溶藻弧菌毒力的作用。此外,细菌感染宿主的第一步是粘附,这主要通过粘附素来完成。前人研究表明溶藻弧菌对Hep-2细胞,上皮细胞,黑鲷的肠粘膜、鳃、表皮等都有较强的粘附作用(Baffone et al,2001; Balebona et al,2001)。其中鞭毛是溶藻弧菌菌毛粘附素之一,本研究中hfq缺失株的运动性下降也可能导致其毒力下降。Berg等(1995)和Liang等(2007)研究发现霍乱弧菌运动功能缺失后不仅影响其在肠道内定殖能力,而且霍乱毒素、溶血素等毒力因子表达缺失(Berg et al,1995; Liang et al,2007)。因此,溶藻弧菌很可能与霍乱弧菌存在一套相同的运动性调控致病性的系统,即Hfq通过调控溶藻弧菌的运动能力,从而调控其对宿主的粘附能力,影响其在宿主体内的定殖,并且调控其相关毒力因子的表达,进而影响溶藻弧菌对宿主的致病性(Josenhans et al,2002; Liang et al,2007)。致病菌粘附定殖宿主后很容易形成生物膜,与外界隔离并适应宿主环境,起到自我保护作用。细菌形成生物膜主要通过减少宿主机体细胞因子产生、酶解宿主细胞因子等抗免疫机制以及对抗生物素等的抗药性机制致病。从生物膜形成动态曲线(图 2)看出: 6h后生物膜形成量达到最多; 24h后hfq缺失株生物膜基本解离完全,且此过程中hfq缺失株生物膜形成速度以及生物膜量均低于野生株和回补株,因此,在溶藻弧菌中生物膜的形成也与其毒力密切相关。此外,本研究发现,hfq缺失株胞外蛋白酶分泌显著增强(P<0.01)(图 4A,4B)。因此,溶藻弧菌胞外蛋白酶对所测试的C2C12细胞以及石斑鱼红细胞可能不具有溶解作用,而其溶血素、碱性丝氨酸蛋白酶(Alkaline serine exoprotease,AspA)等胞外产物调控其毒力作用(Toranzo et al,1983; Chen et al,2000)。
4 结语Hfq调控溶藻弧菌的运动、生物膜形成、铁代谢、胞外蛋白酶分泌等生理生化过程,从而改变其对宿主的侵染粘附以及摄铁能力等,并对宿主产生毒性。Hfq作为分子伴侣,协助相关sRNAs转录后调控相关基因表达,而这些基因中很有可能存在毒力基因,因此下一步通过研究Hfq依赖型sRNAs对溶藻弧菌致病性的调控,寻找新的毒力相关基因,这为控制溶藻弧菌病害暴发提供理论指导具有重要意义。
| 赖迎迢, 陶家发, 孙承文, 等. 2014. 鱼源溶藻弧菌生物学特性和病理组织学观察. 微生物学报, 54(11): 1378–1384 |
| 滕勇勇, 王琪, 吴雷, 等. 2014. 致病性弧菌的生物学特性和致病因子研究进展. 热带医学杂志, 14(10): 1396–1398 |
| Arce-Rodríguez A, Calles B, Nikel P I et al. 2015. The RNA chaperone Hfq enables the environmental stress tolerance super-phenotype of Pseudomonas putida. Environmental Microbiology,http://dx.doi.org/10.1111/1462-2920.13052 |
| Attia A S, Sedillo J L, Wang W, et al. 2008. Moraxella catarrhalis expresses an unusual Hfq protein. Infection and Immunity, 76(6): 2520–2530 |
| Austin B. 2010. Vibrios as causal agents of zoonoses. Veterinary Microbiology, 140(3-4): 310–317 |
| Baffone W, Citterio B, Vittoria E, et al. 2001. Determination of several potential virulence factors in Vibrio spp. isolated from sea water. Food Microbiology, 18(5): 479–488 |
| Balebona M, Moriñigo M A, Borrego J. 2001. Hydrophobicity and adhesion to fish cells and mucus of Vibrio strains isolated from infected fish. International Microbiology, 4(1): 21–26 |
| Berg P, Singer M F. 1995. The recombinant DNA controversy: twenty years later. Proceedings of the National Academy of Sciences of the United States of America, 92(20): 9011–9013 |
| Berghoff B A, Glaeser J, Sharma C M, et al. 2011. Contribution of Hfq to photooxidative stress resistance and global regulation in Rhodobacter sphaeroides. Molecular Microbiology, 80(6): 1479–1495 |
| Campanelli A, Sanchez-Politta S, Saurat J H. 2008. Cutaneous ulceration after an octopus bite: infection due to Vibrio alginolyticus, an emerging pathogen. Annales de Dermatologie et de Vénéréologie, 135(3): 225–227 |
| Chao Y J, Vogel J. 2010. The role of Hfq in bacterial pathogens. Current Opinion in Microbiology, 13(1): 24–33 |
| Chen C, Xie J, Hu C Q. 2009. Phenotypic and genetic differences between opaque and translucent colonies of Vibrio alginolyticus. Biofouling, 25(6): 525–531 |
| Chen F R, Liu P C, Lee K K. 2000. Lethal attribute of serine protease secreted by Vibrio alginolyticus strains in kuruma prawn Penaeus japonicus. Zeitschrift für Naturforschung C, 55(1-2): 94–99 |
| Cui M Q, Wang T K, Xu J, et al. 2013. Impact of Hfq on global gene expression and intracellular survival in Brucella melitensis. PLoS One, 8(8): |
| Davey M E, O¢toole G A. 2000. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews, 64(4): 847–867 |
| Deng Z L, Meng X R, Su S C, et al. 2012. Two sRNA RyhB homologs from Yersinia pestis biovar microtus expressed in vivo have differential Hfq-dependent stability. Research in Microbiology, 163(6-7): 413–418 |
| Feingold M H, Kumar M L. 2004. Otitis media associated with Vibrio alginolyticus in a child with pressure-equalizing tubes. The Pediatric Infectious Disease Journal, 23(5): 475–476 |
| Joelsson A, Kan B, Zhu J. 2007. Quorum sensing enhances the stress response in Vibrio cholerae. Applied and Environmental Microbiology, 73(11): 3742–3746 |
| Josenhans C, Suerbaum S. 2002. The role of motility as a virulence factor in bacteria. International Journal of Medical Microbiology, 291(8): 605–614 |
| Kulesus R R, Diaz-Perez K, Slechta E S, et al. 2008. Impact of the RNA chaperone Hfq on the fitness and virulence potential of uropathogenic Escherichia coli. Infection and Immunity, 76(7): 3019–3026 |
| Liang W L, Pascual-Montano A, Silva A J, et al. 2007. The cyclic AMP receptor protein modulates quorum sensing, motility and multiple genes that affect intestinal colonization in Vibrio cholerae. Microbiology, 153(9): 2964–2975 |
| Liu H, Wang Q Y, Liu Q, et al. 2011. Roles of Hfq in the stress adaptation and virulence in fish pathogen Vibrio alginolyticus and its potential application as a target for live attenuated vaccine. Applied Microbiology and Biotechnology, 91(2): 353–364 |
| Mellin J R, McClure R, Lopez D, et al. 2010. Role of Hfq in iron-dependent and -independent gene regulation in Neisseria meningitidis. Microbiology, 156(8): 2316–2326 |
| Newton A, Kendall M, Vugia D J, et al. 2012. Increasing rates of vibriosis in the United States, 1996-2010: review of surveillance data from 2 systems. Clinical Infectious Diseases, 54(S5): |
| Nielsen A T, Dolganov N A, Otto G, et al. 2006. RpoS controls the Vibrio cholerae mucosal escape response. PLoS Pathogens, 2(10): e109 |
| Roscetto E, Angrisano T, Costa V, et al. 2012. Functional characterization of the RNA chaperone Hfq in the opportunistic human pathogen Stenotrophomonas maltophilia. Journal of Bacteriology, 194(21): 5864–5874 |
| Sittka A, Pfeiffer V, Tedin K, et al. 2007. The RNA chaperone Hfq is essential for the virulence of Salmonella typhimurium. Molecular Microbiology, 63(1): 193–217 |
| Sonnleitner E, Hagens S, Rosenau F, et al. 2003. Reduced virulence of a hfq mutant of Pseudomonas aeruginosa O1. Microbial Pathogenesis, 35(5): 217–228 |
| Sonnleitner E, Schuster M, Sorger-Domenigg T, et al. 2006. Hfq-dependent alterations of the transcriptome profile and effects on quorum sensing in Pseudomonas aeruginosa. Molecular Microbiology, 59(5): 1542–1558 |
| Sousa S A, Ramos C G, Moreira L M, et al. 2010. The hfq gene is required for stress resistance and full virulence of Burkholderia cepacia to the nematode Caenorhabditis elegans. Microbiology, 156(3): 896–908 |
| Su Z H, Nakano M, Koga T, et al. 2010. Hfq regulates anti- oxidative ability in Vibrio parahaemolyticus. The Journal of General And Applied Microbiology, 56(3): 181–186 |
| Toranzo A E, Barja J L, Colwell R R, et al. 1983. Haemagglutinating, haemolytic and cytotoxic activities of Vibrio anguillarum and related vibrios isolated from striped bass on the Atlantic Coast. FEMS Microbiology Letters, 18(3): 257–262 |
| Weber B, Croxatto A, Chen C, et al. 2008. RpoS induces expression of the Vibrio anguillarum quorum-sensing regulator VanT. Microbiology, 154(3): 767–780 |
| Wyckoff E E, Allred B E, Raymond K N, et al. 2015. Catechol Siderophore Transport by Vibrio cholerae. Journal of Bacteriology, 197(17): 2840–2849 |
| Xie Z Y, Hu C Q, Chen C, et al. 2005. Investigation of seven Vibrio virulence genes among Vibrio alginolyticus and Vibrio parahaemolyticus strains from the coastal mariculture systems in Guangdong, China. Letters in Applied Microbiology, 41(2): 202–207 |
 2016, Vol. 47
2016, Vol. 47


