
中国海洋湖沼学会主办。
文章信息
- 叶键, 刘晓宁, 王晓, 徐慧, 沈文英, 高敏杰, 章晓栋. 2016.
- YE Jian, LIU Xiao-Ning, WAN Xiao, XU Hui, SHEN Wen-Ying, GAO Min-Jie, ZHANG Xiao-Dong. 2016.
- 青鱼(Mylopharyngodon piceus)新发病病原类志贺邻单胞菌(Plesiomonas shigelloides)的分离鉴定
- ISOLATION AND IDENTIFICATION OF PATHOGENIC PLESIOMONAS SHIGELLOIDES FEOM DISEASED BLACK CARP MYLOPHARYNGODON PICEUS
- 海洋与湖沼, 47(3): 633-639
- Oceanologia et Limnologia Sinica, 47(3): 633-639.
- http://dx.doi.org/10.11693/hyhz20160300049
-
文章历史
- 收稿日期:2016-03-09
- 改回日期:2016-04-15
2. 杭州市水产技术推广总站 杭州 310001;
3. 杭州大江东产业集聚区农业局 杭州 311222;
4. 绍兴出入境检验检疫局 绍兴 312000
2. Hangzhou Aquacultural Techica Extending Centre, Hangzhou 310001, China;
3. Hangzhou Dajiangdong Industrial District Agricultural Bureau, Hangzhou 311222, China;
4. Shaoxing Entry-exit Inspection and Quaratine Bureau, Shaoxing 312000, China
青鱼(Mylopharyngodon piceus)亦称黑鲩、螺蛳青,属硬骨鱼纲、鲤科鱼类。个体大,生长迅速,最大个体可达70kg,肉味美。分布于中国各大水系,主产于长江以南平原地区,为中国主要淡水鱼类养殖对象,是我国淡水养殖的“四大家鱼”之一(Li et al,1995)。近年来由于环境、饲料、养殖管理等因素导致的青鱼病害问题不断,已经报道的可引发青鱼大规模病害的主要病原菌有嗜水气单胞菌(Aeromonas hydrophila)、荧光假单胞菌(Pseudomonas fluorescens)等(Wang et al,2009; 张波等,2010),尤其是前者容易引起急性暴发,造成青鱼大规模死亡。由于两者均可引发其它大宗淡水鱼类死亡,因而对青鱼的感染及致病机理研究不深入。目前专门针对青鱼病害的研究涉及较少,由类志贺邻单胞菌引发的青鱼病害也未见报道。
2015年8月,杭州市一养殖场青鱼暴发病情,发病鱼不分个体大小,行动缓慢,反应迟钝,常离群独游; 体表出现溃烂,位置不一; 解剖可见肠道充血,肾脏肿大,呈紫红色,日死亡率达5%以上。本实验自病症典型患病鱼体内分离到1株可疑菌株,经生化和分子生物学方法鉴定其为类志贺邻单胞菌,并进一步通过回归感染确定了其病原性,同时检测了其毒力和药物敏感性,为生产中正确预防及治疗该菌的感染提供了科学参考。
1 材料与方法 1.1 材料药敏纸片购自杭州天和微生物试剂有限公司; Premix Ex Taq,PCR产物纯化试剂盒购自TaKaRa公司(日本); 细菌基因组抽提试剂盒购自Qiagen公司(德国); 健康青鱼(1000—1200g)购自杭州市某青鱼养殖场,体表无伤,隔天喂食,养殖一周确认健康后用于致病性实验; 40日龄SPF级BALB/c雌性小鼠购自浙江中医药大学实验动物中心。
1.2 病原菌分离及保存将患病的青鱼用75%的酒精进行体表消毒处理,用手术刀刮除溃烂处腐肉后,从肌肉处分离接种于LB琼脂培养基上; 解剖后从肝脏、肾脏处分离接种于LB琼脂培养基上。将培养基置于37°C培养36 h,挑取优势菌群进行分离纯化,然后接种至营养琼脂上培养。同时将纯化后的菌液加入等体积的20%(V/V)甘油,于-80°C超低温冰箱中保存备用。
1.3 病原菌形态及生理生化特性检测将细菌菌株纯化培养后,经涂片、固定和革兰氏染色后,使用光学显微镜观察。用等渗的无菌生理盐水洗下菌苔,在JSM-6360LV扫描电镜进行观察。对分离菌株用API ID32E系统(Biomerieux,法国)进行生化鉴定。
1.4 16S rDNA的PCR 扩增、测序和分析以细菌基因组为模板,应用16S rRNA通用引物(8F: 5′-AGAGTTTGATCCTGGCTCAG-3′; 1492R: 5′- AAGGAGGTGATCCAGCCGCA-3′)进行PCR扩增。PCR产物用PCR产物纯化试剂盒回收后,交Invitrogen公司测序。将测序所得到菌株16S rRNA序列通过NCBI的Blast检索系统进行序列同源性分析。选取同源性较高的同种菌株的16S rRNA序列,设置外群,使用MEGA4.0软件,采用邻接法构建系统发育树。通过自举分析进行置信度检测,自举数集1000次。
1.5 药敏实验采用纸片扩散法(K-B法)进行细菌药敏性试验,培养24h的细菌以无菌生理盐水洗下,制备成浓度约1×107 CFU/mL,均匀涂布于LB固体培养基上,用无菌镊子将药敏纸片均匀贴在平板上,37°C培养24h后测量抑菌圈直径。
1.6 动物实验取纯化的菌株划线接种于LB平板,30°C下培养18h。用生理盐水将菌苔洗下,稀释成四个浓度的细菌悬液: 1.0×106、1.0×107、1.0×108、1.0×109 CFU/mL,用于感染试验。
1.6.1 细菌回归实验实验用青鱼在实验开始前48h停食。将青鱼分为两组,每组10条。阳性组每条青鱼注射0.1mL菌液; 阴性组每只注射0.1mL生理盐水。控制水温为28°C,期间充氧,不换水。感染后记录发病死亡情况。死亡鱼进行解剖,随机选取两条进行病原菌分离鉴定。
1.6.2 毒力实验健康小鼠25只平均分成5个组。4个阳性组每只小鼠腹腔注射0.1mL菌液,菌液浓度分别为1.0×106、1.0×107、1.0×108、1.0×109 CFU/mL。阴性对照组小鼠每只注射0.1 mL无菌生理盐水。观察记录发病和死亡情况,并用改良寇氏法计算LD50值。
2 结果 2.1 菌株形态分离菌株培养18h后形成的菌落低凸,圆形,直径1—2mm,边缘光滑,表面湿润(图 1),有刺激性气味。光镜检测发现分离菌株革兰氏染色为阴性,短链状杆菌,呈单个或成对分布。透射电镜观察,HZ2015菌株呈末端圆形直杆状,无芽孢和荚膜,两端有丛生鞭毛,大小(短径×长径)为0.7—0.9μm×1.5μm(图 2)。
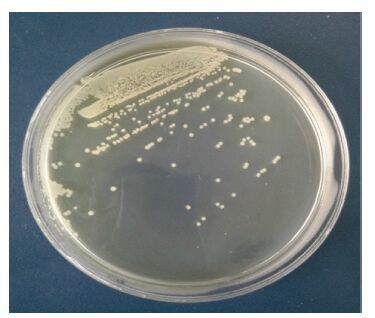 |
| 图 1 营养琼脂上菌落形态 Fig. 1 Arrangement of the colonies shown on nutrient agar |
 |
| 图 2 菌株透射电镜图像 Fig. 2 TEM image of the strain |
ATB ID 32E生化鉴定系统表明(表 1),HZ2015属于类志贺邻单胞菌属,准确率为99.9%。
| Item | HZ2015 | Item | HZ2015 |
| L-鸟氨酸 | + | L-色氨酸 | - |
| L-精氨酸 | + | 丙二酸 | + |
| L-赖氨酸 | + | D-阿拉伯醇 | - |
| 尿素 | - | D-葡萄糖 | - |
| L-阿拉伯糖醇 | - | D-蔗糖 | + |
| 半乳糖醛酸 | - | L-阿拉伯糖 | + |
| 4-硝基苯基-βD-葡萄糖甙 | - | 4-硝基苯基-βD-半乳糖甙 | |
| 5-溴-3-羟基吲哚-壬 | - | D-海藻糖 | - |
| L-天冬氨酸 4-硝基苯胺 | - | 4-硝基苯基-αD-吡喃半乳糖甙 | - |
| 5-溴-4-氯-3-吲哚-N-乙酰1-βD-葡萄糖甙 | - | 4-硝基苯基-αD-吡喃葡萄糖甙 | + |
| D-甘露醇 | - | L-鼠李糖 | - |
| D-麦芽糖 | + | 肌醇 | - |
| 侧金盏花醇 | + | D-纤维二糖 | - |
| 帕拉金糖 | - | D-山梨醇 | - |
| 4-硝基苯基-βD-葡萄糖苷酸 | + | 4-硝基苯基-αD-吡喃麦芽糖甙 | - |
| 5酮基-葡萄糖酸钾 | - | 丙酮酸钠 | - |
将测序所得序列输入到NCBI进行Blast检索,发现菌株HZ2015与类志贺邻单胞菌自然聚类,同源性百分比98.5%—99.9%。选取同源性较高的类志贺邻单胞菌的16S rRNA基因序列,并以肠杆菌科的沙门氏菌属(Salmonella)、爱德华氏菌属(Edwardsiella)和肠杆菌属(Enterobacter)等菌株为外群,进行分子系统发育分析,结果如图 3所示。
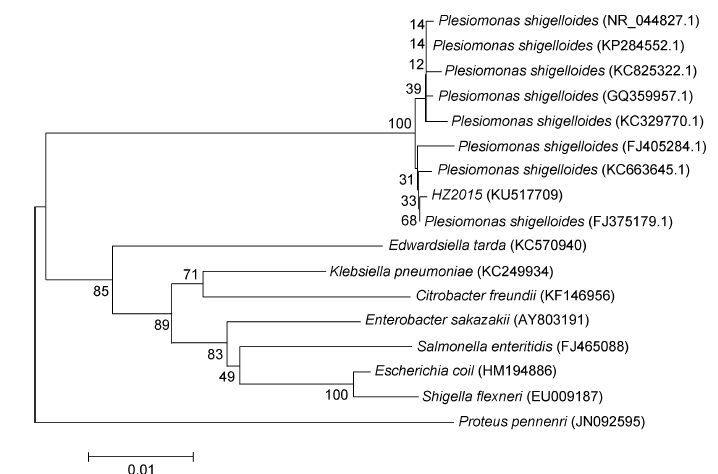 |
| 图 3 菌株HZ2015 16S rDNA基因序列系统发育树 Fig. 3 Phylogenetic tree of strain HZ2015 based on 16S rRNA gene sequence |
对29种药物的敏感性试验结果显示(表 2),菌株HZ2015对头孢哌酮、头孢呋辛、庆大霉素、卡那霉素、先锋霉素5、先锋霉素6、复达欣、新霉素、强力霉素、美满霉素、多粘霉素B和呋喃唑酮高度敏感; 对青霉素、苯唑西林、氨苄西林、头孢曲松、万古霉素、羧苄西林、和头孢氨苄耐药。
| 抗生素 | 抑菌圈直径判定标准(mm) | 抑菌圈直径(mm) | ||
| 耐药 | 中度敏感 | 敏感 | ||
| 青霉素(P) | ≤10 | 11—15 | ≥16 | R(10) |
| 苯唑西林(OX) | ≤10 | 11—12 | ≥13 | R(7) |
| 氨苄西林(AMP) | ≤13 | 14—16 | ≥17 | R(6) |
| 哌拉西林(PRL) | ≤17 | 18—20 | ≥21 | I(20) |
| 头孢曲松(CTRX) | ≤13 | 14—20 | ≥21 | R(0) |
| 头孢呋辛(CXM) | ≤14 | 15—17 | ≥18 | S(27) |
| 头孢哌酮(CFP) | ≤15 | 16—20 | ≥21 | S(24) |
| 麦迪霉素(MID) | ≤13 | 11—15 | ≥17 | I(13) |
| 红霉素(EM) | ≤13 | 14—22 | ≥23 | I(14) |
| 庆大霉素(GM) | ≤12 | 13—14 | ≥15 | S(25) |
| 氧氟沙星(OFLX) | ≤12 | 13—15 | ≥16 | I(13) |
| 诺氟沙星(NOR) | ≤10 | 11—15 | ≥16 | I(12) |
| 克林霉素(DA) | ≤14 | 15—20 | ≥21 | I(16) |
| 万古霉素(VA) | ≤14 | 15—16 | ≥17 | R(10) |
| 四环素(TE) | ≤14 | 15—18 | ≥19 | I(16) |
| 氯霉素(CL) | ≤12 | 13—17 | ≥18 | I(17) |
| 复方新诺明(SXT) | ≤10 | 11—15 | ≥16 | S(22) |
| 羧苄西林(CB) | ≤19 | 20—22 | ≥23 | R(9) |
| 头孢氨苄(CN) | ≤14 | 15—17 | ≥18 | R(10) |
| 先锋霉素VI(PVI) | ≤14 | 15—17 | ≥18 | S(22) |
| 先锋霉素V(PV) | ≤14 | 15—17 | ≥18 | S(21) |
| 复达欣(ZOX) | ≤14 | 15—17 | ≥18 | S(30) |
| 卡那霉素(KA) | ≤14 | 15—16 | ≥17 | S(26) |
| 新霉素(N) | ≤12 | 13—16 | ≥17 | S(22) |
| 强力霉素(DO) | ≤12 | 13—15 | ≥16 | S(21) |
| 美满霉素(LR) | ≤14 | 15—18 | ≥19 | S(24) |
| 环丙氟哌酸(GR) | ≤12 | 13—16 | ≥17 | I(14) |
| 多粘霉素B(PB) | ≤8 | 8—11 | ≥12 | S(15) |
| 呋喃唑酮(AOZ) | ≤14 | 15—16 | ≥17 | S(18) |
结果显示,水温升高至28°C,感染后36h,开始出现死亡,到第48小时,死亡率最高达100%,而对照组死亡率均为0(表 3),病死鱼呈现出与自然发病类似的症状(图 4),表现为体表溃烂,肠道充血肿胀,肾脏肿大。从死亡青鱼的肝脏、肌肉等组织均能分离到形态一致的菌落,对其进行生化鉴定和16S rDNA同源性比对,结果显示为同一菌株。
| 菌株 | 致死率 | |||
| 12h | 24h | 36h | 48h | |
| HZ2015 | 0/10 | 0/10 | 7/10 | 10/10 |
| Control | 0/10 | 0/10 | 0/10 | 0/10 |
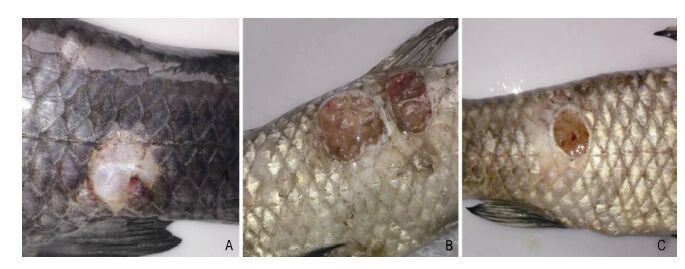 |
| 图 4 病鱼体表溃烂 Fig. 4 Ulcerated body surface of diseased fish |
小鼠于接种菌液后12h开始出现临床症状,高剂量组小鼠在接种后24h大量死亡,其它组死亡高峰出现在接种后48h(表 4)。根据改良寇氏法计算,菌株HZ2015 LD50值为106.6 CFU/mL。
| 组别 | 浓度(CFU/mL) | 数目 | 剂量(mL) | 死亡时间 | 致死率(%) | |||
| 1d | 2d | 3d | 4d | |||||
| 1 | 1×109 | 5 | 0.1 | 4 | 1 | 0 | 0 | 100 |
| 2 | 1×108 | 5 | 0.1 | 1 | 4 | 0 | 0 | 100 |
| 3 | 1×107 | 5 | 0.1 | 0 | 5 | 0 | 0 | 100 |
| 4 | 1×106 | 5 | 0.1 | 0 | 0 | 1 | 0 | 20 |
| 对照组 | PBS | 5 | 0.1 | 0 | 0 | 0 | 0 | 0 |
青鱼属大宗淡水性鱼类,肉厚且嫩,味鲜美,富含脂肪,刺大而少,是淡水鱼中的上品。目前青鱼的研究结果主要集中于养殖及繁育技术、营养需求等,而疾病学研究方面涉及较少,已经明确的病害,很多也是作为与其它大宗淡水鱼类共有的疾病来研究,此次青鱼的病害事件表明,类志贺邻单胞菌对青鱼的危害极大,无论幼鱼、成鱼都无法幸免,一定程度上威胁着青鱼养殖业的发展。本研究从具有典型临床症状的发病青鱼肾脏分离到菌株HZ2015,经过形态学和生理生化鉴定显示该菌株为类志贺邻单胞菌,同时通过16S rDNA序列同源性分析,构建了系统发育树,发现与类志贺邻单胞菌的同源性为98.5%— 99.9%。人工感染实验表明其对青鱼具有较强的致病性,感染鱼体表溃烂,体内各器官不同程度损伤,症状与自然发病鱼类似,并能从肌肉和肾脏中分离到与注射菌形态及生化特性完全相同的细菌,生化鉴定及16S rDNA同源性匹配表明为同一菌株,从而确定该菌株HZ2015为青鱼体表溃烂的致病菌。本文系类志贺邻单胞菌致青鱼发病的首次报道。
类志贺邻单胞菌是一种广泛分布在淡水环境中的细菌,隶属肠杆菌科,邻单胞菌属,能引起人的腹泻,是一种重要的肠道致病菌(Brenner et al,2005),对3536例急性腹泻患者的研究表明(Chen et al,2013),7.3%的细菌性病例与类志贺邻单胞菌有关。类志贺邻单胞菌对鸬鹚的感染率较高(Matsuyama et al,2015),对水生动物亦具有一定的致病力,能引发暗纹东方鲀(Takifagu obscurus)、草鱼(Ctenopharygodon idellus)、中华鳖(Trionyx sinensis)、黄颡鱼(Pelteobagrus fulvidraco)、杂交鲟(Huso huso♀ × Acipenser baeri♂)、尼罗罗非鱼(Tilapia nilotica)、异育银鲫(Carassius auratus gibelio♀ × Cyprinus carpio♂)、罗氏沼虾(Macrobrachium rosenbergiideman)、斑点叉尾鮰(Ietalurus punetaus)、亚洲龙鱼(Scleropages macrocephalus)、革胡子鲇(Clarias leather)、鳗鲡(Anguilla japonica)及虹鳟(Oncorhynchus mykiss)的发病及死亡(Miller et al,1986; 吴惠仙等,2004; 杨鸢劼等,2005; 潘璠等,2007; 陆文浩等,2009; 陈林等,2009; Salgado-Miranda et al,2010; Jun et al,2011; Parvez et al,2011; Joh et al,2012; Lingham et al,2012; 王小亮等,2013; 左跃等,2013; 胡钱东等,2014; 刘志刚等,2015)。尤其是对草鱼,在夏秋季能引发类似症状即体表溃烂(胡钱东等,2014),由于两者同属鲤形目鲤科雅罗鱼亚科,分布与赤眼鳟一起同属东亚的单元群,亲缘关系较近,具有较强的借鉴意义。该菌是否容易引发雅罗鱼亚科鱼类的体表溃烂,还需进一步研究。
类志贺邻单胞菌在35—38°C温度范围内生长最佳(Lingham et al,2012)。该菌对盐度和酸碱度的适应范围较广,能在多种水体中存活,往往在水温较高时流行。回归实验表明,水温在25°C时,该菌不具备对青鱼的致病性,但水温升高到28°C时,对青鱼具有极强的毒力。我们在调查中发现,该菌引起的疾病主要 发生在夏季高温季节,这一点与回归实验的结论相一致。因此,应该尤其注重在高温季节加强预防和控制,合理控制饲料投喂,改良底质和水质,做好水体的消毒工作。
本研究分离得到的类志贺邻单胞菌对头孢哌酮、头孢呋辛、庆大霉素、先锋霉素、强力霉素等高度敏感; 对青霉素、氨苄西林、万古霉素、羧苄西林和头孢氨苄等耐药。这与以往从不同物种中得到的分离株不一致(吴惠仙等,2004; 陆文浩等,2009; Matsuyama et al,2015)。尤其是从人身上分离的菌株对除氨苄青霉素外的大多数抗菌药物敏感(Chen et al,2013)。这可能由于地区、环境不同及接触的药物不同,导致菌株的耐药谱存在差异。因此,正确治疗因该菌引发的青鱼疾病,还应在遵守《渔用药物使用准则》的同时根据药敏试验得出的结果进行施药,避免根据经验盲目用药。
 2016, Vol. 47
2016, Vol. 47


