
中国海洋湖沼学会主办。
文章信息
- 徐苗苗, 李健, 李桂玲, 苏国成, 陈吉刚, 刘静雯. 2016.
- XU Miao-Miao, LI Jian, LI Gui-Ling, SU Guo-Cheng, CHEN Ji-Gang, LIU Jing-Wen. 2016.
- CPA-核酸试纸条快速检测副溶血性弧菌(Vibrio parahaemolyticus)方法的建立及其在海产品检测中的应用
- DEVELOPMENT OF CROSS PRIMING AMPLIFICATION COMBINED WITH NUCLEIC ACID STRIP FOR DETECTION OF VIBRIO PARAHAEMOLYTICUS
- 海洋与湖沼, 47(3): 681-688
- Oceanologia et Limnologia Sinica, 47(3): 681-688.
- http://dx.doi.org/10.11693/hyhz20160200036
-
文章历史
- 收稿日期:2016-02-17
- 改回日期:2016-03-13
2. 福建省高校食品微生物与酶工程重点实验室 厦门 361021;
3. 浙江万里学院生物与环境学院 宁波 315100
2. Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering, Xiamen 361021, China;
3. College of Biological and Environmental Science, Zhenjiang Wanli University, Ningbo 315100, China
副溶血性弧菌(Vibrio parahaemolyticus)隶属弧菌科的弧菌属。是一种嗜盐性海洋人鱼共患致病菌,于1950年由日本的藤原恒三郎教授从引起食物中毒的小沙丁鱼中初次分离得到(藤野恒三郎,1951)。该菌广泛分布于世界各地的近岸海水、海底沉积物、海产品及腌制食品中(Su et al,2007)。副溶血性弧菌食物中毒与进食含有该菌的食物有关,生食或食入未煮熟的受到污染的海产品或腌制食品是其主要传播途径(Chiou et al,2000; McLaughlin et al,2005; Hara-Kudo et al,2012; Nelapati et al,2012; Newton et al,2012)。近年来由副溶血性弧菌引起的食源性食物中毒的比例高达68.0%,居我国沿海地区细菌性食物中毒之首(毛雪丹等,2013)。全球食源性腹泻疾病中有50%—70%是由副溶血性弧菌引起(Wang et al,2013; Xu et al,2014)。因此,选择合适的检测靶点,建立快速简便的检测方法是预防副溶血性弧菌食物中毒最有效的途径之一。
目前用于检测副溶血性弧菌的技术包括传统PCR法、荧光定量PCR法、多重PCR法、酶联免疫吸附法、免疫胶体金、核酸探针技术、基因芯片技术、变性高效液相色谱技术及DNA指纹图谱等(Parida et al,2005; Ward et al,2006; Bisha et al,2012; Ceccarelli et al,2013)。这些方法因所需设备昂贵、耗时,技术水平要求较高等弊端,实用性受到限制(徐苗苗等,2014)。近年发展起来的环介导恒温扩增技术已被广泛应用于病原微生物的快速检测(Prompamorn et al,2011; Xu et al,2012),该方法在恒温条件下就能发生反应,对设备的要求比较低,操作简单,反应只需60min,较传统的PCR技术具有高效、快速等优点,因此在某种程度上很好地解决了目前基因检测的弊端。交叉引物恒温扩增技术(Cross priming amplification,CPA)是基于环介导等温技术基础上的一种新型的恒温扩增技术,其原理与环介导等温技术不尽相同,该方法具有较高的特异性和灵敏度(Fang et al,2009; Xu et al,2012; Yang et al,2014)。将CPA技术与核酸试纸条相结合,通过免疫杂交反应使对扩增产物的检测更为快速、便捷,尤其适用在现场和基层检测使用(Zhao et al,2010)。目前针对副溶血性弧菌的CPA核酸试纸条快速检测方法尚未见报道。tlh基因是副溶血性弧菌三大毒力基因之一,同时也是种特异性基因,无论是环境分离株还是临床致病株均含有该基因(Yamazaki et al,2008; Gutierrez West et al,2013; He et al,2014)。本研究以副溶血性弧菌tlh为靶标基因,建立副溶血性弧菌CPA-核酸试纸条快速检测技术,以用于现场和基层该病原微生物的快速检测。
1 材料与方法 1.1 实验材料 1.1.1 菌种与试剂Bst DNA聚合酶、10×Thermopol购自New England Bio Labs公司; MgSO4、dNTPs、10×PCR Buffer、10×loading Buffer、rTaq DNA、100bp DNA Ladder Marker均购自TaKaRa公司; 甜菜碱购自Sigma公司; 核酸检测试纸条购自杭州优思达生物技术有限公司。FTA Filter及FTA专用缓冲液均购自Whatman公司。副溶血性弧菌、霍乱弧菌、创伤弧菌、溶藻弧菌、沙门氏菌,大肠杆菌、金黄色葡萄球菌均由本实验室保存。
1.1.2 引物与探针的设计通过序列比对确定副溶血性弧菌tlh基因(GenBank: JX262976.1)的保守区域,选取该区域的六个不同位置利用Primer 5.0分别设计外围引物、交叉引物和检测探针(两条探针分别用Fitc和Biotin进行标记)用于CPA扩增反应。引物及探针序列如表 1。
| 引物名称 | 引物及探针序列(5′—3′) |
| VPOF | CAGAAGCACTGATTCGTTTG |
| VPOR | CGGTGAGTTGCTGTTGTTGG |
| VPIF | TGAGCGGTTGATGTCCAAACAATCGTGCGAAAGTGCTTGAGATG |
| VPIR | TCGTGCGAAAGTGCTTGAGATGTGAGCGGTTGATGTCCAAACAA |
| VPDF | Fitc-CAAAGCGCAAGGTTACAACATCA |
| VPDR | Biotin-GAACAAGGCGTGAGTATCAAACAAC |
采用CTAB/NaCl法和热裂解法提取基因组。CTAB/NaCl: 取过夜培养的副溶血性弧菌菌液1 mL,采用CTAB/NaCl法进行基因组的提取(Sambrook et al,2001)。热裂解法: 取过夜培养的菌悬液1 mL于1.5 mL离心管中,12000g离心3 min,尽量吸去上清液,向离心管中加入无菌水洗涤沉淀两次之后加入100 μL无菌水重悬菌体沉淀。将菌悬液置于水浴锅中100°C煮沸10 min,13000g离心2.5 min,取上清于一新的离心管中,-20°C保存待用。
1.2.2 副溶血性弧菌重组克隆质粒的构建以副溶血性弧菌基因组为模板,用外围引物VPOF/VPOR进行PCR扩增,电泳检测扩增产物。PCR反应体系为VPOF 0.8μmol/L、VPOR 0.8μmol/L、10×PCR Buffer 2.5μL、dNTPs 2.0μL、rTaq 0.3μL,加水补足至25μL。反应程序: 94°C 5min; 94°C 30s、59°C 30s、72°C 30s; 72°C 5min。PCR产物经1%琼脂糖凝胶电泳验证,电泳结果显示,PCR产物条带与目的片段大小一致。对目的条带进行切胶回收。纯化后的扩增产物与pMD19-T载体在连接酶的作用下进行连接反应,转化感受态细胞TOP10,挑取阳性菌落进行增菌培养后提取质粒。将重组克隆质粒送上海生工生物技术有限公司进行测序分析。测序结果表明该PCR扩增所得的片段即为特异性副溶血性弧菌核酸片段,是反应的特异性目标序列。
1.2.3 CPA反应体系的建立与优化将两对扩增引物及探针按照通用的CPA扩增条件组成20μL的反应体系(表 2)。置于63°C恒温金属浴中反应60min,对扩增产物进行检测。验证用于CPA扩增的引物及探针的可行性。结果显示扩增反应正常发生,扩增效果理想。证明该引物及探针可以使用,在此基础上对反应体系进一步优化。
| 组分 | 浓度 | 体积(μL) |
| VPOF | 20 μmol/L | 0.1 |
| VPOR | 20 μmol/L | 0.1 |
| VPIF | 20 μmol/L | 0.6 |
| VPIR | 20 μmol/L | 0.6 |
| VPDF | 20 μmol/L | 0.3 |
| VPDR | 20 μmol/L | 0.3 |
| 甜菜碱 | 5 mol/L | 2 |
| MgSO4 | 25 mmol/L | 0.8 |
| dNTPs | 2.5mmol/L | 3.2 |
| Bst DNA Polymerase | 8 U/μL | 1 |
| ThermoPol buffer | 10× | 2 |
| Template | — | 1 |
| ddH2O | — | 8 |
| 合计 | — | 20 |
首先对引物浓度进行优化,通过比较不同浓度引物的扩增效果,选出最佳引物浓度。在确定引物浓度后,依次对扩增体系中的MgSO4、dNTPs、甜菜碱、bst DNA聚合酶、反应温度及反应时间进行优化。首先固定其它因素条件不变,对要优化的因素进行浓度梯度的设置。Mg2+的浓度设置为1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0mmol/L 9个浓度梯度; dNTPs的浓度设置为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8mmol/L 8个浓度梯度; 甜菜碱浓度设置为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mol/L 8个浓度梯度; BstDNA polymerase设置为0、1.6、3.2、4.8、6.4、8.0、9.6 U 7个浓度梯度。反应温度设置为57、59、61、63、65、67°C 6个温度梯度。在确定了以上5个因素后,最后对反应时间进行优化,反应时间分别为0、15、30、45、60、75、90 min,扩增结束后,将扩增产物冰浴并离心。用2%琼脂糖电泳检测扩增产物,通过比较扩增效果从而确定最佳的反应条件。
1.2.4 CPA-核酸试纸条法结果判定CPA扩增结束后,取8—10μL扩增产物,滴加到样品垫上。将试纸条放入含有100μL缓冲液的微孔板中,15—30 min后判读结果。当试纸条上质控线和检测线均出现红色条带,表明样本中含有被检测的目标核酸产物,结果判为阳性。如果试纸条上只有质控线出现红色条带而检测线没有条带出现表明样本中未检测出目的核酸,结果呈阴性。若试纸条质控线和检测线均未有条带出现,说明试纸条可能已损坏、失效或使用操作不当。
1.2.5 CPA法检测副溶血性弧菌特异性验证用CTAB/NaCl法分别提取副溶血性弧菌、创伤弧菌、溶藻弧菌、霍乱弧菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌的基因组。在相同条件下采用CPA法对不同的基因组模板进行扩增,2%琼脂糖电泳法和核酸试纸条法检测扩增产物。
1.2.6 CPA法与普通PCR法检测副溶血性弧菌灵敏度的比较取过夜培养的副溶血性弧菌菌液1 mL经梯度稀释后涂布于LB固体培养平板上进行菌落计数,每个梯度作三个平行。次日观察平板上菌落的生长情况并计数,根据统计的菌落数,计算出同一个稀释度3个平板上的平均菌落数,通过稀释的倍数计算出每毫升样品中菌落形成单位数。将已知浓度的原菌液进行10n倍梯度稀释,进而采用普通热裂解法制备基因组模板,同时进行普通PCR和CPA扩增,电泳和试纸条检测扩增产物,比较两种方法检测纯培养物的灵敏度。CPA扩增在最佳反应体系下进行,扩增引物采用外围扩增引物上游引物VPOF : TGCGAA AGTGCTTGAGAT,下游引物VPOR: GATGAGCGG TTGATGTCC。PCR扩增采用引物为上游引物VPOF: TGCGAAAGTGCTTGAGAT,下游引物VPOR: GATGAGCGGTTGATGTCC。反应条件: 94°C 5min; 94°C 1min,49°C 30 s,72°C 45 s,30个循环; 72°C 5min。
1.2.7 CPA法检测人工污染牡蛎样品中副溶血性弧菌灵敏度的确定实验用新鲜牡蛎样品购自厦门集美菜市场,在人工污染副溶血性弧菌前,该牡蛎样品经国标法检测证实不含有副溶血性弧菌。然后将增菌培养后的副溶血性弧菌菌液人工污染到牡蛎样品中: 取25g样品加入225mL APW中,匀浆机搅拌90s。然后添加不同浓度梯度的副溶血性弧菌菌液到匀浆液中,采用FTA基因组采集卡直接提取牡蛎样品中的副溶血性弧菌基因组进行CPA扩增。
DNA提取: 取10mL匀浆液以500×g离心10min,转移上清液于另一灭菌后的离心管中14000×g离心10min,沉淀用500μL生理盐水悬浮,加入0.25倍体积的乙酸乙酯,振荡器混匀2min,然后17000×g离心10min。弃去上清液,沉淀用20μL生理盐水悬浮,加入直径为2.00mm FTA滤膜片,然后56°C干燥,干燥后的FTA滤膜片,加入10% SDS 200μL煮沸10min,用FTA专用缓冲液洗涤2次,然后再用TE缓冲液洗涤2次,56°C干燥后可直接作为CPA扩增模板(Lampel et al,2004)。
2 结果与分析 2.1 副溶血性弧菌tlh基因片段阳性克隆质粒的构建及验证用引物VPOF/VPOR对副溶血性弧菌基因组DNA进行扩增,对扩增片段进行回收纯化,通过构建重组克隆质粒进行测序分析。结果表明,该扩增片段的大小约为407 bp,与目的序列一致(图 1),是副溶血性弧菌tlh的特异性序列,可以用于后续实验。
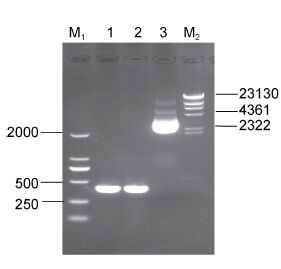 |
| 图 1 重组质粒PMD19-T-tlh琼脂糖凝胶电泳图 Fig. 1 Agarose gel electrophoresis of pMD19-T-tlh recombinant plasmid |
CPA扩增受诸多因素的影响,如Mg2+、dNTPs、甜菜碱、Bst DNA polymerase、反应温度及反应时间等。为了实现该方法对副溶血性弧菌的高效检出,本研究通过各个因素的优化,得到最佳反应体系。
Mg2+是Bst DNA polymerase重要的活性因子,其浓度对扩增产物的产量和扩增特异性有很大的影响。若Mg2+浓度过低会直接影响Bst DNA polymerase的活性,从而使CPA扩增产物的产量减少,以致于出现假阴性。本实验通过比较不同Mg2+添加浓度对扩增效果的影响,确定最佳Mg2+使用浓度,结果如图 2所示。当Mg2+浓度为1.0mmol/L时,未出现梯形电泳条带; 当Mg2+浓度为1.5mmol/L时,开始出现梯形电泳条带; 当Mg2+浓度为4.0mmol/L时,条带最亮; 当Mg2+浓度为4.5mmol/L时,条带开始变暗。所以得出最佳Mg2+使用浓度为4.0mmol/L。
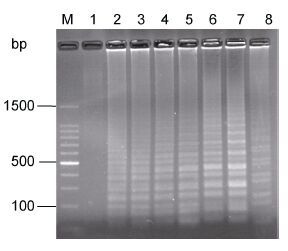 |
| 图 2 Mg2+浓度的优化结果 Fig. 2 Results of the optimal concentration of Mg2+ |
在确定最佳Mg2+的反应体系中添加不同浓度的dNTPs,比较不同dNTPs浓度下产物的扩增效果。结果如图 3所示,dNTPs的使用浓度在0.1—0.8mmol/L范围内均能发生有效扩增,当dNTPs的添加量为0.4mmol/L时,梯形电泳条带最亮,扩增产物最多,为最佳使用浓度。
 |
| 图 3 dNTPs浓度的优化结果图 Fig. 3 Results of the optimal concentration of dNTPs |
甜菜碱能使双链DNA处于不稳定状态,从而有利于维持反应体系的平衡,提高CPA反应的扩增效率。比较不同甜菜碱使用浓度对扩增效果的影响,结果如图 4所示,在甜菜碱的使用浓度为0.2—1.6mol/L时均出现较为清晰的梯形电泳条带,且随着甜菜碱浓度的增大,条带亮度增大。当甜菜碱的使用浓度为0.8mol/L时条带最亮,当超过这个使用浓度时条带逐渐变暗。即甜菜碱的最佳使用浓度为0.8mol/L。
 |
| 图 4 甜菜碱浓度的优化结果图 Fig. 4 Results of the optimal concentration of betaine |
有较显著的影响。比较不同Bst DNA polymerase使用浓度对扩增效果的影响。结果如图 5所示,在Bst DNA polymerase的使用浓度为3.2 U时开始出现梯形电泳条带,且随着Bst DNA polymerase浓度的增大,条带亮度增大。当Bst DNA polymerase的使用浓度为8.0 U和9.6 U时最亮,且两者亮度相当,但是鉴于成本的考虑,选取Bst DNA polymerase的最佳使用浓度为8.0 U。
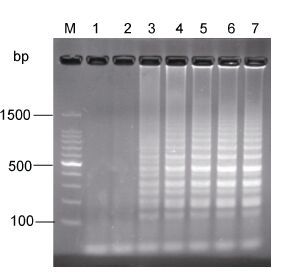 |
| 图 5 Bst DNA polymerase浓度的优化结果图 Fig. 5 Results of the optimal concentration of Bst DNA polymerase |
反应温度也是影响CPA扩增反应能否成功的关键因素,分别在57、59、61、63、65、67°C温度下进行CPA扩增,扩增结果如图 6所示: 当温度为57°C时,CPA反应不能发生,当温度为59°C时,出现扩增条带但扩增条带不明显。当温度为61°C扩增反应出现较为明显的梯形电泳条带,当温度达到63°C条带最亮,而当温度高于63°C时,扩增条带变暗,说明适合CPA扩增的最佳反应温度为63°C。
 |
| 图 6 反应温度的优化结果图 Fig. 6 Results of the optimal reaction temperature |
分别在15、30、45、60、75、90 min不同时间段下进行CPA扩增,扩增结果如图 7所示: 当反应时间为15 min、30 min时CPA反应均不能发生。当反应时间为45 min,出现扩增条带但扩增条带比较暗。当扩增时间为60 min时梯形电泳条带最亮,当反应时间超过60 min后条带逐渐变暗,说明CPA扩增的最佳反应时间为60 min。
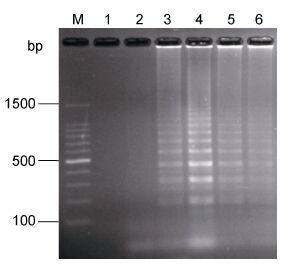 |
| 图 7 反应时间的优化结果图 Fig. 7 Results of the optimal reaction time |
以霍乱弧菌、溶藻弧菌、创伤弧菌、河流弧菌、大肠杆菌、金黄色葡萄球菌等作为参照菌株,分别提取参照菌和目标菌基因组。以无菌水代替基因组模板作为阴性对照,用相同的反应体系(除模板不同)进行CPA扩增,扩增结果用琼脂糖电泳法和试纸条法同时进行检测。结果如图 8所示,在上述条件下只有以副溶血性弧菌基因组DNA为模板的CPA反应发生了有效的扩增,其它对照组和阴性组均未出现有效扩增。说明CPA扩增体系对于副溶血性弧菌进行扩增的特异性较强。
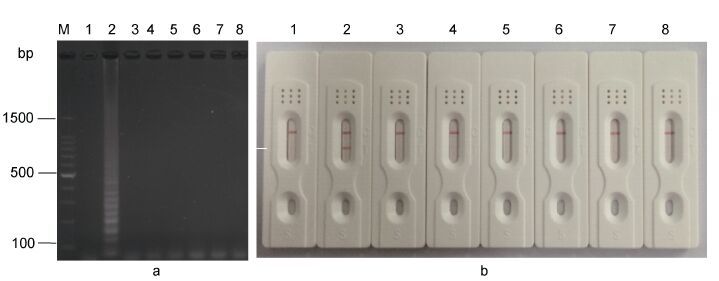 |
| 图 8 CPA扩增反应特异性实验结果 Fig. 8 The results of CPA specificity tests |
为了比较CPA法和PCR法检测副溶血性弧菌纯培养物的灵敏度,将浓缩(经平板菌落计数)的副溶血性弧菌菌悬液稀释至不同浓度,最终加入每反应管的浓度分为5.8×106、5.8×105、5.8×104、5.8×103、5.8×102、5.8×101和5.8 cfu/mL,平行做CPA与PCR检测灵敏度实验。CPA扩增产物同时采用电泳检测法和核酸试纸条检测法两种方法同时进行检测。实验结果如图 9所示,凝胶电泳法检测结果显示,当反应管中模板浓度大于等于5.8 cfu/mL时均出现梯形电泳条带(图 9a)。CPA产物核酸试纸条法检测结果显示,当反应体系中模板浓度大于等于5.8×101 cfu/mL时,试纸条质控线和检测线均呈红色,说明在此浓度范围内CPA-核酸试纸条法能有效的将待检物进行有效的检出,当模板浓度低于5.8×101 cfu/mL时,试纸条只有质控线出现红色条带,即检测结果呈阴性(图 9b)。常规PCR琼脂糖凝胶电泳检测结果显示,当反应体系中模板浓度大于等于5.8×102 cfu/mL时,均可见特异性目的电泳条带,而当检测浓度小于5.8× 102cfu/mL时,未能出现特异性电泳条带(图 9c)。说明PCR法检测副溶血性弧菌最低检测限为5.8× 102cfu/mL,与CPA法相比,CPA法的检测灵敏度为普通PCR法的10倍。
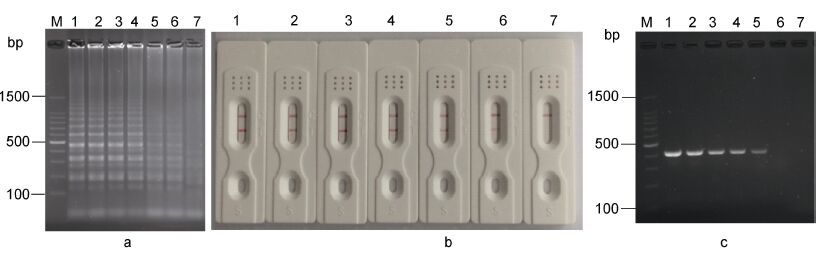 |
| 图 9 CPA和PCR方法测副溶血性弧菌纯培养物的灵敏度结果 Fig. 9 Detection limit of CPA and PCR for V. parahaemolyticus in pure cultures |
如1.2.7所述方法直接利用FTA滤膜提取牡蛎样品中副溶血性弧菌的基因组,采用CPA法对模板进行扩增,最后结合核酸试纸条检测人工污染牡蛎样品中的副溶血性弧菌,该方法的检测限达到1.3×102cfu/ 25g(5.2 cfu/g)(图 10)。
 |
| 图 10 CPA-核酸试纸条法检测污染牡蛎样品中副溶血性弧菌灵敏度 Fig. 10 Detection limit of CPA-nucleic acid strip for V. parahaemolyticus in contaminated oysters samples |
本研究针对副溶血性弧菌种特异性基因tlh保守区域设计一系列引物进行扩增,副溶血性弧菌分为致病菌株和非致病菌株,致病株除了有tlh基因外一般还携带有tdh和/或trh基因,而非致病株一般不携带tdh和trh基因但拥有tlh基因,除此之外,其它菌包括其它弧菌均不拥有此基因,因此选取tlh基因作为副溶血性弧菌检测的靶基因特异性更强(Horisaka et al,2004; Yang et al,2014)。
在反应体系的建立过程中,通过对反应体系中多个因素和反应条件进行优化并对优化结果进行分析发现,较高检测灵敏度的实现不单单受一方面因素的影响,是多个因素共同作用的结果,只有在最佳反应体系下进行CPA扩增才能实现较高的检出率,即较高的灵敏度(Huang et al,2014; Ou et al,2014)。影响CPA扩增效果的因子有Mg2+、dNTPs、甜菜碱、Bst DNA polymerase浓度、反应温度及反应时间。其中Mg2+是Bst DNA polymerase的重要活性因子,其浓度对CPA扩增结果影响较大,因此,首先对Mg2+进行优化。与普通PCR相比,CPA扩增需要更高浓度的dNTPs,dNTPs的浓度与CPA扩增产物的产量呈正相关。选择合适浓度的dNTPs浓度能实现最大量的产物扩增效果,间接提高检测灵敏度。Bst DNA polymerase作为催化CPA扩增最重要的因素,其使用浓度的高低对CPA反应有较显著的影响。Bst DNA polymerase直接影响CPA产物的产量,当反应体系中Bst DNA polymerase浓度过低时,反应无法进行。增加Bst DNA polymerase的浓度,反应产物量也随之增加。本研究从提高实验效率并节约实验成本的角度出发,选择该酶的使用量即在保证高效扩增的前提下最小添加量。基于最佳反应体系,并结合一对特异性探针,本研究成功建立了副溶血性弧菌的CPA-核酸试纸条法。该方法灵敏度高,对于细菌纯培养物和检测限为58 cfu/mL,对污染牡蛎中副溶血性弧菌的检测灵敏度为5.2 cfu/g,在检测灵敏度上是普通PCR的10倍。特异性实验证实,该方法仅对副溶血性弧菌实现特异性检测。此外,该方法操作简便,无需特殊仪器设备,实现了结果的可视化且存储方便,整个检测过程只需75 min。实验过程中对操作人员的技术要求不高,稍加培训即可进行实验操作,且人为因素造成的误差和污染较小,因此易于普及,是一种特异、灵敏、简便、快速的副溶血性弧菌的检测方法。
 2016, Vol. 47
2016, Vol. 47


