
中国海洋湖沼学会主办。
文章信息
- 刘淑雅, 俞志明, 宋秀贤, 曹西华. 2016.
- LIU Shu-Ya, YU Zhi-Ming, SONG Xiu-Xian, CAO Xi-Hua. 2016.
- 改性粘土絮凝法对小球藻(Chlorella vulgaris)生理生化性质的影响
- EFFECT OF MODIFIED CLAY FLOCCULATION ON PHYSIOLOGICAL ACTIVITY OF CHLORELLA VULGARIS
- 海洋与湖沼, 47(4): 748-754
- Oceanologia et Limnologia Sinica, 47(4): 748-754.
- http://dx.doi.org/10.11693/hyhz20160100023
-
文章历史
- 收稿日期:2016-01-29
- 改回日期:2016-03-17
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049
2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
有害藻华在全球范围内频繁爆发,破坏生态平衡,造成鱼类、贝类或鸟类大量死亡,甚至危害人类健康(Sellner et al,2003),已经成为严重的海洋灾害,其预防及治理受到广泛关注。粘土矿物絮凝法因来源丰富、成本较低和没有二次污染,被认为是最具有发展前景的藻华治理方法之一(Anderson,1997)。但由于粘土矿物溶胶性差,自身絮凝速度太快导致去除有害微藻效率较低,在实际应用中需要大量喷洒,存在淤渣大量沉积的问题(俞志明等,1993)。为了提高絮凝效率,俞志明等(1994,1995a,b)提出了粘土改性方法,通过增加粘土颗粒与微藻细胞间的静电吸引作用及在粘土颗粒与生物之间形成“桥联作用”,显著增强了粘土的除藻能力,得到了广泛地推广与应用。在现场应用中发现,改性粘土不仅能够絮凝沉降大量的藻华生物,而且残余部分微藻也未能在短时间内增殖、再次形成藻华,说明改性粘土对未被絮凝的微藻也有抑制作用,但其作用机制尚不清楚。
微藻生理生化性质的变化可以表征不同环境变化对细胞的影响。例如,活性氧(reactive oxygen species,ROS)是藻细胞生长过程中的正常产物,通常情况下它的产生与消除在细胞复杂的调控下处于动态平衡中。但逆境胁迫将导致细胞积累过多的ROS,可使膜脂过氧化、蛋白质损伤、DNA链断裂(蔡以滢等,1999)。ROS也可作为信号传递分子(Dat et al,2000),激发细胞的防御系统,其中抗氧化酶是细胞抵御过氧化伤害的重要防御体系。抗氧化酶系统是微藻在环境胁迫下一个重要的生理生化指标,对细胞消除ROS具有重要作用。有研究表明,紫外辐射(Lee et al, 2009)、强光(卿人韦等,2003)、病原体(蔡以滢等,1999)、化学物质(Mei et al,2014; Martins et al,2015)及重金属(Pinto et al,2003)等逆境胁迫因子能够激发海洋微藻的抗氧化酶防御系统,甚至损害该系统。抗氧化酶活性的提高有助于清除细胞内积累的自由基,从而使细胞在一定程度上忍耐逆境胁迫,因此可以用来指示微藻细胞损伤的程度。本文以小球藻(Chlorella vulgaris)为模式藻(Huang et al,2009; Wang et al,2010),研究改性粘土絮凝法对其超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)等抗氧化酶活性及丙二醛(malondialdehyde,MDA)含量的影响,从生理生化角度探讨改性粘土方法对残留微藻的影响机制。
1 材料与方法 1.1 实验材料本研究所用藻种为小球藻(Chlorella vulgaris),由中国科学院海洋研究所海洋生态与环境科学重点实验室提供(藻种编号: HN-CX),分离自海南海域。实验培养海水取自青岛胶州湾海域,经0.45μm混合纤维膜过滤后121°C高温灭菌30min。采用血球计数板法测定微藻细胞生长情况,选取指数生长期的藻液用于实验。
实验所使用的粘土为江苏吴县高岭土,其理化参数见Liu等人(2016)的报道,所使用的改性剂为无机改性剂聚合氯化铝(poly aluminum chloride,PAC),改性粘土的制备方法参照相关文献(俞志明等,1994)。
1.2 实验方法将小球藻于(20±1)°C,L1培养液(每1L过滤灭菌海水中加入1mL 75g/L NaNO3; 1mL 5g/L NaH2PO4·H2O; 1mL的L1微量金属元素和0.5mL的维他命)中培养,光照强度为72μmol photons/(m2·s),光暗比12h︰12h。小球藻呈现自然指数增长状态,在第10天达到(10.00±0.07)×106cell/mL,将藻液转移至6个5L三角瓶中培养,分为三组: 改性粘土组、原土组(未改性粘土)和对照组,每组2个平行样。为了研究改性粘土絮凝法对未被去除部分微藻细胞的生长影响,本实验设计去除率达50%左右时分离上层藻液进行实验。预实验结果表明,在加入0.15g/L改性粘土和1.5g/L原土时,去除率分别达到56%和51%。所以,本文中各实验组分别为0.15g/L改性粘土组、1.5g/L原土组和不加入任何粘土的对照组。向改性粘土组和原土组分别加入粘土3h后(Wang et al,2011),取上层未被去除的微藻细胞进行培养,测定细胞生长率和生理生化参数。
1.3 去除效率、细胞增长率、透光率和生理生化参数的测定 1.3.1 去除效率(Removal efficiency,RE)的测定加入改性粘土或原土3h后,使用血球计数板测定细胞密度,去除效率的计算公式如下
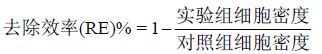
计算公式如下
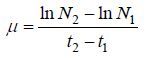
式中: N为细胞密度,t为时间,在本文中时间间隔取1天。
1.3.3 透光率(T)测定小球藻加入改性粘土(或原土)后利用分光光度计对藻液进行全波长(200—700nm)扫描,确定最大吸收波长为380nm。各实验组加入改性粘土和原土后分别取样测定不同时刻下的T380,以此来表示水体的透光率T。
1.3.4 提取酶液将藻液离心(9500r/min,5min)收集,保存于-80°C冰箱。样品加入1mL磷酸缓冲溶液(pH=7.8)于玻璃研磨器中研磨3min,再用超声波破碎仪破碎10min,离心(4°C,5000r/min,10min)收集上清液,即为粗酶液,低温保存。
1.3.5 生理生化参数测定可溶性蛋白含量的测定采用考马斯亮蓝G-250法(王学奎,2006)。SOD、CAT、APX、GSH-PX和MDA采用南京建成生物工程研究所的相应试剂盒测定。
2 结果和讨论 2.1 改性粘土絮凝法对小球藻生长的影响改性粘土组和原土组小球藻呈现出相似生长趋势(图 1),细胞密度先下降后增长,改性粘土组细胞密度略低于原土组。两个实验组经过11天左右的生长,细胞密度恢复到粘土处理前,第11—22天改性粘土组和原土组平均细胞增长率分别为0.0800/d和0.0771/d,远远低于实验前相同细胞密度区间(第5—10天)的平均增长率(0.200/d),说明粘土处理抑制了这部分小球藻的生长(图 1b—c),这与以往粘土对尖刺拟菱形藻(Pseudonitzschia pungens f. multiseries)(俞志明,1998)、塔玛亚历山大藻(Alexandrium tamarense)(孙晓霞,2001; Lu et al,2015a)和赤潮异弯藻(Heterosigma akashiwo)(孙晓霞,2001)等生长的抑制作用研究结果一致。
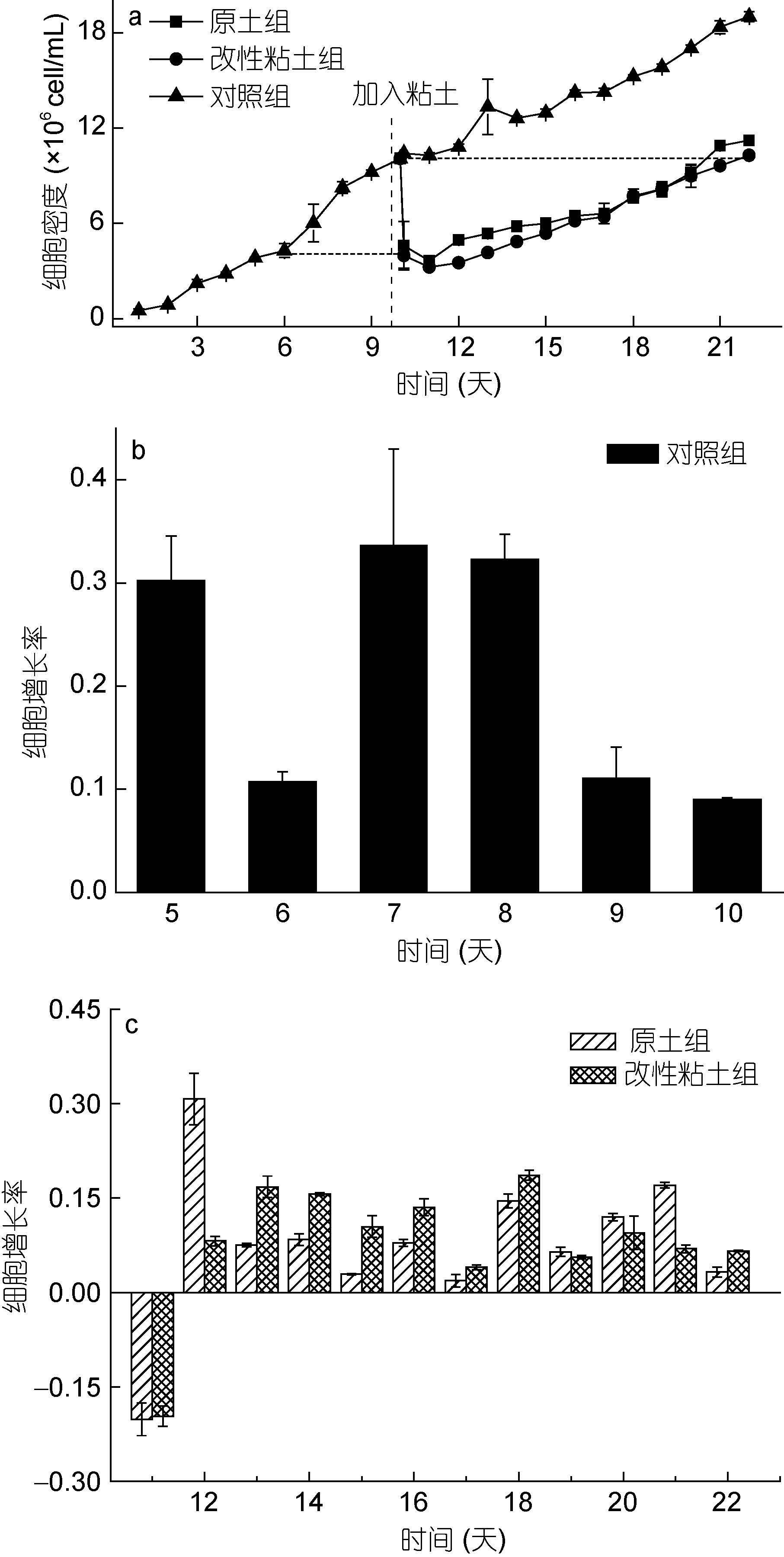 |
| 图 1 改性粘土絮凝法对小球藻生长的影响 Fig. 1 Effect of modified clay flocculation on the growth of Chlorella vulgaris |
为了进一步探讨改性粘土絮凝法对水体残留小球藻生长的抑制作用机制,我们分别研究了水体中残留微藻的可溶性蛋白含量、抗氧化酶活性以及MDA含量对粘土加入的响应与变化特点。
2.2 改性粘土絮凝法对小球藻可溶性蛋白含量的影响可溶性蛋白大多是参与细胞代谢的各种酶类,将粘土作为外源刺激,其含量变化可作为了解藻细胞在此胁迫下的一个抗逆性指标。两个实验组可溶性蛋白含量变化相类似,均呈现出先升高后下降的趋势(图 2)。王丽媛等人(2012)研究了磁性壳聚糖-稀土-粘土复合树脂(MCRC)对赤潮异弯藻的作用,其可溶性蛋白含量表现出了相似的变化趋势。
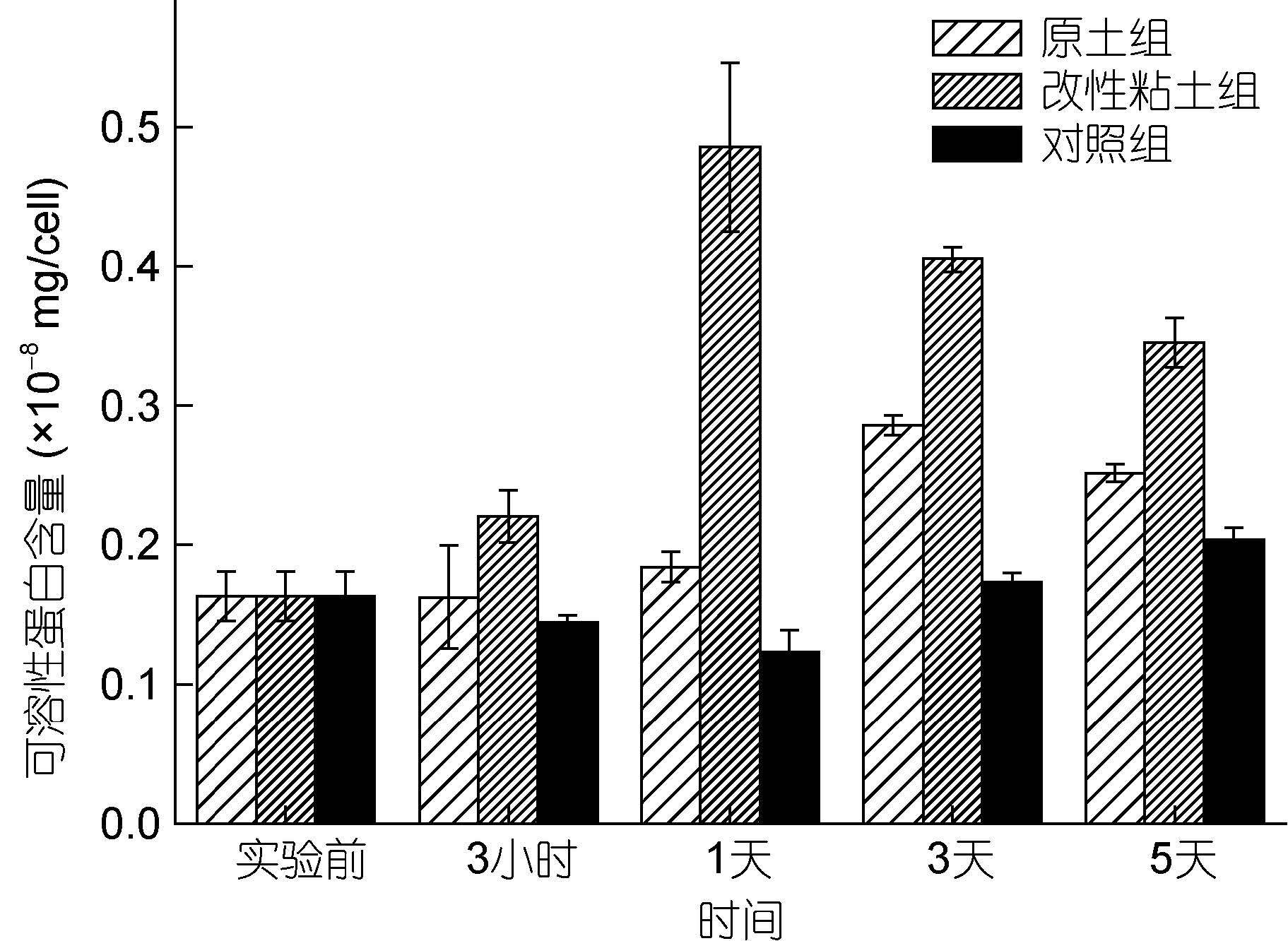 |
| 图 2 改性粘土絮凝法对小球藻可溶性蛋白含量的影响 Fig. 2 Effect of modified clay flocculation on soluble protein content of Chlorella vulgaris |
两个实验组可溶性蛋白含量均高于对照组,改性粘土组可溶性蛋白含量在第1天达到最大值(0.486±0.061)×10-8mg/cell,是对照组的3.93倍。原土组可溶性蛋白含量在第3天呈现出最大值(0.286± 0.007)×10-8mg/cell,是对照组的1.69倍。有研究表明重金属、低温等逆境条件可引起可溶性蛋白含量增加,谷巍等(2001)认为可溶性蛋白提高,是植物抵抗毒害的解毒机制,可增加细胞渗透能力和功能蛋白含量,维持细胞代谢平衡。本实验中粘土絮凝对小球藻造成逆境胁迫,激发了藻细胞的防御系统,这可能是导致可溶性蛋白含量上升的主要因素。
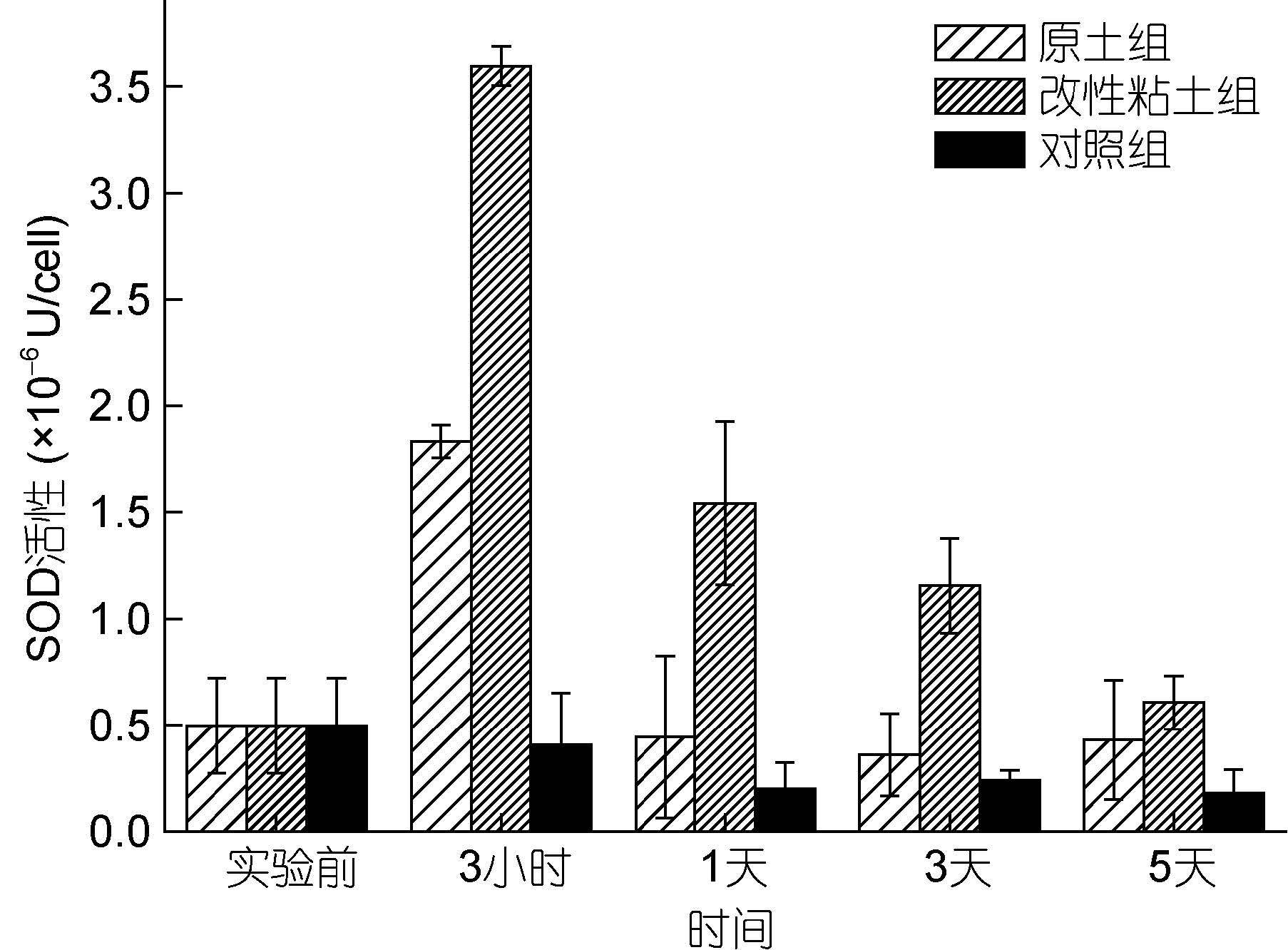
2.3 改性粘土絮凝法对小球藻SOD活性的影响SOD是细胞抵抗过氧化伤害的第一道防线,广泛存在于细胞质、叶绿体和线粒体中(陈鸿鹏等,2007)。添加改性粘土或原土后,这两组的小球藻SOD活性相较于对照组明显提高,而且变化趋势相类似,先上升后下降,均在3h达到最大值(图 3)。有研究表明SOD是自然界唯一可以消除O2-·的酶(Gechev et al,2006),本文中两个实验组SOD活性显著增强,说明添加改性粘土或原土破坏了微藻细胞代谢平衡,致使细胞积累较多O2-·,从而诱导SOD表达。歧化O2-·的作用机理(Mallick et al,2000)如下:
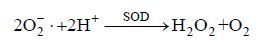
 |
| 图 3 改性粘土絮凝法对SOD活性的影响 Fig. 3 Effect of modified clay flocculation on SOD activity of Chlorella vulgaris |
由此产生的H2O2可再由CAT和APX等酶进一步作用分解。在整个实验过程中,改性粘土组SOD活性明显高于原土组,特别是在加入粘土3h时,为原土组的1.96倍(图 3),这说明同样去除效果下少量的改性粘土对残余微藻细胞产生的胁迫压力较大,积累较多O2·-。
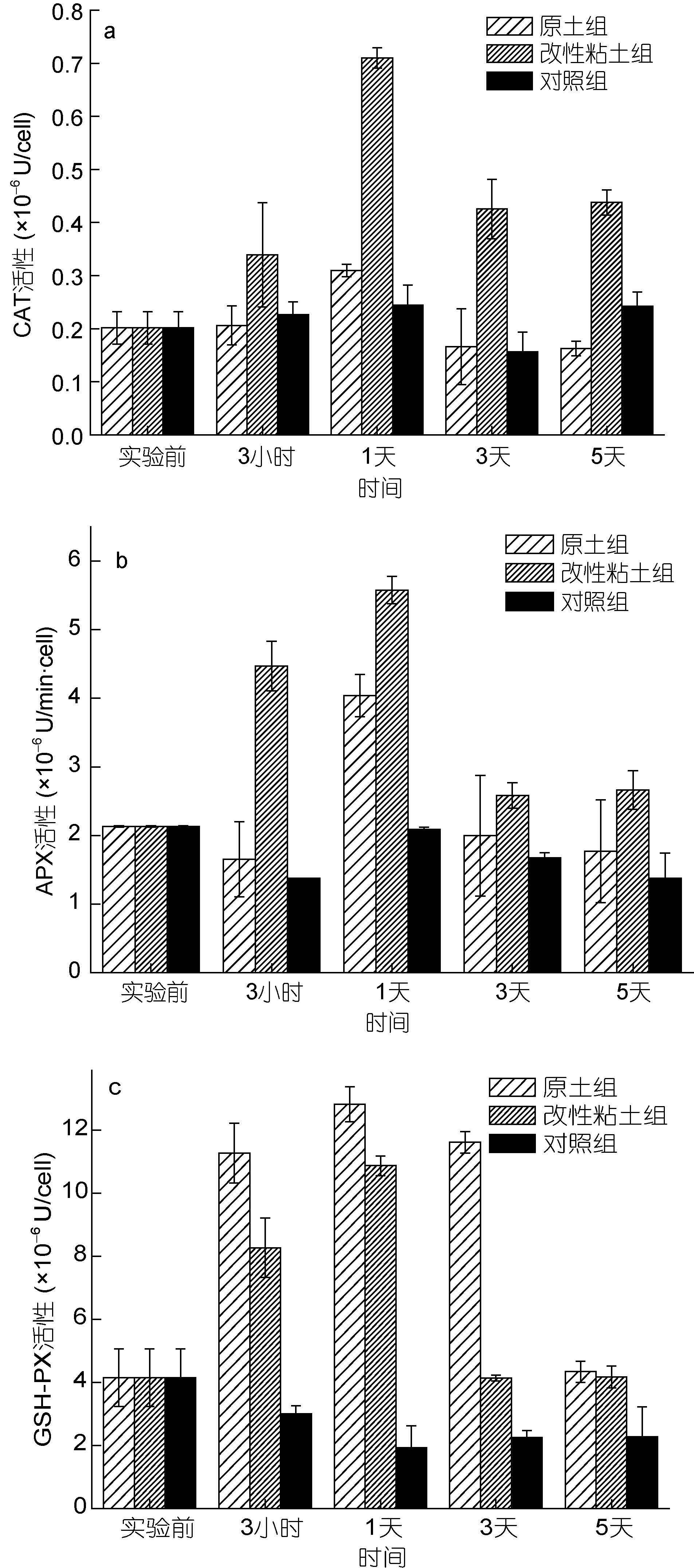
2.4 改性粘土絮凝法对小球藻CAT、APX和GSH-PX活性的影响作为细胞内消除ROS的第二道防线(王咏梅,2005),CAT、APX和GSH-PX均能催化分解H2O2。其中CAT与H2O2具有较高的亲和力,能够清除脂肪酸氧化、光呼吸、线粒体电子传递中产生的H2O2,是H2O2的主要清除剂(陈金峰等,2008)。由于叶绿体中没有CAT和GSH-PX等酶,因此APX是清除叶绿体中产生的H2O2的关键酶(沈文飚等,1997)。GSH-PX也是细胞内重要的活性氧消除剂,主要分布在线粒体和细胞液中,阻止ROS对细胞的进一步伤害(苗雨晨等,2005; 王咏梅,2005)。
改性粘土组的CAT、APX和GSH-PX变化趋势类似(图 4),经粘土絮凝处理,各酶活性显著增强,均在加入粘土1天后达到最大值,分别是对照组的1.27倍、1.94倍和6.65倍,实验后期各酶活性有所下降并稳定到较高水平。
 |
| 图 4 改性粘土絮凝法对小球藻CAT、APX和GSH-PX活性的影响 Fig. 4 Effect of modified clay flocculation on CAT,APX and GSH-PX activity of Chlorella vulgaris |
原土组相对应的各种酶活表现出不同的变化趋势。CAT活性相对于对照组没有明显变化(图 4a)。APX活性随着处理后时间的延长先略有下降后迅速增强,在第1天时达到最大,实验后期APX活性下降并保持在较稳定水平(图 4b)。与其它酶活不同的是,原土组GSH-PX活性高于改性粘土组,其活性迅速增强,保持在较高水平至第3天(图 4c)。
两个实验组中CAT、APX和GSH-PX活性变化幅度各不相同。研究表明H2O2含量较高时,才能激发CAT活性,若含量较低,则需要APX等抗氧化酶和抗氧化物质来消除(Gechev et al,2006)。原土组CAT和APX活性均低于改性粘土组相应活性,尤其CAT活性相比于对照组没有明显的提高,但G SH-PX活性却高于改性粘土组。可能是由于原土组对微藻细胞胁迫产生的H2O2含量较低,未能引起CAT活性提高,为了消除这部分H2O2,则需要APX和GSH-PX的共同作用。由此说明CAT、APX和GSH-PX作为细胞内酶体防御ROS的第二道防线,在消除细胞内H2O2时互相补充、共同作用。
抗氧化酶在清除细胞ROS方面具有十分重要的作用,其活性变化能够反映该藻受到逆境胁迫的程度及自身的抗逆能力。侯秀富等(2013)研究表明,不同粒径的水体悬浮颗粒物对斜生栅藻(Scenedesmus obliquus)的抗氧化酶产生影响,尤其是0—75μm粒径组颗粒物对该藻的影响较大,该粒径与本研究所使用的粘土粒径(Liu et al,2016)相近,因此小球藻抗氧化酶活系统对粘土的响应可能与水体悬浮颗粒物相类似。
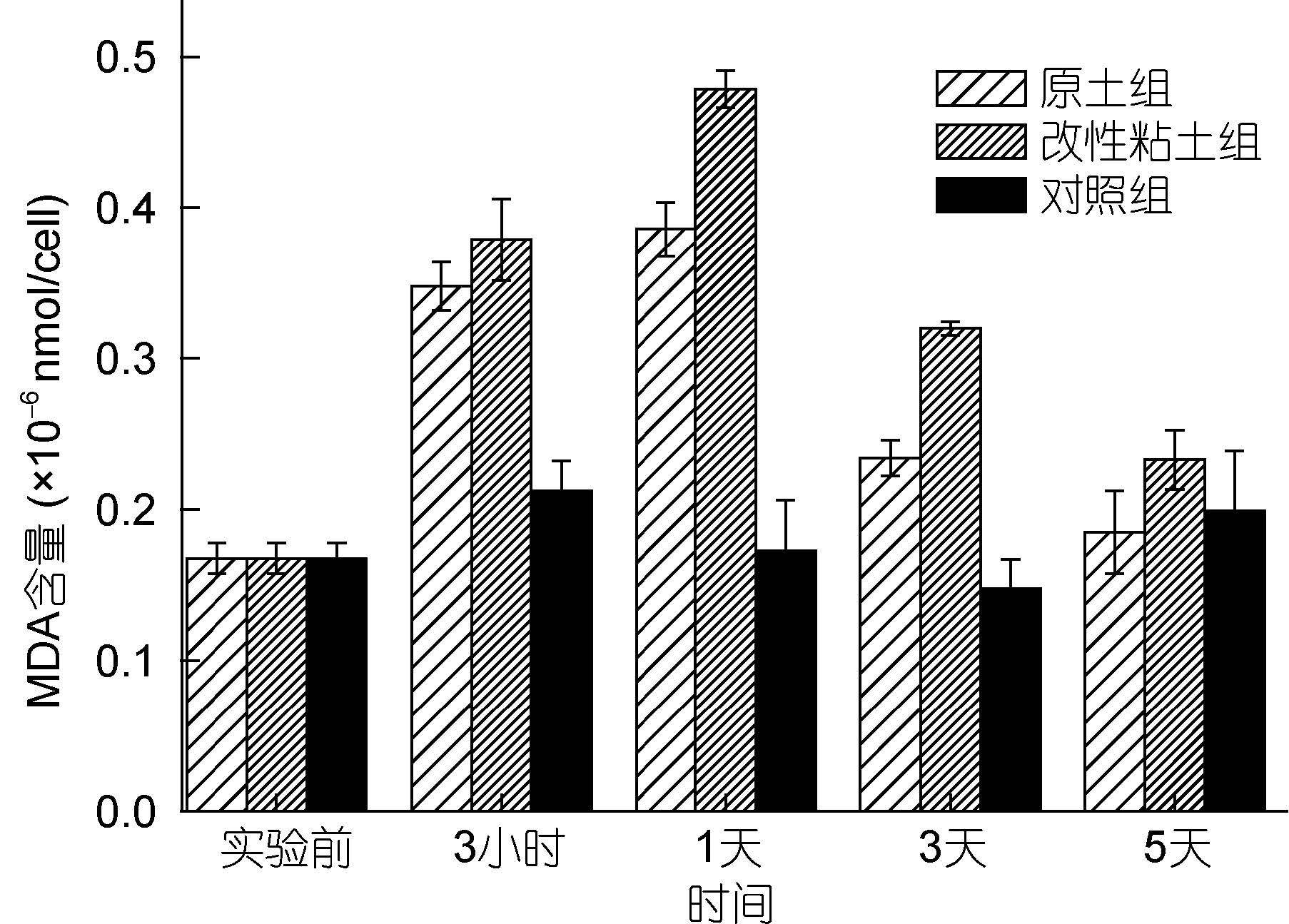
2.5 改性粘土絮凝法对小球藻MDA含量的影响MDA是生物膜系统脂质过氧化的产物之一,其含量变化可以反映细胞膜结构损伤程度,并且MDA对细胞也有毒害作用(刘家忠等,1999)。改性粘土组和原土组小球藻MDA含量变化呈现出一致的变化趋势(图 5),随着粘土处理后时间的延长,MDA含量迅速增大,在1天后达到最大值,分别是对照组的2.77倍(改性粘土组)和2.44倍(原土组),这表明处理组小球藻细胞脂质受到过氧化伤害,同时MDA含量的增加加重了细胞膜的伤害程度,可能是由于粘土絮凝对小球藻形成的逆境导致氧化胁迫,这与抗氧化酶活性变化相吻合,并且原土改性后增强了其对微藻细胞的氧化损伤。在实验后期,该藻MDA含量有所下降,可能是由于抗氧化系统的作用逐步消除细胞内ROS所致。
 |
| 图 5 改性粘土絮凝法对小球藻MDA含量的影响 Fig. 5 Effect of modified clay flocculation on MDA content of Chlorella vulgaris |
综合分析本研究的实验结果可以看出,水体中残留的小球藻对粘土絮凝法的生理生化响应主要由于两部分因素: 一方面这些残留在水体中的微藻细胞尽管没有与粘土颗粒发生有效絮凝作用,沉降于水底,但是絮凝期间会与粘土颗粒发生一系列碰撞作用(俞志明等,1995a,b),这些看似无效的碰撞仍能对细胞表面产生一定的影响,干扰小球藻的正常代谢,从而抑制细胞的正常生长; 另一方面,在粘土絮凝过程中,微藻细胞生长环境(比如光照、营养盐等)发生较大变化,粘土颗粒会在一定程度上削弱水体的光照强度,直接影响小球藻的光合作用。孙晓霞(2001)研究发现,随着粘土浓度的增大,对塔玛亚历山大藻和赤潮异弯藻光合作用的抑制增强,而叶绿体是植物产生ROS的主要场所(Asada,2006),由此可以推测粘土颗粒的“遮荫效应”可以使细胞ROS积累(俞志明等,1995a,b),从而导致抗氧化酶活性和MDA含量等参数的增加。本研究得到相似的实验结果,经粘土处理后透光率迅速下降,改性粘土和原土组透光率分别是对照组的75%和25%。在3h时,改性粘土组的透光率恢复至与对照组相同,但原土组透光率仍比较低,仅为对照组的54%,表明粘土颗粒削弱了水体光照强度,并且由于原土组粘土颗粒较多,对水体光照强度影响较大,这可能是原土组抗氧化酶活性和MDA含量提高的重要原因。
王小冬等(2012)研究发现,营养盐限制能够显著提高赤潮异弯藻和海洋卡盾藻(Chattonella marina)的抗氧化酶活性。粘土能够吸附水体中磷酸盐(俞志明等,1995a,b),改变水体氮磷比例,形成营养盐限制,因此可能会对该藻产生氧化伤害,激发抗氧化酶活性提高。本研究中改性粘土对小球藻产生较大氧化胁迫,可能与改性剂PAC的协同作用相关。本课题组Lu等(2015b)研究发现PAC改性粘土不仅可以去除大部分总磷,也可清除总氮,改变化学计量值,对细胞产生较大营养盐限制,导致改性粘土组抗氧化酶活性和MDA含量要高于原土组。
3 结论改性粘土方法治理赤潮灾害的主要原理是絮凝藻细胞至海底,导致其死亡、分解。除此之外,该方法对未被絮凝的藻细胞有什么影响一直未被关注。本文以小球藻为模式生物,考察了改性粘土絮凝后水体中残余小球藻的生长率、生理生化性质变化等,发现赤潮水体经改性粘土治理后,残余小球藻的生长受到了明显抑制。进一步考察了其生理生化性质,发现絮凝作用导致残余藻细胞的抗氧化酶系统发生变化,SOD、CAT、APX和GSH-PX活性增强,MDA含量上升等。这些变化可能与改性粘土絮凝过程中的物理撞击、改性粘土颗粒的“遮荫效应”和营养盐环境改变等因素有关,从而导致残留细胞的生长受到了影响,难以再次爆发形成赤潮。上述结果进一步深化了对改性粘土方法治理有害藻华机制的认识。
| 王小冬, 王艳. 2012. 赤潮异弯藻和海洋卡盾藻抗氧化酶活性对氮磷比失衡的响应. 海洋环境科学, 31 (3) : 337–340 |
| 王丽媛, 张莉, 汪东风. 2012. 磁性壳聚糖-稀土-粘土复合树脂对赤潮异湾藻的抑制作用. 海洋环境科学, 31 (6) : 808–812 |
| 王咏梅. 2005. 自由基与谷胱甘肽过氧化物酶. 解放军药学学报, 21 (5) : 369–371 |
| 王学奎. 2006. 植物生理生化实验原理和技术(第二版). 北京: 高等教育出版社, 190-192 |
| 刘家忠, 龚明. 1999. 植物抗氧化系统研究进展. 云南师范大学学报, 19 (6) : 1–11 |
| 孙晓霞, 2001. 粘土矿物及无机絮凝剂对有害赤潮的治理研究. 青岛: 中国科学院海洋研究所博士学位论文, 38-50 http://cdmd.cnki.com.cn/article/cdmd-80068-2001002963.htm |
| 谷巍, 施国新, 杜开和, 等. 2001. 汞、镉复合污染对轮叶狐尾藻的毒害影响. 南京师大学报(自然科学版), 24 (3) : 75–79 |
| 沈文飚, 黄丽琴, 徐朗莱. 1997. 植物抗坏血酸过氧化物酶. 生命的化学, 17 (5) : 24–26 |
| 陈金峰, 王宫南, 程素满. 2008. 过氧化氢酶在植物胁迫响应中的功能研究进展. 西北植物学报, 28 (1) : 188–193 |
| 陈鸿鹏, 谭晓风. 2007. 超氧化物歧化酶(SOD)研究综述. 经济林研究, 25 (1) : 59–65 |
| 苗雨晨, 白玲, 苗琛, 等. 2005. 植物谷胱甘肽过氧化物酶研究进展. 植物学通报, 22 (3) : 350–356 |
| 侯秀富, 郭沛涌, 张华想, 等. 2013. 水体悬浮颗粒物对斜生栅藻生理生化及光合活性的影响. 环境科学学报, 33 (5) : 1446–1457 |
| 俞志明. 1998. 粘土矿物对尖刺拟菱形藻多列型生长和藻毒素产生的影响. 海洋与湖沼, 29 (1) : 47–52 |
| 俞志明, 马锡年, 谢阳. 1995a. 粘土矿物对海水中主要营养盐的吸附研究. 海洋与湖沼, 26 (2) : 208–214 |
| 俞志明, 邹景忠, 马锡年. 1994. 一种提高粘土矿物去除赤潮生物能力的新方法. 海洋与湖沼, 25 (2) : 226–232 |
| 俞志明, 邹景忠, 马锡年, 等. 1993. 治理赤潮的化学方法. 海洋与湖沼, 24 (3) : 314–318 |
| 俞志明, 邹景忠, 马锡年, 等. 1995b. 粘土矿物去除赤潮生物的动力学研究. 海洋与湖沼, 26 (1) : 1–6 |
| 卿人韦, 叶华勋, 李扬, 等. 2003. 在高强度光照胁迫下极大螺旋藻两种抗氧化酶活力变化的研究. 四川大学学报(自然科学版), 40 (3) : 565–569 |
| 蔡以滢, 陈珈. 1999. 植物防御反应中活性氧的产生和作用. 植物学通报, 16 (2) : 107–112 |
| Anderson D M. 1997. Turning back the harmful red tide. Nature, 388 (6642) : 513–514 DOI:10.1038/41415 |
| Asada K. 2006. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiology, 141 (2) : 391–396 DOI:10.1104/pp.106.082040 |
| Dat J, Vandenabeele S, Vranová E, et al. 2000. Dual action of the active oxygen species during plant stress responses. Cellular and Molecular Life Sciences, 57 (5) : 779–795 DOI:10.1007/s000180050041 |
| Gechev T S, Van Breusegem F, Stone J M, et al. 2006. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death. BioEssays, 28 (11) : 1091–1101 DOI:10.1002/(ISSN)1521-1878 |
| Huang Z Y, Li L P, Huang G L, et al. 2009. Growth-inhibitory and metal-binding proteins in Chlorella vulgaris exposed to cadmium or zinc. Aquatic Toxicology, 91 (1) : 54–61 DOI:10.1016/j.aquatox.2008.10.003 |
| Liu Y, Cao X H, Yu Z M, et al. 2016. Flocculation of harmful algal cells using modified clay: effects of the properties of the clay suspension. Journal of Applied Phycology, 28 (3) : 1623–1633 DOI:10.1007/s10811-015-0735-x |
| Lee T M, Shiu C T. 2009. Implications of mycosporine-like amino acid and antioxidant defenses in UV-B radiation tolerance for the algae species Ptercladiella capillacea and Gelidium amansii. Marine Environmental Research, 67 (1) : 8–16 DOI:10.1016/j.marenvres.2008.09.006 |
| Lu G Y, Song X X, Yu Z M, et al. 2015a. Environmental effects of modified clay flocculation on Alexandrium tamarense and paralytic shellfish poisoning toxins (PSTs). Chemosphere, 127 : 188–194 DOI:10.1016/j.chemosphere.2015.01.039 |
| Lu G Y, Song X X, Yu Z M, et al. 2015b. Effects of modified clay flocculation on major nutrients and diatom aggregation during Skeletonema costatum blooms in the laboratory. Chinese Journal of Oceanology and Limnology, 33 (4) : 1007–1019 DOI:10.1007/s00343-015-4162-2 |
| Mallick N, Mohn F H. 2000. Reactive oxygen species: response of algal cells. Journal of Plant Physiology, 157 (2) : 183–193 DOI:10.1016/S0176-1617(00)80189-3 |
| Martins P L G, Marques L G, Colepicolo P. 2015. Antioxidant enzymes are induced by phenol in the marine microalga Lingulodinium polyedrum. Ecotoxicology and Environmental Safety, 116 : 84–89 DOI:10.1016/j.ecoenv.2015.03.003 |
| Mei X Q, Zheng K, Wang L D, et al. 2014. Studies on the effects on growth and antioxidant responses of two marine microalgal species to uniconazole. Journal of Ocean University of China, 13 (5) : 877–882 DOI:10.1007/s11802-014-2326-x |
| Pinto E, Sigaud-kutner T C S, Leitão M A S, et al. 2003. Heavy metal-induced oxidative stress in algae. Journal of Phycology, 39 (6) : 1008–1018 DOI:10.1111/j.0022-3646.2003.02-193.x |
| Sellner K G, Doucette G J, Kirkpatrick G J. 2003. Harmful algal blooms: causes, impacts and detection. Journal of Industrial Microbiology and Biotechnology, 30 (7) : 383–406 DOI:10.1007/s10295-003-0074-9 |
| Wang D F, Li H Y, Wang L Y, et al. 2010. Effects of chitosan-RE3+-bentonite on growth of Chlorella vulgaris. Journal of Rare Earths, 28 (S1) : 149–153 |
| Wang H L, Yu Z M, Cao X H, et al. 2011. Fractal dimensions of flocs between clay particles and HAB organisms. Chinese Journal of Oceanology and Limnology, 29 (3) : 656–663 DOI:10.1007/s00343-011-0065-z |
 2016, Vol. 47
2016, Vol. 47


