
中国海洋湖沼学会主办。
文章信息
- 王祖忠, 王朝阳, 张迪骏, 司开学, 董丽莎, 张红燕, 崔晨茜, 韩姣姣, 周君, 苏秀榕. 2016.
- WANG Zu-Zhong, WANG Zhao-Yang, ZHANG Di-Jun, SI Kai-Xue, DONG Li-Sha, ZHANG Hong-Yan, CUI Chen-Qian, HAN Jiao-Jiao, ZHOU Jun, SU Xiu-Rong. 2016.
- 宁波沿海陆源排污口弓形杆菌属(Arobacter sp.)和梭菌属(Clostridium sp.)的分布特点
- AROBACTER AND CLOSTRIDIUM DISTRIBUTION IN SEWAGE OUTLETS ALONG NINGBO COAST
- 海洋与湖沼, 47(4): 862-868
- Oceanologia et Limnologia Sinica, 47(4): 862-868.
- http://dx.doi.org/10.11693/hyhz20160400081
-
文章历史
- 收稿日期:2016-04-17
- 改回日期:2016-04-28
弓形杆菌(Arcobacter. sp)又称为类弯曲菌(Campylobacter-like),与类弯曲菌形态相似,亲缘关系很近,呈弯曲或螺旋形杆状,不产芽孢,最佳生长氧气浓度为微量氧气(3%—10%),正常大气氧浓度条件和厌氧条件下也可以生长。目前已发现Arcobacter有15个种,其中有9种分离自环境中,例如,四联球弓形杆菌(Arcobacter halophilus)、埃利斯弓形杆菌(A. ellis)和硝化弓形杆菌(A. nitrofigilis)等(Levican et al,2013)。弓形杆菌属最高生长温度为40°C,被认为最低生长温度为15°C,最佳生长温度为25—30°C(Houf et al,2007; 游淑珠等,2011)。弓形杆菌属主要分离于猪肉、牛肉、禽肉等动物和水体中,是一种人畜共患病的食源性和水源性病原菌,与人类胃肠炎和菌血症有关。
梭菌属是能形成芽孢、厌氧生长的革兰氏染色阳性大杆菌。通常多形态,以周生鞭毛运动,芽孢椭圆或球形孢囊膨大。大多数为化能异养菌,有的是化能自养菌或无机化能异养菌。可以分解糖、蛋白质,通常可以产生混合的有机酸和醇类,不还原硫酸盐。它们的代谢物极富多样性,广泛分布在环境中,许多种可产生外毒素危害人类和牲畜生命健康。例如破伤风梭菌,一般通过深部创伤感染,产生痉挛毒素,引起破伤风(Sheffield et al,2004); 肉毒梭菌,容易在鱼贝类肠道、腮和内脏中生长,在适宜条件下能产生肉毒毒素,人进食这些含毒素食品后,即发生肉毒中毒。弓形杆菌属和梭菌属作为危害人类身体健康的病原菌,一直是研究热点问题之一,但目前主要集中在水体和食品方面,陆源排污口中的弓形杆菌属和梭菌属未见报道。本文选取宁波沿海10个主要的陆源排污口20个站位的水样进行分析,研究陆源排污口弓形杆菌属和梭菌属生物种类和分布特点。
1 材料与方法 1.1 样品采集分别于2011年3月、5月、8月、10月,在宁波沿海5个工业型排污口(S1象山爵溪东塘排污口,S3象山石浦水产加工园区排污口,S4象山西周工业园区排污口,S5象山墙头综合排污口,S7宁海西店崔家综合排污口,S10余姚黄家埠排污口),3个排污河型排污口(S6北仑三山排污口,S8奉化下陈排污口,S9宁海颜公河入海排污口)和1个市政型排污口(S2象山水桶岱垃圾场排污口)以及距离排污口50m以外的10个站位点处采集表面水层(图 1),采用微生物采水器,每次采集4L水样,注入无菌采样瓶中,4°C下保存。
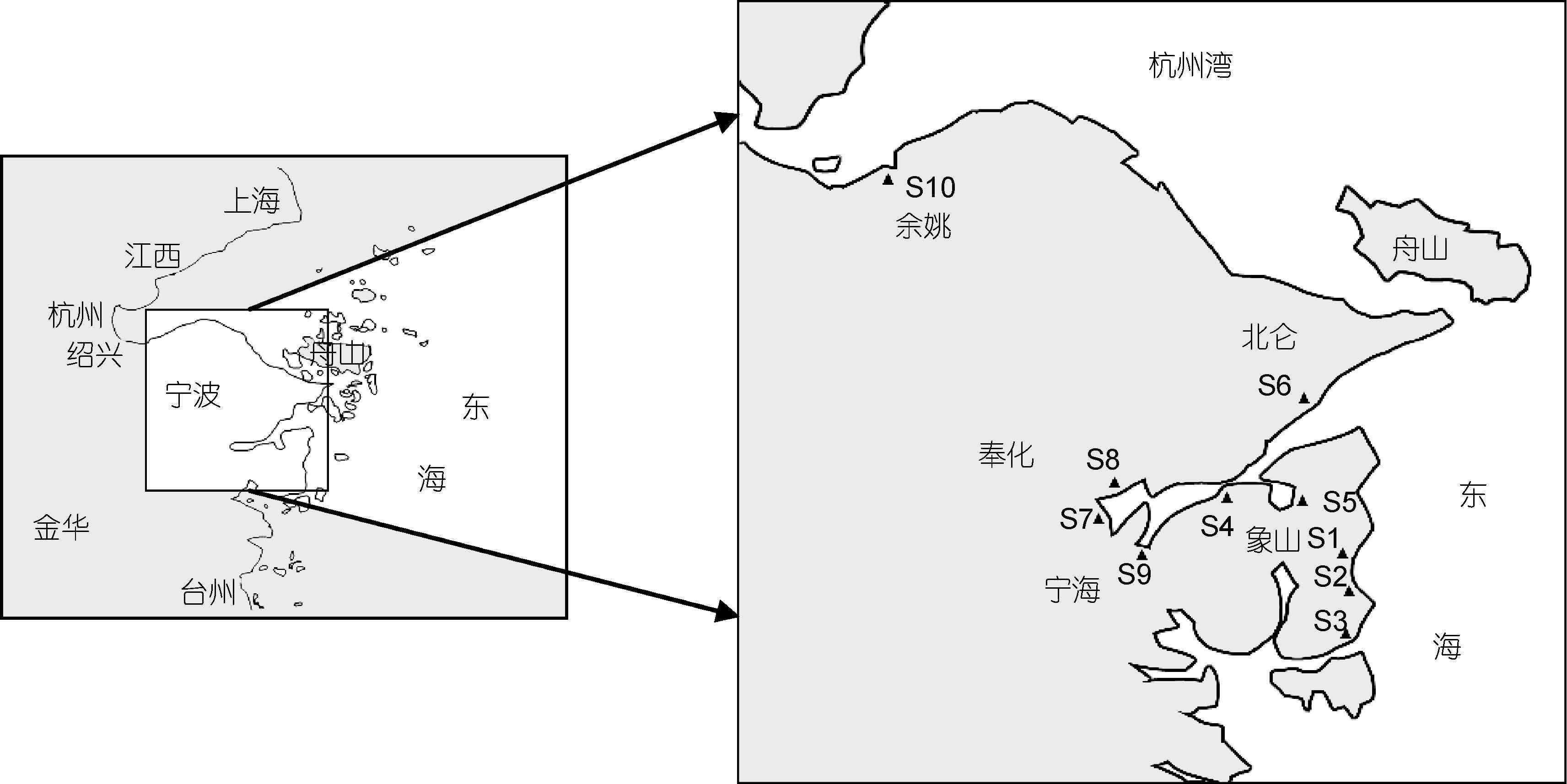 |
| 图 1 陆源排污口的名称和地理位置 Fig. 1 The name and location of the land-based sewage outfall |
取采集的排污口的海水用0.22μm的微孔滤膜富集微生物,利用试剂盒提取基因组 DNA(美国Omega生物技术公司)。
1.2.2 PCR扩增根据细菌16S rRNA的保守序列,利用Primer Premier 5.0设计扩增引物: 16SF(5-CCA TCT CAT CCC TGC GTG TCT CCG ACT CAG-3)和16SR(5-CCT ATC CCC TGT GTG CCT TGG CAG TCT CAG-3)。
20μL扩增反应体系: 2μL 10×buffer,2μL MgCl2,2μL dNTP,上游引物和下游引物各25μL,0.2μL Taq DNA聚合酶和1μL DNA模版。PCR扩增产物用2%的琼脂糖凝胶电泳检测(张迪骏等,2013; 陈丽萍等,2013)。
PCR扩增条件: 94°C预变性4min,94°C变性30s,退火温度从65°C到55°C,退火30s,20个循环; 72°C延伸30s,94°C变性30s,55°C退火30s,72°C延伸30s,35个循环; 最终72°C延伸10min(刘兵等,2009)。
1.2.3 测序与分析将纯化后的PCR产物进行454焦磷酸测序(王中华等,2014; Wang et al,2014),结果用罗氏软件2.5.3进行信号处理分析。根据细菌在文库中出现的频次数量,进一步用R For Window 2.15.2、SPSS等进行统计分析。
2 结果与讨论 2.1 排污口中弓形杆菌属和梭菌属的种类通过454高通量测序的结果分析,共检测出弓形杆菌属2个种,分别是嗜低温弓形杆菌(A. cryaerophilus)、布氏弓形杆菌(A. butzleri); 梭菌属12个种,分别是产气荚膜梭菌(Clostridium perfringens)、丁酸梭菌(C. butyricum)、多枝梭菌(C. ramosum)、嗜纤维杆菌(C. cellulovorans)、丙酮丁醇梭菌(C. acetobutylicum)、热纤维梭菌(C. thermocellum)、破伤风梭菌(C. tetani)双酶梭菌(C. bifermentans)、类腐败梭菌(C. paraputrificum)、近端梭菌(C. subterminale)、巴氏梭菌(C. pasteurianum)、柔嫩梭菌(C. leptum)。其中弓形杆菌属的嗜低温弓形杆菌、布氏弓形杆菌和梭菌属的产气荚膜梭菌、丁酸梭菌为优势菌种。
2.2 弓形杆菌属和梭菌属排污口分布特点弓形杆菌属分别是3月份S1、S2和S8站点; 5月份S2、S3和S5站点; 8月份S2、S3站点和10月份S1、S2与S3站点的优势菌属。由图 2可以看出,弓形杆菌属主要分布在工业排污口和市政排污口,而在排污河类型的排污口检出次数很少。这也与许小红等(2009)在对菜市场污水细菌多样性分析的结果一致,该研究认为弓形杆菌属在菜市场污水中所在的比例最高,高达27.6%,而市政排污口的污水来源于生活污水。工业排污口和市政排污口的污染物中氮氨、磷酸盐的含量比较高,而排污河类型的排污口处氮、磷含量相对较低,因此推测工业排污口和市政排污口处的较高的氮、磷含量造成了弓形杆菌属的大量繁殖。
 |
| 图 2 弓形杆菌属在排污口的分布情况 Fig. 2 Distribution of Arcobacter in outlet |
对比弓形杆菌属,梭菌属却只在3月份的S7站点呈现出相对较高的比例(7.5%),在其它月份、站点均不是优势菌属,所占比例均在2%以下(图 3)。王想霞等(2000)在对濮阳市肉毒梭菌生态分布的研究中也得出相应的结论,其研究结果显示,肉毒梭菌在土壤中的分布最高,达到14.6%,而污水的分离比率却只有4.7%,说明肉毒梭菌的主要分布区域是土壤,而非污水(王想霞等,2000)。同样,石家庄市肉毒梭菌在环境中的分布也呈现相同的趋势,土壤中肉毒梭菌的分离比率为5.3%,要高于水样2.0%(郭占景等,2010)。
 |
| 图 3 梭菌属在排污口的分布情况 Fig. 3 Distribution of Clostridium in outlet |
从弓形杆菌属的分布看,S1站点与S2站点、S4站点与S5站点和S6站点与S8站点的分布情况最为接近,而从梭菌属的分布看,S2站点与S3站点、S4站点与S5站点、S6与S8站点和S10站点和S7站点的分布情况最为接近(图 4),结合弓形杆菌和梭菌属的站点聚类结果,发现无论是弓形杆菌属还是梭菌属,S4站点与S5站点,S6站点与S8站点的分布均呈现出高度相似的特点。从排污口的类型上看,S4站点与S5站点是工业性排污口,S6站点与S8站点都是排污河,因此可以推测弓形杆菌属和梭菌属的分布与排污口的类型存在较密切的联系。
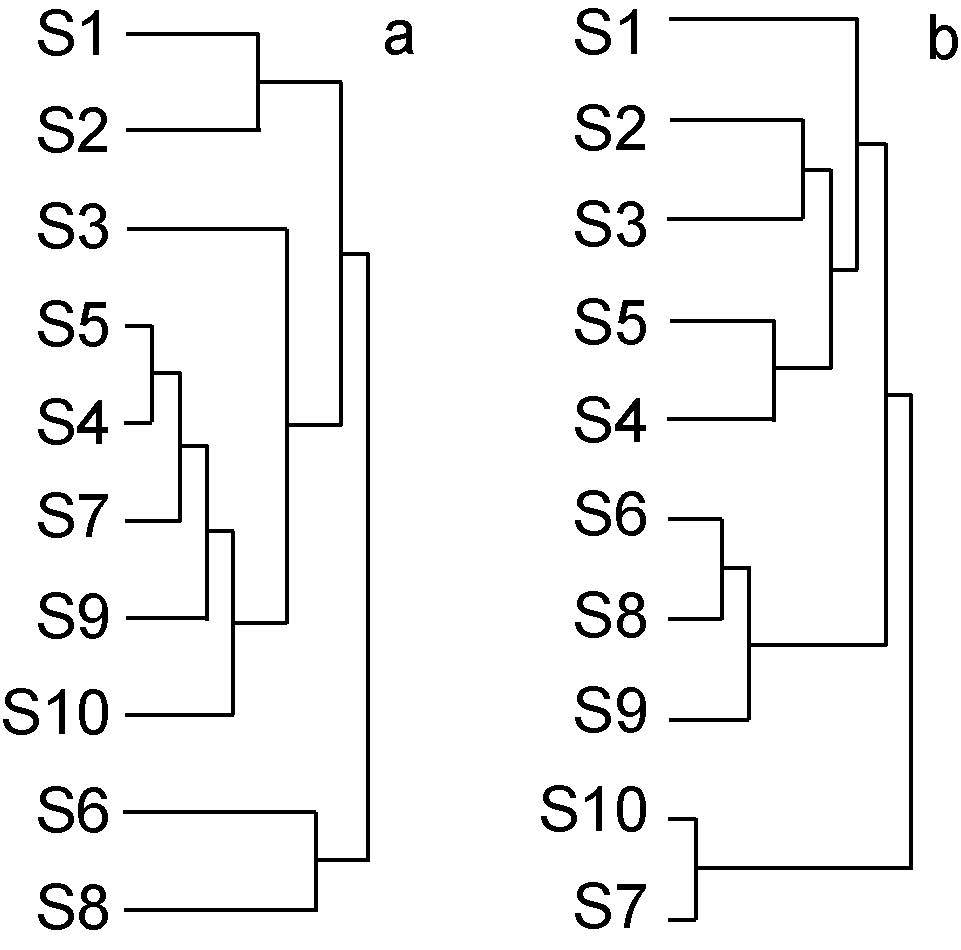 |
| 图 4 站点聚类分析图 Fig. 4 The cluster analysis of sites |
数据的SPSS分析发现(表 1),梭菌属和弓形杆菌属的偏度和峰态均大于1,不符合正态分布,故对两者进行相关性分析时,采用Spearman相关性分析方法,分析结果显示梭菌属和弓形杆菌属的相关性系数为0.536,显著性(双边检验)为小于0.05,说明两者数据之间呈现正相关性,且相关性具有统计学意义。
| 菌属 | 次数 | 最小值 | 最大值 | 偏度 | 峰态 |
| 弓形杆菌属 | 40 | 1 | 6668 | 4.640 | 24.712 |
| 梭菌属 | 40 | 2 | 731 | 3.222 | 10.855 |
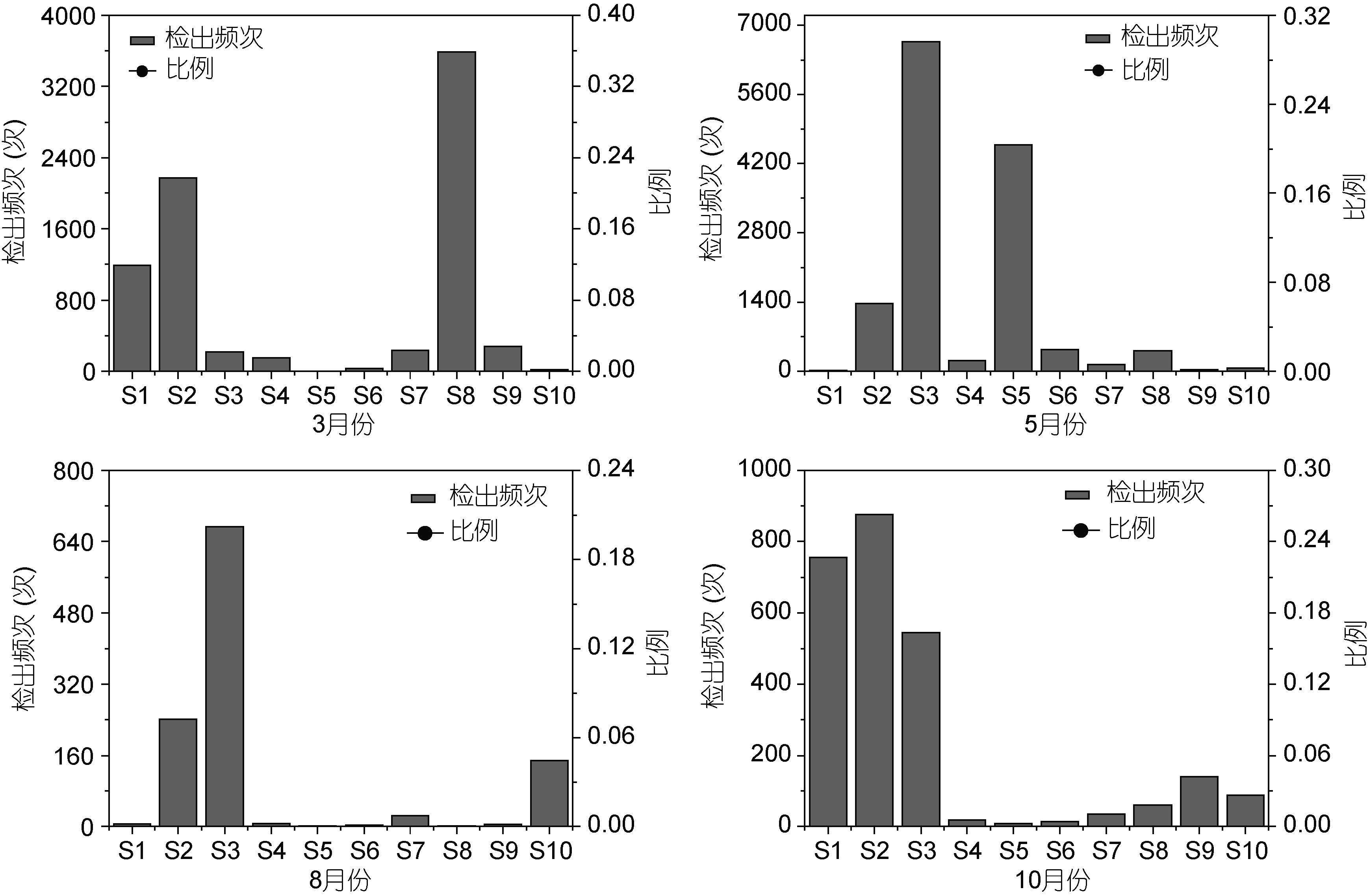
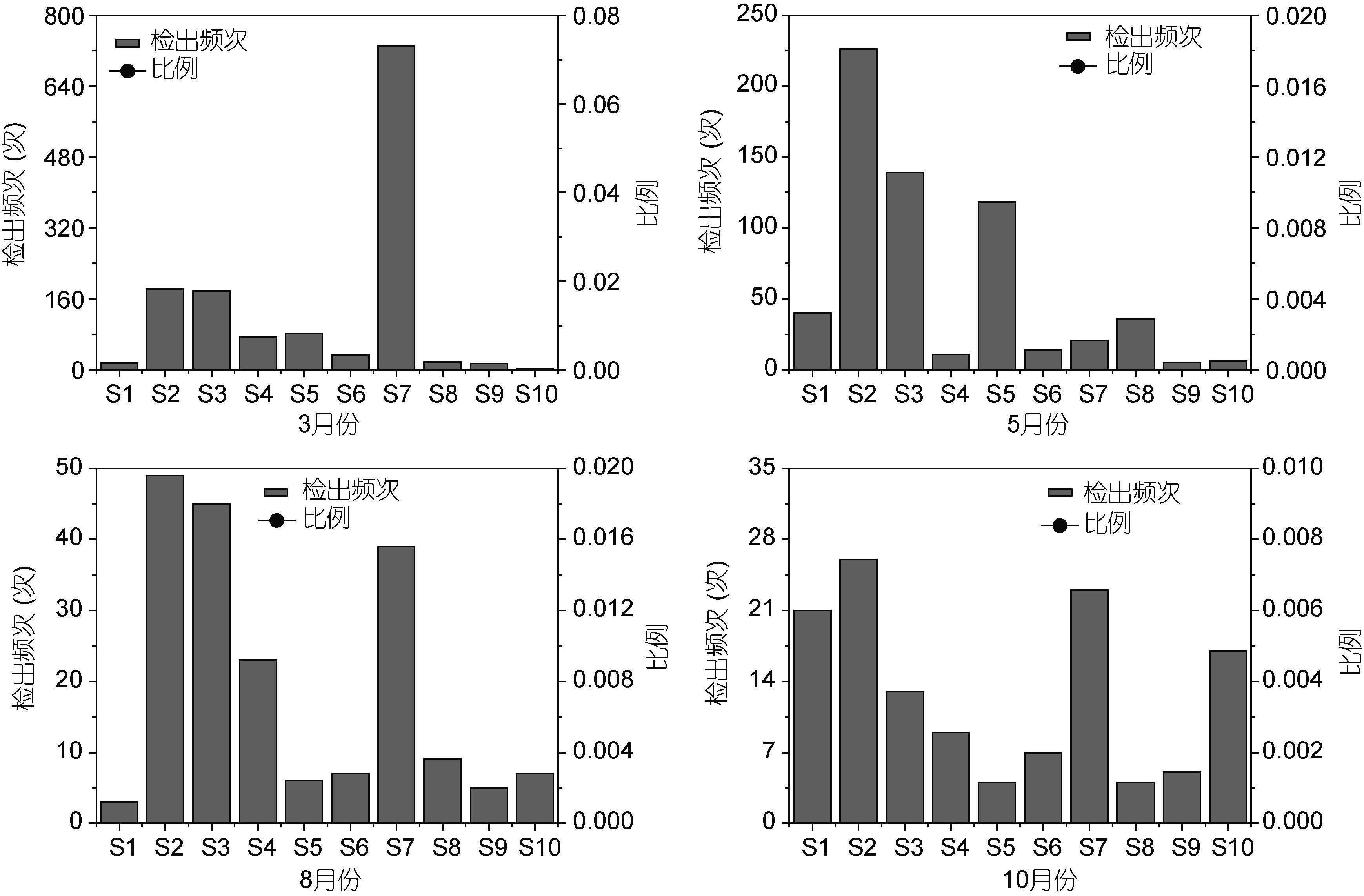
3月份,弓形杆菌属在S1象山爵溪东塘排污口检出次数最高(444次)。梭菌属在S7宁海西店崔家综合排污口检出次数最高(211次); 5月份,弓形杆菌属在S5象山墙头综合排污口检出次数最高(4122次)。梭菌属在S2象山水桶岱垃圾场排污口检出次数最高(189次); 8月份,弓形杆菌属在S3象山石浦水产加工园区排污口检出次数最高(467次),其它排污口检出次数均相对较低。梭菌属S3象山石浦水产加工园区排污口检出次数最高(25次); 10月份,弓形杆菌属在S3象山石浦水产加工园区排污口检出次数最高(541次)。梭菌属在S7宁海西店崔家综合排污口检出次数最高(13次)(图 5,图 6)。
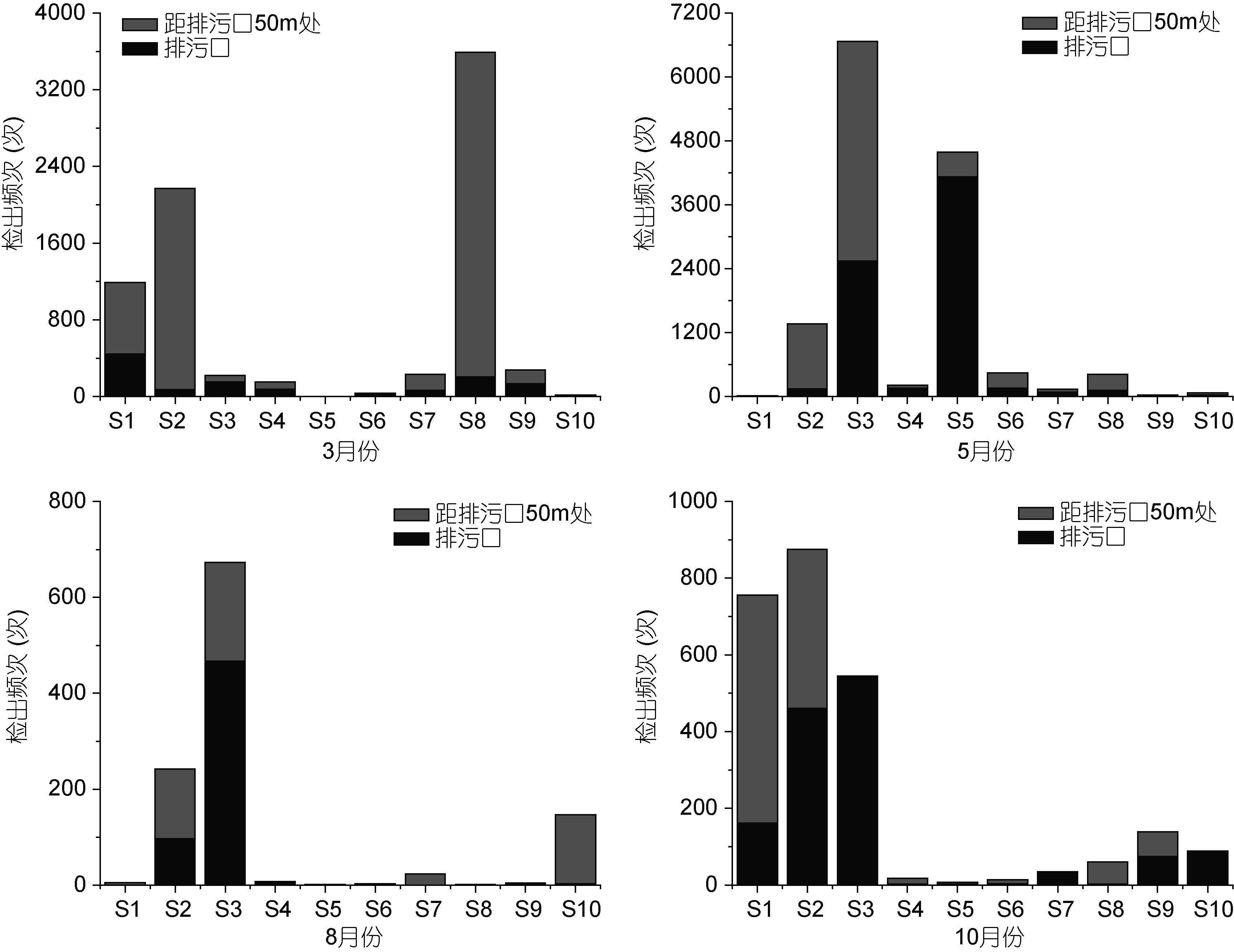 |
| 图 5 弓形杆菌属各月份的分布情况 Fig. 5 Distribution of Arcobacter in each month |
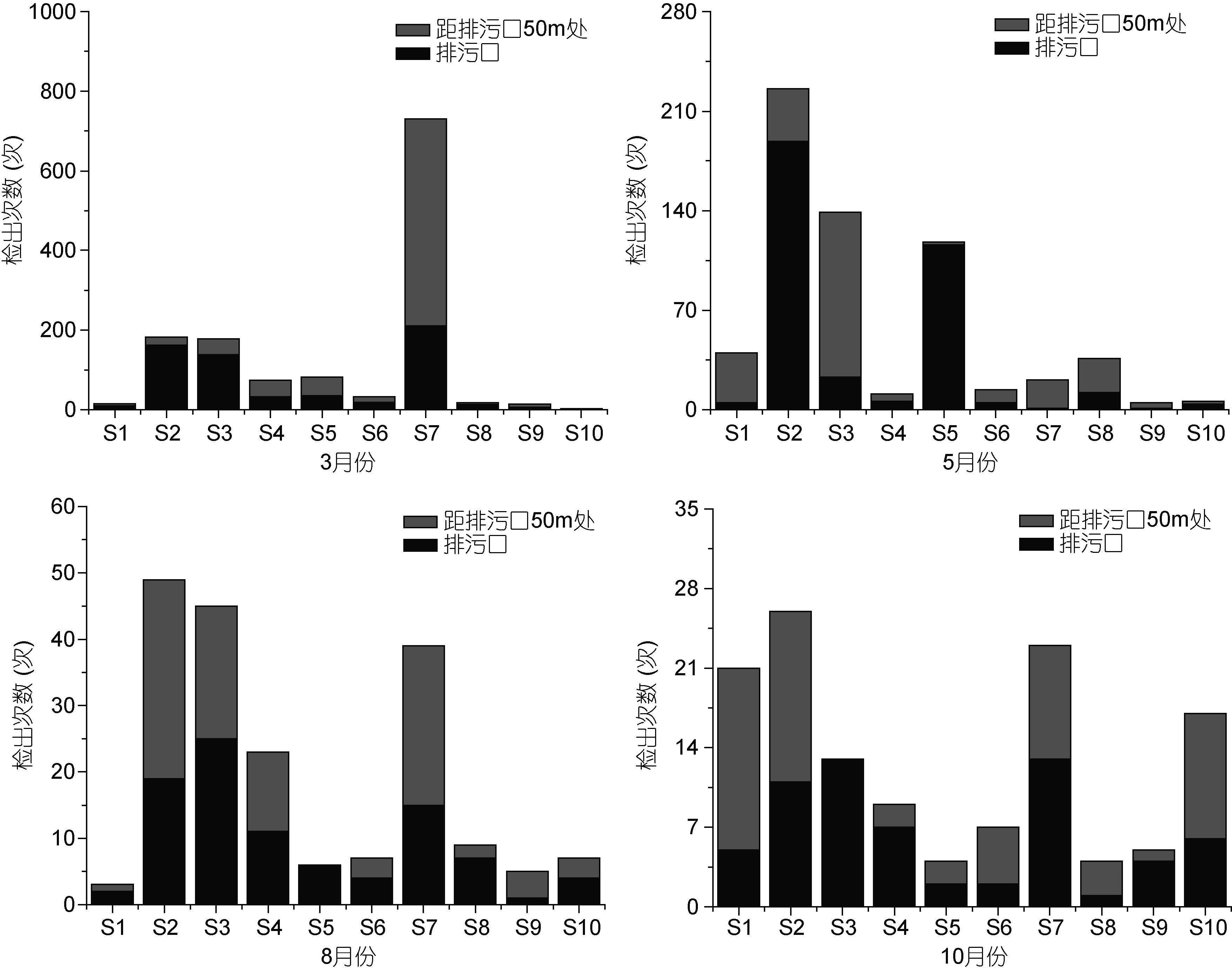 |
| 图 6 梭菌属各月份的分布情况 Fig. 6 Distribution of Clostridium in each month |
弓形杆菌属最适生长温度为25—30°C,在37°C和42°C下生长不良,4°C下几乎不生长(毕水莲等,2013),2011年宁波5月份日均最低温度为17°C,最高温度为25°C,另外S5排污口属于工业型排污口,污染物中含有大量的无机氮和活性磷酸盐,从而造成弓形杆菌属的大量生长,其在5月份,S5排污口的检出量明显高于其它月份。宁波8月份日均最低温度为25°C,日均最高温度为32°C,但是由于高温使部分企业停工,污水排放量减少,没有造成弓形杆菌属大量繁殖(谢利等,2016)。梭菌属适宜生长温度范围较广,为10—65°C,其在3月份,S7号排污口检出量最多,S7号排污口为工业型排污口,污染物中含有大量的氮、磷,有利于梭菌属的生长。但是梭菌属不适宜在水中生长,主要广泛存在于土壤,淤泥及人和动物肠道中(Stewart et al,1990; 邓志爱等,2006),所以各个月份与弓形杆菌属相比检出量均较低。
弓形杆菌属是一类人畜共患的食源性和水源性病原菌(Ho et al,2006),可导致人类胃肠炎和菌血症,引起的胃肠炎的临床病症与弯曲杆菌病类似(毕水莲等,2009)。低温弓形杆菌和布氏弓形杆菌主要寄生在动物性食物中,尤其是鸡肉(Rivas et al,2004),其中布氏弓形杆菌被认为造成腹泻疾病的第四大病原菌(Ferreira et al,2014),梭菌属主要通过外毒素的方式,引起人畜共患病,例如产气荚膜可共产生12种毒素,主要造成人畜肠胃患病(陈小云,2005),而肉毒梭菌易于通过污染食物而引起人畜患病。因此,采取以预防为主的手段是非常必要的,可以从消灭或者减少食物链中的弓形杆菌属和梭菌属入手,按照不同菌种在不同月份的生长特点对排污口进行重点监控。
3 结论利用454高通量测序技术发现,宁波沿海2个重点排污口、8个一般排污口的20个站位的弓形杆菌属有2个种和梭菌属有12个种。弓形杆菌属比较适合在工业型和市政型污水生长,而梭菌属只有3月份的S7号排污口检出量较高,其它排污口均较低。弓形杆菌属和梭菌属的分布与排污口的类型有着较密切的联系,相同类型的排污口有着高度相似分布特点。季节性不同而引起的温度差异,也会引起两种微生物生长状态的变化,弓形杆菌属受温度影响较大,梭菌属适宜生长温度范围较大,而且两者的分布数据呈现正相关性。弓形杆菌属和梭菌属都容易通过水源和食物链危害人类健康,弓形杆菌属容易造成人体肠胃炎和腹泻等疾病,梭菌属可以造成多种由其外毒素引起的疾病,如破伤风,恶性水肿和肠毒血症等疾病,所以应该依照不同季节和不同类型的排污口针对性地对两种微生物进行监控和治理,防止污染水体和其它水生生物。
| 王中华, 徐茂琴, 谢利, 等. 2014. 宁波沿海陆源排污口拟杆菌(Bacteroidetes)分布的特点. 海洋与湖沼, 45 (5) : 1030–1036 |
| 王想霞, 杜俊甫, 麻顺广. 2000. 濮阳市肉毒梭菌生态分布的研究. 中国公共卫生, 16 (3) : 282 |
| 邓志爱, 李孝权, 李钏华, 等. 2006. 食品中产气荚膜梭菌的分离鉴定与基因分型. 热带医学杂志, 6 (6) : 682–684 |
| 许小红, 吴春笃, 宁德刚, 等. 2009. 菜市场污水中细菌多样性检测分析. 中国公共卫生, 25 (6) : 731–733 |
| 毕水莲, 李琳, 唐书泽, 等. 2009. 变形杆菌属食物中毒的特点与防控措施. 现代食品科技, 25 (6) : 690–695 |
| 毕水莲, 孟赫诚. 2013. 致病性弓形杆菌属生物学特性及诊断研究进展. 现代食品科技, 29 (1) : 211–214 |
| 张迪骏, 李春丽, 周君, 等. 2013. 宁波沿海陆源排污口细菌结构多样性和铁代谢相关的毒力基因的研究. 海洋与湖沼, 44 (6) : 1627–1635 |
| 陈小云, 关孚时, 张存帅, 等. 2005. 产气荚膜梭菌主要外毒素最新研究进展. 中国兽药杂志, 39 (6) : 29–33 |
| 陈丽萍, 侯付景, 张迪骏, 等. 2013. 宁波沿海陆源排污口假单胞菌属(Pseudomonas)分布特点. 海洋与湖沼, 44 (4) : 926–930 |
| 郭占景, 王生平, 狄振宇, 等. 2010. 石家庄市肉毒梭菌在环境中的分布研究. 中国食品卫生杂志, 22 (6) : 549–551 |
| 游淑珠, 王小玉, 胡松楠, 等. 2011. 食品中弓形菌16S rRNA特异性扩增检测方法的建立. 食品科技, 36 (10) : 293–296 |
| 谢利, 王朝阳, 张迪骏, 等. 2016. 宁波沿海陆源排污口蓝藻(Cyanobacteria)和裸藻纲(Euglenoidea)生物的分布特点. 海洋与湖沼, 47 (1) : 188–194 |
| Ferreira S, Queiroz J A, Oleastro M, et al. 2014. Genotypic and phenotypic features of Arcobacter butzleri pathogenicity. Microbial Pathogenesis, 76 : 19–25 DOI:10.1016/j.micpath.2014.09.004 |
| Ho H T K, Lipman L J A, Gaastra W. 2006. Arcobacter, what is known and unknown about a potential foodborne zoonotic agent!. Veterinary Microbiology, 115 (1-3) : 1–13 DOI:10.1016/j.vetmic.2006.03.004 |
| Houf K, Stephan R. 2007. Isolation and characterization of the emerging foodborn pathogen Arcobacter from human stool. Journal of Microbiological Methods, 68 (2) : 408–413 DOI:10.1016/j.mimet.2006.09.020 |
| Levican A, Collado L, Figueras M J. 2013. Arcobacter cloacae sp. nov. and Arcobacter suis sp. nov., two new species isolated from food and sewage. Systematic and Applied Microbiology, 36 (1) : 22–27 |
| Rivas L, Fegan N, Vanderlinde P. 2004. Isolation and characterisation of Arcobacter butzleri from meat. International Journal of Food Microbiology, 91 (1) : 31–41 DOI:10.1016/S0168-1605(03)00328-3 |
| Sheffield J S, Ramin S M. 2004. Tetanus in pregnancy. American Journal of Perinatology, 21 (4) : 173–182 DOI:10.1055/s-2004-828605 |
| Stewart C F, Arbuck S G, Fleming R A, et al. 1990. Changes in the clearance of total and unbound etoposide in patients with liver dysfunction. Journal of Clinical Oncology, 8 (11) : 1874–1879 |
| Wang Z H, Yang J Q, Zhang D J, et al. 2014. Composition of microbial communities in industrial drain outlets. Journal of Pure and Applied Microbiology, 8 (1) : 807–815 |
 2016, Vol. 47
2016, Vol. 47

