
中国海洋湖沼学会主办。
文章信息
- 巴秋爽, 李雪, 刘妍, 代存芳, 范亚文. 2016.
- BA Qiu-Shuang, LI Xue, LIU Yan, DAI Cun-Fang, FAN Ya-Wen. 2016.
- 扎龙湿地藻类植物群落结构特征及水质初步评价
- ALGAL COMMUNITY STRUCTURE AND WATER QUALITY EVALUATION IN ZHALONG WETLAND
- 海洋与湖沼, 47(5): 924-934
- Oceanologia et Limnologia Sinica, 47(5): 924-934.
- http://dx.doi.org/10.11693/hyhz20160300058
-
文章历史
- 收稿日期:2016-03-17
- 收修改稿日期:2016-06-06
湿地作为地球上物种资源多样性最高的生态系统, 与森林、海洋并称为全球三大系统, 是水资源、陆地系统、动植物等的综合体, 不但有许多重要的功能, 还具有无法代替的生态价值、经济价值和社会价值(万忠娟等, 2003; 种国旗, 2012)。水生生态系统是湿地的重要组成部分, 对于维持湿地生态功能具有举足轻重的作用(武安泉, 2015)。近年来, 湿地因其特有的生态学效应受到国内外学者的广泛关注(Zhang et al, 2010)。不同类型水体在水动力学因素(流速、水深、滞留时间等)、营养盐浓度以及气象条件(光照等)等方面都存在显著差异(Montecino et al, 1982), 而藻类作为湿地系统中的初级生产者, 同时也是水环境中的重要指示生物, 受水环境影响, 其群落物种组成和物种多样性会响应水体类型的改变而发生相应的变化(Büsing, 1998; Díaz-Pardo et al, 1998; 赵怡冰等, 2002; 杨浩等, 2012)。
扎龙湿地位于黑龙江省松嫩平原西部, 地处乌裕尔河、双阳河下游, 面积为21万hm2, 地理坐标为46°52′—47°32′N, 123°47′—124°37′E。扎龙湿地是我国北方同纬度地区保留最完整、最原始、最开阔的湿地生态系统, 是许多生物尤其是重要鸟类和珍稀水禽的理想繁殖和栖息地, 是国际重要的珍稀鹤类迁徙、繁殖基地, 被誉为丹顶鹤的故乡, 1992年被列入国际重要湿地名录(Mitsch et al, 1993)。扎龙湿地最大的作用就是和嫩江以西的湿地一起形成过渡带, 保护石油基地大庆和东北粮仓的所在地—松嫩平原(王雪松, 2008), 具有极其重要的生态价值和经济价值。
近几十年来, 气候变化以及随着人口和社会经济的迅速发展导致的水资源、土地资源利用, 都对扎龙湿地的水环境、生物多样性以及生态功能产生了明显的胁迫作用(Kadlee et al, 1996; 郭跃东等, 2003)。目前, 对扎龙湿地藻类植物群落结构特征及其环境相关性的研究相对较少, 仅见于周晏敏(1993)、李晶(2012)和于洪贤等(2012)的报道。为进一步探究扎龙湿地藻类植物群落结构的变化特征及其与水环境的关系, 本文对扎龙湿地2011年春、夏、秋季的藻类植物群落结构进行研究, 以期为扎龙湿地的资源调查、生态环境的评价及保护提供依据。
1 材料与方法 1.1 采样时间和样点分布本研究于2011年的春、夏、秋三季对扎龙湿地分别进行了藻类植物标本的采集。根据生态环境的分布特点, 在研究区域内共设置了9个采样点:木桥广场(SⅠ)、丹顶鹤养殖区附近(SⅡ)、神鹤湖(SⅢ)、鹤侣桥(SⅣ)、扎龙湖南岸(SⅤ)、扎龙湖北岸(SⅥ)、扎龙湖西岸(SⅦ)、扎龙湖中心(SⅧ)和扎龙湖东岸(SⅨ)。具体生境类型包括开阔型水体(木桥广场SⅠ)、小型封闭水体(丹顶鹤养殖区附近SⅡ)、湿地型水体(神鹤湖SⅢ和鹤侣桥SⅣ)和湖泊型水体(扎龙湖南岸SⅤ、扎龙湖北岸SⅥ、扎龙湖西岸SⅦ、扎龙湖中心SⅧ和扎龙湖东岸SⅨ)。采样点分布见图 1。
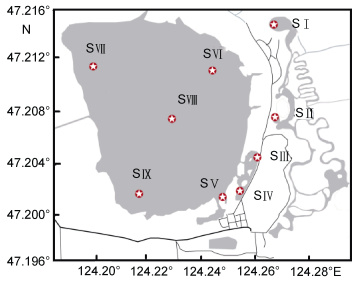 |
| 图 1 扎龙湿地采样点位图 Fig. 1 Sampling sites in the Zhalong Wetland 注: SⅠ:木桥广场; SⅡ:丹顶鹤养殖区附近; SⅢ:神鹤湖; SⅣ:鹤侣桥; SⅤ:扎龙湖南岸; SⅥ:扎龙湖北岸; SⅦ:扎龙湖西岸; SⅧ:扎龙湖中心; SⅨ:扎龙湖东岸 |
藻类植物的样品采集分为定性采集和定量采集两种。定性样品(包括浮游和固着两种形式)按常规浮游生物调查方法(Jin et al, 1990)进行采集, 浮游样品用25号浮游生物网在水体表面以下0.5米处做“∞”字形往复捞取; 固着样品的采集主要使用镊子、牙刷等工具刮取附着在水草、石头等基质上的附着物, 所有采集的藻类植物样品均在现场用5%的甲醛固定液进行固定。定量样品的采集用有机玻璃采水器采集1L水样, 现场加入鲁格氏液固定, 带回实验室后, 沉淀48h, 浓缩至30mL, 取0.1mL浓缩样品于浮游生物计数框中在MoticBA200显微镜(北京翔天智远科技有限公司, 中国)下根据相关文献(沈韫芬等, 1990; Krammer et al, 1997a, 1997b, 1997c, 1997d; 胡鸿钧等, 2006; 王全喜等, 2008; 胡鸿钧, 2011)对所有定性、定量藻类植物样品进行种类的鉴定并计数, 硅藻样品经强酸处理后进行封片标本观察。水温(WT)、pH等环境参数用KL-009Ⅲ笔式高精度酸度计(上海五宏交通设施制品厂)进行现场测定, 用DDB-11APortable便携式数字电导率仪(上海耶茂仪器仪表有限公司)测定电导率。生物需氧量(BOD)、化学需氧量(COD)、总氮(TN)、总磷(TP)浓度用DRB200型数字反应器(哈希公司, 美国)测定; 溶解氧(DO)浓度用Hydrolab多参数水质分析仪(哈希公司, 美国)测定。
1.3 数据分析与处理 1.3.1 α多样性分析(1) Shannon-Wiener多样性指数 H′=–∑(ni/N) log2(ni/N)
(2) Margalef丰富度指数 D=(S–1)/lnN
(3) Pielou均匀度指数 J=H′/lnS
(4) Simpson生态优势度指数 D=1–∑(ni/N)2
式中, ni为i种的数量, N为所有种类总个体数, S为物种数(Hunter et al, 1988; Belaoussoff et al, 2003)。
1.3.2 优势种的确定优势种根据调查的藻类植物每个种的优势度值(Y)来确定:

式中, ni为i种的个体数, N为所有种类总个体数, fi为该种出现的频率。Y值大于0.02的为优势种(陈亚瞿等, 1995; 徐兆礼等, 1995; 孙翠慈等, 2006)。
1.3.3 聚类分析采用聚类分析和多维尺度分析(Multidimensional scaling, MDS)两种多元统计分析方法, 运用大型多元统计分析软件PRIMER5.0对藻类植物群落结构特征进行分析, 以春、夏、秋三个季节9个样点的藻类植物物种和各物种的细胞密度为原始数据矩阵, 以各采样点藻类植物的种类及细胞密度为矩阵变量, 为排除藻类植物稀有种对实验结果的影响, 本分析中选取藻类细胞相对丰度至少在一个采样点要大于1%的种类进行分析。
2 结果与分析 2.1 扎龙湿地环境因子变化扎龙湿地属温带大陆性季风气候, 季节变化明显, 除pH外, 其它环境因子均呈现出明显的季节变化。营养盐浓度呈现出夏季 > 秋季 > 春季的状态(表 1)。环境因子的空间变化见图 2。从图 2中可见, 除水温(WT)和pH值在各季的生境间差异不明显外, 其它环境因子在各季的采样点间均差异显著。根据中国水质指标的营养分类标准(金相灿等, 1995), 综合TN、TP浓度, 表明本研究区域大部分处于贫-中营养状态。
| 环境因子 | 春季 | 夏季 | 秋季 | |||||
| 平均 | 范围 | 平均 | 范围 | 平均 | 范围 | |||
| WT(℃) | 16.8 | 14.8—18.0 | 22.0 | 20.6—23.5 | 9.3 | 8.3—10.5 | ||
| pH | 7.16 | 6.86—7.40 | 7.40 | 7.00—7.88 | 8.06 | 7.64—8.26 | ||
| SpCond(μs/cm) | 403.6 | 280.0—631.0 | 309.1 | 232.0—425.0 | 281.8 | 261.0—450.0 | ||
| DO(mg/L) | 6.69 | 5.60—7.40 | 4.64 | 2.30—5.80 | 5.78 | 4.80—6.80 | ||
| CODMn(mg/L) | 7.38 | 6.83—8.21 | 12.09 | 7.21—15.30 | 10.02 | 3.02—14.30 | ||
| BOD(mg/L) | 8.99 | 7.04—10.50 | 10.26 | 7.17—12.40 | 7.96 | 5.63—9.30 | ||
| CODCr(mg/L) | 31.63 | 29.10—39.70 | 34.38 | 25.70—42.10 | 23.81 | 20.30—32.50 | ||
| TN(mg/L) | 0.806 | 0.759—0.923 | 1.031 | 0.696—1.250 | 1.148 | 0.978—1.210 | ||
| TP(mg/L) | 0.022 | 0.012—0.032 | 0.086 | 0.076—0.098 | 0.066 | 0.026—0.088 | ||
| 注: WT:水温; pH:酸碱度; SpCond:电导率; DO:溶解氧; CODMn:高锰酸盐指数; BOD:生物需氧量; CODCr:化学需氧量; TN:总氮; TP:总磷 | ||||||||
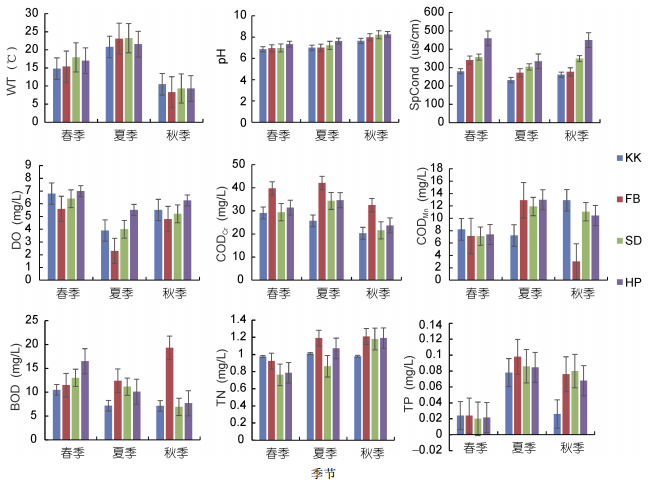 |
| 图 2 环境因子的空间变化 Fig. 2 Spatial distribution of environmental variables 注: KK代表开阔型水体; FB代表小型封闭水体; SD代表湿地型水体; HP代表湖泊型水体 |
研究结果显示, 扎龙湿地藻类植物种类组成丰富, 共鉴定出藻类植物349个分类单位(包括变种、变型), 隶属于8门12纲19目38科105属(图 3), 绿藻和硅藻是藻类植物群落的最主要类群, 其中绿藻门45属134种11变种, 占藻类植物总数的41.55%;硅藻门32属96种16变种, 占藻类植物总数的32.56%;藻类植物群落结构呈现绿-硅藻型的规律。此外, 蓝藻和裸藻在群落组成上均有一定的贡献。在四种不同类型的水体中, 藻类植物的组成成分明显不同(表 2)。在开阔型水体中共发现藻类植物61属137种; 在小型封闭水体中共鉴定出藻类植物68属165种; 在湿地型水体中共鉴定出藻类植物84属274种; 而在湖泊型水体中共检测出藻类植物83属292种。
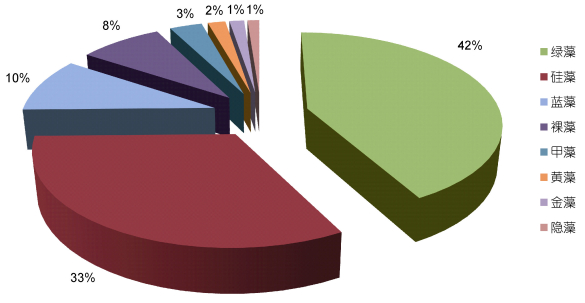 |
| 图 3 藻类植物种类构成 Fig. 3 Composition of algae species |
| 水体类型 | 绿藻 | 硅藻 | 裸藻 | 蓝藻 | 金藻 | 黄藻 | 甲藻 | 隐藻 | 总共 |
| 开阔型水体 | 60 | 42 | 15 | 13 | 3 | 2 | 1 | 1 | 137 |
| 小型封闭水体 | 72 | 48 | 19 | 17 | 4 | 1 | 3 | 1 | 165 |
| 湖泊型水体 | 127 | 87 | 18 | 21 | 5 | 5 | 7 | 4 | 274 |
| 湿地型水体 | 128 | 96 | 26 | 24 | 3 | 1 | 10 | 4 | 292 |
表 3所示的是研究期间各类型生境优势种的组成及分布。春季, 研究区域藻类植物主要以长锥形锥囊藻(Dinobryon bavaricum)占优势; 夏季优势种的分布比较多样化, 主要为隐头舟形藻, 其次为旋转囊裸藻(Trachelomonas volvocina); 秋季占优势的为弯棒杆藻和梅尼小环藻(Cyclotella meneghiniana)。
| 类别 | 优势种 | 开阔型水域 | 小型封闭水域 | 湿地型水域 | 湖泊型水域 | |||||||||||
| 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | |||||
| 绿藻 | 旋转囊裸藻Trachelomonas volvocina | + | + | + | + | |||||||||||
| 四尾栅藻Scenedesmus quadricauda | + | + | + | + | ||||||||||||
| 湖生卵囊藻Oocystis lacustris | + | + | ||||||||||||||
| 镰形纤维藻Ankistrodesmus falcatus | + | + | + | |||||||||||||
| 硅藻 | 弯棒杆藻Rhopalodia gibba | + | + | + | + | + | ||||||||||
| 隐头舟形藻Navicula cryptocephala | + | + | + | + | ||||||||||||
| 梅尼小环藻Cyclotella meneghiniana | + | + | ||||||||||||||
| 波罗的海胸膈藻Mastogloia baltica | + | |||||||||||||||
| 甲藻 | 微小多甲藻Peridinium pusillum | + | + | + | ||||||||||||
| 威氏多甲藻Peridinium willer | + | + | ||||||||||||||
| 埃宁顿拟多甲藻Peridiniopsis cunningtonii | + | + | ||||||||||||||
| 金藻 | 长锥形锥囊藻Dinobryon bavaricum | + | + | + | + | |||||||||||
| 裸藻 | 尾裸藻Euglena caudata | + | + | + | + | |||||||||||
| 注: “+”代表优势种出现 | ||||||||||||||||
扎龙湿地采样点间藻类植物的细胞密度存在差异, 变化范围在11.41×104—23.30×104ind./L之间, 不同生境类型采样点的平均细胞密度也不尽相同(图 4)。开阔型水体的平均细胞密度为5.67×104ind./L, 小型封闭水体的平均细胞密度为15.60×104ind./L, 湿地型和湖泊型水体的平均细胞密度分别为10.70× 104ind./L和10.92×104ind./L。其中, 采样点SⅠ中藻类植物的细胞密度最低, 为5.67×104ind./L; 采样点SⅡ中藻类植物的细胞密度最高, 为15.60×104ind./L; 参考况琪军等(2005)利用藻类植细胞密度进行水质评价, 小型封闭水体、开阔型水体、湿地型和湖泊型水体均为极贫营养型; 藻类植物平均细胞密度的高峰值出现在夏季, 其次是春季和秋季, 整体呈现夏季高, 春、秋季低的特点。
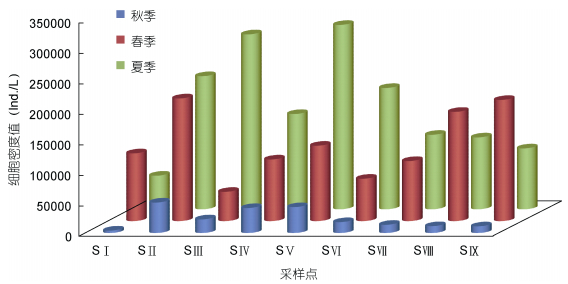 |
| 图 4 藻类植物细胞密度季节变化 Fig. 4 Seasonal variation in algal density |
应用Shannon-Wiener多样性指数、Margalef丰富度指数、Pielou均匀度指数和Simpson生态优势指数对扎龙湿地藻类植物群落结构进行分析, 不同生境的各种水体类型的多样性指数如图 5所示。Shannon-Wiener多样性指数的变化范围从大到小依次为:湖泊型水体 > 湿地型水体 > 开阔型水体 > 小型封闭水体; Margalef丰富度指数的变化范围从大到小依次为:湖泊型水体 > 湿地型水体 > 开阔型水体 > 小型封闭水体; Pielou均匀度指数的变化范围从大到小依次为:开阔型水体 > 湖泊型水体 > 小型封闭水体 > 湿地型水体; Simpson生态优势指数的变化范围从大到小依次为:湿地型水体 > 开阔型水体 > 湖泊型水体 > 小型封闭水体。
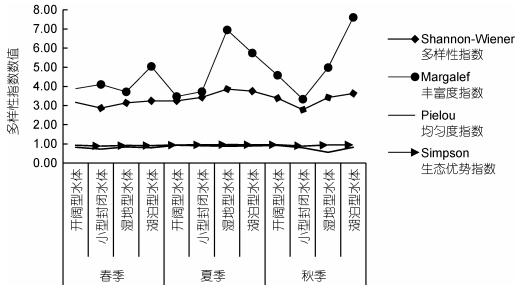 |
| 图 5 多样性指数季节变化 Fig. 5 The seasonal variation of diversity index |
Margalef丰富度指数、Shannon-Wiener多样性指数和Pielou均匀度指数均显示出明显的季节差异, 丰富度指数和多样性指数均表现为夏季 > 秋季 > 春季, 当夏季来临时, 丰富度指数和多样性指数开始升高, 达到全年最高值; 夏季过后, 数值逐渐下降。夏季的丰富度指数和多样性指数均高于其他季节。与多样性指数和丰富度指数相比, Pielou均匀度指数的季节变化规律略有不同:春季 > 秋季, 最低值(SⅣ)出现在秋季, 最高值仍出现在夏季。而Simpson生态优势指数各个季节的差异性较小。
物种多样性是衡量群落中物种组成的稳定程度及其数量分布的均匀程度和群落结构特征的重要营养指标(李然然等, 2014)。Shannon-Wiener多样性指数和Pielou均匀度指数评价标准为其指数值越高, 则代表水质条件越好, 即群落结构的复杂程度与其稳定性呈正相关。本次研究的四种生境类型水体的Shannon-Wiener多样性指数均 > 3, 表明这四种生境类型的水体均为轻或无污染; 开阔型水体和小型封闭水体的Margalef丰富度指数处于3—4, 表明水质呈中度污染状态, 而湿地型水体和湖泊型水体均 > 5, 表明其水质良好, 为清洁水体; 四种生境类型水体的Pielou均匀度指数均在0.5—0.8之间, 呈轻污染或无污染状态(Kolasa et al, 1991)。根据多样性指数可以初步推断扎龙湿地的水体基本处于轻度污染或无污染状态。
2.4 群落分布聚类分析和多维标度分析Ortega-Mayagoitia等(2003)认为, 聚类分析能将无序个体按相似程度归类, 结构图直观明了, 近年来在生态环境领域备受青睐。为了解扎龙湿地内9个采样点藻类植物群落结构特点及群落间的相似性程度, 对其进行聚类分析, 得到9个采样点在春、夏、秋三季的聚类树状图(图 6)和多维标度分析(MDS)排序图(图 7)。聚类结果表明, 类群内各水域藻类植物群落的相似性较高, 类群间差异明显。从图 6可以看出, 春季开阔型水域和小型封闭水域群落结构相似, 以长锥形锥囊藻、镰形纤维藻、威氏多甲藻(Peridinium willei)为优势种。位于神鹤湖的湿地型水体, 四尾栅藻在此处密集, 细胞丰度为4.8×104ind./L。湿地型水体和扎龙湖的湖泊型水体相似, 此区域人为活动较少, 营养盐结构相似, 群落结构比较接近, 这两个水体优势种为长锥形锥囊藻和四尾栅藻。
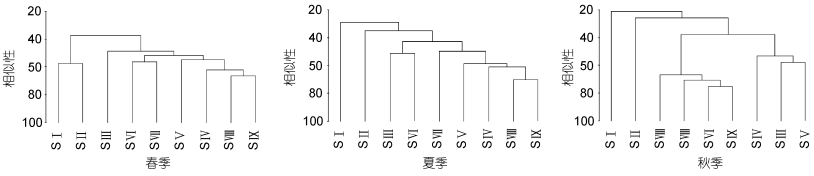 |
| 图 6 扎龙湿地春、夏、秋藻类植物群落相似性聚类图 Fig. 6 Cluster dendrogram of algae community in Zhalong Wetland in spring, summer, and autumn |
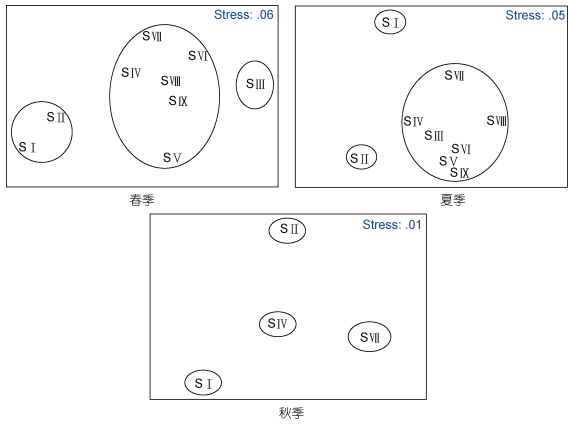 |
| 图 7 扎龙湿地春、夏、秋藻类植物群落相似性MDS排序图 Fig. 7 MDS ordination of algae community in Zhalong Wetland in spring, summer, and autumn |
夏季的群落结构与春季有所不同。夏季湿地水温升高, 雨量增加, 营养盐输入开始增强, 使喜温种的数量增加, 聚类划分的三个区域之间藻类植物群落组成差异性显著。开阔型水域与湿地内其它水体距离较远, 因水面开阔, 芦苇丛生, 此处细胞密度也较低, 为5.5×104ind./L, 种类组成大部分为清水种, 如月形短缝藻(Eunotia lunaris)、四眼鼓藻(Cosmarium tetraophthalmum)等。湿地型水体和湖泊型水体的群落结构划分为一区, 此区细胞密度大, 藻类植物群落组成的相似性较高, 群落结构最复杂, 隐头舟形藻和旋转囊裸藻是这个区域的优势种, 湖生卵囊藻(Oocystis lacustris)细胞密度也比较大。小型封闭水域为一区, 这个区水域面积小、水体封闭, 细胞密度较大, 为21.8×104ind./L。该水域位于丹顶鹤养殖区附近, 丹顶鹤等大型水禽常在此处活动, 受其粪便等污染物影响较大。
秋季的群落结构区域划分类似于夏季, 分开阔型水体、小型封闭水体、湿地型水体及湖泊型水体四个群体, 湖泊型水体的5个采集地藻类植物群落相似程度最高, 优势种为湖生卵囊藻、四尾栅藻, 旋转囊裸藻和隐头舟形藻。湿地型水体和小型封闭水体优势种均为梅尼小环藻、弯棒杆藻, 小型封闭水体细胞密度最高, 但与夏季相比有大幅度下降。其余区域细胞密度无大幅度波动, 整体看来都远小于夏季。
从MDS多维尺度分析图(图 7)中可以看出, 2011年春、夏、秋的排序中, 应力系数均小于0.1, 吻合很好, 说明MDS分析排序图可以准确有效的解释四种水体之间的关系, 为了能更直观的观察各分组之间的藻类植物群落组成, 将不同聚类分析组进行了线性圈画。扎龙湿地大体可分为开阔型水域、小型封闭水域、湿地型水域、湖泊型水域四个主要生态类群。不同的植被生境、水体流速、湿地水体空间分布次序等空间异质性, 导致了该湿地藻类植物群落的差异性, 这四大类群在距离测度值上相差不明显, 但基本反映了水体在空间上各阶段的变化历程。其结果与聚类分析结果一致, 从二维角度证明了聚类分析的结论, 支持了聚类分析的结果。
3 讨论 3.1 藻类植物群落结构变化特征藻类植物的空间异质性由水体理化特性(如局部水动力、营养盐、温度及光照透明度等)和生态过程造成(Martin et al, 2003; Seuront et al, 2005; Pinel-Alloul et al, 2007), 现已被认为是水生生态系统存在的一个普遍特征, 它对生态系统的稳定性、多样性和水质状况等有重要的影响。水深、透明度和温度对藻类植物生长及群落结构组成有极大的影响(盛海燕等, 2010; 陈立婧等, 2011)。扎龙湿地属温带大陆性季风气候, 季节变化明显, 其藻类植物种类和类群组成丰富, 研究期间共鉴定出藻类植物349个分类单位, 隶属于8门12纲19目38科105属, 绿藻和硅藻是藻类植物群落的最主要类群, 藻类植物群落结构春、夏、秋三季均呈现绿-硅藻型。
水位作为重要的水文因子影响着藻类植物的群落结构, 它直接或间接地通过食物链影响藻类植物的种类组成(史为良等, 1984; 邬红娟等, 1995)。根据扎龙湿地生境特点, 将扎龙湿地研究区域分为开阔型水域、小型封闭水域、湿地型水域和湖泊型水域四个生态类型, 不同水域藻类植物群落结构特征明显不同。湖泊型水体包括了湿地中扎龙湖的主要范围, 水位较其它区域高, 利于沿岸带沉水植物的生长, 为鱼类提供了广阔的繁殖和索饵场所, 该水域鱼类种群规模增加, 强化了对浮游动物的摄取, 减轻了对藻类植物的摄食压力, 因此湖泊型水体中藻类植物种类丰富。开阔型水体位于湿地内木桥广场处, 此处水域开阔, 具大片芦苇生长, 各种藻类分布均匀, 生化耗氧量和化学需氧量均在此水域出现最低值, 这与其水域面积广阔、水量大、营养物质不易富集且生长有芦苇等大量挺水植物, 能够有效净化水体等密切相关, 该水域的平均细胞密度仅为5.67×104ind./L, 在所有水域中最低, 出现的优势种为镰形纤维藻、弯棒杆藻、长锥形锥囊藻等, 其中锥囊藻一般生长在透明度较大, 有机质含量低的水体中, 为贫营养指示种。而小型封闭水体位于鹤类养殖区附近, 在一定程度上受到鹤类和人类活动的影响, 容易富集由河流、鸟类粪便等携入的外源性营养物质, 受有机污染严重, 大量的有机物质会加速藻类植物的代谢活动(孙翠慈等, 2006)。小型封闭水体的总氮和总磷浓度最高, 明显高于其它水域, 说明该水体已经受到了一定程度的污染, 且水中挺水植物较少, 水域面积小, 水体自净能力较差, 水体富营养化程度较为严重, 因此在春、夏、秋三季中均出现频率较大的谷皮菱形藻(Nitzschia palea)和隐头舟形藻(Navicula cryptocephala)等多为中污带的指示种; 同时由于其水体中氮、磷营养物质的含量高, 使水体中藻类植物的生长繁殖得到了相应的促进作用, 这也是小型封闭水体中藻类植物细胞密度大的原因之一。而湿地型水体相对开阔, 周围遍布小型沼泽、塔头, 环境条件复杂、多样性变化明显, 空间异质性高, 是一个生态交错区, 为生物生存提供了更多样的栖息环境, 因此其藻类植物种类组成数量和结构最为复杂。
一般情况下, 硅藻适宜生长在温度较低的春季, 或在光线较弱的秋季占据优势地位, 绿藻、蓝藻则容易在温度较高的夏季成为优势种类(Welch, 1980; Schabhüttl et al, 2013)。扎龙湿地水体水温的高低随季节变化明显, 夏季水温最高, 春季和秋季温度较低。藻类植物种类的变化呈现出明显的季节特征, 当夏季到来, 雨水增加、湿地水深增加、水温升高, 同时伴随着喜温藻类植物的大量繁殖, 表现为蓝藻门的固氮鱼腥藻、圆柱鱼腥藻(Anabaena cylindrica)、水华微囊藻(Microcystis flos-aquae)、铜绿微囊藻(Microcystis aeruginosa), 绿藻门的纤维藻类群(卷曲纤维藻(Ankistrodesmus convolutus)、镰形纤维藻、狭形纤维藻(Ankistrodesmus angustus)、针形纤维藻(Ankistrodesmus acicularis))和微小四角藻(Tetraёdron minimum)等偏爱夏季高温的种群大量出现, 虽未形成优势类群, 但也导致了水体透明度降低。春季和秋季水温相对较低, 光照强度也明显下降, 以致藻类植物生长速率维持在一个很低的状态, 甚至有一些藻类会同泥沙、石头等附着物沉下水底, 从而使水体透明度增加, 透光度也随之增大(方芳等, 2009), 此时, 好低温的硅藻类植物和长有鞭毛器官、具有运动功能的藻类植物可在该生态环境下生长并占据一定优势, 因此裸藻门的尾裸藻, 甲藻门的多甲藻类群(微小多甲藻(Peridinium pusillum)、威氏多甲藻、埃宁顿拟多甲藻(Peridiniopsis cunningtonii))和硅藻门的弯棒杆藻等多成为这两季的优势类群。扎龙湿地调查区域藻类植物优势度较高且大量出现的分类单位主要以金藻门的长锥形锥囊藻, 绿藻门的鼓藻属(Cosmarium)和角星鼓藻属(Staurastrum), 硅藻门的梅尼小环藻、钝脆杆藻(Fragilaria capucina)以及裸藻门的旋转囊裸藻和隐藻门的啮蚀隐藻(Cryptomonas erosa)为主, 这些种类通常分布在贫营养和中营养的水体中。有报道指出囊裸藻属(Trachelomonas)经常出现在中营养的浅水湖泊中(Philipose, 1988), 这些优势度较高的种类中仅有隐藻门的啮蚀隐藻常出现在富营养的水体环境中(Fernández et al, 2014)。虽然调查期间有富营养类型水体的种类出现, 如固氮鱼腥藻(Anabaena azotica)、拟短形颤藻(Oscillatoria subbrevis), 隆顶栅藻(Scenedesmus protuberans)等, 但这些藻类植物种属所占比例不大。因此, 通过扎龙湿地优势藻类植物群落的组成特点, 可以初步判断扎龙湿地的水体整体上基本处于贫营养到中营养的状态, 只有个别水域存在水体富营养化现象。
由于气候的季节变化导致水文和水体物理化学条件的改变, 也使藻类植物的种类组成和细胞密度产生明显的季节性节律(邬红娟等, 2001)。扎龙湿地藻类植物细胞密度随季节变化呈单周期型, 即每年受温度的影响, 在夏季形成一年中藻类植物的最高峰。这主要是由于扎龙湿地属温带大陆性季风气候, 四季变化分明, 夏季的平均水温(22℃)明显的高于春季(16.8℃)和秋季(9.3℃)。适宜的水温条件为大多数藻类提供了良好的生长繁殖条件, 使得喜温性的藻类植物大量快速生长, 尤其是有利于喜温的绿藻门和蓝藻门藻类植物的生长, 从而使夏季藻类植物生长的优势高于春、秋两季。而进入秋季后, 随着水温降低、光照强度减弱等条件影响, 在一定程度上抑制了藻类植物的生长, 从而使藻类植物的数量减少, 细胞密度的均值也随之降低。水体的酸碱度值主要反映为溶解于水体中的二氧化碳与水分子的反应, 生成碳酸, 继而分解出氢离子, 保持一定的电解平衡(陈亚瞿等, 1995), 从而影响水体的pH值变化。扎龙湿地水体基本呈碱性状态, pH值最高的水域位于扎龙湖中心的湖泊型水体(8.26), 其细胞密度相对较高, 在此区域发现了一些适合在碱性水体中生活的种类, 且优势度较高, 如弯棒杆藻、隐头舟形藻和颗粒直链藻极狭变种(Melosira granulata var. angustissima)。与历史数据相比, 本研究扎龙湿地藻类植物群落结构及优势种组成已经呈现出显著的差异, 既有交叉又有演替, 其演变总趋势为:藻类植物种类数量增加, 优势种除了四尾栅藻、梅尼小环藻保持不变外, 已由1988—1990年的颗粒直链藻和尖针杆藻演替为2011年的弯棒杆藻、隐头舟形藻和镰形纤维藻(周晏敏等, 1993)。
3.2 藻类植物群落多样性生物多样性指数是反映生物群落组成特征的重要参数。多样性指数越高, 表明群落中生物种类越多, 其自动调节能力越强, 群落越稳定, 越有助于维持生态平衡(马克平, 1994; 杨宏伟等, 2012)。在选择多样性指数来研究藻类植物时需要慎重考虑, 单纯使用一种多样性指数来解释藻类植物群落的多样性容易造成较大偏差(孙军等, 2004)。因此, 本研究应用Shannon-Wiener多样性指数、Margalef丰富度指数、Pielou均匀度指数和Simpson生态优势指数对扎龙湿地藻类植物群落结构进行了分析。在三个季节中夏季各项指数都高于其它季节。从不同水域的多样性指数来看, 湖泊型水体的Shannon-Wiener多样性指数均高于其他水体, 表明其生物多样性高, 对环境变化和群落内种群变动的缓冲功能强, 群落结构最为复杂, 水体处于贫营养状态; Margalef丰富度指数也表明湖泊型水体为清洁型水体。此外, 不同水域Simpson生态优势指数和Pielou均匀度指数均较高, 差异性较小, 表明复杂度较一致, 藻类植物群落内物种分布数量较均匀, 群落结构比较完整。总的来说, 扎龙湿地藻类群落结构比较丰富, 稳定性较好, 部分水域可能处于一定的污染状态。
藻类植物能够适应多变的环境条件, 容易成为水体主要种类, 并对环境有很好的指示作用, 具有较明显的响应特征, 既受环境因子的影响又能灵敏地反映环境的变化特征(Crossetti et al, 2013)。相比扎龙湿地其它研究结果, 2011年扎龙湿地水体中分布的藻类植物多为寡污带和中污带的种类, 且寡污带的藻类植物要明显多于中污带。据此, 我们可以推断扎龙湿地的水体基本处于贫营养-中营养状态, 只有极少数水域处于富营养状态。这与王泽斌等(2011)在利用藻类植物群落结构多样性指数方法对扎龙湿地的水体进行的检测结果相一致。谭景旺等(2013)利用浮游动物污染指数(IBP)对扎龙湿地的水质状况进行评价认为扎龙湿地水质总体上属于轻度污染, 临近β-中度污染; 易映彤等(2015)利用硅藻对扎龙湿地的水质营养状态进行评价, 得出扎龙湿地普遍处于中营养状态, 个别区域出现富营养的结论, 都与本文的研究结果基本一致, 即扎龙湿地研究区域内的水体基本处于贫营养-中营养状态, 只有个别水域存在轻微至中度污染, 说明近年来扎龙湿地的水体质量并未受到人为的或其他原因的严重破坏, 基本处于相对稳定的营养状态。
4 结论本研究在2011年春、夏、秋季对扎龙湿地9个点位进行藻类植物采集调查的基础上, 确定扎龙湿地的藻类植物群落结构特征, 利用聚类分析划分扎龙湿地藻类植物分布类型, 并对扎龙湿地水体进行了初步评价。主要结论如下:
(1) 调查期间, 扎龙湿地共检出藻类植物8门105属349个分类单位, 种类组成以绿藻和硅藻为主; 与1988—1990年相比, 藻类植物种属数量均呈上升趋势。在不同类型的水体中, 藻类植物的群落结构不同。藻类植物的细胞密度产生明显的单周期型季节性节律, 夏季形成最高峰; 细胞密度总体呈现出小型封闭水体最高, 开阔型水体最低, 湖泊型水体大于湿地型水体的特征。主要优势种由春季金藻门的长锥形锥囊藻演替为夏季硅藻门的隐头舟形藻和裸藻门的旋转囊裸藻, 秋季以硅藻门的弯棒杆藻和梅尼小环藻为优势类群。
(2) 聚类结果表明, 类群内各水域藻类植物群落的相似性较高, 类群间差异明显。扎龙湿地研究区域可分为开阔型水域、小型封闭水域、湿地型水域、湖泊型水域四个主要生态类群。综合运用藻类优势种群、藻类指示种、藻类细胞密度和多样性指数这几种方法评价扎龙湿地的水体, 表明扎龙湿地基本处于贫营养-中营养状态, 只有极少数水域处于富营养状态。
| 于洪贤, 赵菲, 2012. 扎龙湿地浮游植物群落结构特征与水质评价. 东北林业大学学报, 40 (11) : 99–101 |
| 万忠娟, 于少鹏, 王海霞, 等, 2003. 松嫩平原典型湿地脆弱性分析与评价. 东北师大学报自然科学版, 35 (2) : 93–99 |
| 马克平, 1994. 生物群落多样性的测度方法——I α多样性的测度方法(上). 生物多样性, 2 (3) : 162–168 |
| 王全喜, 曹建国, 刘妍, 等, 2008. 上海九段沙湿地自然保护区及其附近水域藻类图集. 北京: 科学出版社, 55-70 |
| 王泽斌, 马云, 李晶, 2011. 扎龙湿地浮游植物群落结构及多样性研究. 环境科学与管理, 36 (5) : 1–4 |
| 王雪松, 2008. 扎龙生态资源在生物教学与科研中的优势. 长春师范学院学报(自然科学版), 27 (1) : 140–143 |
| 方芳, 李哲, 田光, 等, 2009. 三峡小江回水区磷素赋存形态季节变化特征及其来源分析. 环境科学, 30 (12) : 3488–3493 |
| 史为良, 1984. 清河水库夏季水位降低引起的水质变化. 水产科学, (2) : 1–7 |
| 邬红娟, 胡传林, 1995. 黑龙滩水库夏季不同水位对鱼产量及浮游生物的影响. 水生生物学报, 19 (4) : 360–367 |
| 邬红娟, 郭生练, 2001. 水库水文情势与浮游植物群落结构. 水科学进展, 12 (1) : 51–55 |
| 孙军, 刘东艳, 2004. 多样性指数在海洋浮游植物研究中的应用. 海洋学报, 26 (1) : 62–75 |
| 孙翠慈, 王友绍, 孙松, 等, 2006. 大亚湾浮游植物群落特征. 生态学报, 26 (12) : 3948–3958 |
| 李晶, 祁佩时, 马云, 等, 2012. 扎龙湿地夏秋季浮游植物群落结构. 东北林业大学学报, 40 (5) : 86–90 |
| 李然然, 章光新, 张蕾, 等, 2014. 查干湖湿地浮游植物与环境因子关系的多元分析. 生态学报, 34 (10) : 2663–2673 |
| 杨浩, 曾波, 孙晓燕, 等, 2012. 蓄水对三峡库区重庆段长江干流浮游植物群落结构的影响. 水生生物学报, 36 (4) : 715–723 |
| 杨宏伟, 高光, 朱广伟, 2012. 太湖蠡湖冬季浮游植物群落结构特征与氮、磷浓度关系. 生态学杂志, 31 (1) : 1–7 |
| 况琪军, 马沛明, 胡征宇, 等, 2005. 湖泊富营养化的藻类生物学评价与治理研究进展. 安全与环境学报, 5 (2) : 87–91 |
| 沈韫芬, 章宗涉, 龚循矩, 等, 1990. 微型生物监测新技术. 北京: 中国建筑工业出版社, 119-139 |
| 陈立婧, 吴竹臣, 胡忠军, 等, 2011. 上海崇明岛明珠湖浮游植物群落结构. 应用生态学报, 22 (6) : 1599–1605 |
| 陈亚瞿, 徐兆礼, 王云龙, 等, 1995. 长江口河口锋区浮游动物生态研究Ⅰ生物量及优势种的平面分布. 中国水产科学, 2 (1) : 49–58 |
| 武安泉, 郭宁, 覃雪波, 2015. 寒区典型湿地浮游植物功能群季节变化及其与环境因子关系. 环境科学学报, 35 (5) : 1341–1349 |
| 易映彤, 李慧, 刘妍, 等, 2015. 扎龙国家级自然保护区硅藻植物特征及其环境指示作用. 湖泊科学, 27 (6) : 1035–1041 |
| 金相灿, 刘树坤, 章宗涉, 等, 1995. 中国湖泊环境. 北京: 海洋出版社, |
| 周晏敏, 朱桂香, 韩梅, 等, 1993. 应用浮游植物对扎龙自然保护区水质的初步评价. 干早环境监测, 7 (2) : 80–82 |
| 赵怡冰, 许武德, 郭宇欣, 2002. 生物的指示作用与水环境. 水资源保护, 16 (2) : 11–13, 16 |
| 胡鸿钧, 2011. 水华蓝藻生物学. 北京: 科学出版社, 63-94 |
| 胡鸿钧, 魏印心, 2006. 中国淡水藻类-系统、分类及生态. 北京: 科学出版社, 23-948 |
| 种国旗, 2012. 黑龙江省湿地保护法治问题研究. 哈尔滨: 东北林业大学, 3-5 |
| 徐兆礼, 王云龙, 陈亚瞿, 等, 1995. 长江口最大浑浊带区浮游动物的生态研究. 中国水产科学, 2 (1) : 39–48 |
| 郭跃东, 邓伟, 潘继花, 2003. 扎龙河滨湿地水体营养化污染特征及水环境恢复对策. 生态环境, 12 (4) : 393–397 |
| 盛海燕, 虞左明, 韩轶才, 等, 2010. 亚热带大型河流型水库-富春江水库浮游植物群落及其与环境因子的关系. 湖泊科学, 22 (2) : 235–243 |
| 谭景旺, 于洪贤, 2013. 夏季扎龙湿地底栖动物双向指示种(TWINSPAN)分类与水质生物监测. 水产学杂志, 26 (2) : 43–48 |
| Belaoussoff S, Kevan P G, Murphy S, et al, 2003. Assessing tillage disturbance on assemblages of ground beetles(Coleoptera: Carabidae) by using a range of ecological indices. Biodiversity and Conservation, 12 (5) : 851–882 DOI:10.1023/A:1022811010951 |
| Büsing N, 1998. Seasonality of phytoplankton as an indicator of trophic status of the large perialpine 'Lago di Garda'. Hydrobiologia, 369-370 : 153–162 DOI:10.1023/A:1017055523201 |
| Crossetti L O, Stenger-Kovács C, Padisák J, 2013. Coherence of phytoplankton and attached diatom-based ecological status assessment in Lake Balaton. Hydrobiologia, 716 (1) : 87–101 DOI:10.1007/s10750-013-1547-0 |
| Díaz-Pardo E, Vazquez G, López-López E, 1998. The phytoplankton community as a bioindicator of health conditions of Atezca Lake, Mexico. Aquatic Ecosystem Health and Management, 1 (3-4) : 257–266 DOI:10.1016/S1463-4988(98)00025-6 |
| Fernández C, Cáceres E J, Parodi E R, 2014. Phytoplankton development in a highly eutrophic man-made lake from the pampa plain of Argentina-a functional approach. International Journal of Environmental Research, 8 (1) : 1–14 |
| Hunter P R, Gaston M A, 1988. Numerical index of the discriminatory ability of typing systems: an application of Simpson's index of diversity. Journal of Clinical Microbiology, 26 (11) : 2465–2466 |
| Jin X C, Tu Q Y, 1990. Criterion of Eutrophication Survey on Lakes. Beijing: China Environmental Science Press, 21-111 |
| Kadlee R H, Knight R L, 1996. Treatment Wetlands. Boea Raton New York: Lewis Publishers, 5-134 |
| Kolasa J, Pickett S T A, 1991. Ecological Heterogeneity. New York: Springer Verlag, 1-332 |
| Krammer K, Lange-Bertalot H, 1997a. Bacillariophyceae. 1. Teil:Naviculaceae. Berlin: Spektrum Akademischer Verlag Heidelberg, 488-857 |
| Krammer K, Lange-Bertalot H, 1997b. Bacillariophyceae. 2. Teil:Bacillariophyceae, Epithemiaceae, Surirellaceae. Berlin: Spektrum Akademischer Verlag Heidelberg, 224-585 |
| Krammer K, Lange-Bertalot H, 1997c. Bacillariophyceae. 3. Teil:Centrales, Fragilariaceae, Eunotiaceae. Berlin: Spektrum Akademischer Verlag Heidelberg, 232-560 |
| Krammer K, Lange-Bertalot H, 1997d. Bacillariophyceae. 4. Teil:Achnanthaceae, Kritische Ergänzunge zu Achnanthes S.L., Navicula S. Str., Gomphonema Gesamtliteratur-verzeichnis Teil 1-4. Berlin: Spektrum Akademischer Verlag Heidelberg, 250-425 |
| Martin A P, 2003. Phytoplankton patchiness: the role of lateral stirring and mixing. Progress in Oceanography, 57 (2) : 125–174 DOI:10.1016/S0079-6611(03)00085-5 |
| Mitsch W J, Gosselink J G, 1993. Wetlands. New York: Van Nostrand Reinhold, 1-722 |
| Montecino V, Cabrera S, 1982. Phytoplankton activity and standing crop in an impoundment of central Chile. Journal of Plankton Research, 4 (4) : 943–950 DOI:10.1093/plankt/4.4.943 |
| Ortega-Mayagoitia E, Rojo C, Rodrigo M A, 2003. Controlling factors of phytoplankton assemblages in wetlands: an experimental approach. Hydrobiologia, 502 (1-3) : 177–186 DOI:10.1023/B:HYDR.0000004280.74279.74 |
| Philipose M T, 1988. Contributions to our knowledge of Indian algae-3. Euglenineae Part 3. The genera trachelomonas Ehrenberg and strombomonas deflandre. Proceedings: Plant Sciences, 98 (5) : 317–394 |
| Pinel-Alloul B, Ghadouani A, 2007. Spatial heterogeneity of planktonic microorganisms in aquatic systems. In: Franklin R B, Mills A L eds. The Spatial Distribution of Microbes in the Environment. Netherlands: Springer, 203-310 |
| Schabhüttl S, Hingsamer P, Weigelhofer G, et al, 2013. Temperature and species richness effects in phytoplankton communities. Oecologia, 171 (2) : 527–536 DOI:10.1007/s00442-012-2419-4 |
| Seuront L, 2005. Hydrodynamic and tidal controls of small-scale phytoplankton patchiness. Marine Ecology Progress Series, 302 : 93–101 DOI:10.3354/meps302093 |
| Welch E B, 1980. Ecological Effects of Waster Water. New York: Cambridge University Press, |
| Zhang L, Wang M H, Hu J, et al, 2010. A Review of published wetland research, 1991-2008: ecological engineering and ecosystem restoration. Ecological Engineering, 36 : 973–980 DOI:10.1016/j.ecoleng.2010.04.029 |
 2016, Vol. 47
2016, Vol. 47


