
中国海洋湖沼学会主办。
文章信息
- 李俊磊, 孙晓霞, 张文静, 陈芸燕. 2016.
- LI Jun-Lei, SUN Xiao-Xia, ZHANG Wen-Jing, CHEN Yun-Yan. 2016.
- 2014年冬季西太平洋浮游植物光合作用特征
- PHOTOSYNTHETIC CHARACTERISTICS OF PHYTOPLANKTON IN THE WESTERN PACIFIC IN WINTER 2014
- 海洋与湖沼, 47(5): 935-944
- Oceanologia et Limnologia Sinica, 47(5): 935-944.
- http://dx.doi.org/10.11693/hyhz20160300062
-
文章历史
- 收稿日期:2016-03-21
- 收修改稿日期:2016-07-08
2. 中国科学院大学 北京 100049;
3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
海洋浮游植物是海洋最主要的初级生产者, 承担着地球上一半的光合作用任务, 贡献了全球总初级生产力的45%—50%(Field et al, 1998)。光合作用是浮游植物初级生产中最为关键的过程, 浮游植物吸收光能后进行光合驱动产生氧气并制造有机物, 其余的光能以热能的形式耗散, 或者重新发射形成叶绿素荧光(Papageorgiou et al, 2007)。测量叶绿素荧光产量, 可以获得光化学过程与热耗散效率的变化信息, 并且可以进一步研究不同生态因子对光合作用的影响机制(Bolhar-Nordenkampf et al, 1989)。活体叶绿素荧光检测技术具有简便、快捷、无破坏性的优点, 并可以应用于大时空尺度下的海洋调查中, 成为近20年来海洋学研究的一项重要技术手段(Fu et al, 2013)。
在一系列可以反映浮游植物光合信息的叶绿素荧光参数中, 最大光化学量子产量Fv/Fm是反映各种外界胁迫条件对藻类光合作用影响的一个重要指标(Häder et al, 1998), Fv/Fm通常情况下是一个稳定值, 藻类约为0.65, 但是当植物体受到胁迫时则明显下降(Kolber et al, 1988)。20世纪90年代, Kolber等(1990)最早开展了应用活体叶绿素荧光技术研究野外浮游植物光合作用的工作, 其在缅因湾的调查发现, Fv/Fm值与距无机氮盐跃层的距离成反比, 首次证实了在自然水体中浮游植物光化学效率会受营养盐限制的影响(Kolber et al, 1990)。随后他们在高营养盐低叶绿素海域的研究显示, 铁加富实验可以明显增强浮游植物的光合作用能力(Kolber et al, 1994)。近年来国内学者开始对中国近海浮游植物光合作用特征进行相关研究。付翔(2007)在胶州湾的研究表明, 浮游植物Fv/Fm受到营养盐的影响存在滞后效应, 即Fv/Fm的变化更可能是对营养盐浓度变化的响应而不取决于营养盐浓度本身(付翔, 2007);王小冬等(2012)在大亚湾的研究表明, 热带和亚热带海区的硅藻必须在高光照下才能达到较高的光合效率, 这是因为它们形成了很好的耐强光能力和光保护能力(王小冬等, 2012);Wang等(2014)通过对长江口中肋骨条藻和东海原甲藻赤潮暴发前后浮游植物光合活性变化研究得出结论, 赤潮暴发前Fv/Fm的值会升高, 表明Fv/Fm可以作为预测赤潮暴发的一个重要指标(Wang et al, 2014)。
受光照、温度、营养盐等环境因子的影响, 分布在不同海区的浮游植物会呈现不同的光合作用特征(Suggett et al, 2009)。赤道西太平洋海区年均水温高, 表层海水盐度相对较低, 受温跃层影响营养跃层深度较深, 富营养盐海水难以上涌, 导致表层生产力水平低, 叶绿素(chl a)浓度通常低于1mg/m3, 具有高温寡营养低生产力的特征(Messié et al, 2006)。对该地区海洋浮游植物分布和初级生产已有一定了解, 而对该地区的浮游植物光合作用特征的研究未见报道。本研究借助2014年冬季西太平洋雅浦海山航次, 采用活体叶绿素荧光技术, 从中国近海到菲律宾海北赤道流区(117°—137°E, 8°—35°N)进行了较大空间尺度海区的浮游植物光合作用特征原位调查研究, 结合同步采集的温度、盐度、营养盐、叶绿素a浓度等生态因子数据, 分析探讨该区域浮游植物光合机制与其生境和生态位选择的内在联系, 为系统研究热带西太平洋生态系统特征提供数据支持和重要的科学依据。
1 材料与方法 1.1 调查站位本研究搭乘“科学号”海洋考察船, 于2014年12月3日—2015年1月7日对中国近海到西太平洋暖池区两个走航断面共57个站位表层海水进行了浮游植物光合作用特征调查, 其中走航A断面27个站, 走航B断面30个站。另在菲律宾海选取了9个站位(DY断面)不同水层进行浮游植物光合作用特征研究, 该断面跨越黑潮源区(DY1-4)和北赤道流海区(DY8-12)。具体采样站位详见图 1。
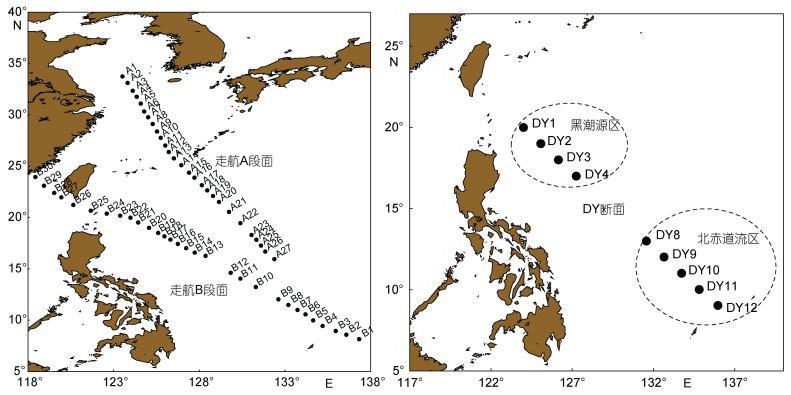 |
| 图 1 中国近海到西太平洋走航A、B断面和大洋区DY断面调查站位图 Fig. 1 Sampling stations in the western Pacific: Transect A, Transect B, and Transect DY |
走航断面的表层海水由科学号走航实验室采水系统采集, 采用CTD(SBE25-02)测定表层水温度、盐度。DY断面采用Niskin采水器在各站采集水样, 采水层次为表层、30m、75m、100m、150m和200m, 用CTD(SBE 9)测量温度、盐度。走航断面与DY断面叶绿素a采集与测定根据海洋调查规范(GB/T12763.6-2007)进行, 水样先用200μm的筛绢过滤, 滤去水体中的浮游动物, 用0.7μm的GF/F玻璃纤维滤膜进行总叶绿素过滤, 过滤体积为2000mL, 样品避光-20℃冷冻保存。在实验室内样品经90%丙酮萃取, 用Turner-Designs-Model 10荧光光度计测定, 计算总叶绿素a的含量。
DY断面硝酸盐、亚硝酸盐、磷酸盐、硅酸盐样品的采集按照海洋调查规范(GB12763.6-2007)进行, 水样过滤后装入250mL的高密度聚乙烯瓶中, 氯仿固定后于-20℃下冷冻保存, 在实验室通过连续流动分析仪(QuAAtro, Germany)测定。
1.3 光合活性原位测定利用Phyto-PAM(Walz, Effeltrich, Germany)测定主要光合作用参数, 控制软件为Phytowin2.13(Walz)。每站位表层水用移液器取2mL水样放入测量杯, 经过暗适应10min, 打开光通量密度很弱的测量光(Measuring Radiation)获得初始荧光F0, 然后打开饱和脉冲(Saturation Pulse)获得最大荧光Fm, 继而便可获得PSII的最大光化学量子产量Fv/Fm=(Fm-F0)/Fm, 它反映着植物体进行光化学反应的最大潜力。光合有效辐射PAR从1μmol/(s·m2)开始, 每隔20s使光化光(Actinic Light)增强100μmol/(s·m2)直至2000μmol/(s·m2), 则得到快速光曲线RLC。快速光曲线按照Platt等(1980)的公式: P=Pm(1-e-α×PAR/Pm) e-β×PAR/Pm, 采用最小二乘法用OriginPro 8.0软件进行拟合, 获得最大潜在相对电子传递速率Pm (rETRmax)和光能利用效率α等光合活性参数。
1.4 数据分析用Origin8.0软件和Surfer9.0软件作图, 用SPSS 16软件进行独立样本T检验, Pearson相关性分析和双侧显著性检测。
2 结果 2.1 A、B断面Fv/Fm、温度、盐度、叶绿素的分布趋势走航A段面和B断面Fv/Fm、温度、盐度、叶绿素的分布趋势如图 2所示。A段面从中国外海延伸到西太平洋赤道逆流区, 海水温度呈不断上升趋势, A1站位温度最低, 为16.0℃, 到A11温度上升到25℃, A24以后温度保持在28℃以上。盐度也呈现不断上升趋势, 从中国外海A1站位海水盐度数值约为30.5, 到A5站位以后盐度值维持在34以上。Chl a浓度总体呈现下降趋势, 最高值为A2站位的0.68mg/m3, A9站位以后基本维持在0.1mg/m3以下。最大光化学量子产量Fv/Fm分布趋势与chl a浓度分布趋势相似, 数值从中国外海向外不断下降, 最高值为A2站位的0.63, A9站位以后基本维持在0.2以下。
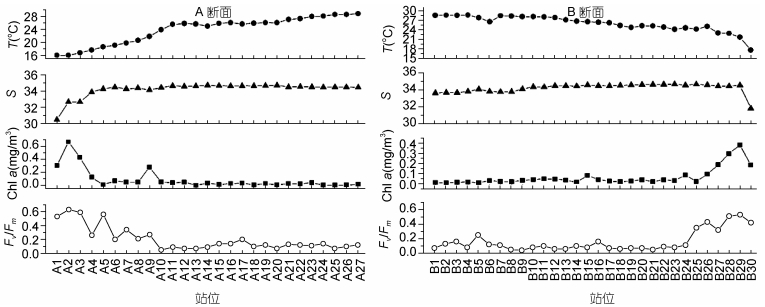 |
| 图 2 A断面和B断面表层最大光化学量子产量Fv/Fm、温度、盐度、叶绿素分布趋势 Fig. 2 Distribution of Fv/Fm, temperature, salinity, chl a on transect A and transect B |
B段面从高温高盐的西太平洋暖池区域开始, 经过赤道逆流区、黑潮区, 穿越巴士海峡, 一直延伸到中国福建近海。由图 2可知, 从B1站位开始, 海水温度呈不断下降趋势, 从B1站位的29.02℃下降到福建近海B30站位的17.65℃。而盐度数值基本维持在34左右。Chl a浓度从B1到B25都低于0.1mg/m3, 靠近台湾与福建近海开始升高, 最大值出现在B29站位, Chl a浓度为0.68mg/m3。Fv/Fm分布趋势与chl a浓度分布趋势相似, 数值从西太平洋暖池区到福建近海不断升高, 最高值为B29站位的0.53, 但是B23站位以前基本维持在0.2以下。
2.2 DY断面Fv/Fm、温度、盐度、营养盐、叶绿素垂直分布DY断面最大光化学量子产量Fv/Fm与温度、盐度、营养盐、叶绿素垂直分布见图 3。Fv/Fm的变化范围为0.01—0.37, 平均值为0.16±0.09, Fv/Fm最大值水层出现在100m层, 平均值为0.25±0.10 (图 3a), 而chl a浓度最大值(DCM)水层同样出现在100m层(只有DY1出现在75m层), 平均值为0.129mg/m3(图 3b)。图 3f—g代表DY断面温度和盐度分布。DY断面75m以上海水温度维持在25℃以上, 75m以下开始出现温跃层(图 3f), 图 3g显示表层海水盐度较低, 盐度高值层出现在75—100m层。图 3c—e分别是DY断面总氮浓度、硅酸盐、磷酸盐分布图, 各营养盐浓度在200m以下较高。
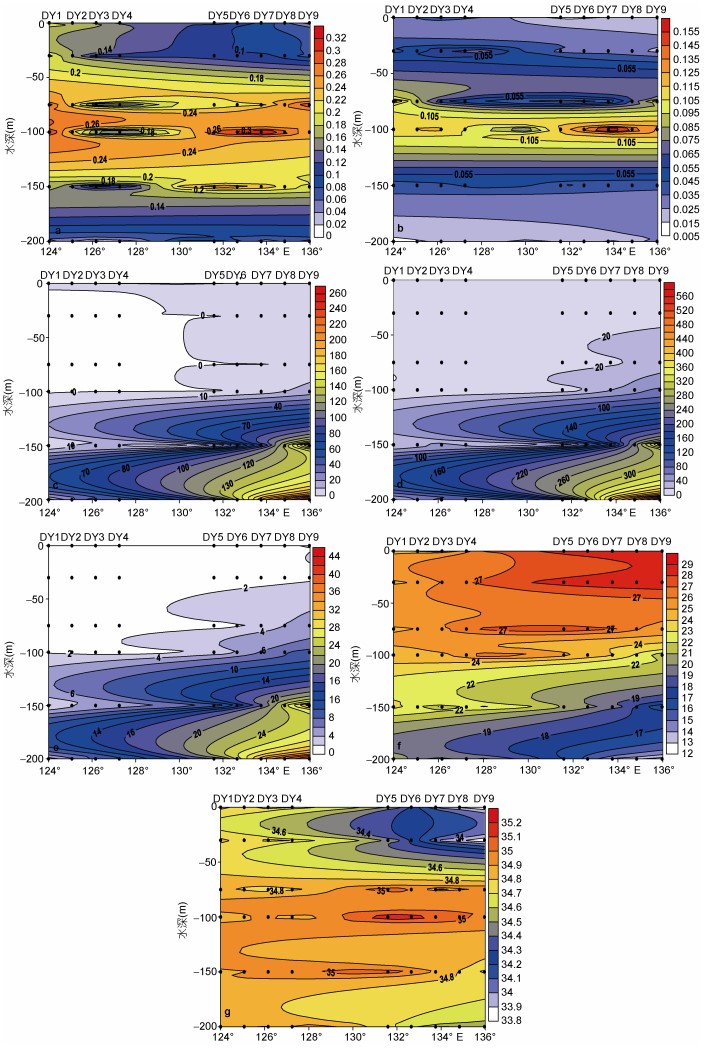 |
| 图 3 DY断面Fv/Fm、温度、盐度、营养盐、叶绿素垂直分布 Fig. 3 Vertical distribution of Fv/Fm, temperature (℃), salinity, chl a, nutrients on transect DY 注:a: Fv/Fm; b:叶绿素a, 单位mg/m3; c:总氮浓度, 单位μg/L; d:硅酸盐, 单位μg/L; e:磷酸盐, 单位μg/L; f:温度, 单位℃; g:盐度 |
根据站位设置, DY断面分为黑潮源区站位(DY1—4)和北赤道流海区站位(DY8—12), 为比较两部分站位之间Fv/Fm以及环境因子差异性, 我们进行独立样本T检验。根据检验结果可知, 黑潮源区站位与北赤道流海区站位相比, 营养盐浓度含量较低(两个区域营养盐最大层总氮浓度、硅酸盐、磷酸盐含量均差异显著, P < 0.05), 表层盐度较高(P < 0.05), 但是DCM层叶绿素浓度差异不显著。另外, 两个海域相同水层之间Fv/Fm差异不显著(P > 0.05)。
2.3 DY断面Fv/Fm与其他光合活性系数测定结果 2.3.1 DY断面Fv/Fm与其它光合活性系数垂直分布DY断面Fv/Fm、光能利用效率α、最大电子传递速率rETRmax、饱和光强Ek垂直分布如图 4所示。Fv/Fm垂直分布特点在图 3a已有描述。光能利用效率α的变化范围为0.007—0.117, 平均值为0.039±0.028, α最大值水层出现在75m层, 平均值为0.060±0.038。rETRmax变化范围为6.8—113.4 (μmol/(s·m2)), 平均值为32.72±21.56(μmol/(s·m2)), rETRmax最大值水层出现在100m层, 平均值为46.54±35.98(μmol/ (s·m2))。饱和光强Ek的变化范围为60.3—1662.7(μmol/ (s·m2)), 平均值为846.83±356.15(μmol/(s·m2)), Ek最大值水层出现在表层, 平均值为1099.57±388.70(μmol/(s·m2))。
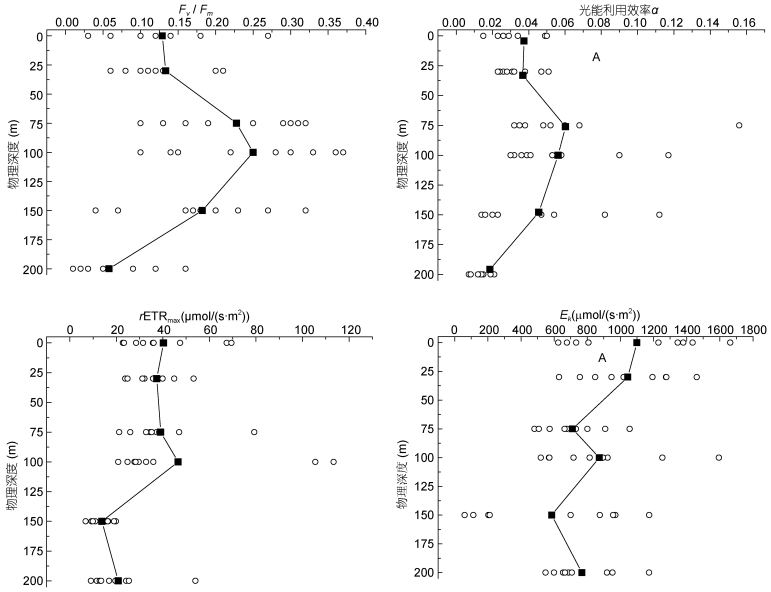 |
| 图 4 DY断面最大光化学量子产量Fv/Fm、光能利用效率α、最大电子传递速率rETRmax、饱和光强Ek垂直分布 Fig. 4 Vertical variations in Fv/Fm, α, rETRmax, and Ek of phytoplankton community on transect DY 注:图中黑色方块代表每层光合系数的平均值 |
为了解西太海区浮游植物快速光曲线(RLC)特点, 选取DY断面100m层(DCM层)为代表水层进行研究。由图 5可以看出, 各站位样品快速光曲线十分典型, 在低光强范围内, 随光照强度的上升, 浮游植物样品rETR快速上升, 当光强超过1000μmol/(s·m2)后, rETR增速缓慢并逐渐达到平稳状态(rETRmax)。快速光曲线系数见表 1, 光能利用效率(α)大部分低于0.1, DY11站最高, 达到0.33;rETRmax大部分站位低于100μmol/(s·m2), DY10站最高, 达到113.4μmol/(s·m2);饱和光强(Ek)均值为873.02μmol/(s·m2), 最高值出现在DY10站。
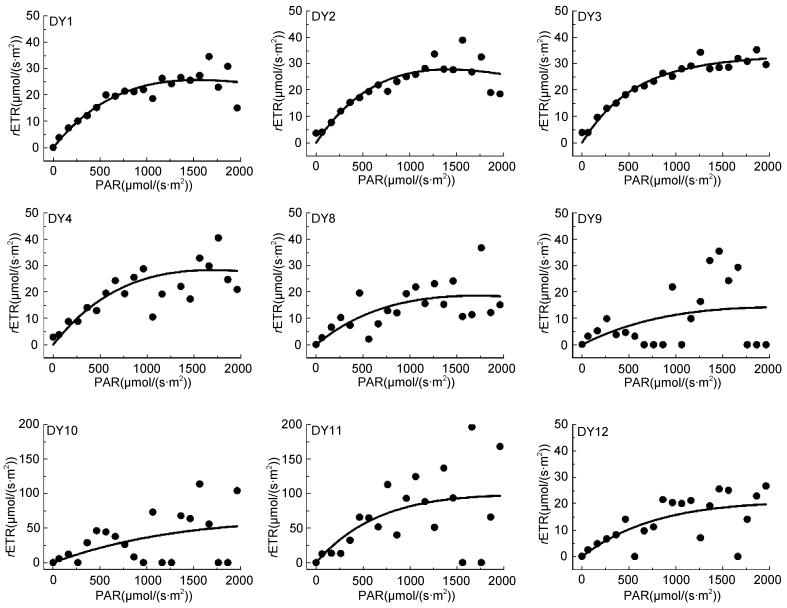 |
| 图 5 DY断面100m层(DCM层)浮游植物快速光曲线 Fig. 5 The rapid light curves of phytoplankton at depth 100m(DCM) on transect DY |
| 站位 | Fv/Fm | 初始斜率(α) | rETRmax(μmol/(s·m2)) | Ek(μmol/(s·m2)) |
| DY1 | 0.37 | 0.039 | 35.9 | 922.8 |
| DY2 | 0.14 | 0.053 | 27.8 | 519.9 |
| DY3 | 0.15 | 0.058 | 32.8 | 568.9 |
| DY4 | 0.10 | 0.041 | 29.6 | 717.3 |
| DY8 | 0.28 | 0.036 | 20.8 | 571.4 |
| DY9 | 0.33 | 0.032 | 28.3 | 894.9 |
| DY10 | 0.36 | 0.090 | 113.4 | 1594.2 |
| DY11 | 0.30 | 0.117 | 105.5 | 1253.4 |
| DY12 | 0.22 | 0.030 | 24.8 | 814.4 |
| 平均值±标准差 | 0.25±0.10 | 0.055±0.029 | 46.54±35.97 | 873.02±354.18 |
根据独立样本T检验结果可知, 黑潮源区站位(DY1—4)与北赤道流海区站位相比(DY8—12), 100m层Fv/Fm以及其它光曲线系数α、rETRmax, Ek, 差异均不显著(P > 0.05)。
2.4 走航断面和DY断面Fv/Fm与其他生态因子相关性分析为了研究调查海域Fv/Fm与环境因子的关系, 我们将走航站位和DY断面站位的Fv/Fm与温度、盐度、叶绿素、各种营养盐等环境要素进行相关性分析。表 2显示, 走航站位的Fv/Fm与叶绿素浓度呈极显著正相关关系, 与温度和盐度呈极显著负相关关系;DY断面站位Fv/Fm与叶绿素浓度和盐度呈极显著正相关关系。
| 温度(℃) | 盐度 | 叶绿素a (mg/m3) | 总氮浓度(μg/L) | 硅酸盐(μg/L) | 磷酸盐(μg/L) | |
| 走航断面Fv/Fm | -0.767** | -0.527** | 0.780** | |||
| DY断面Fv/Fm | 0.14 | 0.499** | 0.562** | -0.242 | -0.223 | -0.17 |
| 注:*表示差异显著(P < 0.05), **表示差异极显著(P < 0.01) | ||||||
最大光化学量子产量Fv/Fm是海洋浮游植物光合作用特征研究中最常用和最具有代表性的一个光合活性指标, 能够反映各种外界环境因子对藻类光合作用的影响, 不同生存环境下不同种类的浮游植物具有不同的Fv/Fm值(Cermeño et al, 2005)。通常情况下, 生活在营养盐丰富的温带海区的浮游植物具有较好的光合活性(Fv/Fm值接近0.65)(McMinn et al, 2004)。胶州湾冬季浮游植物具有较高的光合活性与潜力, 最大光化学量子产量保持在0.69左右(李俊磊等, 2014)。大亚湾秋季调查显示, 浮游植物最大光量子收益(Fv/Fm)范围在0.5—0.7之间, 说明浮游植物细胞生长良好(王小冬等, 2012)。美国大陆架边缘的乌尼马克岛海域具有丰富的营养元素, 浮游植物Fv/Fm值为0.61, 是整个阿留申群岛附近海域调查时出现的最大值, 但是越深入大洋海区, Fv/Fm相对越低(Suzuki et al, 2002)。本次调查从中国近海到菲律宾海北赤道流区(117°—137°E, 8°—35°N), 跨越了较大空间尺度海区内, 研究发现, 近海表层浮游植物Fv/Fm值大于外海大洋, 近海Fv/Fm通常可以接近藻类最适值0.65, 而越向外海直至大洋区, Fv/Fm不断下降。A9站位以后, B25站之前, 表层chl a浓度基本维持在0.1mg/m3以下, 而Fv/Fm值基本在0.2以下, 说明大洋表层浮游植物细胞生长状况较差, 可能受到温度、光照、营养盐等因素的限制(Kruskopf et al, 2006)。在一些高温寡营养低生产力的大洋海区, 通常存在被称为“海洋沙漠”的海域, 其主要特征是海水表层的叶绿素含量极低, 初级生产者的数量和种类极少, 通常每立方米表层海水的叶绿素含量在0.07mg以下, 结合本次光合活性调查结果来分析这种现象出现的原因, 最大可能就是由于温盐跃层导致下层富含营养盐海水难以上涌, 再加上表层较强的光照辐射和较高的温度, 环境因子的限制抑制了浮游植物光合作用, 导致光合活性降低, 固碳能力下降, 造成了该海域低生产力现象的出现。
Fv/Fm与海区的光照和水深也有重要关系。北冰洋南部斯瓦尔巴群岛海区浮游植物光合活性调查显示, 在20—40米水深范围内Fv/Fm最大, 约为0.65, 表层Fv/Fm约比该值低20%—30%, 40米以下Fv/Fm值逐渐下降, 在400米深度处仅为0.1(McMinn et al, 2004)。这种分布特征是由于表层强烈的光辐射和紫外线照射会降低甚至损伤浮游植物PS II光反应蛋白活性(Neale et al, 1991; Bergmann et al, 2002; Bouchard et al, 2005), 因此表层浮游植物需要通过降低PS Ⅱ反应中心活性来降低光合利用效率(Bracher et al, 2000; Kaiblinger et al, 2007)。根据对DY断面调查显示, Fv/Fm的变化范围为0.01—0.37, Fv/Fm最大值水层出现在100m层, 平均值为0.25±0.10, 并且与DCM层相吻合。寡营养盐海区DCM层深度主要受物理因素(光照条件及水体混合程度)影响, DCM层贡献的初级生产力约占整个水体的30%—70%, 随海洋表面辐照度增强, 真光层变厚, DCM层显著变深(Hanson et al, 2007)。DY断面Fv/Fm最大值水层与DCM层相吻合, 既保护了浮游植物光反应中心不受强烈光辐射影响, 又支持了DCM层浮游植物相对较强的光合作用和对整个水体初级生产力的贡献率。
Fv/Fm值与生态因子的相关性因海域而异, 一般来说, Fv/Fm值与营养盐浓度呈正相关(Babin et al, 1996), 营养盐(特别是氮盐)的供应状况是影响浮游植物光化学效率的主要因素之一(Kolber et al, 1988)。但也有调查研究显示Fv/Fm值与任何一种营养盐都没有明显的相关性, Olaizola等(1996)将这一现象解释为水体运动、光照条件等因素的影响(Olaizola et al, 1996)。本次调查显示, 走航站位的Fv/Fm与叶绿素浓度呈极显著正相关关系, 与温度和盐度呈极显著负相关关系;DY断面站位Fv/Fm与叶绿素浓度和盐度呈极显著正相关关系。根据上文的分析, 我们可以推断大洋海区Fv/Fm最大值水层与DCM层的一致性, 是导致Fv/Fm与叶绿素浓度呈极显著正相关关系的原因, 而由于走航站位和大洋站位在空间尺度和调查水层的差异性, 造成了Fv/Fm与生态因子相关性的差异。
快速光曲线RLC可用于分析海洋浮游藻类的实际光合作用能力, 并能反映海洋浮游藻类在一定光强范围内的潜在光合能力。对快速光曲线进行拟合, 可以得到一系列重要光合活性参数。α是快速光曲线的初始斜率, 由叶绿素的吸收截面积和最大光化学量子产量决定, 反映了光能利用的效率(Dubinsky et al, 2009), rETR与光合放氧速率和CO2固定速率在达到光饱和前具有良好的线性关系(Figueroa et al, 2003), Ek可以反映浮游植物对强光的适应能力, 不同海区的浮游植物具有不同的光适应机制, α值等光合参数也随藻类生活环境的变化而改变。夏季大亚湾高光照条件下浮游植物的光能利用效率低于0.2, 而饱和光强超过1500μmol/(s·m2), 这有利于长期生活在高光强环境中的大亚湾浮游植物更加有效的利用光化学能(王小冬等, 2012)。胶州湾冬季有效光合辐射较其他季节低, 但浮游植物的光能利用效率α大部分处于0.2—0.3之间, 有利于提高冬季胶州湾浮游植物对光能的利用效率, 最大电子传递速率rETRmax也较高, 表明此时浮游植物的光合潜力和光合活性比较高(李俊磊等, 2014)。本次调查显示DY断面Fv/Fm平均值仅为0.16, 光能利用效率α的变化范围为0.007—0.117, 平均值为0.039;最大电子传递速率rETRmax变化范围为6.8—113.4 (μmol/(s·m2)), 平均值为32.72(μmol/(s·m2));饱和光强Ek的变化范围为60.3—1662.7 (μmol/(s·m2)), 平均值为846.83(μmol/ (s·m2))。分析表明DY断面浮游植物具有极低的光能利用效率却需要较高的光强来达到光饱和, 导致这种生活环境下浮游植物处于一种低活衰老的状态(McMinn et al, 2004), 这是造成大洋海区低生产力的现象出现的原因之一。
4 小结通过对冬季西太平洋浮游植物光合作用特征进行原位研究, 可以得出如下结论:
(1) 在一些高温寡营养低生产力海域, 温盐跃层导致下层富含营养盐海水难以上涌, 再加上表层较强的光照辐射和较高的温度, 环境因子的限制抑制了浮游植物光合作用, 导致光合活性降低, 固碳能力下降, 造成了低生产力海域的出现。
(2) DY断面Fv/Fm最大值水层与DCM层相吻合, 既保护了浮游植物光反应中心不受强烈光辐射影响, 又支持了DCM层浮游植物相对较强的光合作用和对整个水体初级生产力的贡献率。大洋海区Fv/Fm最大值水层与DCM层的一致性, 是导致Fv/Fm与叶绿素浓度呈极显著正相关关系的原因。
(3) DY断面Fv/Fm平均值仅为0.16, 光能利用效率α的变化范围为0.007—0.117, 平均值为0.039;最大电子传递速率rETRmax变化范围为6.8—113.4 (μmol/(s·m2)), 平均值为32.72(μmol/(s·m2));饱和光强Ek的变化范围为60.3—1662.7(μmol/(s·m2)), 平均值为846.83(μmol/(s·m2))。分析表明DY断面浮游植物具有极低的光能利用效率却需要较高的光强来达到光饱和, 导致这种生活环境下浮游植物处于一种低活衰老的状态, 这是造成大洋海区低生产力现象出现的原因之一。
致谢 本研究中温盐数据由中国科学院海洋研究所海洋专项办公室提供, 营养盐数据由李学刚老师和李宁老师提供, 此次海上调查得到了“科学号”考察船全体工作人员的支持, 谨致谢忱。| 王小冬, 江涛, 岑竞仪, 等, 2012. 大亚湾浮游植物光合作用特征. 海洋与湖沼, 43 (3) : 589–594 |
| 付翔, 2007.中国近海浮游植物光合作用研究——初级生产力模型计算与活体叶绿素荧光测量.青岛:中国科学院海洋研究所博士学位论文, 138-140 |
| 李俊磊, 孙晓霞, 2014. 胶州湾冬季浮游植物光合作用特征原位研究. 海洋与湖沼, 45 (3) : 468–479 |
| Babin M, Morel A, Claustre H., et al, 1996. Nitrogen-and irradiance-dependent variations of the maximum quantum yield of carbon fixation in eutrophic, mesotrophic and oligotrophic marine systems. Deep Sea Research Part I:Oceanographic Research Papers, 43 (8) : 1241–1272 DOI:10.1016/0967-0637(96)00058-1 |
| Bergmann T, Richardson T L, Paerl H W., et al, 2002. Synergy of light and nutrients on the photosynthetic efficiency of phytoplankton populations from the Neuse River estuary, North Carolina. Journal of Plankton Research, 24 (9) : 923–933 DOI:10.1093/plankt/24.9.923 |
| Bolhar-Nordenkampf H R, Long S P, Baker N R., et al, 1989. Chlorophyll fluorescence as a probe of the photosynthetic competence of leaves in the field: a review of current instrumentation. Functional Ecology, 3 (4) : 497–514 DOI:10.2307/2389624 |
| Bouchard J N, Campbell D A, Roy S, 2005. Effects of UV-B radiation on the D1 protein repair cycle of natural phytoplankton communities from three latitudes (Canada, Brazil, and Argentina). Journal of Phycology, 41 (2) : 273–286 DOI:10.1111/(ISSN)1529-8817 |
| Bracher A, Wiencke C, 2000. Simulation of the effects of naturally enhanced UV radiation on photosynthesis of Antarctic phytoplankton. Marine Ecology Progress Series, 196 : 127–141 DOI:10.3354/meps196127 |
| Cermeño P, Estévez-Blanco P, Marañón E., et al, 2005. Maximum photosynthetic efficiency of size-fractionated phytoplankton assessed by 14C uptake and fast repetition rate fluorometry. Limnology and Oceanography, 50 (5) : 1438–1446 DOI:10.4319/lo.2005.50.5.1438 |
| Dubinsky Z, Stambler N, 2009. Photoacclimation processes in phytoplankton: mechanisms, consequences, and applications. Aquatic Microbial Ecology, 56 (2-3) : 163–176 |
| Field C B, Behrenfeld M J, Randerson J T., et al, 1998. Primary production of the biosphere: integrating terrestrial and oceanic components. Science, 281 (5374) : 237–240 DOI:10.1126/science.281.5374.237 |
| Figueroa F L, Conde-Álvarez R, Gómez I, 2003. Relations between electron transport rates determined by pulse amplitude modulated chlorophyll fluorescence and oxygen evolution in macroalgae under different light conditions. Photosynthesis Research, 75 (3) : 259–275 DOI:10.1023/A:1023936313544 |
| Fu X, Li F, Lü Z B., et al, 2013. Lagged response of phytoplanktonic photosynthetic competence to variation of nitrogen concentration in Jiaozhou Bay, China. Chinese Journal of Oceanology and Limnology, 31 (6) : 1295–1305 DOI:10.1007/s00343-013-3001-6 |
| Häder D P, Porst M, Santas R, 1998. Photoinhibition by solar radiation in the Mediterranean alga Peyssonnelia squamata measured on site. Plant Ecology, 139 (2) : 167–175 DOI:10.1023/A:1009753215314 |
| Hanson C E, Pesant S, Waite A M., et al, 2007. Assessing the magnitude and significance of deep chlorophyll maxima of the coastal eastern Indian Ocean. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 54 (8-10) : 884–901 DOI:10.1016/j.dsr2.2006.08.021 |
| Kaiblinger C, Greisberger S, Teubner K., et al, 2007. Photosynthetic efficiency as a function of thermal stratification and phytoplankton size structure in an oligotrophic alpine lake. Hydrobiologia, 578 (1) : 29–36 DOI:10.1007/s10750-006-0430-7 |
| Kolber Z, Zehr J, Falkowski P, 1988. Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem Ⅱ. Plant Physiology, 88 (3) : 923–929 DOI:10.1104/pp.88.3.923 |
| Kolber Z, Wyman K V, Falkowski P G, 1990. Natural variability in photosynthetic energy conversion efficiency: a field study in the Gulf of Maine. Limnology and Oceanography, 35 (1) : 72–79 DOI:10.4319/lo.1990.35.1.0072 |
| Kolber Z S, Barber R T, Coale K H., et al, 1994. Iron limitation of phytoplankton photosynthesis in the equatorial Pacific Ocean. Nature, 371 (6493) : 145–149 DOI:10.1038/371145a0 |
| Kruskopf M, Flynn K J, 2006. Chlorophyll content and fluorescence responses cannot be used to gauge reliably phytoplankton biomass, nutrient status or growth rate. New Phytologist, 169 (3) : 525–536 DOI:10.1111/nph.2006.169.issue-3 |
| McMinn A, Hegseth E N, 2004. Quantum yield and photosynthetic parameters of marine microalgae from the southern Arctic Ocean, Svalbard. Journal of the Marine Biological Association of the UK, 84 (5) : 865–871 DOI:10.1017/S0025315404010112h |
| Messié M, Radenac M H, 2006. Seasonal variability of the surface chlorophyll in the western tropical Pacific from SeaWiFS data. Deep Sea Research Part I: Oceanographic Research Papers, 53 (10) : 1581–1600 DOI:10.1016/j.dsr.2006.06.007 |
| Neale P J, Heaney S I, Jaworski G H M, 1991. Responses to high irradiance contribute to the decline of the spring diatom maximum. Limnology and Oceanography, 36 (4) : 761–768 DOI:10.4319/lo.1991.36.4.0761 |
| Olaizola M, Geider R J, Harrison W G., et al, 1996. Synoptic study of variations in the fluorescence based maximum quantum efficiency of photosynthesis across the North Atlantic Ocean. Limnology and Oceanography, 41 (4) : 755–765 DOI:10.4319/lo.1996.41.4.0755 |
| Papageorgiou G C, Tsimilli-Michael M, Stamatakis K, 2007. The fast and slow kinetics of chlorophyll a fluorescence induction in plants, algae and cyanobacteria: a viewpoint. Photosynthesis Research, 94 (2-3) : 275–290 DOI:10.1007/s11120-007-9193-x |
| Platt T, Gallegos C L, Harrison W G, 1980. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton. Journal of Marine Research, 38 (4) : 687–701 |
| Suggett D J, Macintyre H L, Kana T M., et al, 2009. Comparing electron transport with gas exchange: parameterising exchange rates between alternative photosynthetic currencies for eukaryotic phytoplankton. Aquatic Microbial Ecology, 56 (2-3) : 147–162 |
| Suzuki K, Liu H B, Saino T., et al, 2002. East-west gradients in the photosynthetic potential of phytoplankton and iron concentration in the subarctic Pacific Ocean during early summer. Limnology and Oceanography, 47 (6) : 1581–1594 DOI:10.4319/lo.2002.47.6.1581 |
| Wang Z Y, Wang J T, Tan L J, 2014. Variation in photosynthetic activity of phytoplankton during the spring algal blooms in the adjacent area of Changjiang River estuary. Ecological Indicators, 45 : 465–473 DOI:10.1016/j.ecolind.2014.05.010 |
 2016, Vol. 47
2016, Vol. 47


