中国海洋湖沼学会主办。
文章信息
- 周孔霖, 孙松, 张芳. 2016.
- ZHOU Kong-Lin, SUN Song, ZHANG Fang. 2016.
- 2014年春末黄海中华哲水蚤(Calanus sinicus)的呼吸率与油脂积累
- METABOLISM AND LIPID ACCUMULATION OF CALANUS SINICUS IN THE YELLOW SEA IN LATE SPRING 2014
- 海洋与湖沼, 47(5): 971-976
- Oceanologia et Limnologia Sinica, 47(5): 971-976.
- http://dx.doi.org/10.11693/hyhz20160300053
-
文章历史
- 收稿日期:2016-03-14
- 收修改稿日期:2016-06-08
2. 中国科学院大学 北京 100049;
3. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
4. 中国科学院海洋研究所山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
4. Jiaozhou Bay Marine Ecosystem Research Station, Chinese Ecosystem Research Network, Qingdao 266071, China
作为我国近海浮游动物的优势种, 中华哲水蚤(Calanus sinicus)是黄海大型桡足类功能群的代表, 在食物网中起到承上启下的重要作用, 其种群的数量变动将影响到当地生态系统的结构和功能(Sun et al, 2010)。黄海冷水团区和近岸浅水区的中华哲水蚤种群拥有不同的生活策略。黄海冷水团种群全年有4-5个世代, 其中春末形成的G3和G4世代能够积累大量油脂, 种群以C5期桡足类幼体(简称C5期)为主在初夏迁移至温跃层以下的冷水团进行休眠度夏(王世伟, 2009)。中华哲水蚤属于温带种类, 夏季黄海表层海水的高温环境( > 26℃)将大大提高其死亡率, 而温跃层以下黄海冷水团的低温环境( < 10℃)为中华哲水蚤提供庇护场所, 种群因此得以保存与延续(Zhang et al, 2007)。相比之下, 近岸种群全年活跃, 无休眠现象(王世伟, 2009)。夏季, 近岸水体垂直混合较好, 中华哲水蚤因高温胁迫死亡率高, 种群丰度较低(Zhang et al, 2007)。
度夏期间C5期处于静息状态, 个体的新陈代谢、蜕皮发育和垂直移动均受到抑制, 个体几乎不摄食, 仅依赖储存的油脂维持生命(Li et al, 2004; Pu et al, 2004; Zhou et al, 2016a)。度夏前, 油脂的积累程度不仅关系到中华哲水蚤能否顺利度夏, 也可能是度夏启动的内源性因子(孙松等, 2011)。油脂积累过程受到多种环境因素的影响(如食物、温度等)(Johnson et al, 2008)。然而, 春末仅冷水团种群的C5期油囊体积达到全年最大, 而近岸区C5期的油囊体积全年变化较小, 且油囊体积与食物丰度(叶绿素a浓度)并无显著相关性(孙松等, 2011)。中华哲水蚤C5期存在昼夜垂直移动的习性, 夜间能上升至温跃层进行摄食, 白天则迁移至底层(Huang et al, 1993; 张芳等, 2001)。Enright(1977)认为桡足类通过昼夜垂直移动能有效降低代谢消耗, 从而提高对食物的利用, 增加能量的积累。鉴于春末黄海近岸区与冷水团区的水团特征以及两个区域的中华哲水蚤C5期油脂积累程度均存在较大的差异, 我们推测这一时期黄海温跃层和冷水团的形成有利于C5期的油脂积累, 然而其具体作用尚不明确。
本研究对春末黄海冷水团内外、冷水团区温跃层上下的中华哲水蚤C5期呼吸率、油囊体积等形态特征以及种群结构进行比较研究, 探索冷水团对C5期油脂积累的影响作用, 为中华哲水蚤度夏机制的研究提供基础数据。
1 材料与方法 1.1 调查站位与样品采集于2014年春末搭载“科学三号”科学考察船参加战略性先导专项黄东海航次的调查。各站位温度等水文数据由CTD(Seabird SBE9)现场测定(共64个站位), 数据由中国科学院海洋研究所于非研究员提供。根据往年5、6月份黄海冷水团的经验范围, 在南黄海冷水团水域选取3个站位(3400-8、3500-10和3600-8), 近岸浅水区选取2个站位(3500-4和3875-5)进行中华哲水蚤C5期幼体的现场呼吸率测定实验(如图 1所示)。现场实验自5月28日开始, 并于6月6日结束。采样时间均处于夜间或凌晨(19:50-次日05:03)。
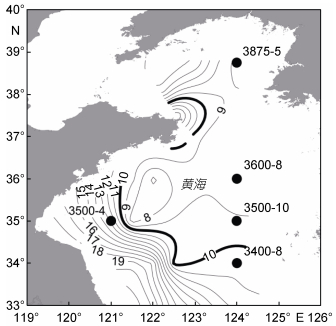 |
| 图 1 现场实验站位图 Fig. 1 Map of field experiment stations 注: ·表示实验站位; 黑色细线为底层等温线; 黑色粗线为底层10℃等温线, 用以标记黄海冷水团的边界 |
在冷水团区, 为研究温跃层上下中华哲水蚤C5期形态特征与呼吸率的差异, 用北太平洋分层网(网口内径: 80cm; 筛绢孔径: 330μm)从底层(离海底4m)至温跃层下界垂直拖取浮游生物作为各站位底层样品, 从温跃层下界到表层拖取浮游生物作为各站位表层样品。在近岸区2个站位, 用大型浮游生物网(网口内径: 80cm; 筛绢孔径: 505μm)从底层至表层垂直拖取样品。以上活体样品均小心转移到装有预冷海水的保温桶中暂存。每个站位另用大型浮游生物网从底层至表层拖取浮游生物样品一份, 以5%甲醛海水溶液固定, 用以分析中华哲水蚤种群丰度和各发育阶段组成。
1.2 呼吸率的测定将现场采集的活体样品移至船载实验室内, 通过肉眼挑选大小相似、健康完整的中华哲水蚤C5期幼体, 在解剖镜(Nikon SMZ645)下确认其发育阶段, 并暂存于预冷的过滤海水中。培养瓶采用500mL的棕色磨口玻璃瓶, 每组实验分别有三个实验瓶和空白瓶。将C5期个体经过滤海水清洗后, 小心转移到实验瓶中, 每瓶约20只。用虹吸法移入过滤海水, 盖上瓶盖并用封口膜密封, 瓶中不留气泡。培养瓶置于培养箱(江南SPX-270)中黑暗培养24-27小时, 培养温度与现场底温一致。培养结束后, 用虹吸法从各培养瓶中取两份水样(每份约130mL), 并参照国家海洋调查规范测定溶解氧浓度。培养后的C5期经计数确认后保存于5%甲醛海水溶液中。培养实验所用海水均经0.45μm醋酸纤维膜过滤并曝气, 随后存放于培养箱中预冷。
鉴于桡足类的呼吸率受生物量的影响(Ikeda et al, 2001), 本文采用基于生物量的呼吸率(Carbon-weight-specific oxygen consumption rate, OCR)来描述各站位C5期的呼吸率。呼吸率的计算公式为:
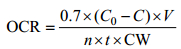
式中, 0.7为将氧质量转为相应体积的系数, C和C0分别是实验瓶和空白瓶的溶解氧浓度(mg/L), V(mL)为培养瓶的体积, n为桡足类个数, t(h)为培养时间, CW(mg)为C5期的平均含碳量, OCR的单位为μLO2/(mgC·h)。CW由体长(PL)估算(Uye, 1988):
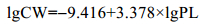
此外, 根据个体碳含量(CW)和培养温度(T)估算C5期的常规呼吸率(OCRE)作为参考值(Ikeda et al, 2001):
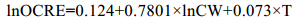
在解剖镜(Zeiss Stemi SV11 Apro)下对现场实验样品进行测量, 测量指标包括C5期幼体的前体部体长(PL)、体宽(PW), 油囊长(OL)和油囊宽(OW)。根据Svetlichny等(2006)的公式计算中华哲水蚤前体部的体积(Prosome Volume, PV)和油囊体积(Oil Sac Volume, OSV):
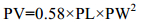 (1)
(1)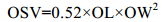 (2)
(2)公式(2)中油囊体积可用于表示桡足类油脂积累的程度。鉴于油囊体积受到个体大小的影响(Miller et al, 2000), 因此本文选用油囊体积百分数(Oil sac volume proportion, OSV%)来描述C5期油脂积累的情况, 即油囊体积占其前体部体积的百分比(孙松等, 2011):
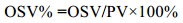
在解剖镜下对浮游生物大网样品进行分类鉴定。C3期以及更小发育期幼体的体宽小于505μm, 因此本研究仅对中华哲水蚤C4期、C5期、雄体和雌体进行计数。
1.4 统计方法本文统计分析均使用SPSS(16.0)完成。对各站位中华哲水蚤C5期的形态特征与呼吸率进行方差分析和T检验。若方差分析结果差异显著, 选用S-N-K方法(Student-Newman-Keuls test)进行多重比较以分析不同站位间的差异。采用Pearson相关系数进行相关性分析。
2 结果 2.1 水文特征根据底层水温10℃等温线对黄海冷水团的范围进行估计(翁学传等, 1982)。春末, 冷水团站位的温跃层已经形成(图 2), 黄海冷水团初具规模(图 1)。结果显示:黄海中部的3500-10和3600-8站位于南黄海冷水团范围内, 其温跃层均在次表层出现, 厚度分别为19和25m, 温差为6.7℃和9.2℃, 温跃层的平均强度为0.3℃/m和0.5℃/m; 黄海中部3400-8虽然位于冷水团外缘, 但其次表层有较厚的温跃层(24m), 跃层上下温差为7.9℃, 平均强度为0.3℃/m, 其水温环境与3500-10和3600-8两站相似, 因此将这三个站位划分为冷水团站位。近岸3500-4站位于冷水团外, 温跃层最薄(3m), 温差为3.2℃, 强度为1.1℃/m; 黄海北部近岸3875-5站表层水温变化大, 温跃层厚度为10m, 温差为5.4m, 平均强度为0.5℃/m。
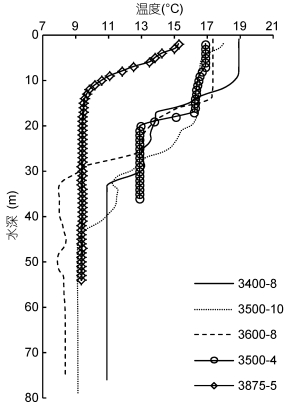 |
| 图 2 各站位水温垂直分布图 Fig. 2 Vertical profiles of temperature in each station |
如图 3所示, 中华哲水蚤的丰度在各站位相近, 范围为184.6-271.0ind./m3。各站位中华哲水蚤桡足类幼体所占比例较高, 其中C5期所占比例为26%-53%, C4期所占比例为16%-83%。3500-10和3400-8两个站位成体比例低(分别为4%和7%), 其余三个站位的成体比例较高(22%-38%)。近岸两个站位种群的性比(雌体/雄体)分别为0.8和1.7, 冷水团种群的性比值范围为4.4-12。
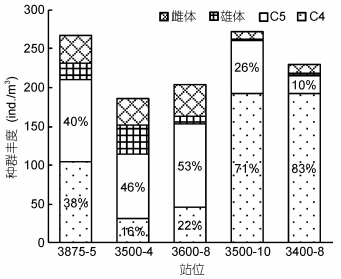 |
| 图 3 春末黄海中华哲水蚤种群丰度与各发育阶段比例 Fig. 3 Population abundance and proportions of different development stages in the Yellow Sea in late Spring |
各站位中华哲水蚤C5期幼体的体长相似, 平均为2.02-2.20mm。各站位C5期的OSV%存在差异, 3500-10站底层的C5期油囊体积最大, OSV%为(22.6±6.1)%。冷水团站位底层的C5期OSV%均显著高于表层以及近岸的C5期(图 4; ANOVA, F7, 16=11.997, P=0.000)。
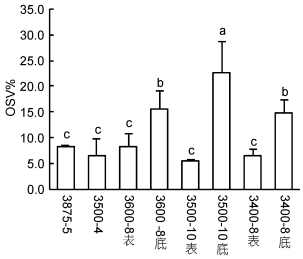 |
| 图 4 各站位中华哲水蚤C5期的油囊体积百分数(OSV%) Fig. 4 The oil sac proportions(OSV%) of C5s in each station 注: a、b、c代表显著性差异, P < 0.05 |
各站位C5期的呼吸率如图 5所示。冷水团站位的呼吸率为1.93-3.71μLO2/(mgC·h), 其中表层与底层的C5期呼吸率无显著差异(T检验, t=0.161, P=0.874)。近岸两个站位C5期的呼吸率相似, 平均值为4.04和4.28μLO2/(mgC·h)(T检验, t=0.649, P=0.552)。冷水团内C5期的呼吸率显著低于近岸种群, 平均值是近岸种群的68%(T检验, t=-3.750, P=0.001)。各站位的呼吸率与培养温度(r=0.011, P=0.958)和OSV%(r=-0.181, P=0.397)均无显著相关性。近岸和3600-8站表层C5期的呼吸率均与常规呼吸率的估计值相近。冷水团其它站位C5期的呼吸率则低于常规呼吸率的估计值, 是后者的46%-76%(图 5)。
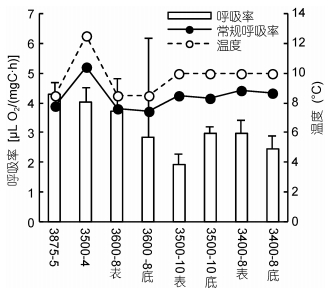 |
| 图 5 各站位中华哲水蚤C5期的呼吸率与培养温度 Fig. 5 Oxygen consumption rate at stage C5s and temperature in each station |
王世伟(2009)根据C5期的体长频数分布描述了南黄海冷水团区中华哲水蚤全年世代交替的情况。与其研究结果相比, 春末冷水团区C5期的体长处于2007年4-5月的水平, 应属于G3、G4世代。然而冷水团区仅3600-8站的C5期占种群比例较高(53%), 其余两个站位C5期仅占种群的10%和26%, 远远小于度夏种群的C5期所占比例(74%和84%)(Zhou et al, 2016a), 由此推测此时度夏种群的主体尚未完全形成。此外, 冷水团区C5期的OSV%虽然大于近岸种群, 但仍未达到全年的最高水平(30%)(孙松等, 2011)。由此推测, 本研究中冷水团区的中华哲水蚤仍处于度夏前的准备阶段。
度夏前, 冷水团区3500-10和3400-8两个站位的中华哲水蚤种群以C4期为主, 各占总体丰度的71%和83%。此外, C3期的丰度分别为36.6和8.1ind./m3, 分别是C5期丰度的53%和35%。由于C3期的前体部宽度(235.29-388.01μm)小于本研究采样网具的筛绢孔径(505μm), C3期的实际丰度应高于实测值。根据室内培养实验的研究结果, 中华哲水蚤在10-16℃和10-19℃的变温培养下, 从C4期发育到C5期分别需要4.2和1.2天, 从C3期发育到C5期则分别需要6.8和3.8天(Zhou et al, 2016b)。5月底大量C3、C4期幼体可以在短期内发育成C5期并积累大量的油脂, 从而构成度夏种群的主体。春末夏初, 黄海表层海水升温迅速, 温跃层逐步加强。鉴于体长与温度的负相关关系(Uye, 1988), 新蜕皮发育而成的C5期的体长预计较小。这应是8月份度夏种群C5期体长(1.91mm±0.12mm)比本研究C5期短的原因之一(Pu et al, 2004; 王世伟, 2009; Zhou et al, 2016a)。
3.2 春末冷水团C5期的呼吸率与油脂积累春季, 冷水团海区表层与底层的C5期呼吸率相似。桡足类的呼吸率主要受到温度和个体生物量的影响(Ikeda et al, 2001)。此时黄海冷水团已经形成, 温跃层强度比夏季小。中华哲水蚤C5期具有昼夜垂直移动的习性(Huang et al, 1993; 张芳等, 2001), 冷水团水域的表、底层群体生活环境相似, 个体的体长因此相近, 呼吸率也相似。然而在夏季, 大西洋北部深层的极北哲水蚤(Calanus hyperboreus)的呼吸率仅为表层群体的54%, 前者处于滞育状态而后者较为活跃(Auel et al, 2003)。由此推测, 本研究中冷水团内的C5期仍未进入度夏休眠阶段。
在油脂积累方面, 冷水团区底层C5期的OSV%为表层的1.9-4.2倍。具有大体积油囊的C5期偏好在冷水团底部活动, 这与度夏期间中华哲水蚤C5期垂直移动减弱相吻合(Pu et al, 2004; Zhang et al, 2007)。相似地, 春末大西洋北部的飞马哲水蚤(Calanus finmarchicus)C5期幼体在积累大量油脂后下沉至深水区并开始休眠, 而表层群体继续积累油脂或蜕皮为成体(Arashkevich et al, 2004)。本研究中, 温跃层上下C5期的体长和呼吸率均无显著差异, 应为同一个世代的个体。由此推测, 表层的C5期比底层的“年轻”, 经过一段时间的油脂积累后会下潜至冷水团底部进行度夏。
春季, 冷水团底层C5期的OSV%为近岸种群的2.4倍。在代谢方面, 各站位呼吸率与温度并无显著相关关系。适温条件下, 中华哲水蚤的呼吸率随温度升高而增加(张武昌等, 2000)。然而, 冷水团内C5期的呼吸率却比水温更低的黄海北部的近岸种群低, 而后者应处于常规代谢水平。冷水团内C5期的平均呼吸率为常规呼吸率的46%-76%, 新陈代谢活动比近岸种群弱。根据呼吸率估算呼吸所需的碳量(Li et al, 2004), 冷水团内C5期的平均代谢消耗碳量为2.35μgC/(ind.·d), 是近岸两站位平均值的73%。由此可见, 冷水团区次表层较厚的温跃层以及温跃层以下冷水团的低温环境有利于C5期降低代谢消耗, 从而促进油脂的积累。
油脂的积累与摄食活动有关。中华哲水蚤的摄食率随饵料浓度的增加而增加(张武昌等, 2000)。研究表明, 多种哲水蚤在高饵料浓度组培养下比低饵料浓度组能积累更多的油脂(Hakanson, 1984; Escribano et al, 1992; Hygum et al, 2000; Rey-Rassat et al, 2002)。然而, 孙松等(2011)发现黄海中华哲水蚤的油脂积累与饵料浓度并无显著相关性。除了外界环境因素的影响外, 内源性因素也可能起到重要作用(Rey-Rassat et al, 2002; Tarrant et al, 2008)。休眠前, 哲水蚤的C5期可能存在一个能量分配问题, 即C5期可以选择将摄食所获取的能量用于油脂积累或者蜕皮发育(Ji, 2011)。夏季黄海冷水团内外的中华哲水蚤种群恰好是这两种不同的选择(孙松等, 2011), 这可能是种群对环境长期适应的结果。然而大体积油囊形成的生理过程及其与多种环境因素间的相互作用尚无明确定论, 需进一步研究以探讨中华哲水蚤度夏休眠的启动机制。
4 结论5月底黄海冷水团中华哲水蚤种群应处于度夏前的准备阶段。春末是黄海中华哲水蚤油脂积累以及度夏种群形成的关键时期。黄海冷水团特殊的水文环境有利于中华哲水蚤C5期幼体减少呼吸消耗, 从而增加油脂积累。积累大量油脂后的C5期幼体偏向在冷水团底部活动。
致谢 中国科学院海洋研究所于非研究员提供黄海水温数据, 本课题组张永山和王卫成在样品采集上给予帮助, 王世伟在样品分析上给予指导, 谨致谢忱。| 王世伟, 2009.黄海中华哲水蚤繁殖、种群补充与生活史研究.青岛:中国科学院研究生院(海洋研究所)博士学位论文, 96-106 |
| 孙松, 王世伟, 李超伦, 2011. 黄海中华哲水蚤C5发育期油脂积累初步研究. 海洋与湖沼, 42 (2) : 165–169 |
| 张芳, 孙松, 2001. 中华哲水蚤生态学研究进展. 海洋科学, 25 (11) : 16–19 |
| 张武昌, 王荣, 王克, 2000. 温度对中华哲水蚤代谢率的影响. 海洋科学, 24 (2) : 42–44 |
| 翁学传, 王从敏, 1982.黄海冷水团边界及温盐范围的确定.见:中国湖沼学会水文气象学术会议(1980)论文集.北京:科学出版社, 61-70 |
| Arashkevich E G, Tande K S, Pasternak A F, et al, 2004. Seasonal moulting patterns and the generation cycle of Calanus finmarchicus in the NE Norwegian Sea, as inferred from gnathobase structures, and the size of gonads and oil sacs. Mar Biol, 146 (1) : 119–132 DOI:10.1007/s00227-004-1416-5 |
| Auel H, Klages M, Werner I, 2003. Respiration and lipid content of the Arctic copepod Calanus hyperboreus overwintering 1 m above the seafloor at 2, 300 m water depth in the Fram Strait. Mar Biol, 143 (2) : 275–282 DOI:10.1007/s00227-003-1061-4 |
| Enright J T, 1977. Diurnal vertical migration: adaptive significance and timing. Part 1. Selective advantage: a metabolic model. Limnol Oceanogr, 22 (5) : 856–872 |
| Escribano R, McLaren I A, 1992. Influence of food and temperature on lenghts and weights of marine copepods. J Exp Mar Biol Ecol, 159 (1) : 77–88 DOI:10.1016/0022-0981(92)90259-D |
| Hakanson J L, 1984. The long and short term feeding condition in field-caught Calanus pacificus, as determined from the lipid content. Limnol Oceanogr, 29 (4) : 794–804 DOI:10.4319/lo.1984.29.4.0794 |
| Huang C, Uye S, Onbé T, 1993. Ontogenetic diel vertical migration of the planktonic copepod Calanus Sinicus in the Inland Sea of Japan Ⅲ. Early summer and overall seasonal pattern. Mar Biol, 117 (2) : 289–299 |
| Hygum B H, Rey C, Hansen B W, et al, 2000. Importance of food quantity to structural growth rate and neutral lipid reserves accumulated in Calanus finmarchicus. Mar Biol, 136 (6) : 1057–1073 DOI:10.1007/s002270000292 |
| Ikeda T, Kanno Y, Ozaki K, et al, 2001. Metabolic rates of epipelagic marine copepods as a function of body mass and temperature. Mar Biol, 139 (3) : 587–596 |
| Ji R B, 2011. Calanus finmarchicus diapause initiation: new view from traditional life history-based model. Mar Ecol Prog Ser, 440 : 105–114 DOI:10.3354/meps09342 |
| Johnson C L, Leising A W, Runge J A, et al, 2008. Characteristics of Calanus finmarchicus dormancy patterns in the Northwest Atlantic. ICES J Mar Sci, 65 (3) : 339–350 DOI:10.1093/icesjms/fsm171 |
| Li C, Sun S, Wang R, et al, 2004. Feeding and respiration rates of a planktonic copepod (Calanus sinicus) oversummering in Yellow Sea Cold Bottom Waters. Mar Biol, 145 (1) : 149–157 |
| Miller C B, Crain J A, Morgan C A, 2000. Oil storage variability in Calanus finmarchicus. ICES J Mar Sci, 57 (6) : 1786–1799 DOI:10.1006/jmsc.2000.0975 |
| Pu X M, Sun S, Yang B, et al, 2004. Life history strategies of Calanus sinicus in the southern Yellow Sea in summer. J Plankton Res, 26 (9) : 1059–1068 DOI:10.1093/plankt/fbh101 |
| Rey-Rassat C, Irigoien X, Harris R, et al, 2002. Energetic cost of gonad development in Calanus finmarchicus and C. helgolandicus. Mar Ecol Prog Ser, 238 : 301–306 DOI:10.3354/meps238301 |
| Sun S, Huo Y Z, Yang B, 2010. Zooplankton functional groups on the continental shelf of the yellow sea. Deep Sea Res Part Ⅱ Top Stud Oceanogr, 57 (11-12) : 1006–1016 DOI:10.1016/j.dsr2.2010.02.002 |
| Svetlichny L S, Kideys A E, Hubareva E S, et al, 2006. Development and lipid storage in Calanus euxinus from the Black and Marmara seas: variabilities due to habitat conditions. J Mar Syst, 59 (1-2) : 52–62 DOI:10.1016/j.jmarsys.2005.09.003 |
| Tarrant A M, Baumgartner M F, Verslycke T, et al, 2008. Differential gene expression in diapausing and active Calanus finmarchicus (Copepoda). Mar Ecol Prog Ser, 355 : 193–207 DOI:10.3354/meps07207 |
| Uye S, 1988. Temperature-dependent development and growth of Calanus sinicus (Copepoda: Calanoida) in the laboratory. Hydrobiologia, 167-168 (1) : 285–293 DOI:10.1007/BF00026316 |
| Zhang G T, Sun S, Yang B, 2007. Summer reproduction of the planktonic copepod Calanus sinicus in the Yellow Sea:influences of high surface temperature and cold bottom water. J Plankton Res, 29 (2) : 179–186 DOI:10.1093/plankt/fbm005 |
| Zhou K L, Sun S, 2016b. The effect of diurnal temperature difference on lipid accumulation and development in Calanus sinicus (Copepoda: Calanoida). Chin J Oceanol Limnol, http://dx.doi.org/10.1007/s00343-017-6039-z |
| Zhou K L, Sun S, Wang M X, et al, 2016a. Differences in the physiological processes of Calanus sinicus inside and outside the Yellow Sea Cold Water Mass. J Plankton Res, 38 (3) : 551–563 DOI:10.1093/plankt/fbw011 |
 2016, Vol. 47
2016, Vol. 47


