
中国海洋湖沼学会主办。
文章信息
- 张珍妮, 姜玥璐, 李曼璐, 魏鹏骥. 2016.
- ZHANG Zhen-Ni, JIANG Yue-Lu, LI Man-Lu, WEI Peng-Ji. 2016.
- 强壮前沟藻(Amphidinium carterae Hulbert)在多重逆境条件下的生长和生理响应
- THE GROWTH AND PHYSIOLOGICAL CHANGES OF AMPHIDINIUM CARTERAE HULBERT UNDER ENVIRONMENTAL STRESSES
- 海洋与湖沼, 47(5): 982-989
- Oceanologia et Limnologia Sinica, 47(5): 982-989.
- http://dx.doi.org/10.11693/hyhz20160300068
-
文章历史
- 收稿日期:2016-03-27
- 收修改稿日期:2016-05-25
2. 清华大学 环境学院 北京 100084
2. School of Environment, Tsinghua University, Beijing 100084, China
浮游植物是海洋中主要的初级生产者, 为全球贡献了约40%的初级生产力, 在海洋生态系统中有着不可替代的地位(Bidle et al, 2004; Jiang et al, 2014)。浮游植物的生长和死亡, 不仅受到来自细胞群体外部的海洋环境, 如光、温度、盐度、营养盐等物理化学条件和捕食者、真菌、病毒等生物条件的影响, 同时也受到种群内彼此之间的影响(Vidoudez et al, 2008; Ianora et al, 2010), 使浮游植物细胞作为群体处于一种生与死的动态平衡中(Redfield, 1958; Falkowski et al, 1998)。
强壮前沟藻(Amphidinium carterae Hulbert)是一种能产生溶血性毒素的有害赤潮藻种(冀晓青等, 2012)。除了韩笑天等(2004)从生长率和细胞形态入手, 对强壮前沟藻在不同环境下的生长特性进行了研究之外, 国内对不同环境条件下强壮前沟藻的生理生化过程的研究很少。尽管单一逆境条件对浮游植物生长生理变化的影响已被广泛研究, 然而, 自然环境中常见的多重逆境条件(如大面积赤潮灾害引起的海水营养盐匮乏, 浮游植物下沉到海洋底层黑暗低温环境, 以及随时可能遭遇的温度突变等)对浮游植物的影响研究却相对匮乏。根据现有的研究成果, 无法对浮游植物群落演替和海洋生态环境变化的关系进行合理的预测与控制(郭匿春, 2007)。
本文希望通过研究多重逆境条件(黑暗、低温、氮限制和磷限制)对强壮前沟藻细胞的生理、生化影响, 估测其对多重逆境条件的生理生态响应。
1 材料与方法 1.1 藻种培养强壮前沟藻(CCMA-279)购自厦门大学近海海洋国家重点实验室海洋藻类保种中心。藻种保存在f/2培养基无硅配方中(f/2-Si)(Guillard et al, 1962), 培养温度为(20±1)℃, 光照条件为80μmol photon/ (m2·s), 光周期L/D=14︰10。实验用海水为经过0.22μm滤膜过滤的大亚湾冬季海水, 盐度为33, 海水及所用培养器皿均经高压灭菌(121℃, 20min), 保持实验藻种单种培养。培养过程中, 通过过滤空气(4258 Acro50空气过滤器, PALL, 美国)曝气防止培养基碳限制及细胞沉降的发生, 并将pH维持在8.0—8.2。
1.2 实验条件设计如表 1所示, 本次实验设定了9种培养条件, 包括三种物理环境:常温、低温、低温+黑暗; 以及三种营养条件:营养充足(f/2-Si)、缺氮(f/2-Si-N)、缺磷(f/2-Si-P); 不同的物理环境结合不同的营养条件, 得到对照组, 以及单重或多重逆境条件下的实验组。当藻细胞浓度达到对数生长末期时, 在20℃下以2500g转速离心15min(台式冷冻离心机Allegra X-15R, Beckman Coulter, 美国), 经无菌海水清洗两次后再悬浮于相应的培养基中:对照组(f/2-Si)、缺氮(f/2-Si-N)、缺磷(f/2-Si-P)。并分别放置于三种不同培养环境中(表 1), 每个实验条件下设三个平行样, 将开始分组实验的当天记为第0天。
| 组别 | 培养基 | 温度(℃) | 光周期 | |
| 常温组 | CON(常温对照) | f/2-Si | 20 | 10:14 |
| CON-N(常温缺氮) | f/2-Si-N | 20 | 10:14 | |
| CON-P(常温缺磷) | f/2-Si-P | 20 | 10:14 | |
| 低温组 | CL(低温对照) | f/2-Si | 10 | 10:14 |
| CL-N(低温缺氮) | f/2-Si-N | 10 | 10:14 | |
| CL-P(低温缺磷) | f/2-Si-P | 10 | 10:14 | |
| 低温黑暗组 | CD(低温黑暗对照) | f/2-Si | 10 | 0:24 |
| CD-N(低温黑暗缺氮) | f/2-Si-N | 10 | 0:24 | |
| CD-P(低温黑暗缺磷) | f/2-Si-P | 10 | 0:24 | |
本次研究中用藻液光密度对强壮前沟藻种群的生物量(沈萍萍等, 2001)进行观测, 以空白培养基作为对照, 使用分光光度计(UV-1780, Shimadzu, 日本)测试强壮前沟藻细胞在750波长下光密度(OD750), 按下列公式计算其生长速率:
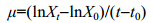
式中μ代表生长速率, Xt代表实验进行到第t天时藻细胞的OD750, X0代表实验进行到第0天时藻细胞的OD750(Sriharan et al, 1990)。
1.3.2 叶绿素a测定藻液经玻璃纤维滤膜(GF/F, Whatman, 英国)过滤, 于-20℃冷冻保存。叶绿素a含量(chl a)经90%丙酮低温4℃黑暗提取16h后利用分光光度计(UV-1780, Shimadzu, 日本)测定(Maxwell, 1984)。
1.3.3 光合作用效率测定采集后的样品避光保存15min, 用PHYTO-PAM(Walz, 德国)测试光合系统II最大光化学量子产量(Fv/Fm), 操作过程避光。
1.3.4 SYTOX Green荧光染色SYTOX Green(SYTOX® Green Nucleic Acid StainS7020, Thermo Fisher, 美国)作为一种细胞染料, 可以对不同膜透性的细胞进行不同程度的染色, 由于死亡细胞膜透性远大于活细胞, 从而可以用于死细胞鉴别(Jauzein et al, 2013; Jiang et al, 2014)。在藻细胞液中加入SYTOX Green染色剂(最终浓度为5×10-5mol/L), 样品置于96孔板, 于室温黑暗放置10min后测量荧光值, 激发光波长为480nm(多功能酶标仪SpectraMax i3x, Molecular Devices, 美国)。
1.3.5 碳、氮含量测定藻液用GF/F玻璃纤维滤膜(预先于550℃灼烧12h)过滤收集后, 于-20℃储存。在60℃烘干后用元素分析仪(Vario MACRO cube, Elementar, 德国)测定碳、氮含量, 并计算碳氮比(C/N摩尔比)。
1.4 数据处理与分析实验数据用SPSS 21.0进行统计分析, 采用2-way ANOVA Analysis(P < 0.05)对多因素逆境胁迫条件下的实验结果进行分析, 检测单一及两种耦合逆境条件对藻细胞生理生化变化的影响, 找出显著影响因素并检测两因素之间是否存在显著相关效应。
2 结果与分析 2.1 多重逆境条件对强壮前沟藻生长的影响从图 1可见, 低温组的OD750下降最为明显, 在第5天, 营养充足(CL)、氮限制(CL-N)和磷限制实验组(CL-P)分别下降至(0.17±0.03)、(0.17±0.01)和(0.21±0.02), 而此时常温光照和低温黑暗环境中这三种营养条件下的OD750分别是低温组的1.4—3倍和1.4—1.8倍。
 |
| 图 1 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻OD750值的影响 Fig. 1 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on the OD750of Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
通过Two-way ANOVA分析显示(表 2所示), 单独低温逆境并没有对OD750造成显著性影响(P=0.316), 而营养限制条件(缺氮、缺磷)(P < 0.05)、黑暗条件(P < 0.001)以及低温和营养限制两种逆境条件同时发生时(P < 0.01)对OD750有显著影响。
| 条件 | OD750 | chl a | Fv/Fm | SYTOX | C/N |
| 营养 | * | NS | NS | NS | * |
| 低温 | NS | NS | *** | *** | NS |
| 黑暗 | *** | *** | *** | *** | NS |
| 营养×低温 | ** | NS | NS | NS | ** |
| 营养×黑暗 | NS | NS | NS | NS | NS |
| 注: NS表示无显著影响; *代表P < 0.05; **代表P < 0.01; ***代表P < 0.001 | |||||
强壮前沟藻在常温条件下, 营养充足和磷限制时, 生长速率分别为(0.01±0.02)和(0.02±0.02)/天, 而其它逆境实验组(CON-N、CL、CL-N、CL-P、CD、CD-N、CD-P)的生长速率皆为负值。常温氮限制条件(CON-N)下细胞生长速率为(-0.06±0.01);低温组的三种营养盐条件下细胞生长速率分别为(-0.19±0.06)/天(CL)、(-0.17±0.02)/天(CL-N)和(-0.12±0.02)/天(CL-P); 低温黑暗组三种营养盐条件下细胞生长速率分别为(-0.07±0.00)/天(CD)、(-0.08±0.01)/天(CD-N)和(-0.05±0.00)/天(CD-P)(表 3)。
| 组别 | 时间 | 生长速率(/天) | |
| 常温组 | CON | 第0—11天 | 0.01±0.02 |
| CON-N | 第0—11天 | -0.06±0.01 | |
| CON-P | 第0—11天 | 0.02±0.00 | |
| 低温组 | CL | 第0—5天 | -0.19±0.06 |
| CL-N | 第0—5天 | -0.17±0.02 | |
| CL-P | 第0—5天 | -0.12±0.02 | |
| 低温黑暗组 | CD | 第0—11天 | -0.07±0.00 |
| CD-N | 第0—11天 | -0.08±0.01 | |
| CD-P | 第0—11天 | -0.05±0.00 | |
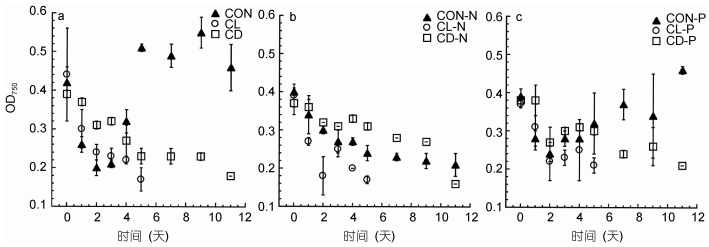
低温黑暗环境下强壮前沟藻的chl a浓度高于其它常温组及低温组, 在第11天, 三种营养条件下chl a浓度分别为(109.03±5.43)μg/L(CD)、(155.97±8.43)μg/L(CD-N)和(213.90±18.09)μg/L(CD-P)。而低温光照环境下强壮前沟藻的chl a持续下降, 不论营养条件如何chl a五天内全部下降至10μg/L以下(图 2)。根据Two-way ANOVA分析(表 2), 黑暗对chl a的浓度产生显著性影响(P < 0.001), 而营养限制条件、低温, 以及低温和营养限制条件、黑暗和营养限制条件一同发生, 对chl a浓度无显著性影响(P值均 > 0.05)。
 |
| 图 2 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻chl a值的影响 Fig. 2 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on the Chla of Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
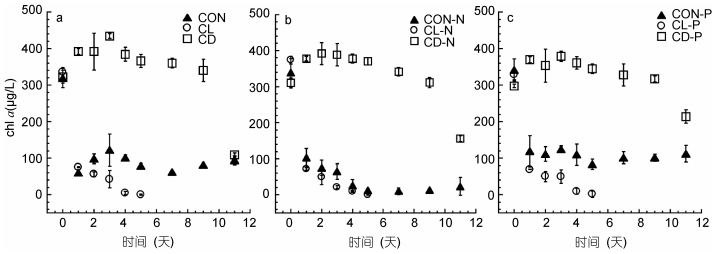
 |
| 图 3 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻Fv/Fm值的影响 Fig. 3 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on the Fv/Fmof Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
营养充足条件下常温组(CON)Fv/Fm值最高, 经过短暂的较低水平后, 第3天升高为(0.53±0.02)后较为稳定。常温光照条件下的氮限制(CON-N)和磷限制(CON-P)实验组Fv/Fm值仅次于对照组, 低温黑暗条件中强壮前沟藻的Fv/Fm虽然最终低于对照组, 但呈现缓慢上升趋势且较为稳定。而低温光照条件下实验组的Fv/Fm最低。Two-way ANOVA分析表明(表 2), 单一低温条件或黑暗条件会对Fv/Fm产生显著性影响(P < 0.001), 而其它逆境条件不会对Fv/Fm有显著性影响(P值均 > 0.05)。
2.3 SYTOX Green染色结果低温黑暗条件下营养充足、氮限制和磷限制实验组的SYTOX Green值最低, 即死亡藻细胞较少。而低温光照条件下的SYTOX Green值要高于其它条件下的实验组, 即死亡藻细胞较多。单一低温、黑暗环境条件对SYTOX Green染色结果有显著性影响(P < 0.001, 见表 2)。
2.4 多重逆境条件对强壮前沟藻颗粒碳含量和氮含量的影响常温光照环境下的实验组颗粒有机碳(particulate organic carbon, POC)、颗粒有机氮(particulate organic nitrogen, PON)较高, 而在低温环境中无论是有光照还是黑暗环境, POC都有所下降。与其它实验组相比, 低温黑暗环境实验组的POC、低温光照环境实验组的PON降低最为明显。而从C/N摩尔比来看, 无论营养条件如何, 低温黑暗实验组的C/N比最低。营养条件以及营养和低温耦合条件会对C/N产生显著性影响(P < 0.05)(表 2)。
 |
| 图 4 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻SYTOX Green染色(取对数值)的影响 Fig. 4 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on the SYTOX Green staining (logarithmic value) of Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
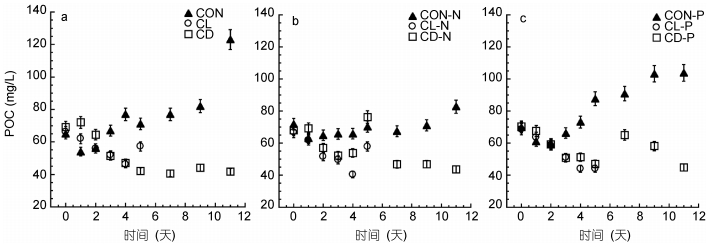 |
| 图 5 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻POC的影响 Fig. 5 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on POC of Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
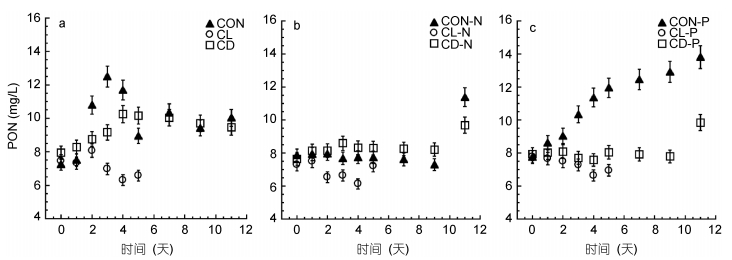 |
| 图 6 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻PON的影响 Fig. 6 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on PON of Amphidinium carterae 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
相对于营养匮乏, 本研究数据显示低温和黑暗逆境条件会对强壮前沟藻的生长、生理产生更加不利的影响, 且这两种条件在多重逆境下是主导的关键性因素, 其中, 10℃低温对强壮前沟藻的不利影响最为显著。本研究结果表明, 单独低温逆境下, 强壮前
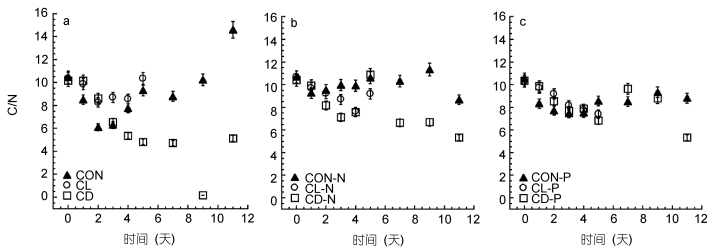 |
| 图 7 常温(CON)、低温(CL)和低温黑暗(CD)条件对强壮前沟藻C/N比的影响 Fig. 7 The effect of normal condition (CON), low temperature (CL) and cold dark environment (CD) on C/N of Amphidinium cartera 注: a.营养充足情况下; b.氮限制情况下; c.磷限制情况下 |
沟藻SYTOX Green荧光染色增强, 表明藻细胞死亡加剧, 同时Fv/Fm快速下降, 其光合活性迅速降低。其内在原因为低温胁迫可同时作用于藻细胞的基因表达、功能蛋白合成、多糖合成等多个过程, 可干扰光合作用并影响细胞的固氮能力, 当温度低于藻细胞的耐受温度时, 则会引起细胞死亡(贡保东珠, 2011; 王海燕, 2011)。除低温条件外, 黑暗作为单独逆境因素也具有致死性, 如Bidle等(2004)的研究表明, 长时间的黑暗能诱发浮游植物的细胞程序性死亡过程。从本研究看, 黑暗逆境对强壮前沟藻的OD750、chl a、Fv/Fm、SYTOX Green染色结果产生了显著性影响(P < 0.001, 如表 2所示)。
当黑暗和低温逆境条件耦合时, 强壮前沟藻的细胞死亡过程反而得以缓解, 其具体表现为在低温黑暗环境中藻细胞SYTOX Green染色强度处于较低水平, chl a稳定, Fv/Fm有所上升。据此, 进一步推断藻细胞可能处于一种“休眠”状态, 细胞内光合效率大幅度减弱的同时胞内酶活性降低, 呼吸作用得到抑制, 新陈代谢与物质损耗变慢, 从而可以帮助藻细胞保存实力, 在营养条件和光照状况好转时快速恢复生长。这一推断在前人的研究中也得到了印证, Montechiaro等(2006)将此称为微藻生物的内稳态策略(homeostatic responses), 即在极端环境下浮游植物会通过降低代谢和抑制生长繁殖来增大存活几率。魏静等(2013)研究发现, 低温黑暗环境可暂时抑制南极衣藻(Chlamydomonas sp.)细胞的生长, 并降低细胞运动速率, 同时衣藻细胞的光合作用能力得到保护, POC含量保持稳定。Peters等(1996)也发现了黑暗低温环境下四种硅藻的内稳态策略。本次实验的结果显示, 强壮前沟藻作为非极地藻亦可借助“内稳态”策略在低温黑暗环境下提高其生存概率。
营养限制和低温逆境条件耦合会对强壮前沟藻细胞内直接与物质代谢相关的生理生化指标(生物量OD750和碳氮比C/N)产生显著性影响(P < 0.01, 见表 2), 这点与营养限制或低温逆境单独作用下强壮前沟藻的生理生化表现有所不同。单独营养限制下, OD750和C/N也会受到显著性影响(P < 0.05, 见表 2), 但其显著性低于营养限制与低温并存的双重逆境条件。而单独低温条件下, 强壮前沟藻的SYTOX Green和Fv/Fm受影响显著(P < 0.001, 见表 2)。营养限制与低温逆境并同发生时, 彼此产生了耦合效应, 其效果不再是两个逆境因素单独作用于强壮前沟藻时生理生化反应的叠加。
3.2 多重逆境条件对强壮前沟藻种群的影响从种群的角度出发, 逆境条件的致死性是相对的。低温、黑暗和营养匮乏等逆境条件可以使单个藻细胞致死, 但对细胞群体却不尽然, 这与前人的研究结果一致(Berges et al, 1998)。从实验结果来看, SYTOX Green染色增强, 由此可知藻细胞作为个体死亡增加, 然而多数情况下, 存活的少数藻细胞反而可以借助死亡细胞所释放的营养物质和空间优势, 在环境转好时快速生长繁殖(Redfield et al, 1958; Falkowski et al, 1998)。从“红皇后假说”(the red queen hypothesis)的理论出发, 细胞死亡可被视为浮游植物种群调控个体数量的一种方式, 在群体遭遇逆境环境时, 部分细胞的“无私死亡”增大了群体存活的概率(Franklin et al, 2006)。对于该现象, 藻细胞除了因逆境导致“被动”死亡并释放营养物质以供存活细胞利用外, 还可能存在一定的“主动”倾向, 即其可能借助激素、化学物质等方式通过化感作用调节种间与种内关系(Hu et al, 2008; Vidoudez et al, 2008; Ianora et al, 2010)。
4 结语综上所述, 从单个浮游植物细胞的层面来看, 藻细胞内部的光合作用、新陈代谢、程序性死亡等过程相互影响, 彼此关联, 在海洋微藻生理生化研究中应给予其更全面的考虑。从赤潮预估的角度来看, 虽然氮、磷营养限制确实会对浮游植物的生理代谢、生长繁殖产生影响, 如干扰细胞的生物量和有机碳氮比, 但从本次实验结果中看, 其影响远不及低温和黑暗逆境条件。赤潮发生时, 营养盐限制并非浮游植物种群消亡、群落演替的唯一限制性因素, 低温和黑暗条件对多个生理生化指标也可产生显著影响。温度变化会导致浮游植物的突发性增殖, 影响浮游植物的群落结构与年际变化(Agawin et al, 2000; Zinser et al, 2007), 而受天气影响的光照变化会导致短时间内群落结构改变和赤潮发生。根据往年观测, 东海春季暴发大规模夜光藻(Noctiluca scientillans)、东海原甲藻(Prorocentrum micans)赤潮时大多是连日阴雨多云天气, 而夏秋季节爆发中肋骨条藻(Skeletonema costatum)赤潮时大多以晴天为主(孙霞, 2005)。在海洋环境中, 天气变化、洋流运动、气流交锋等时有发生, 光照温度条件随之变化, 进而影响赤潮的发展动态, 对赤潮预测具有重要的参考价值。
致谢 感谢陈道毅老师以及厦门大学藻种库对本次研究的支持。| 王海燕, 2011.发状念珠藻对低温胁迫的响应机制研究.兰州:兰州大学硕士学位论文, 10-13 |
| 孙霞, 2005.光照对东海赤潮高发区赤潮藻类生长的影响.青岛:中国海洋大学博士学位论文, 5-6 http://industry.wanfangdata.com.cn/jt/Detail/Thesis?id=Thesis_Y829312 |
| 贡保东珠, 2011.低温胁迫下发状念珠藻蛋白质组学的研究.兰州:兰州大学硕士学位论文, 3-4 http://cdmd.cnki.com.cn/article/cdmd-10730-1011140529.htm |
| 沈萍萍, 王朝晖, 齐雨藻, 等, 2001. 光密度法测定微藻生物量. 暨南大学学报(自然科学版), 22 (3) : 115–119 |
| 郭匿春, 2007.浮游动物与藻类水华的控制.武汉:中国科学院研究生院(水生生物研究所)博士学位论文, 11-16 |
| 韩笑天, 颜天, 邹景忠, 等, 2004. 强壮前沟藻(Amphidinium carterae Hulburt)形态特征及其生长特性研究. 海洋与湖沼, 35 (3) : 279–283 |
| 冀晓青, 韩笑天, 杨佰娟, 等, 2012. 强壮前沟藻化感物质分析. 生态学报, 32 (6) : 1745–1754 |
| 魏静, 王小冬, 2013. 南极衣藻对黑暗和低温的适应与恢复. 中国海洋大学学报, 43 (6) : 81–86 |
| Agawin N S R, Duarte C M, Agustí S, 2000. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 45 (3) : 591–600 DOI:10.4319/lo.2000.45.3.0591 |
| Berges J A, Falkowski P G, 1998. Physiological stress and cell death in marine phytoplankton: Induction of proteases in response to nitrogen or light limitation. Limnology and Oceanography, 43 (1) : 129–135 DOI:10.4319/lo.1998.43.1.0129 |
| Bidle K D, Falkowski P G, 2004. Cell death in planktonic, photosynthetic microorganisms. Nature Reviews Microbiology, 2 (8) : 643–655 DOI:10.1038/nrmicro956 |
| Falkowski P G, Barber R T, Smetacek V, 1998. Biogeochemical controls and feedbacks on ocean primary production. Science, 281 (5374) : 200–206 DOI:10.1126/science.281.5374.200 |
| Franklin D J, Brussaard C P D, Berges J A, 2006. What is the role and nature of programmed cell death in phytoplankton ecology?. European Journal of Phycology, 41 (1) : 1–14 |
| Guillard R R L, Ryther J H, 1962. Studies of marine planktonic diatoms: I. Cyclotella nana Hustedt, and Detonula confervacea (cleve) Gran. Canadian Journal of Microbiology, 8 (2) : 229–239 |
| Hu Z Q, Li D H, Xiao B, et al, 2008. Microcystin-RR induces physiological stress and cell death in the cyanobacterium Aphanizomenon sp. DC01 isolated from Lake Dianchi, China. Fundamental and Applied Limnology, 173 (2) : 111–120 |
| Ianora A, Miralto A, 2010. Toxigenic effects of diatoms on grazers, phytoplankton and other microbes: a review. Ecotoxicology, 19 (3) : 493–511 |
| Jauzein C, Erdner D L, 2013. Stress-related responses in Alexandrium tamarense cells exposed to environmental changes. Journal of Eukaryotic Microbiology, 60 (5) : 526–538 DOI:10.1111/jeu.12065 |
| Jiang Y L, Yin K D, Berges J A, et al, 2014. Effects of silicate resupply to silicate-deprived Thalassiosira weissflogii(Bacillariophyceae) in stationary or senescent phase:short-term patterns of growth and cell death. Journal of Phycology, 50 (3) : 602–606 |
| Maxwell R, 1984. Plant pigments. In: Parsons T R, Maita Y eds. A Manual of Chemical and Biological Methods for Seawater Analysis. Oxford, UK: Pergamon Press, 101-105 |
| Montechiaro F, Hirschmugl C J, Raven J A, et al, 2006. Homeostasis of cell composition during prolonged darkness. Plant, Cell and Environment, 29 (12) : 2198–2204 DOI:10.1111/pce.2006.29.issue-12 |
| Peters E, Thomas D N, 1996. Prolonged darkness and diatom mortality I: marine Antarctic species. Journal of Experimental Marine Biology and Ecology, 207 (1-2) : 25–41 DOI:10.1016/S0022-0981(96)02520-8 |
| Redfield A C, 1958. The biological control of chemical factors in the environment. American Scientist, 46 (3) : 205–221 |
| Sriharan S, Bagga D, Sriharan T P, 1990. Effects of nutrients and temperature on lipid and fatty acid production in the diatom Hantzshia DI-60. Applied Biochemistry and Biotechnology, 24-25 : 309–316 DOI:10.1007/BF02920255 |
| Vidoudez C, Pohnert G, 2008. Growth phase-specific release of polyunsaturated aldehydes by the diatom Skeletonema marinoi. Journal of Plankton Research, 30 (11) : 1305–1313 |
| Zinser E R, Johnson Z I, Coe A, et al, 2007. Influence of light and temperature on Prochlorococcus ecotype distributions in the Atlantic Ocean. Limnology and Oceanography, 52 (5) : 2205–2220 |
 2016, Vol. 47
2016, Vol. 47


