
中国海洋湖沼学会主办。
文章信息
- 张晶晶, 周进, 张怀瑾, 汪翔, 宋俊廷, 蔡中华. 2016.
- ZHANG Jing-Jing, ZHOU Jin, ZHANG Huai-Jin, WANG Xiang, SONG Jun-Ting, CAI Zhong-Hua. 2016.
- 不同营养条件下铜绿微囊藻(Microcystis aeruginosa)和小球藻(Chlorella vulgaris)的生长竞争行为
- GROWTH COMPETITION BETWEEN MICROCYSTIS AERUGINOSA AND CHLORELLA VULGARIS UNDER NUTRITION CONTROL
- 海洋与湖沼, 47(5): 1013-1023
- Oceanologia et Limnologia Sinica, 47(5): 1013-1023.
- http://dx.doi.org/10.11693/hyhz20160400085
-
文章历史
- 收稿日期:2016-04-22
- 收修改稿日期:2016-06-28
2. 清华大学深圳研究生院 深圳 518055
2. Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China
有害藻华是全球面临的三大水生生态环境问题之一(Paerl, 2014)。我国是世界上蓝藻水华暴发最严重、分布最广泛且蓝藻种类最多的国家之一(吴庆龙等, 2008), 太湖、巢湖、滇池、洱海等内陆湖泊是蓝藻藻华的高频发生区(王丹等, 2013)。藻华的频繁出现对水体生态健康都构成巨大威胁, 也对生态景观和人类生活带来潜在风险(陈楠, 2015)。以内陆四大淡水湖泊为例, 蓝藻藻华灾害不仅导致周边城市严重的供水危机(陈卫民等, 2010; Yu et al, 2014); 而且藻毒素经食物链传递积累于水产品中, 对公众健康构成威胁(例如诱发人体肝脏肿瘤和性腺功能障碍)(Li et al, 2014)。藻华事件一直是学者、公众和社会共同关心的议题(Paerl, 2014)。
过去30年里围绕蓝藻藻华展开的工作主要集中两大方面:一是形成机制(孔繁翔等, 2005; 许海等, 2011); 二是防控措施(孔繁翔等, 2006; 王志富等, 2014)。营养作为藻类生长的重要物质条件, 被多数学者认为是藻类生物量增加和藻华暴发的重要原因(Wang et al, 2015; Li et al, 2014; Scavia et al, 2014; O’Neil et al, 2013), 所以治理藻华的主要方向也是围绕控制富营养化而展开(孔繁翔等, 2006; 朱广伟, 2008)。但是单纯进行营养控制治理藻华的效果并不理想, 大规模藻华的暴发并未得到有效遏制(Paerl et al, 2013)。
从生态平衡来看, 藻华的暴发除了表现出生物量大量增加这一特点外, 还有另一个显著的特点:即单一物种占主导、多样性偏低(潘克厚等, 2004)。目前控制藻华的主要方法是针对第一个特点, 多采用降低藻类生物量和水体中叶绿素的方式(王明翠等, 2002)。然而针对第二个特点却关注不多。从生态学角度来看, 单一物种的大量生长不仅与营养相关, 也与物种之间对资源的竞争利用相关(Grover, 1991a, b)。一个良好的生态系统中不同藻之间存在竞争, 藻类跟浮游动物之间也存在捕食, 呈现此消彼长的态势, 多样性指数处在动态平衡中, 而当平衡打破时, 则有可能引发生态事件或者生态灾害(如藻华)(Steinberg et al, 1988; Qin et al, 2013)。另外, 藻华物种也通常是较为固定的几类, 如蓝藻藻华中的微囊藻属, 鱼腥藻属, 颤藻属等(Paerl, 2014), 这也表明治理藻华不仅要降低藻类生物量, 还要从根本上防止藻华生物在暴发的各个阶段获得相对的竞争优势, 才能减少藻华的暴发几率。因此, 提高共生藻的竞争优势和藻类的多样性是利用生态学原理防治藻华的可能策略。
本文结合营养和生物竞争两个方面, 考察了不同营养水平下藻类的生长竞争; 随后模拟自然水体环境, 从整体营养水平和单一重要元素(N、P)限制方式下, 探讨了藻类的竞争表现和适应行为, 以期更深入地认识藻类的营养竞争策略, 为藻华的防控提供借鉴思路。
1 材料与方法 1.1 藻种与培养基实验所用铜绿微囊藻(Microcystis aeruginosa)和小球藻(Chlorella vulgaris, FACHB-8), 均来自中国科学院水生生物研究所淡水藻种库(FACHB)。培养基为BG11 (NaNO3: 1.50g/L; K2HPO4·3H2O: 0.04g/L; MgSO4·7H2O: 0.075g/L; CaCl2·7H2O: 0.036g/L; Na2EDTA: 0.001g/L; Na2CO3: 0.02g/L; 柠檬酸: 0.006g/L; 柠檬酸铁铵: 0.006g/L; 微量元素A5溶液: 1mL/L)。为避免外源营养源的干扰, 所用玻璃器皿用10%盐酸浸泡48h, 清水冲洗后并用蒸馏水润洗3遍。实验过程中为保证培养基中的营养成分不被高压灭菌条件所破环, 采用0.22μm孔径过滤的方式进行除菌。
1.2 营养等级的设置整体营养水平下藻类的竞争实验。实验所用的基础培养基为BG11, 首先根据湖泊富营养化等级标准(王明翠等, 2002)中总氮(TN)和总磷(TP)的浓度, 将配好的BG11培养基用蒸馏水稀释到超富营养、富营养、中营养、贫营养四个营养等级, 具体稀释倍数见表 1。
| 营养等级 | BG11稀释倍数 | 稀释后培养基中 TN(mg/L) |
稀释后培养基中 TP(mg/L) |
| 超富营养 | 1/4 | 61.89 | 1.78 |
| 富营养 | 1/13 | 19.04 | 0.55 |
| 中营养 | 1/28 | 8.84 | 0.25 |
| 贫营养 | 1/280 | 0.88 | 0.03 |
N或P限制下藻类的竞争实验。单独改变BG11中N或者P的浓度, 其它成分不变, 设计不同初始N梯度(247.05mg-N/L, 61.89mg-N/L, 20.63mg-N/L, 6.88mg-N/L)和P梯度(7.12mg-P/L, 1.78mg-P/L, 0.6mg-P/L, 0.2mg-P/L)。每个梯度均设置三种培养方式:铜绿微囊藻单培养、小球藻单培养、以及两种藻共生培养, 每组均设两个平行。
接种。分别将培养至对数期的铜绿微囊藻和小球藻接种至250mL锥形瓶中(培养体积为150mL), 接种前将铜绿微囊藻和小球藻用无菌水洗涤5遍去除细胞表面吸附的营养盐。两种藻的初始接种浓度均为7×105cells/mL。培养期间温度为25℃, 光照强度为3000 lx, 光暗周期为12h : 12h。实验周期中每天定时摇动3次, 为保证光照均匀, 每天随机交换培养瓶的位置。
1.3 藻类生物量的测定参照陈慧婷等(2013)及谭啸等(2006)的方法, 采用BD FACSCaliburTM流式细胞仪进行藻细胞计数。用标准计数微珠作为内参进行标定, 利用FlowJo软件对流式结果进行藻细胞密度的分析统计。
1.4 培养基中总氮、总磷的测定总氮和总磷的测定分别采用硫酸肼还原法和钼蓝法(国家海洋局, 2007)。采用间断化学分析仪(德国DeChem-Tech/Cleverchem380)进行测定。测定前, 总氮和总磷分析用碱性过硫酸钾和过硫酸钾高温消解30min。
1.5 培养基中总氮、总磷的测定藻细胞内主要元素C、N、S的测定采用元素分析仪(德国Element/vario MACRO cube)。首先离心收集藻细胞, 并用超纯水清洗5遍去除培养基的干扰, 再将收集到的细胞进行冷冻干燥, 称取一定质量的干燥样品用元素分析仪进行测定。P元素测定用1.4中消解的方法, 称取一定量冷冻干燥的藻细胞在过硫酸钾高温消解后进行测定。
1.6 数据分析 1.6.1 铜绿微囊藻和小球藻的比增长率铜绿微囊藻和小球藻的比增长率计算公式参照文献进行(Amano et al, 2012):
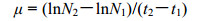 (1)
(1)式中, μ表示比增长率(d-1), t表示培养天数(d), N1、N2分别表示在培养t1、t2天后的细胞密度(cells/mL), 取对数期的比增长率作为该营养浓度下的比增长率。
1.6.2 半饱和常数的计算营养浓度对藻类比增长率的影响可用Monod方程(Zhang et al, 2014)描述, 即:
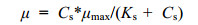 (2)
(2)式中, Cs为某一限制性营养的浓度, μ为在该浓度下的比增长率, μmax为最大比增长率, Ks为半饱和常数, 即当比增长率达到最大比增长率的一半μmax/2时所需要的营养浓度。参照Hanes-Woolf方法(崔启武, 1991)将方程(2)整理成:
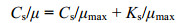 (3)
(3)令y=Cs/μ, x=Cs, 以最小二乘法对上述方程进行线性回归分析, 求出斜率1/μmax和截据Ks/μmax。斜率的倒数即为最大比增长率μmax, 斜率的倒数与截据的乘积即为半饱和常数Ks。
2 结果与分析 2.1 不同营养等级中两种藻单独培养下的生长特性图 1所示为单独培养的两种微藻在超富营养(A)、富营养(B)、中营养(C), 和贫营养(D)四个水平下的生长曲线。表 2为不同营养等级中两种藻的最大生物量和比增长率。由图 1和表 2可知, 随着营养水平的下降, 两种藻的最大生物量和比增长率整体呈现明显下降趋势。在超富营养条件下, 铜绿微囊藻和小球藻最大生物量分别为255×105和123×105cells/mL, 在富营养和中营养情况下生物量下降到(30—40)× 105cells/mL, 最为显著的变化出现在贫营养组, 两种藻的生物量急剧减少, 仅为超富营养状态下的百分之一(P < 0.01)。这表明两种藻类对营养有直接的依赖性, 营养是决定其生物量的重要因素。
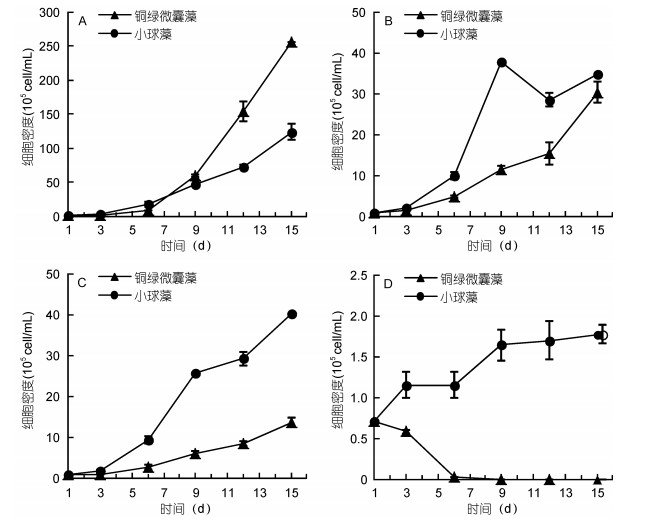 |
| 图 1 铜绿微囊藻与小球藻在不同营养水平中的生长曲线(单培养) Fig. 1 Growth curves of M. aeruginosa and C. vulgaris at different concentrations of nutrients (uni-culture) 注: A.超富营养; B.富营养; C.中营养; D.贫营养 |
| 单培养 | 超富营养 | 富营养 | 中营养 | 贫营养 | |
| 最大生物量 (105cell/mL) |
M. aeruginosa | 255.43 | 30.41 | 13.69 | 0.000 |
| C. vulgaris | 123.37 | 34.65 | 40.10 | 1.77 | |
| 比增长率 | M. aeruginosa | 0.421 | 0.269 | 0.212 | -0.604 |
| C. vulgaris | 0.369 | 0.279 | 0.289 | 0.066 | |
在超富营养水平下铜绿微囊藻的比增长率及最大生物量均显著高于小球藻, 表明铜绿微囊藻在超富营养状态下可能具有竞争优势。但是随着营养水平的下降, 铜绿微囊藻的比增长率大幅下降, 而小球藻的比增长率下降趋缓。在富营养和中营养下, 小球藻的最大生物量和比增长率均大于铜绿微囊藻。在贫营养下, 铜绿微囊藻接种后就呈现负增长, 而小球藻仍能实现生物量不同程度的增殖, 表明小球囊藻在低营养环境中的耐受能力更强, 体现一定的优势。
2.2 不同营养等级中藻类共培养的生长规律图 2所示为共培养的两种微藻在超富营养(A)、富营养(B)、中营养(C)、贫营养(D)四个水平下的生长曲线。表 3为共培养下, 两种藻的最大生物量、比增长率。
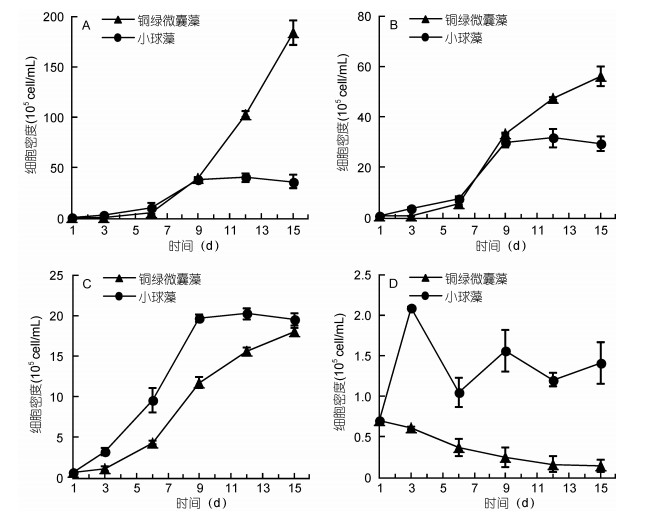 |
| 图 2 铜绿微囊藻和小球藻在不同营养水平中的生长曲线(共培养) Fig. 2 Growth curves of M. aeruginosa and C. vulgaris at different concentrations of nutrients (co-culture) 注: A:超富营养; B:富营养; C:中营养; D:贫营养 |
| 共培养 | 超富营养 | 富营养 | 中营养 | 贫营养 | |
| 最大生物量 (105cell/mL) |
M. aeruginosa | 183.99 | 56.09 | 18.02 | 0.15 |
| C. vulgaris | 36.41 | 29.61 | 19.52 | 1.41 | |
| 比增长率 | M. aeruginosa | 0.398 | 0.313 | 0.232 | -0.112 |
| C. vulgaris | 0.282 | 0.267 | 0.238 | 0.050 | |
由图 2可知, 在共培养下两种藻的生长规律与单培养时的趋势基本一致:随着营养水平的下降, 两种藻的生物量呈现数量级水平的下降, 呈现极显著差异(P < 0.01);表明在共培养条件下营养的充裕程度依旧是生物量的决定因素, 并且铜绿微囊藻的最大生物量和比增长率都比小球藻的下降得更显著。铜绿微囊藻的生物量和比增长率在超富和富营养条件下均高于小球藻, 而在中营养和贫营养条件下又低于小球藻。需要指出的是, 铜绿微囊藻和小球藻共培养时的最大生物量并非都小于单培养条件, 说明共培养环境中原因除了营养源本身, 藻类之间的也有相互作用。
2.3 两种藻在不同营养等级下胞内C、N、P、S元素的含量图 3为单培养15d后, 铜绿微囊藻和小球藻胞内C、N、P、S四种主要元素占藻细胞质量的百分比。由图可知随着营养等级的下降, 两种藻细胞内C的百分含量较为稳定; S的百分含量呈现不稳定性波动; N和P均呈现下降趋势, 这说明随着营养等级下降, 两种藻主要受到了N和P的限制。此外, 小球藻在超富营养条件下, P所占百分比较高, 在富营养、中营养和贫营养条件下迅速下降, 说明小球藻对P的依赖性比铜绿微囊藻高。
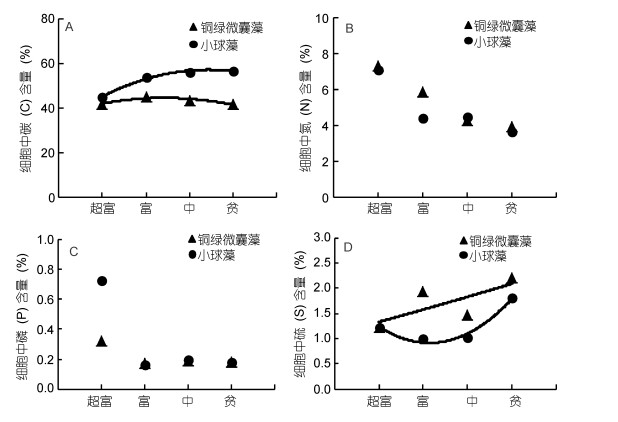 |
| 图 3 铜绿微囊藻和小球藻在不同营养水平中胞内碳、氮、磷、硫的百分含量(%) Fig. 3 The intracellular element content (%) of C, N, P, S of M. aeruginosa and C. vulgaris at different concentrations of nutrients 注: A:碳; B:氮; C:磷; D:硫 |
单位细胞消耗元素的量C=(C0– C1)/(N1– N0), 其中C0和C1分别表示培养基中初始和培养15d后的营养浓度, N0和N1分别表示初始和培养15d后藻的数量, 结果如图 4所示。需要指出的是:实验中由于在贫营养条件下接种后铜绿微囊藻逐渐消亡, 培养基中TN、TP浓度有所上升, 因此该浓度下的结果未呈现。其它组别的结果显示(图 4), 随着营养梯度的下降, 铜绿微囊藻和小球藻单位细胞对TN、TP的消耗量均呈现下降趋势。此外, 在各营养等级下, 两种藻对TN、TP的消耗量也呈现出差异:单位细胞N的消耗量, 铜绿微囊藻 > 小球藻(P < 0.05);单位细胞P的消耗量, 小球藻 > 铜绿微囊藻(P < 0.05)。
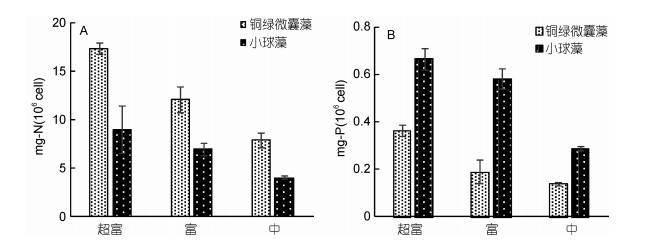 |
| 图 4 铜绿微囊藻和小球藻在不同营养水平下单位细胞N、P消耗量(单培养) Fig. 4 The consumption of N and P per cell of M. aeruginosa and C. vulgaris at different concentrations of nutrients (uni-culture) 注: A:单位细胞N的消耗; B:单位细胞P的消耗 |
两种藻在不同N和P梯度下的比增长率如表 4所示, 以Cs/μ对Cs作图, 以最小二乘法求出斜率和截据, 计算出铜绿微囊藻和小球藻在N限制和P限制下的半饱和常数Ks和最大比增长率μ, 结果如表 5所示。半饱和常数Ks是指当比增长率到达最大比增长率一半时所需要的底物浓度。
| N浓度(Cs) (mg/L) | 比增长率μ | Cs/μ | P浓度(Cs) (mg/L) | 比增长率μ | Cs/μ | |
| M. aeruginosa | 247.05 | 0.412 | 599.282 | 7.12 | 0.412 | 17.271 |
| 61.88 | 0.356 | 173.726 | 1.78 | 0.307 | 5.795 | |
| 20.63 | 0.314 | 65.786 | 0.60 | 0.299 | 2.009 | |
| 6.88 | 0.167 | 41.070 | 0.20 | 0.269 | 0.743 | |
| C. vulgaris | 247.05 | 0.300 | 823.500 | 7.12 | 0.300 | 23.724 |
| 61.88 | 0.319 | 193.966 | 1.78 | 0.229 | 7.775 | |
| 20.63 | 0.270 | 76.389 | 0.60 | 0.177 | 3.388 | |
| 6.88 | 0.242 | 28.409 | 0.20 | 0.105 | 1.914 |
| 限制元素 | 截距(Ks/μmax) | 斜率(1/μmax) | Ks | μmax | R2 | Sig.F | |
| N | M. aeruginosa | 23.69 | 2.33 | 10.17 | 0.43 | 0.9978 | 0.0002 |
| C. vulgaris | 1.66 | 3.31 | 0.50 | 0.30 | 0.9994 | 0.0003 | |
| P | M. aeruginosa | 0.77 | 2.34 | 0.33 | 0.43 | 0.9939 | 0.0031 |
| C. vulgaris | 1.63 | 3.12 | 0.52 | 0.32 | 0.9984 | 0.0008 |
在N限制时, 铜绿微囊藻的半饱和常数远大于小球藻, 表明铜绿微囊藻对N的亲和能力没有小球藻高, 小球藻在较低N浓度时依然可以保持较高的比增长率。从图 5也可看出, 在N浓度小于20mg/L时, 铜绿微囊藻受到N限制的影响更大, 其比增长率低于小球藻, 此时小球藻具有竞争优势; 当N浓度大于20mg/L时, 此时N对铜绿微囊藻的限制逐渐解除, 其比增长率大于小球藻, 此时的铜绿微囊藻具有竞争优势。
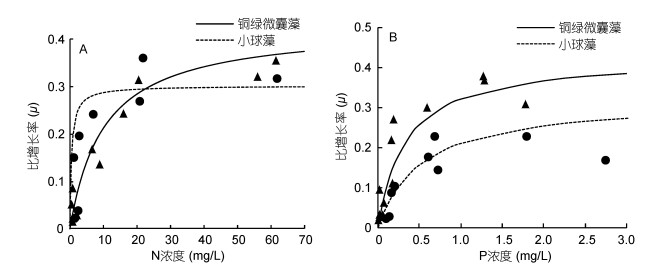 |
| 图 5 铜绿微囊藻和小球藻在N限制和P限制下Monod方程曲线 Fig. 5 The Monod functions for M. aeruginosa and C. vulgar under N or Plimitation 注: A: N限制; B: P限制; p代表铜绿微囊藻实际测量结果; ●代表小球藻实际测量结果 |
在P限制时, 铜绿微囊藻的半饱和常数小于小球藻, 说明铜绿微囊藻对P的亲和力更高, 并且铜绿微囊藻的最大比增长率大于小球藻, 因此铜绿微囊藻在P限制时具有竞争优势。
2.6 基于竞争结果的模型预测为了探究野外条件下的竞争结果, 我们借助模型预估了自然水体中的竞争行为。相比于实验室规模, 湖泊生态系统尺度更大, 可以近似认为藻类对湖泊中N和P的消耗对整个湖泊而言未产生显著影响。因此藻类在湖泊中的生长可以认为是在一个相对稳定的状态中。根据2.5中两种藻单培养计算出的动力学参数Ks和ρmax, 预测输入不同N和P浓度时, 混合培养的铜绿微囊藻和小球藻竞争结果, 如图 6所示。
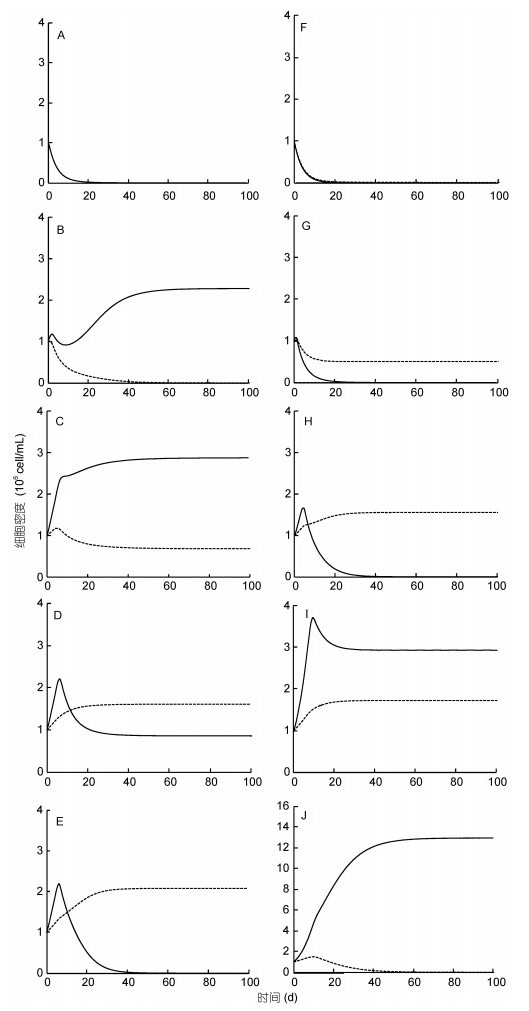 |
| 图 6 不同N和P浓度下铜绿微囊藻和小球藻的竞争结果预测 Fig. 6 The Prediction of competition results between M. aeruginosa and C. vulgaris at different concentrations of N and P 注:实线代表铜绿微囊藻, 虚线代表小球藻。图A—E: N浓度均为4mg/L, P浓度分别为0.01、0.1、0.3、0.4、0.5mg/L; 图F—J: N浓度分别为0.05、1、3、6、15mg/L, P浓度均为0.5 mg/L; A.两藻均未生长; B.铜绿微囊藻生长, 小球藻消亡; C/D.两藻稳定共存; E.小球藻生长, 铜绿微囊藻消亡; F.两藻均未生长; G/H.小球藻生长, 铜绿微囊藻消亡; I.两藻稳定共存; J.铜绿微囊藻生长, 小球藻消亡 |
竞争预测结果显示, N或者P任何一种营养较低时, 两种藻均不能较好生长(图 6A); N浓度恒定为4mg/L, 而P处在偏低条件下时, 两种藻所受到的限制都主要来自于P, 由于Ks(P):铜绿微囊藻 < 小球藻, 因此铜绿微囊藻表现出优势(图 6B)。随着P浓度的升高, 小球藻主要限制因子仍然是P, 而铜绿微囊藻受限因子由P变成了N, 由于Ks(N):小球藻 < 铜绿微囊藻, 因此两种藻竞争呈现出共存(图 6C/D)。当P更高时, 两种藻的受限因子演变为N, 此时小球藻具有优势。
同样的, 当P浓度恒定为0.5mg/L, N浓度由0.05mg/L到15mg/L时, 两种藻受限的先决因子是N随后铜绿微囊藻在一定范围依然受N限制, 而小球藻则主要受限于P, 到N浓度足够富余时, 此时两种藻的限制因子都变成了P, 因此呈现出的总体生长行为是:首先是小球藻具有优势, 然后是共存, 最后是铜绿微囊藻胜出, 占据生态位优势(图 6F—J)。
3 讨论竞争是群落结构组建的主导因子, 也是决定物种进化模式的重要因素(Choi et al, 2005)。竞争在浮游植物群落中的重要性及其作用机制一直是生态学工作者讨论的焦点(金相灿等, 2007)。浮游植物间因争夺有限的空间和资源存在竞争现象, 进而导致生态系统群落生物多样性的改变。作为衡量生态系统是否稳定的重要指标, 生物多样性常用来评估水体的生态健康(Borja et al, 2008)。一般而言, 水体中浮游藻类种类越多样, 生态系统越趋于稳定(李果等, 2011), 而当多样性降低或某一种藻类占据绝对优势时, 生态稳定性趋于临界状态, 存在藻华暴发的风险。以往对于藻华形成原因的研究多关注于营养盐, 认为富营养化是导致藻华的成因(秦伯强, 2009)。事实上, 不同的藻类对营养源的需求存在差异, 有数量上的阈值和种类上的偏好(Hansson, 1988; Miller et al, 2005), 这使得我们考虑:营养条件是诱发藻华的必要条件还是充要条件。因此, 研究营养与种间竞争关系能帮助我们对藻华的营养学理论有更多的认识, 丰富对藻华形成机制的理解。
此次实验中, 我们发现在单独培养条件下, 铜绿微囊藻和小球藻对营养盐存在明显的浓度依赖性, 在超富营养环境中分别能到达最大生物量250× 105cell/mL和100×105cell/mL, 当营养下降为原来的1/4时, 铜绿微囊藻和小球藻的生物量分别下降了88.3%和72.4%。在贫营养条件下, 铜绿微囊藻几乎不能生长, 而小球藻能实现缓慢稳定的增殖。说明营养限制时, 铜绿微囊藻受到的影响更大。铜绿微囊藻对营养浓度的高度依赖也吻合蓝藻作为原核生物对环境变化敏感的特点。
在共生培养实验中, 两者在生长特征上呈现与单独培养不同的特点, 体现竞争互作的特征。小球藻对营养浓度的改变表现得相对稳定。在贫营养水平下营养极度缺乏, 而小球藻依然呈现较为缓慢增长的状态, 说明在同等条件下小球藻能耐受营养临界值, 显示出比铜绿微囊藻更强的耐饥饿能力。值得注意的是, 两种藻的竞争过程是交互的。我们推测这种现象的形成一方面来自营养的供给受限, 另一方面也来自于铜绿微囊藻产生的藻毒素对小球藻的影响(Bittencourt-Oliveira et al, 2015)。
N、P元素为藻类进行光合作用、合成有机物提供物质基础, N、P的赋存状态和浓度共同影响着藻类的生长(陈蕾等, 2016)。因此, N、P被认为是藻类生长竞争的重要影响因子。本次工作中通过对不同营养等级中两种藻胞内C、N、P、S的百分含量测定发现随着营养等级的降低N、P的百分含量显著下降。说明N、P对两种藻的生长具有较大影响。对N、P的消耗情况进行分析发现, 两种藻对N、P的需求和同化能力呈现出较大差异。Tilman等(1981)认为最大比增长率(μmax)和半饱和常数(Ks)是评价藻类竞争能力的重要指标; 当资源有限时, 具有较小Ks和较大μmax的物种将会获得竞争优势。本文通过N、P限制实验得出了铜绿微囊藻和小球藻在N限制和P限制下的Monod方程曲线及半饱和常数、最大比增长率。由于铜绿微囊藻对N具有较高的半饱和常数以及较大的最大比增长率, 因此我们推测当N充足时铜绿微囊藻将处于竞争优势, 随着N浓度的下降, 小球藻将超越铜绿微囊藻成为优势种。Yue等(2015)通过对铜绿微囊藻在N缺乏和P缺乏的下的生长和蛋白组学分析表明, 铜绿微囊藻受N缺乏的影响更大, 而缺P条件下依然可以生长7天。本次实验从半饱和常数和比增长率的角度进一步佐证了前人的观点。
P限制实验结果发现, 铜绿微囊藻比小球藻具有更低的半饱和常数和较高的最大比增长率, 因此铜绿微囊藻无论是否受到P的限制都将具有竞争优势。Fernández等(2015)的研究结果也显示P对微囊藻属的生长并没有限制作用。这说明蓝绿藻对N的需求量大于P, N是蓝藻门的生长限制因子。本次实验中计算得出铜绿微囊藻类对N : P的消耗比在10—20之间, 这也符合浮游植物生长的Redfield指数(C︰N︰P=106︰16︰1) (Redfield et al, 1958)。对P的需求中, 小球藻对P的依赖更为明显, Belkoura等(1994)的研究表明缺N和缺P小球藻的叶绿素分别下降了44%和83%, 这进一步印证了小球藻对P的需求性。根据两种藻对N和P利用的动力学参数和生长行为, 借助模型可以对藻类竞争结果进行预测, 从而帮助我们从N源和P源这两个营养角度来认识藻华的成因以及提出相关的建议。
4 结论铜绿微囊藻和小球藻的竞争结果与营养水平相关, 整体营养水平的降低, 两种藻的生物量均呈现显著下降, 但是铜绿微囊藻对营养的依赖程度更强, 下降程度更明显。共培养实验结果也证明在营养降低时, 铜绿微囊藻在低营养水平时优势作用消失, 而小球藻优势作用凸显; 铜绿微囊藻更容易在高营养浓度条件下暴发。
通过对两种藻胞内元素百分含量以及对N、P的消耗发现, N、P是影响两种藻竞争的重要原因。进一步对两种藻的N、P营养动力学参数的测定发现, 不同营养水平下的竞争结果与两种藻对N、P营养动力学特征相关。铜绿微囊藻对N具有较高的半饱和常数和较大的比增长率, 而小球藻对P具有较高的半饱和常数和较小的比增长率, 因此我们预测限制水体中N的浓度一方面能够有效降低铜绿微囊藻的生物量, 另一方面也能提高小球藻的竞争优势, 消耗水体中的营养, 从而能够更有效地降低铜绿微囊藻藻华的风险; 限制水体中的P虽然能够降低水体中铜绿微囊藻的生物量, 但是铜绿微囊藻依然处于优势地位, 当高N浓度下依然具有再次暴发铜绿微囊藻藻华的可能。本次试验中观察到的竞争行为能帮助我们: 1)更深入地了解藻华优势种的形成原因及藻华发生与营养盐的关系, 重新审视营养控制学说的必要性和充分性; 2)指导藻华的治理, 控制N浓度或适当增加P浓度能体现生物竞争行为, 发挥生物“相生相克”的原理, 从而遏制蓝藻藻华。
| 王丹, 刘桂梅, 何恩业, 等, 2013. 有害藻华的预测技术和防灾减灾对策研究进展. 地球科学进展, 28 (2) : 233–242 |
| 王志富, 俞志明, 宋秀贤, 等, 2014. 有害藻华治理过程中改性粘土对仿刺参(Apostichopus japonicas Selenka)稚参的影响. 海洋与湖沼, 45 (2) : 233–238 |
| 王明翠, 刘雪芹, 张建辉, 2002. 湖泊富营养化评价方法及分级标准. 中国环境监测, 18 (5) : 47–49 |
| 孔繁翔, 胡维平, 范成新, 等, 2006. 太湖流域水污染控制与生态修复的研究与战略思考. 湖泊科学, 18 (3) : 193–198 |
| 孔繁翔, 高光, 2005. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考. 生态学报, 25 (3) : 589–595 |
| 朱广伟, 2008. 太湖富营养化现状及原因分析. 湖泊科学, 20 (1) : 21–26 |
| 许海, 朱广伟, 秦伯强, 等, 2011. 氮磷比对水华蓝藻优势形成的影响. 中国环境科学, 31 (10) : 1676–1683 |
| 李果, 吴晓莆, 罗遵兰, 等, 2011. 构建我国生物多样性评价的指标体系. 生物多样性, 19 (5) : 497–504 |
| 吴庆龙, 谢平, 杨柳燕, 等, 2008. 湖泊蓝藻水华生态灾害形成机理及防治的基础研究. 地球科学进展, 23 (11) : 1115–1123 |
| 陈楠, 2015.太湖沉积物微生物群落组成与物质循环及藻华暴发的相关性.北京:中国农业大学博士学位论文, 1-6 |
| 陈蕾, 李超伦, 赵增霞, 等, 2016. N/P比失衡对两种硅藻元素组成及水体中氮磷组成的影响. 海洋与湖沼, 47 (1) : 9–15 |
| 陈卫民, 戴树桂, 张清敏, 2010. 铜绿微囊藻竞争机制的探讨. 安全与环境学报, 10 (5) : 73–77 |
| 陈慧婷, 陶益, 朱佳, 2013. 藻细胞计数及死/活分析的流式细胞仪方法. 深圳职业技术学院学报, 12 (1) : 23–27 |
| 国家海洋局, 2007. GB/T 12763.4-2007海洋调查规范第4部分:海水化学要素调查. 北京: 中国标准出版社, 1-65 |
| 金相灿, 杨苏文, 姜霞, 2007. 非稳态条件下藻类种间非生物资源竞争理论及研究进展. 生态环境, 16 (2) : 632–638 |
| 秦伯强, 2009. 太湖生态与环境若干问题的研究进展及其展望. 湖泊科学, 21 (4) : 445–455 |
| 崔启武, 刘家冈, 1991. 生物种群增长的营养动力学. 北京: 科学出版社, 78-150 |
| 谭啸, 孔繁翔, 曹焕生, 等, 2006. 利用流式细胞仪研究温度对两种藻竞争的影响. 湖泊科学, 18 (4) : 419–424 |
| 潘克厚, 姜广信, 2004. 有害藻华(HAB)的发生、生态学影响和对策. 中国海洋大学学报, 34 (5) : 781–786 |
| Amano Y, Takahashi K, Machida M, 2012. Competition between the cyanobacterium Microcystis aeruginosa and the diatom Cyclotella sp. under nitrogen-limited condition caused by dilution in eutrophic lake. Journal of Applied Phycology, 24 (4) : 965–971 |
| Belkoura M, Dauta A, 1994. Stockage intracellulaire des nutriments chez l'algue verte Chlorella sorokiniana Shihira & Krauss. Annales de Limnologie-International Journal of Limnology, 30 (4) : 313–321 DOI:10.1051/limn/1994023 |
| Bittencourt-Oliveira M D C, Chia M A, de Oliveira H S B, et al, 2015. Allelopathic interactions between microcystinproducing and non-microcystin-producing cyanobacteria and green microalgae: implications for microcystins production. Journal of Applied Phycology, 27 (1) : 275–284 DOI:10.1007/s10811-014-0326-2 |
| Borja A, Bricker S B, Dauer D M, et al, 2008. Overview of integrative tools and methods in assessing ecological integrity in estuarine and coastal systems worldwide. Marine Pollution Bulletin, 56 (9) : 1519–1537 DOI:10.1016/j.marpolbul.2008.07.005 |
| Choi H G, Norton T A, 2005. Competitive interactions between two fucoid algae with different growth forms, Fucus serratus and Himanthalia elongata. Marine Biology, 146 (2) : 283–291 DOI:10.1007/s00227-004-1441-4 |
| Fernández C, Estrada V, Parodi E R, 2015. Factors triggering cyanobacteria dominance and succession during blooms in a hypereutrophic drinking water Supply reservoir. Water, Air, & Soil Pollution, 226 : 73 |
| Grover J P, 1991a. Dynamics of competition among microalgae in variable environments: experimental tests of alternative models. Oikos, 62 (2) : 231–243 DOI:10.2307/3545269 |
| Grover J P, 1991b. Resource competition in a variable environment: phytoplankton growing according to Monod's model. The American Naturalist, 138 (4) : 811–835 DOI:10.1086/285254 |
| Hansson L A, 1988. Effects of competitive interactions on the biomass development of planktonic and periphytic algae in lakes. Oral Diseases, 13 (1) : 121–128 |
| Li Y P, Tang C Y, Yu Z B, et al, 2014. Correlations between algae and water quality: factors driving eutrophication in Lake Taihu, China. International Journal of Environmental Science and Technology, 11 (1) : 169–182 DOI:10.1007/s13762-013-0436-4 |
| Miller T E, Burns J H, Munguia P, et al, 2005. A critical review of twenty years' use of the resource-ratio theory. The American Naturalist, 165 (4) : 439–448 DOI:10.1086/428681 |
| O'Neil J M, Davis T W, Burford M A, et al, 2013. The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change. Harmful Algae, 14 : 313–334 |
| Paerl H W, 2014. Mitigating harmful cyanobacterial blooms in a human-and climatically-impacted world. Life, 4 (4) : 988–1012 DOI:10.3390/life4040988 |
| Paerl H W, Otten T G, 2013. Harmful cyanobacterial blooms:causes, consequences, and controls. Microbial Ecology, 65 (4) : 995–1010 DOI:10.1007/s00248-012-0159-y |
| Qin B Q, Gao G, Zhu G W, et al, 2013. Lake eutrophication and its ecosystem response. Chinese Science Bulletin, 58 (9) : 961–970 DOI:10.1007/s11434-012-5560-x |
| Redfield A C, 1958. The biological control of chemical factors in the environment. American Scientist, 46 (3) : 205–221 |
| Scavia D, Allan J D, Arend K K, et al, 2014. Assessing and addressing the re-eutrophication of Lake Erie: central basin hypoxia. Journal of Great Lakes Research, 40 (2) : 226–246 DOI:10.1016/j.jglr.2014.02.004 |
| Steinberg C E W, Hartmann H M, 1988. Planktonic bloomforming cyanobacteria and the eutrophication of lakes and rivers. Freshwater Biology, 20 (2) : 279–287 DOI:10.1111/fwb.1988.20.issue-2 |
| Tilman D, Mattson M, Langer S, 1981. Competition and nutrient kinetics along a temperature gradient: an experimental test of a mechanistic approach to niche theory. Limnology and Oceanography, 26 (6) : 1020–1033 DOI:10.4319/lo.1981.26.6.1020 |
| Wang P F, Wang Y X, Wang C, et al, 2015. Ecological characteristics and environmental factors of phytoplankton during different seasons and in different parts of Taihu Lake. Fundamental and Applied Limnology, 187 (1) : 33–42 DOI:10.1127/fal/2015/0724 |
| Yu G L, Jiang Y G, Song G F, et al, 2014. Variation of Microcystis and microcystins coupling nitrogen and phosphorus nutrients in Lake Erhai, a drinking-water source in Southwest Plateau, China. Environmental Science and Pollution Research, 21 (16) : 9887–9898 DOI:10.1007/s11356-014-2937-1 |
| Yue D M, Peng Y K, Yin Q, et al, 2015. Proteomic analysis of Microcystis aeruginosa in response to nitrogen and phosphorus starvation. Journal of Applied Phycology, 27 (3) : 1195–1204 DOI:10.1007/s10811-014-0405-4 |
| Zhang Q, Hong Y, 2014. Effects of stationary phase elongation and initial nitrogen and phosphorus concentrations on the growth and lipid-producing potential of Chlorella sp. HQ. Journal of Applied Phycology, 26 (1) : 141–149 DOI:10.1007/s10811-013-0091-7 |
 2016, Vol. 47
2016, Vol. 47


