
中国海洋湖沼学会主办。
文章信息
- 高玮玮, 潘宝平, 闫春财. 2016.
- GAO Wei-Wei, PAN Bao-Ping, YAN Chun-Cai. 2016.
- 青蛤(Cyclina sinensis) TRAF6基因克隆及其在Poly I:C胁迫下的免疫应答
- CLONING OF CSTRAF6 GENE FROM CYCLINA SINENSIS AND IMMUNE RESPONSE UNDER POLY I: C STIMULATION
- 海洋与湖沼, 47(5): 1040-1046
- Oceanologia et Limnologia Sinica, 47(5): 1040-1046.
- http://dx.doi.org/10.11693/hyhz20160600125
-
文章历史
- 收稿日期:2016-06-15
- 收修改稿日期:2016-06-30
2. 天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387
2. College of Life Science, Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin Normal University, Tianjin 300387, China
青蛤(Cyclina sinensis)是我国近海重要的经济软体动物。近年来, 海水贝类养殖业中各种病害的爆发严重制约着行业的健康发展。因此, 开展软体动物先天性免疫识别路径方面的研究尤为重要, 能够为其免疫学理论及病害防治措施提供有价值的实验数据。
软体动物具有非特异性的先天免疫系统, 其Toll样受体(TLRs), 是一类很重要的模式识别受体, 能够识别细菌、真菌、原生动物以及病毒等病原体的侵染(Akira et al, 2006)。有研究表明, TLR3可以识别双链RNA(dsRNA)的类似物, 聚肌苷-脱氧胞苷酸(Poly I:C) (Yamamoto et al, 2003), TLR3缺陷型的小鼠还对巨细胞病毒呈易感性(Tabeta et al, 2004)。肿瘤坏死因子受体相关因子(Tumor necrosis factor receptor-associated factors, TRAFs)是衔接Toll样/白细胞介素1受体(Toll/IL-1 receptor, TIR)超家族以及肿瘤坏死因子(Tumor necrosis factor)超家族的重要分子。目前在哺乳动物中已经发现的TRAFs家族成员有7个(TRAF1-7)。Ishida等(1996)通过酵母双杂交对于CD40信号传导作用的研究时, 发现了能与CD40作用的TRAF6。其分子包括C端的指环型锌指结构, 两个TRAF型锌指结构, N端的coiled-coil结构域以及MATH(Meprin and TRAF homology)结构域。TRAF6是衔接Toll样/白细胞介素1受体(Toll/IL-1 receptor, TIR)超家族以及肿瘤坏死因子(Tumor necrosis factor)超家族的重要分子, 在动物机体的脑、心脏、肝、骨骼肌、肾脏、脾脏等组织中均能表达。
1 材料与方法 1.1 材料青蛤样品采于天津大港海域, 选取成体、形态无显著差异的个体[平均壳长(29.14±1.23)mm, 平均壳宽(19.12±0.57)mm, 平均壳高(29.52±1.47)mm]。实验前在通气海水中暂养, 海水密度1.02—1.04g/cm3, 水温21—24℃, pH 7.0, 投喂5‰小球藻, 一周后进行实验。
1.2 方法 1.2.1 青蛤转录组文库的构建及数据筛选采用Trizol法提取活体青蛤各组织总RNA, 采用QIAGEN公司的Oligotex mRNA Kits方法进行分离纯化。采用Illumina MiSeq二代测序仪完成转录组测序。对Unigene进行Pathway通路的注释和预测(Pan et al, 2015), 从中筛选得到青蛤TRAF6(Cs TRAF6)基因的类似序列。
1.2.2 侵染实验实验所用Poly I:C浓度为1μg/g。利用随机分组方法选取对照组和实验组, 每组设置10个平行试验。在实验组青蛤的闭壳肌内注射50μL Poly I:C悬液, 对照组注射等量灭菌海水。注射前准确称取青蛤闭壳肌、鳃、性腺、外套膜和肝脏各50mg, 迅速放入液氮中, 在预冷匀浆器中按质量体积比1︰9加入预冷生理盐水进行匀浆, 4°C, 4500r/min离心15min, 取上清备用。分别于注射后0h、3h、6h、9h、12h、24h、48h提取血淋巴, 4°C, 8000r/min离心10min, 收集血细胞, 加入1mL Trizol, 于–80°C超低温冰箱冷冻备用。
1.2.3 生物信息学分析利用筛选得到的青蛤CsTRAF6基因类似序列设计引物Cs TRAF6-S、CsTRAF6-A (表 1)并克隆, 测序后与GenBank核酸数据库进行BLASTX (http://www.ncbi.nlm.nih.gov)比对分析; ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)预测开放阅读框(ORF); 利用ExPASy (http://web.expasy.org/compute_pi/)在线分析蛋白质性质; 使用ProtParam分析预测蛋白质的理论分子量以及等电点; SMART (http://smart.embl-heidelberg.de/)查找蛋白质结构域; 使用ClustalX1.83对氨基酸序列进行比对, 并根据邻接法(NJ), 使用MEGA4.1构建基因的物种进化树, 采用bootstrap1000个循环检验拓扑结构的置信度。
| 引物名称 | 引物序列(5′—3′) |
| Cs TRAF6-S | CAGAACAGTGCGGGTAGT |
| Cs TRAF6-A | ACAGCCCTTTGTATGATTGG |
| β-actin-F | CACCACAACTGCCGAGAG |
| β-actin-R | CCGATAGTGATGA CCTGACC |
| Cs TRAF6-F | AGGGAGTCAGAGTCACGGT |
| Cs TRAF6-R | ACAGCCCTTTGTATGATTGG |
参考(魏星等, 2015)方法, 将青蛤闭壳肌、鳃、性腺、外套膜和肝脏的上清液与注射0h的血细胞分别置于1mL TRIZOL中用于提取总RNA, 根据TaKaRa公司的PrimerScriptTM 1st Strand cDNA Synthesis Kit反转录成cDNA, 以cDNA为模板, β-actin基因为内参基因进行实时荧光定量PCR。根据β-actin基因和克隆得到的CsTRAF6基因序列分别设计引物: β-actin-F, β-actin-R, CsTRAF6-F, CsTRAF6-R (表 1)。反应在iQ5荧光定量PCR仪上进行, 扩增体系20μL, 反应程序: 95°C预变性30s, 94°C变性5s, 60°C退火30s, 72°C延伸30s, 共40个循环。数据的处理采用2-ΔΔCT法(Livak et al, 2001), 数据分析利用SPSS软件进行。
1.2.5 Poly I:C侵染后青蛤血淋巴CsTRAF6基因的时序性表达分别在注射后0h、3h、6h、12h、24h、48h提取青蛤血淋巴细胞总RNA, 方法及引物同1.2.4。反应程序: 95°C预变性30s, 95°C变性5s, 58°C退火30s, 72°C延伸30s, 共40个循环。数据的处理采用2−ΔΔCt法, 使用SPSS软件对相同时间点实验组及对照组, 实验组及空白组的表达量进行单因素方差分析。
2 结果 2.1 CsTRAF6基因的序列分析青蛤CsTRAF6基因的ORF为2337bp, 能够编码出含有778个氨基酸的多肽。该多肽的估计分子量为86.59kDa, 估计等电点为6.16。通过SMART在线分析表明CsTRAF6编码的氨基酸包含RING型锌指结构(183—221aa), 两个TRAF型锌指结构(266—320aa, 320—377aa), coiled-coil结构域(592—624aa)以及MATH结构域(629—756aa)(图 1)。CsTRAF6基因在GenBank中的注册号为KP067203。
 |
| 图 1 青蛤TRAF6的开放阅读框及结构域 Fig. 1 The open reading frame and the structural domain of CsTRAF6 注:方框表示起始密码子, *为终止密码子, 阴影部分分别表示RING型锌指结构(183—221aa), TRAF型锌指结构(266—320aa, 320—377aa), coiled-coil结构域(592—624aa)以及MATH结构域(629—756aa) |
利用BLASTP比对表明, 青蛤CsTRAF6基因的氨基酸与栉孔扇贝TRAF6基因的同源性最高, 达到60%。与霸王花青螺Lottia gigantean TRAF6 (XP_ 009051677.1)、虾夷扇贝TRAF6基因氨基酸序列同源性分别为56%和48%。利用16个物种的TRAF6基因(图 2)构建的系统树表明, 不同物种的TRAF6基因各自聚成一支, 其中哺乳动物与软体动物的TRAF6基因明显的聚在两个分支上, 青蛤CsTRAF6基因与其它软体动物的TRAF6基因聚在一支。果蝇、对虾的TRAF6基因分别独立聚成一支。刺参与文昌鱼的TRAF6基因聚在一个分支上。由此可见, 青蛤CsTRAF6基因的分子生物学特性与软体动物在分类学上的进化地位的一致性。
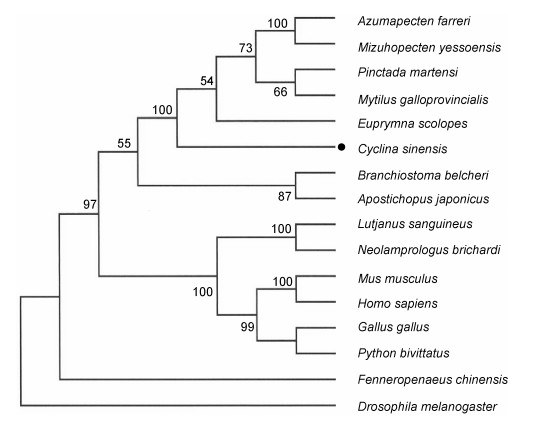 |
| 图 2 利用邻接法(NJ)建立的16个物种的TRAF6基因氨基酸序列系统进化树 Fig. 2 Phylogenetic tree of the amino acid sequences of TRAF6 from 16 species constructed using the Neighbor Joining method 注: Mus musculus TRAF6 (BAA12705.1); Python bivittatus TRAF6 (XP_007435082.1); Azumapecten farreri TRAF6 (ABC73694.1); Lutjanus sanguineus TRAF6(AIC37510.1); Apostichopus japonicas TRAF6 (AHA83604.1); Neolamprologus brichardi TRAF6 (XP_006793845.1); Fenneropenaeus chinensis TRAF6 (AFU51810.1); Homo sapiens TRAF6 (NP_665802.1); Branchiostoma belcheri TRAF6 (ABN04154.1); Mizuhopecten yessoensis TRAF6 (AFU52971.1); Pinctada martensi TRAF6 (AHC94802.1); Mytilus galloprovincialis TRAF6 (AHI17288.1);Gallus gallus TRAF6 (XP_421089.2); Cyclina sinensis TRAF6 (KP067203); Euprymna scolopes TRAF6 (AAY27978.1); Drosophila melanogaster TRAF6 (AAD47895.1) |
以青蛤β-actin基因作为内参对照, 运用Real-time PCR方法检测青蛤CsTRAF6在血淋巴、闭壳肌、鳃、性腺、外套膜和肝脏中的表达量(图 3)。结果显示, CsTRAF6在青蛤的六种组织中均能够表达, 而在血淋巴中的表达水平最高, 在闭壳肌中的表达水平次之, 在肝脏的表达量最低。
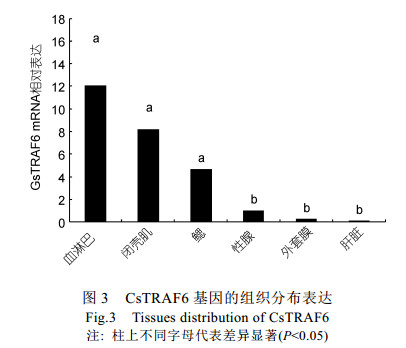 |
| 图 3 CsTRAF6基因的组织分布表达 Fig. 3 Tissues distribution of CsTRAF6 注:柱上不同字母代表差异显著(P < 0.05) |
青蛤在Poly I:C侵染后, 不同时间点的血淋巴中CsTRAF6基因相对于β-actin基因的表达变化如图 4所示。结果显示, 实验组的表达量在侵染后的3h时迅速升高; 表达量在6h时达到最大值, 与对照组相比差异显著(P < 0.05), 约为对照组的3.8倍, 并且显著高于空白组(P < 0.05)。6h后其表达量开始下降, 逐渐恢复至正常水平。
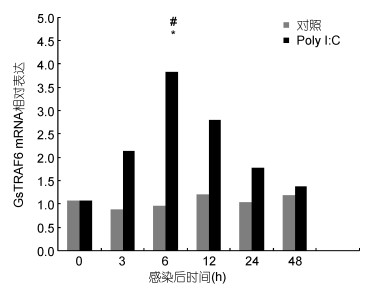 |
| 图 4 Poly I:C感染后青蛤CsTRAF6基因的相对表达量 Fig. 4 Relative expression of CsTRAF6 in C. sinensis after infection with Poly I:C 注: *表示在同一时间点下, 实验组与对照组TRAF6的相对表达量具有显著差异(P < 0.05);#表示在这一时间点下, 对照组TRAF6的相对表达量同组注射前(0h)相比差异显著(P < 0.05) |
通过青蛤转录组文库筛选得到的青蛤CsTRAF6基因的类似序列, 经克隆及二次测序后, 通过BLAST核苷酸数据库进行比对获得了青蛤CsTRAF6的cDNA序列, 其ORF为2337bp, 能够编码778个氨基酸的蛋白质。预测的CsTRAF6蛋白估计分子量为86.59kDa, 估计等电点为6.16。通过SMART在线分析CsTRAF6基因编码的氨基酸序列包含RING型锌指结构(183—221aa), 两个TRAF型锌指结构(266—320aa, 320—377aa), coiled-coil结构域(592— 624aa)以及MATH结构域(629—756aa)。这些结构域在青蛤中是保守的, 表明它们具有与哺乳动物TRAF6s基因类似的功能。相关研究表明, N端RING型锌指结构与TRAF型锌指结构用于激活IKK (Grech et al, 2000), coiled-coil结构域的作用是自动泛素化从而激活下游NF-κB信号通路(Yang et al, 2004)。此外, MATH结构域能够与通路上游信号分子IRAK相互作用(Arch et al, 1998)。
通过BLASTP比对表明青蛤CsTRAF6的氨基酸与栉孔扇贝TRAF6的同源性最高, 达60%。与霸王花青螺、虾夷扇贝TRAF6氨基酸序列同源性为56%和48%。通过MEGA构建的系统树表明, 不同物种的TRAF6基因各自聚成一支, 青蛤CsTRAF6基因与其它软体动物的CsTRAF6基因聚在一支, 脊椎动物的TRAF6基因聚在其它分支上。黑腹果蝇的TRAF6基因氨基酸序列单独在一个分支上。结果表明, 青蛤CsTRAF6基因与软体动物TRAF6基因进化距离较近, 相反与昆虫以及脊椎动物的TRAF6基因的进化距离较远, 因此, CsTRAF6基因可能是TRAF6家族的一个新成员。
本研究中利用Real-time PCR方法检测其在各个组织中的表达情况。结果显示, 青蛤CsTRAF6基因在所有的组织中普遍表达, 表明其参与多种生物学过程。青蛤像其它双壳类软体动物一样, 有一个开放的循环系统, 其体内的血液渗透压和温度会随着环境而波动。这个开放的血液循环体系对于无脊椎动物的免疫防御有关键的作用(Bigas et al, 2006)。它们可以充当吞噬细胞以及参与体液因子的分泌。CsTRAF6基因在血淋巴中的表达量最高, 这与虾夷扇贝TRAF6的表达情况相似(He et al, 2013), 这表明CsTRAF6可能在抵御病原物质感染时发挥着重要作用。然而这与栉孔扇贝TRAF6(CfTRAF6)基因在组织中的表达情况不同, 其CfTRAF6主要在性腺中表达, 表明CfTRAF6基因在扇贝的发育过程中起着重要作用。上述结果表明CsTRAF6在青蛤体内主要起到免疫作用, 亦说明不同种类软体动物的TRAF6基因在组织中的表达模式及调节功能有明显差别。
前人相关研究认为, 低等动物血液可以直接吞噬和破坏微生物(Sun et al, 2001), 而软体动物的先天免疫系统主要依靠血淋巴的循环运转(Pipe et al, 1997; Wootton et al, 2003)。在脊椎动物中, TLR3是通过识别双链RNA以及合成类似物如Poly I:C, 随后引发MyD88非依赖性途径, 从而引起干扰素的分泌(Alexopoulou et al, 2001)。TRAF6是Toll样受体信号通路中重要的信号转导分子, 本研究中的CsTRAF6基因在Poly I:C的刺激下, 其表达量在侵染后的3h便迅速升高, 说明CsTRAF6基因参与了对于Poly I:C刺激的免疫应答反应, 并且青蛤内存在于TLR3所介导的信号通路, 有关该通路在青蛤体内所发挥的免疫功能还需进一步探索。
| 魏星, 张海静, 潘宝平, 2015. 青蛤(Cyclina sinensis)IκB基因的克隆及其在鳗弧菌(Vibrio anguillarum)刺激下的表达分析. 海洋与湖沼, 46 (4) : 793–799 |
| Akira S, Uematsu S, Takeuchi O, 2006. Pathogen recognition and innate immunity. Cell, 124 (4) : 783–801 DOI:10.1016/j.cell.2006.02.015 |
| Alexopoulou L, Holt A C, Medzhitov R, et al, 2001. Recognition of double-stranded RNA and activation of NF-κB by Toll-like receptor 3. Nature, 413 (6857) : 732–738 DOI:10.1038/35099560 |
| Arch R H, Gedrich R W, Thompson C B, 1998. Tumor necrosis factor receptor-associated factors (TRAFs)-a family of adapter proteins that regulates life and death. Genes Dev, 12 : 2821–2830 DOI:10.1101/gad.12.18.2821 |
| Bigas M, Durfort M, Poquet M, 2006. Cytological response of hemocytes in the European flat oyster, Ostrea edulis, experimentally exposed to mercury. Biometals, 19 (6) : 659–673 DOI:10.1007/s10534-006-9003-5 |
| Grech A, Quinn R, Srinivasan D, et al, 2000. Complete structural characterisation of the mammalian and Drosophila TRAF genes: implications for TRAF evolution and the role of RING finger splice variants. Mol Immunol, 37 (12-13) : 721–734 DOI:10.1016/S0161-5890(00)00098-5 |
| He C B, Wang Y, Liu W D, et al, 2013. Cloning, promoter analysis and expression of the tumor necrosis factor receptor-associated factor 6 (TRAF6) in Japanese scallop(Mizuhopecten yessoensis). Mol Biol Rep, 40 (8) : 4769–4779 DOI:10.1007/s11033-013-2573-8 |
| Ishida T, Mizushima S I, Azuma S, et al, 1996. Identification of TRAF6, a novel tumor necrosis factor receptor-associated factor protein that mediates signaling from an aminoterminal domain of the CD40 cytoplasmic region. J Biol Chem, 271 (46) : 28745–28748 DOI:10.1074/jbc.271.46.28745 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCT methods. Methods, 25 : 402–408 DOI:10.1006/meth.2001.1262 |
| Pan B P, Ren Y P, Gao J, et al, 2015. De novo RNA-Seq analysis of the venus clam, Cyclina sinensis, and the identification of immune-related genes. PLoS One, 10 (4) : e0123296 DOI:10.1371/journal.pone.0123296 |
| Pipe R K, Farley S R, Coles J A, 1997. The separation and characterisation of haemocytes from the mussel Mytilus edulis. Cell Tissue Res, 289 (3) : 537–545 DOI:10.1007/s004410050899 |
| Sun H S, Li G Y, 2001. Humoral factors of bivalves participating in immunity defence. Marine Sciences, 25 (4) : 34–36 |
| Tabeta K, Georgel P, Janssen E, et al, 2004. Toll-like receptors 9 and 3 as essential components of innate immune defense against mouse cytomegalovirus infection. Proc Natl Acad Sci USA, 101 (10) : 3516–3521 DOI:10.1073/pnas.0400525101 |
| Wootton E C, Dyrynda E A, Ratcliffe N A, 2003. Bivalve immunity:comparisons between the marine mussel (Mytilus edulis), the edible cockle (Cerastoderma edule) and the razor-shell (Ensis siliqua). Fish Shellfish Immunol, 15 (3) : 195–210 DOI:10.1016/S1050-4648(02)00161-4 |
| Yamamoto M, Sato S, Hemmi H, et al, 2003. Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway. Science, 301 (5633) : 640–643 DOI:10.1126/science.1087262 |
| Yang K, Zhu J M, Sun S G, et al, 2004. The coiled-coil domain of TRAF6 is essential for its auto-ubiquitination. Biochem Biophys Res Commun, 324 (1) : 432–439 DOI:10.1016/j.bbrc.2004.09.070 |
 2016, Vol. 47
2016, Vol. 47


