中国海洋湖沼学会主办。
文章信息
- 赵婷, 韩笑天, 詹天荣, 赵卫红. 2016.
- ZHAO Ting, HAN Xiao-Tian, ZHAN Tian-Rong, ZHAO Wei-Hong. 2016.
- 温度对四种产油微藻生长和油脂特性的影响
- EFFECT OF TEMPERATURE ON GROWTH AND LIPID PROPERTIES OF FOUR OIL-PRODUCING MICROALGAE
- 海洋与湖沼, 47(6): 1140-1148
- Oceanologia et Limnologia Sinica, 47(6): 1140-1148.
- http://dx.doi.org/10.11693/hyhz20160500102
-
文章历史
- 收稿日期:2016-05-06
- 收修改稿日期:2016-08-01
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071;
3. 青岛海洋科学与技术国家实验室 青岛 266237
2. Key laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
能源危机与环境问题的日益加剧, 使人们越来越关注清洁的可再生能源。生物柴油作为可再生能源的一种, 因其众多的优点已日渐成为石油燃料的替代品(黄超雄等, 2012; Rashid et al, 2014)。在众多的生物柴油原料中, 微藻被认为是最有潜力制成生物柴油的生物质资源(李元广等, 2009; Mofijur et al, 2013)。微藻中油脂含量可观, 且微藻脂肪酸一般由14-20个碳链组成, 与生物柴油的14-18个左右的碳链数相近(韩笑天等, 2008; 李华等, 2011), 所以从微藻中提取得到的油脂成分可以作为生物柴油直接应用于工业上, 具有广泛的应用价值。由微藻油脂制备生物柴油正日益被视为一个可持续和可行的替代陆地生物能源作物的常规原料(Doan et al, 2011)。因此开发微藻油脂是可持续利用海洋资源, 解决能源危机及环境污染的最佳选择之一。
微藻除作为生物柴油的原料之外, 也是高价值化学药品和医药品的重要来源。微藻中的多不饱和脂肪酸(PUFA)尤其是二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)对海洋动物和人类都具有营养学和医学上的价值(叶丽等, 2015)。DHA俗称“脑黄金”, 是人体必需脂肪酸, 可以维持神经系统生长, 促进胎儿大脑发育及视网膜光感细胞的成熟, 在治疗癌症、炎症和老年痴呆方面有明显疗效。EPA属于Ω-3系列多不饱和脂肪酸, 可以降低胆固醇, 促进人体内饱和脂肪酸的代谢, 而且和DHA共同作用可以防止血管壁上的垃圾堆积, 预防动脉粥状硬化(李荷芳等, 1999; 石娟等, 2004)。在水产养殖上, DHA和EPA又是水产经济动物幼体生长发育所必需的营养元素, 可作为饵料饲养鱼虾贝类(Watanabe et al, 1983; 高秀芝等, 2014)。
海洋微藻脂肪酸的组成和含量不仅受自身遗传因素的控制, 在很大程度上也受到环境因子的影响, 在诸多环境效应中, 温度是一个非常重要的影响因素(李文权等, 2003; 石娟等, 2004; 蒋汉明等, 2005)。微藻细胞内的各种生化反应, 酶的活性等都与温度的调控直接有关。在适温范围内, 升温可使微藻的生长加快, 降温使微藻的生长速率降低。温度过高或者过低都会对这些生理活动产生影响, 甚至威胁到微藻的存亡。本实验室经过多年研究, 已经确定了部分藻株的油脂含量。本文从已确定藻株中选取了4株富油微藻, 分别为三株海洋微藻-三角褐指藻(Phaeodactylum tricornutum, CCMM 2012)、小球藻(Chlorella vulgaris, CCMM 4004)、微拟球藻(Nannochloropsis sp., CCMM 6004), 和一株淡水微藻-栅藻(Scenedesmus quadricauda, CCMM 4002), 研究了温度对4株微藻的生长、总脂含量及脂肪酸组成的影响, 旨在为规模化利用提供理论依据。
1 材料与方法 1.1 藻种本实验所采用藻种三角褐指藻(P. tricornutum, CCMM 2012), 小球藻(C. vulgaris, CCMM 4004), 微拟球藻(Nannochloropsis sp., CCMM 6004), 栅藻(S. quadricauda, CCMM 4002), 由中国科学院海洋研究所海洋生态与环境科学重点实验室藻种库提供。
1.2 培养条件三角褐指藻、微拟球藻、小球藻三株海洋微藻用L1培养基培养, 栅藻用BG11培养基培养(Thiansathit et al, 2015)。接种对数生长期的藻种, 每1L海水/淡水里接种100mL藻液, 初始密度分别为2.2×106、4×105、7.1×106和5×105ind./mL, 培养瓶置于GXZ-280C-CO2-LED型光照培养箱中培养, 光暗周期为12h/12h, 光照20000lux, 光照培养箱腔体内通入5%的CO2, 实验设定15、20、25℃三个温度组, 每个温度设置三个平行。
1.3 细胞生长和单位体积油脂产率的测定和计算取0、3、6、9和12天藻液, 采用血球计数板法测定藻细胞密度, TD-700活体荧光计测定荧光值, PHS-3C型pH计测定pH。称重法测生物量(王付冬等, 2010; 叶丽等, 2015), 藻液于4℃离心机6000r/min离心10min, 蒸馏水洗涤2次, 离心、收集藻泥, -80℃冷冻干燥, 称重。总脂含量=(m2-m1)/m×100%计算, 其中m为试样质量, g; m1为提脂瓶质量, g; m2为提脂瓶与样品所含总脂质量, g; 单位体积油脂产率(mg/L/d)=(mt×Lt-m0×L0)/t×1000, 其中mt为终生物量, g/L; Lt为收获时总脂含量; m0为接种时干重, g/L; L0为接种时总脂含量; t为培养时间。
1.4 GC-MS样品制备与测定总脂抽提与测定(Bligh et al, 1959; 徐继林等, 2006; Berndmeyer et al, 2014):干燥后的藻粉液氮研磨, 称取10mg (m)藻粉, 用3mL CH3OH-CHCl3 (v︰v=2︰1)提取, 超声5min, 4℃离心15min, 有机相倒入分液漏斗中, 残渣再加3mL CH3OH-CHCl3 (v︰v=2︰1), 超声, 离心, 重复提取直至提取物颜色很浅。合并有机相至分液漏斗中加2.5mL CHCl3和3mL 1%NaCl混匀, 静置分层, 回收下层。再加2.5mL CHCl3于原上层中再萃取, 重复两次。下层液置于提脂瓶(m1)中, 氮吹至恒重, 于天平称量得到海藻总脂和提脂瓶的总重量(m2)。重量法计算总脂类的含量w=(m2-m1)/m×100%。
脂肪酸甲酯的测定(李秀波等, 2010; 尹琳琳等, 2010; 梁英等, 2013):将提取的总脂置于10mL具塞试管中, 加入KOH-CH3OH溶液2.0mL, 置于75℃水浴环境下皂化60min, 皂化过程中每隔10min振荡一次; 将皂化好的样品取出冷却至室温后加入HCl-CH3OH (v︰v=1︰9)溶液2.0mL, 混匀, 在60℃水浴甲酯化20min, 甲酯化过程中每隔10min振荡一次; 将甲酯化好的样品冷却后加入饱和食盐水3.0mL, 加入正己烷1.0mL, 充分振荡, 静置, 取正己烷层用无水硫酸钠脱水后进行色谱分析。
色谱分析:毛细管色谱柱HP-5MS (30m× 250cm× 0.25um), 进样口温度280℃, 起始温度为50℃, 保持1min, 以20℃/min升至190℃, 再以4℃/min升至240℃, 然后以10℃/min升至280℃, 维持2min。不分流, 进样量1μL。通过与标准脂肪酸(Sigma)保留时间的对比鉴别各脂肪酸组分, 外标法计算各组分含量。
2 结果 2.1 温度对四种微藻生长的影响在整个培养过程中, 三角褐指藻在25℃下细胞生长最好。培养第3天和第6天时, 三角褐指藻25℃下的藻密度分别为8.1×106和1.2×106ind./mL, 远高于15℃(4.4×106和7.5×106ind./mL)和20℃(3.5×106和5.2×106ind./mL)下的藻密度, 其中第9天时细胞密度达到最高值1.3×106ind./mL, 几乎为15℃和25℃下的细胞密度(7.7×106和6.7×106ind./mL)的两倍。培养到第12天时, 微藻在25℃下进入生长衰退期, 20℃下到达生长平缓期, 15℃微藻继续生长, 这说明三角褐指藻在25℃时可以快速生长到达其生长最大值, 温度较低时先缓慢生长等其适应低温后再开始快速生长(图 1)。小球藻对温度的适应范围较广, 5-30℃均可正常生长, 20℃为最适宜生长温度。本实验在小球藻培养过程中, 前6天其生长密度在15和20℃下约为2.8×106ind./mL; 第6天之后, 20℃下小球藻快速生长到第12天达9.3×106ind./mL; 而15℃时小球藻在第9天开始快速生长, 第12天细胞密度为6.2×106ind./mL; 25℃培养下的小球藻整个生长过程均缓慢(图 1); 微拟球藻在25℃条件下生长最快, 第9天时细胞数达到最大值4.8×106ind./mL, 远高于15℃(3.3×106ind./mL)和20℃(2.7×106ind./mL)下的藻密度, 第9天之后细胞逐渐进入衰亡期。前6天微拟球藻在20℃下的细胞密度要高于15℃的密度, 第6天之后其在15℃下生长加快, 到第9天和第12天时15℃下的藻密度分别为3.3×106和3.6×106ind./mL, 均高于20℃下的藻密度。本实验中微拟球藻在25℃下生长最快, 第12天已到衰退期, 根据生长曲线走势, 微拟球藻在15℃和20℃下仍有可能继续生长(图 1); 栅藻在25℃高温下更适宜生长, 此温度下细胞数量达到最大值为2.5×106ind./mL。整个培养过程中, 栅藻在15℃下细胞数量从刚开始接种时的最低5.9×105ind./mL到第9天时的最高值1.2×106ind./mL, 数量增长不到两倍。由此看出, 栅藻的最适生长温度为25℃, 低于20℃或高30℃均不适合栅藻的生长(图 1)。
 |
| 图 1 温度对三角褐指藻(P. tricornutum)、小球藻(C. vulgaris)、微拟球藻(Nannochloropsis sp.)和栅藻(S. quadricauda)生长的影响 Fig. 1 Effect of temperature on the growth of P. tricornutum, C. vulgaris, Nannochloropsis sp., and S. quadricauda |
综上所述, 三角褐指藻、微拟球藻和栅藻的最适生长温度为25℃, 小球藻的最适温度为20℃。
2.2 温度对四种微藻油脂产率的影响三角褐指藻在15℃和25℃下的油脂产率分别为2和2.29mg/L/d, 其中在20℃下油脂产率最多, 为2.94mg/L/d (图 2)。小球藻在15℃下油脂产率最少, 为2.78mg/L/d, 20℃和25℃下油脂产率相对较多, 分别为5.79和5.02mg/L/d (图 2)。微拟球藻20℃下油脂产率最少, 仅为1.85mg/L/d, 而15℃和25℃的油脂产率较多, 分别为5.43和6.45mg/L/d (图 2)。栅藻在低温15℃下油脂产率为2.38mg/L/d, 在20 ℃下最多, 为5.83mg/L/d, 25℃稍微有所降低, 为5.44mg/L/d (图 2)。
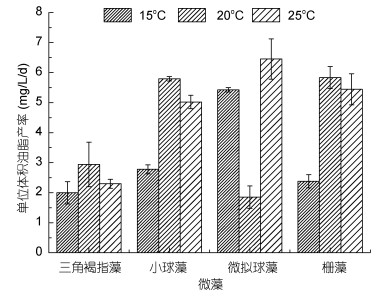 |
| 图 2 温度对三角褐指藻(P. tricornutum)、小球藻(C. vulgaris)、微拟球藻(Nannochloropsis sp.)和栅藻(S. quadricauda)单位体积油脂产率的影响 Fig. 2 Effect of temperature on the oil yield per volume of P. tricornutum, C. Vulgaris, Nannochloropsis sp., and S. quadricauda |
由上可知, 三角褐指藻、小球藻和栅藻在20℃下油脂产率最多, 而微拟球藻在25℃下油脂产率最多。
2.3 温度对四种微藻C14-C18组分含量的影响三角褐指藻在15、20和25℃三个温度下的C14-C18组分含量分别为44.45%、39.02%和46.27%(图 3)。小球藻培养在15、20和25℃下的C14-C18组分含量随温度升高而增多, 分别为22.08%、30.87%和35.12%(图 3)。微拟球藻在15和20℃下的C14-C18组分含量分别为20.1%和40.26%, 25℃下C14-C18组分含量最多, 达到71.23%(图 3)。栅藻在15、20和25℃的C14-C18组分含量分别为15.88%、23.88%和25.36%(图 3)。
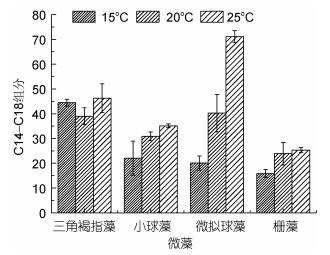 |
| 图 3 温度对三角褐指藻(P. tricornutum)、小球藻(C. vulgaris)、微拟球藻(Nannochloropsis sp.)和栅藻(S. quadricauda) C14-C18组分含量的影响 Fig. 3 Effect of temperature on C14-C18 content for P. tricornutum, C. Vulgaris, Nannochloropsis sp., and S. quadricauda |
所以, 四种微藻均在25℃下C14-C18组分最多。
2.4 温度对四种微藻脂肪酸含量及组成的影响在微藻中共检出17种主要脂肪酸, 其中饱和脂肪酸(SFA) 6种、单不饱和脂肪酸(MUFA) 4种、多不饱和脂肪酸(PUFA)7种, 其中多不饱和脂肪酸主要含有C20:5(EPA)、C22:6(DHA)组分。
三角褐指藻细胞中饱和脂肪酸(SFA)在三个温度下所占脂肪酸的比例分别为13.44%、15.24%和15.89%, 单不饱和脂肪酸(MUFA)的百分比15℃下最多, 为38.54%, 20℃和25℃下分别为21.98%和28.52%, 多不饱和脂肪酸(PUFA)不同温度下的百分含量分别为24.94%、22.99%和21.43%。对三角褐指藻来说, 25℃最有利于饱和脂肪酸(SFA)的积累, 15 ℃最有利于单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的积累(图 4)。小球藻细胞中饱和脂肪酸(SFA)在三个温度下所占比例分别为21.25%、20.6%和20.01%, 单不饱和脂肪酸(MUFA)不同温度下的百分含量为8.05%、9.54%和9.08%, 多不饱和脂肪酸(PUFA)的百分比为12.06%、18.46%和22.18%。对小球藻来说, 15℃最有利于饱和脂肪酸(SFA)的积累, 20℃最有利于单不饱和脂肪酸(MUFA)的积累, 25℃最有利于多不饱和脂肪酸(PUFA)的积累(图 5)。微拟球藻细胞中饱和脂肪酸(SFA)在三个温度下所占比例15℃最少为9.28%、25℃最多为30.1%, 20℃为15.26%, 单不饱和脂肪酸(MUFA)不同温度下的百分含量为10.69%、24.26%和34.98%, 多不饱和脂肪酸(PUFA)的百分比为14.07%、23.18%和32.55%。对微拟球藻来说, 25℃最有利于饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的积累, 且含量都是随着温度的升高而增多(图 6)。栅藻细胞中饱和脂肪酸(SFA)在三个温度下所占比例15℃最少为9.37%, 20和25℃分别为13.18%和15.09%, 单不饱和脂肪酸(MUFA)不同温度下的百分含量分别为6.48%、9.21%和9.19%, 多不饱和脂肪酸(PUFA)的百分比为10.25%、12.74%和14.1%。对栅藻来说, 25℃最有利于饱和脂肪酸(SFA)和多不饱和脂肪酸(PUFA)的积累, 20℃最有利于单不饱和脂肪酸(MUFA)的积累(图 7)。
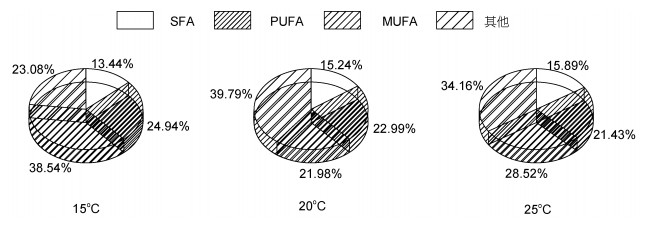 |
| 图 4 温度对三角褐指藻(P. tricornutum)饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)百分含量的影响 Fig. 4 Effect of temperature on the percentages of saturated fatty acids (SFA), monounsaturated fatty acids (MUFA), and polyunsaturated fatty acids (PUFA) in P. tricornutum |
 |
| 图 5 温度对小球藻(C. vulgaris)饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)百分含量的影响 Fig. 5 Effect of temperatures on the percentage of saturated fatty acids (SFA), monounsaturated fatty acids (MUFA), and polyunsaturated fatty acids (PUFA) in C. vulgaris |
 |
| 图 6 温度对微拟球藻(Nannochloropsis sp.)饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)百分含量的影响 Fig. 6 Effect of temperature on the percentages of saturated fatty acids (SFA), monounsaturated fatty acids (MUFA), and polyunsaturated fatty acids (PUFA) in Nannochloropsis sp. |
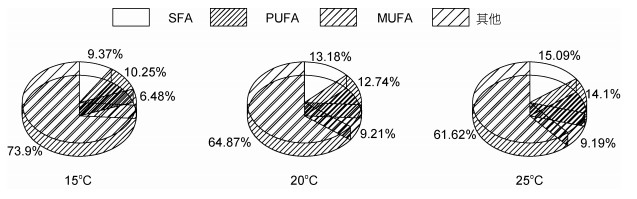 |
| 图 7 温度对栅藻(S. quadricauda)饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)百分含量的影响 Fig. 7 Effect of temperature on the percentages of saturated fatty acids (SFA), monounsaturated fatty acids (MUFA), and polyunsaturated fatty acids (PUFA) in S. quadricauda |
三角褐指藻在15、20和25℃三个温度下的EPA含量分别为14.66%、12.32%和10.2%, DHA含量普遍较少, 分别为1.81%、1.79%和1.76%(图 8)。小球藻在15、20和25℃下EPA和DHA含量普遍较少, 其中EPA含量分别为1.11%、1.14%和1.01%, DHA含量为1.39%、1.45%和1.28%(图 8)。微拟球藻的EPA含量随温度升高而增多, 分别为6.22%、12.97%和21.29%, DHA含量分别为1.37%、1.42%和1.45%(图 8)。栅藻在15、20和25℃下的EPA和DHA含量都较少, EPA在三个温度下含量为1.21%、1.15%和1.20%, DHA含量分别为1.51%、1.60%和1.47%(图 8)。
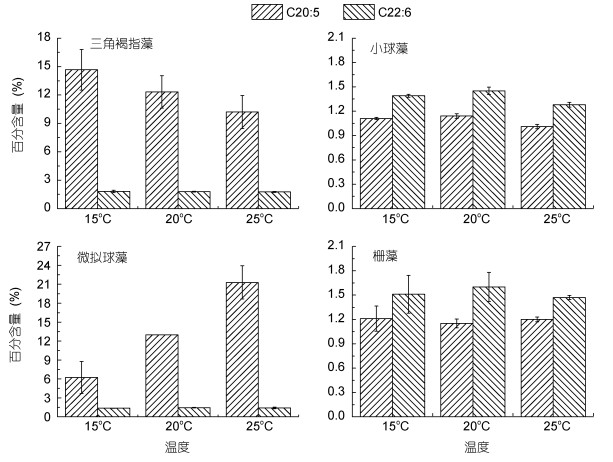 |
| 图 8 温度对三角褐指藻(P. tricornutum)、小球藻(C. vulgaris)、微拟球藻(Nannochloropsis sp.)和栅藻(S. quadricauda)中C20:5(EPA)和C22:6(DHA)含量的影响 Fig. 8 Effect of temperature on C20:5(EPA) and C22:6(DHA) contents in P. tricornutum, Chlorella vulgaris, Nannochloropsissp., and S. quadricauda |
综上所述, 对三角褐指藻来说, 25℃最有利于饱和脂肪酸(SFA)的积累, 15℃最有利于单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)(包括DHA和EPA)的积累; 对小球藻来说, 15℃最有利于饱和脂肪酸(SFA)的积累, 20℃最有利于单不饱和脂肪酸(MUFA)的积累, 25℃最有利于多不饱和脂肪酸(PUFA)的积累, EPA和DHA在三个温度下含量普遍较少; 对微拟球藻来说, 25℃下饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)积累最多, DHA和EPA也都是在25℃下最多, 且含量都是随着温度的升高而增多; 对栅藻来说, 25℃最有利于饱和脂肪酸(SFA)和多不饱和脂肪酸(PUFA)的积累, 20℃最有利于单不饱和脂肪酸(MUFA)的积累, EPA和DHA含量都较少。
3 讨论微藻细胞内的生化反应、酶的活性等都对温度特别敏感, 都与温度的调控有着直接关系, 每一个微藻都有一个生长繁殖最快, 代谢活动最旺盛的最适温度生长范围。通常, 在微藻能够生长的温度范围内, 升高温度可使微藻的生长加快, 降低温度使微藻的生长速率降低。但是, 温度过高( > 30℃)或过低( < 5℃)微藻几乎都不生长, 甚至死亡。微藻中的脂质含量与细胞内ω-3脱氢酶的活性有关, 温度能够调节ω-3脱氢酶的活性(石娟等, 2004)。在低温胁迫条件下, 藻体内的不饱和脂肪酸的含量会增加, 以维持细胞膜的流动性, 保证细胞活动的正常进行, 而饱和脂肪酸则与之相反(Renaud et al, 2002), 但并不是说所有的微藻都符合这一规律。本文所研究的三角褐指藻与梁英等(2013)、臧正荣等(2015)和潘瑾等(2010)的研究结果均显示在20-25℃之间三角褐指藻生长最旺盛, 生物量最多。三角褐指藻在20℃下油脂产率最多, 在15℃下总脂含量最多, 而且这个温度最有利于单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)(包括EPA和DHA)的积累, 而25℃时饱和脂肪酸(SFA)和C14-C18组分的脂肪酸含量最多, 这与前文的研究规律保持一致。蒋霞敏(2002)指出微拟球藻具有0-30℃广泛的温度适应性, 本实验中25℃下的微拟球藻生长最快, 生物量最大, 总脂含量和油脂产率也最多, 25℃下最有利于饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的积累, 且含量都随温度的升高而增多, 显然与上文所说的规律并不完全相符, 不饱和脂肪酸并不是在低温下含量最多。吴松(2008)和杨桂娟等(2009)等提出了小球藻在5-30℃下均可正常生长, 25℃为最适宜生长温度。本研究中25℃下培养的小球藻整个过程生长缓慢, 与前人所说的小球藻的最适宜生长温度为25℃这一结论相悖, 而且脂肪酸积累为15℃饱和脂肪酸(SFA)的积累量最多, 20℃油脂产率最多且这个温度下最有利于单不饱和脂肪酸(MUFA)、EPA和DHA两种多不饱和脂肪酸的积累, 25℃最有利于C14-C18的脂肪酸含量的积累。郑忠明等(2008)和晁建颖等(2011)的研究结果显示低于20℃或高于30℃均不适合栅藻的生长, 本文研究发现栅藻20℃的油脂产率最多, 栅藻的最适生长温度为25℃。栅藻各个培养时期也均是25℃高温下油脂含量最多, 其中饱和脂肪酸(SFA)、多不饱和脂肪酸(PUFA)和C14-C18组分含量最多。小球藻和栅藻的研究结果与前文的油脂积累规律不符, 这可能是所采用的实验条件不同, 本实验采用了高光照强度和通入CO2控制pH等手段, 目的是缩短微藻的生长周期, 使其尽快达到生长平缓期, 这无疑对微藻细胞在数量上的增多是有益的, 但对于藻细胞内的生化反应的影响则可能导致不一样的实验结果。
海洋微藻的脂肪酸组成及含量受自身遗传因素的影响, 不仅不同种类微藻的脂肪酸组成差别很大, 甚至同一种类不同品系之间也存在很大的差别。同时也会因为环境因素的改变而变化, 不同藻纲的脂肪酸组成存在一定的特点(陈百灵, 2011; 吴伟伟, 2012)。硅藻纲(Bacillariophyceae)的主要脂肪酸为C14:0、C16:0、C16:1、C18:2、C18:1、C20:5(EPA)和C22:6(DHA), 以上7种脂肪酸总含量可以占到总脂肪酸的一半以上。统计分析表明, 正常生长条件下, 硅藻的平均油脂含量为22.7%, 而胁迫条件下, 可以实现总脂含量保持在44.6%(Hu et al, 2006)。绿藻纲(Chlorophyceae)的主要脂肪酸组成为C14:1、C16:0、C16:1、C18:3、C18:2、C18:1、C18:0、C19:0和C20:5(EPA), 单不饱和脂肪酸和多不饱和脂肪酸含量较高, 一般主要是C16和C18类。数据表明, 含油绿藻平均总脂含量为25.5%, 当绿藻细胞遭受不利的培养条件, 如光氧化压力或营养缺乏时, 脂质含量会大大增加(双倍或三倍)。平均来说, 含油绿藻在压力条件下生长获得的总脂质含量为45.7%(Hu et al, 2006)。真眼点藻纲(Eustigmatophyceae)的主要脂肪酸组成为C14:0、C16:0、C16:1、C18:3、C18:1和C20:5(EPA), 尤其以C16:0、C16:1和C20:5(EPA)含量最多。
本文四株微藻中三角褐指藻属于硅藻纲, 小球藻和栅藻属于绿藻纲, 微拟球藻属于真眼点藻纲, 温度对不同类别微藻的脂肪酸含量影响不同。微藻中脂肪酸的合成比较复杂, 主要通过乙酰辅酶A羧化酶和脂肪酸合成酶两个酶系的反应进行, 一般有ω-3和ω-6两条合成途径, 两条途径的产物均以二酯酰甘油的形式转运到叶绿体, 被糖基化为相应的单糖基二酯酞甘油。三角褐指藻的脂肪酸含量较高的是C16:1和C20:5, 15℃低温更有利于C20:5(EPA)的生成, 温度对C22:6(DHA)影响不大, 这与李文权等(2003)的研究结果相一致。三角褐指藻的合成最有可能的是在Δ5、Δ6、Δ9和Δ12去饱和酶共同催化下结合两种途径合成(Domergue et al, 2002, 2003)。小球藻的脂肪酸含量较高的是C19:0, 25℃的C14-C18组分最多, 温度对C20:5(EPA)、C22:6(DHA)的含量影响不大, 与Converti等(2009)的研究结果一致。小球藻的脂肪酸是在ω-3、Δ12和Δ15去饱和酶催化下完成的, 以ω-3途径为主(Koushirou et al, 2002)。微拟球藻的脂肪酸含量较高的是C16:1和C20:5, 高温更有利于C20:5(EPA)和C14-C18组分的生成, 且含量与温度呈正相关, 温度对C22:6(DHA)影响不大, 微拟球藻的脂肪酸是在只有ω-3去饱和酶催化下完成的, 以ω-3途径为主。栅藻的脂肪酸含量较高的是C19:0, 温度对C20:5(EPA)、C22:6(DHA)的含量影响不大, 高温更有利于C14-C18组分的生成, 栅藻与绿藻同属绿藻纲, 脂肪酸生成规律也相似。
4 结论(1)三角褐指藻、微拟球藻和栅藻的最适生长温度为25℃, 小球藻的最适温度为20℃。
(2)三角褐指藻、小球藻、微拟球藻三株微藻均是在25℃下生物量最多, 分别为0.32、0.35和0.33g, 栅藻在20℃下生物量最多, 为0.15g。
(3)三角褐指藻在15℃下总脂含量最多。小球藻培养温度越高, 总脂含量越多。微拟球藻在25℃高温下油脂量最多。栅藻各个培养时期均为高温下油脂含量最多。
(4)三角褐指藻、小球藻和栅藻在20℃下油脂产率最多, 微拟球藻在25℃下油脂产率最多。四种微藻均是在25℃下C14-C18组分最多。
(5)三角褐指藻25℃下SFA和C14-C18组分最多, 15℃下MUFA和PUFA (包括DHA和EPA)含量最多。小球藻15℃下SFA最多, 20℃下MUFA最多, 25℃下PUFA和C14-C18组分最多, EPA和DHA在三个温度下含量普遍较少。微拟球藻25℃下SFA、MUFA和PUFA积累最多, C14-C18组分、DHA和EPA也最多, 且含量都随温度的升高而增加。栅藻25℃下SFA、PUFA和C14-C18组分含量最多, 在20℃下最有利于MUFA的积累, EPA和DHA含量均较少。
| 王付冬, 桑敏, 李爱芬, 等, 2010. 光照对眼点拟微绿球藻和三角褐指藻生长及总脂的影响. 中国油脂, 35 (6) : 71–75 |
| 尹琳琳, 杨佰娟, 郑立, 等, 2010. 浒苔脂肪酸前处理方法优化及GC/MS分析. 海洋科学, 34 (11) : 46–50 |
| 石娟, 潘克厚, 2004. 不同培养条件对微藻总脂含量和脂肪酸组成的影响. 海洋水产研究, 25 (6) : 79–85 |
| 叶丽, 蒋霞敏, 毛欣欣, 等, 2015. 温、光、盐对三角褐指藻紫外诱变株生长、总脂及脂肪酸的影响. 生态学杂志, 34 (2) : 454–462 |
| 李华, 王伟波, 刘永定, 等, 2011. 微藻生物柴油发展与产油微藻资源利用. 可再生能源, 29 (4) : 84–89 |
| 李元广, 谭天伟, 黄英明, 等, 2009. 微藻生物柴油产业化技术中的若干科学问题及其分析. 中国基础科学, 11 (5) : 64–70 |
| 李文权, 李芊, 廖启斌, 等, 2003. 温度对四种海洋微藻脂肪酸组成的影响. 台湾海峡, 22 (1) : 9–13 |
| 李秀波, 徐旭东, 孔任秋, 2010. 五种微绿球藻产油和产多不饱和脂肪酸的研究. 水生生物学报, 34 (5) : 893–897 |
| 李荷芳, 周汉秋, 1999. 海洋微藻脂肪酸组成的比较研究. 海洋与湖沼, 30 (1) : 34–40 |
| 杨桂娟, 栾忠奇, 周笑辉, 2009. 温度对小球藻生长量和溶氧量影响研究. 农机化研究, 31 (9) : 157–158 |
| 吴松, 2008. 小球藻工厂化人工培育技术. 海洋与渔业, (8) : 34–35 |
| 吴伟伟, 2012.环境因子和抑制剂对三角褐指藻脂肪酸合成的影响.南京:南京农业大学硕士学位论文, 4-9 http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284382.htm |
| 陈百灵, 2011.磷硅对三角褐指藻生长和脂肪酸组成的影响.青岛:中国海洋大学硕士学位论文, 5-7 http://cdmd.cnki.com.cn/Article/CDMD-10423-1011229832.htm |
| 郑忠明, 白培峰, 陆开宏, 等, 2008. 铜绿微囊藻和四尾栅藻在不同温度下的生长特性及竞争参数计算. 水生生物学报, 32 (5) : 720–727 |
| 晁建颖, 颜润润, 张毅敏, 2011. 不同温度下铜绿微囊藻和斜生栅藻的最佳生长率及竞争作用. 生态与农村环境学报, 27 (2) : 53–57 |
| 徐继林, 严小军, 周成旭, 等, 2006. 19种(株)海洋微藻脂肪酸组成及充气产生的影响. 宁波大学学报(理工版), 19 (2) : 180–185 |
| 高秀芝, 蒋霞敏, 叶丽, 2014. 温度、光照和盐度对2株曼氏骨条藻生长及脂肪酸组成的影响. 生物学杂志, 31 (6) : 64–70 |
| 黄雄超, 牛荣丽, 2012. 利用海洋微藻制备生物柴油的研究进展. 海洋科学, 36 (1) : 108–116 |
| 梁英, 石伟杰, 田传远, 2013. 微藻脂肪酸组成测定方法概述. 中国海洋大学学报, 43 (4) : 21–28 |
| 蒋汉明, 翟静, 张媛英, 等, 2005. 温度对海洋微藻生长及脂肪酸组成的影响. 食品研究与开发, 26 (6) : 9–12 |
| 蒋霞敏, 2002. 温度、光照、氮含量对微绿球藻生长及脂肪酸组成的影响. 海洋科学, 26 (8) : 9–13 |
| 韩笑天, 郑立, 孙珊, 等, 2008. 海洋微藻生产生物柴油的应用前景. 海洋科学, 32 (8) : 76–81 |
| 臧正蓉, 解修俊, 赵佩佩, 等, 2015. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响. 海洋科学, 39 (7) : 1–6 |
| 潘瑾, 俞建中, 马晓磊, 等, 2010. 温度影响三角褐指藻生长和脂肪酸组成的初步探讨. 渔业科学进展, 31 (6) : 90–94 |
| Berndmeyer C, Thiel V, Blumenberg M, 2014. Test of microwave, ultrasound and Bligh&Dyer extraction for quantitative extraction of bacteriohopanepolyols (BHPs) from marine sediments. Organic Geochemistry, 68 : 90–94 DOI:10.1016/j.orggeochem.2014.01.003 |
| Bligh E G, Dyer W J, 1959. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 37 (8) : 911–917 DOI:10.1139/o59-099 |
| Converti A, Casazza A A, Ortiz E Y, et al, 2009. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production. Chemical Engineering and Processing:Process Intensification, 48 (6) : 1146–1151 DOI:10.1016/j.cep.2009.03.006 |
| Doan T T Y, Sivaloganathan B, Obbard J P, 2011. Screening of marine microalgae for biodiesel feedstock. Biomass and Bioenergy, 35 (7) : 2534–2544 DOI:10.1016/j.biombioe.2011.02.021 |
| Domergue F, Lerchl J, Zähringer U, et al, 2002. Cloning and functional characterization of Phaeodactylum tricornutum front-end desaturases involved in eicosapentaenoic acid biosynthesis. European Journal of Biochemistry, 269 (16) : 4105–4113 DOI:10.1046/j.1432-1033.2002.03104.x |
| Domergue F, Spiekermann P, Lerchl J, et al, 2003. New insight into Phaeodactylum tricornutum fatty acid metabolism. Cloning and functional characterization of plastidial and microsomal Δ12-fatty acid desaturases.Plant Physiology, 131 (4) : 1648–1660 |
| Hu Q, Zhang C W, Sommerfeld M, 2005. Biodiesel from algae:lessons learned over the past 60 years and future perspectives. Journal of Phycology, 42 (1) : 7–12 |
| Koushirou S, Ken-Ichi H, Naoki F, et al, 2002. Two low-temperature-inducible Chlorella genes for Δ12 and ω-3 fatty acid desaturase (FAD):isolation of Δ12 and ω-3 fad cDNA clones, expression of Δ12 fad in Saccharomyces cerevisiae, and expression of ω-3 fad in Nicotiana tabacum. Bioscience, Biotechnology, and Biochemistry, 66 (6) : 1314–1327 DOI:10.1271/bbb.66.1314 |
| Mofijur M, Atabani A E, Masjuki H H, et al, 2013. A study on the effects of promising edible and non-edible biodiesel feedstocks on engine performance and emissions production:a comparative evaluation. Renewable and Sustainable Energy Reviews, 23 : 391–404 DOI:10.1016/j.rser.2013.03.009 |
| Rashid N, Rehman M S U, Sadiq M, et al, 2014. Current status, issues and developments in microalgae derived biodiesel production. Renewable and Sustainable Energy Reviews, 40 : 760–778 DOI:10.1016/j.rser.2014.07.104 |
| Renaud S M, Van Thinh L, Lambrinidis G, et al, 2002. Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures. Aquaculture, 211 (1-4) : 195–214 DOI:10.1016/S0044-8486(01)00875-4 |
| Thiansathit W, Keener T C, Khang S J, et al, 2015. The kinetics of Scenedesmus obliquus microalgae growth utilizing carbon dioxide gas from biogas. Biomass and Bioenergy, 76 : 79–85 DOI:10.1016/j.biombioe.2015.03.012 |
| Watanabe T, Kitajima C, Fujita S, 1983. Nutritional values of live organisms used in Japan for mass propagation of fish:a review. Aquaculture, 34 (1-2) : 115–143 DOI:10.1016/0044-8486(83)90296-X |
 2016, Vol. 47
2016, Vol. 47


