中国海洋湖沼学会主办。
文章信息
- 杜飞雁, 王亮根, 王雪辉, 宁加佳, 谷阳光, 李亚芳. 2016.
- DU Fei-Yan, WANG Liang-Gen, WANG Xue-Hui, NING Jia-Jia, GU Yang-Guang, LI Ya-Fang. 2016.
- 南沙群岛海域长腹剑水蚤(Oithona spp.)的种类组成、数量分布及其与环境因子的关系
- ASSEMBLAGE AND ABUNDANCE OF OITHONA AND ENVIRONMENTAL FACTORS IN NANSHA ISLANDS WATERS, SOUTH CHINA SEA
- 海洋与湖沼, 47(6): 1176-1184
- Oceanologia et Limnologia Sinica, 47(6): 1176-1184.
- http://dx.doi.org/10.11693/hyhz20160700143
-
文章历史
- 收稿日期:2016-07-01
- 收修改稿日期:2016-07-29
桡足类(Copepods)是海洋中小型浮游动物(0.2-20mm)中种类最丰富、数量最大的类群, 在海洋生态系统中具有重要的地位和作用。长腹剑水蚤属(Oithona)属于甲壳动物亚门(Crustacea)颚足纲(Maxillopoda)桡足亚纲(Copepoda)剑水蚤目(Cyclopoidea)长腹剑水蚤科(Oithonidae), 是海洋中小型桡足类数量最大的类群之一, 广泛分布于近岸和外海中(Paffenhöfer, 1993), 在海洋食物网、微食物环与碳循环中处于关键的位置(Nakamura et al, 1997; Saiz et al, 2003; Turner, 2004)。长腹剑水蚤是海洋食物网中重要的中间捕食者, 以单细胞生物和桡足类幼虫为食, 既为仔鱼和其他食浮游动物的动物提供饵料, 又是微食物环中的食碎屑者, 在碳循环中细菌碳和藻类碳向高营养级转化的过程里扮演着重要角色(Hwang et al, 2010)。我国海域目前已记录的长腹剑水蚤有17种, 在南海均有分布(刘瑞玉, 2008)。长腹剑水蚤个体小且形态差异微小, 采用传统形态学分类法对其准确鉴定具有一定的困难, 存在大量的隐种, 且该属种间具体的系统进化关系尚不明确, 影响了海洋食物网结构与功能和海洋生态系统相关研究的深入开展。
南沙群岛海域地处我国最南端的热带海域, 地理、地貌、气候和生态环境独特, 水文环境复杂(方文东, 2000), 岛屿众多, 紧邻大陆坡和深海盆地, 季风盛行, 环流形势复杂多变(杨海军等, 1998), 是海洋生物多样性最为丰富的区域之一。南沙群岛海域目前已有记录的长腹剑水蚤共有12种, 但其数量分布和季节变化情况尚不清楚(陈清潮, 2003)。本文以2013年在南沙群岛海域按季度月开展的4个航次的生态调查数据为基础, 对该海域长腹剑水蚤的种类组成、组群结构、数量的水平和垂直分布及其季节变化进行研究, 为后续深入开展长腹剑水蚤的分子生物学研究提供基础资料。
此外, 浮游生物与影响因子之间关系复杂, 不是简单的线性响应, 故引入非线性的广义可加模型(generalized additive model, GAM)分析长腹剑水蚤与环境因子之间的关系。对于单物种与环境之间定量关系的研究, GAM模型主要取决于原始数据, 能更加深入地探讨物种与环境变量间的关系, 提供更为丰富的信息, 是目前被认为较先进的方法(Hastie et al, 1990; Bigelow et al, 1999; 牛明香等, 2010)。GAM模型虽然在生态学领域运用广泛(Christos et al, 1997; 刘佳等, 2009; Chang et al, 2010; 唐浩等, 2013; Bai et al, 2015;), 但在浮游动物生态学研究方面的应用相对较少。
1 材料与方法 1.1 调查设置及取样方法2013年按季度月分别于3-4月、6-7月、9-10月和11-12月, 对南沙群岛海域(111°30′E-112°30′E, 4°30′N-11°30′N)设置的35个站位, 进行春、夏、秋、冬季4个航次生态环境的综合调查。采样过程中因恶劣海况和外界干扰, 各航次的作站情况有所差异, 其中春季完成23个站位(不含S1、S3、S5、S6、S8、S11、S17、S25、S26、S28、S29和S35站)、夏季完成21个站位(不含S7、S9、S10、S11、S12、S16、S18、S19、S23、S26、S27、S29、S33和S34站)、秋季完成24个站位(不含S1、S3、S8、S11、S17、S18、S25、S26、S29、S34和S35站)、冬季完成18个站位(不含S1、S3、S6、S7、S8、S9、S13、S17、S19、S22、S23、S25、S7、S28、S33、S34和S35站), 站位地理位置见图 1和表 1所示。每站分别使用中型浮游生物网(网长280cm, 网口内径50cm, 网口面积0.2m2, 网目大小0.077mm)自200m至表层垂直拖曳, 共采获样品86份。此外, 为了解南沙群岛海域浮游动物的垂直分布, 于2013年11月分别在9°30′N和111°30′E两个断面设置3个站位, 共5个站位(S4、S14、S15、S16和S33站), 使用Multinet浮游生物连续采样网(HYDRO-BIOS德国, 网口面积0.25m2, 网目大小300µm), 分0-30m、30-75m、75-150m、150-500m和500-750m等5层, 进行浮游动物垂直分层采集, 每站采集1次, 共采获样品22份。样品的处理、保存、计数等均按《海洋调查规范》(GBT12763.6-2007)进行。
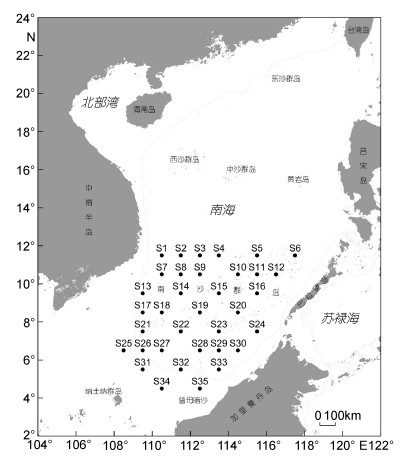 |
| 图 1 调查站位设置示意图 Fig. 1 Sketch map of sampling stations |
海水温度(T)、盐度(S)使用CTD (Sea-Bird美国)测定。采集5、10、25、50、75、100、150和200m水样, 使用10-AU-005-CE荧光仪(Turner Designs美国)测定叶绿素a(chl a)。
1.2 数据统计及分析 1.2.1 出现频率通过出现频率反映长腹剑水蚤单一种在调查期的出现情况, 计算式为:
F=(a/b)×100%
其中: a为该种出现站次, b为总采样站次。
1.2.2 种类更替选用种类更替率(R)进行种类组成的季节变化研究(连光山等, 1990), 其计算式为:
R=[(a+b-2c)/(a+b-c)]×100%
其中: a与b分别为相邻2个季节的种数, c为相邻2个季节共同的种数。
1.2.3 组群分析通过聚类分析研究长腹剑水蚤的组群结构。首先将全年0-200m垂直采集的在各采样站次中出现次数大于或等于3的11种长腹剑水蚤, 按其出现与或缺情况进行聚类分析和组群划分。聚类分析采用距离系数(D=1-相关系数), 建立种类的二维矩阵, 进而采用组间连接法(between-groups linkage)进行聚类分析。数据处理采用PRIMER6.0统计软件进行。
1.2.4 GAM模型分析GAM模型的优点是通过非参数平滑曲线建立预测变量和响应变量之间的非线性关系(Maravelias, 2001; Wood, 2006), 且预测变量之间的关系是可加的。它能应用非参数的方法检测数据结构, 并找出其中的规律, 从而能得到更好的预测结果(Wood, 2006)。通过GAM模型分析长腹剑水蚤栖息密度与环境因子之间的关系, 表达式如下:
log10(D)=M+s(T)+s(S)+s(chla)+s(lat) +s(lon)+ε
其中, D为长腹剑水蚤调查期各站栖息密度, M为采样月份, T为海水平均温度, S为海水盐度, chla为叶绿素a浓度(温度、盐度和叶绿素a浓度, 取长腹剑水蚤主要分布水层的平均值), lat为采样纬度, lon为采样经度, s是光滑样条函数(spline smoother), ε为随机误差项, 利用t检验评估预测变量的显著性。以上模型的构建过程均利用R统计软件(Version 3.3.0, https://www.r-project.org/)中的mgcv软件包实现。
2 结果 2.1 种类组成该海域在调查期间共出现长腹剑水蚤15种(包括1个未定种), 其中线长腹水蚤(Oithona linearis)、粗长腹剑水蚤(O. robusta)和长刺长腹剑水蚤(O. longispina)为南沙群岛海域首次记录。全部86个调查站位中, 除1个站没有采获外, 其余85个站均有长腹剑水蚤分布。
各季中, 秋季出现种类数最多, 有12种; 春季次之, 出现11种; 冬季出现9种; 夏季最少, 仅有6种(表 1)。南沙群岛四季均有出现的种类仅有羽长腹剑水蚤(O. plumifera)、瘦长腹剑水蚤(O. tenuis)、拟长腹剑水蚤(O. similis)、细长腹剑水蚤(O. attenuata)和坚长腹剑水蚤(O. rigida)等5种, 其年均出现频率分别为98.9%、84.5%、90.6%、26.1%和26.8%, 其他种类均为季节性出现种。简长腹剑水蚤(O. simplex)和长刺长腹剑水蚤除夏季外, 各季均有出现, 年均出现频率为7.7%和8.1%。伪长腹剑水蚤(O. fallax)、刺长腹剑水蚤(O. setigera)、敏长腹剑水蚤(O. vivida)和未定种等4种为2个季节出现的种类, 年均出现频率在2.5%-18.9%。1个季节出现种包括线长腹水蚤(春季)、隐长腹剑水蚤(O. decipiens)(春季)、粗长腹剑水蚤(秋季)和短角长腹剑水蚤(O. brevicornis)(秋季)等4种, 其出现频率也很低, 为3.3%和1.1%。全部15种长腹剑水蚤平均年出现频率为25.8%。春夏季、夏秋季和秋冬季长腹剑水蚤的季节更替率分别为45.5%、61.5%和25%, 平均更替率为44%。表明长腹剑水蚤属虽然在南沙群岛海域广泛分布, 但单种的出现频率较低, 其种类出现的季节性较强。
| 种类 | 春季 | 夏季 | 秋季 | 冬季 | 年平均值 |
| 线长腹水蚤Oithona linearis* | 13.0 | 0 | 0 | 0 | 3.3 |
| 伪长腹剑水蚤O. fallax | 8.7 | 0 | 29.2 | 0 | 9.5 |
| 隐长腹剑水蚤O. decipiens | 4.3 | 0 | 0 | 0 | 1.1 |
| 羽长腹剑水蚤O. plumifera | 95.7 | 100 | 100 | 100 | 98.9 |
| 刺长腹剑水蚤O. setigera | 4.3 | 71.4 | 0 | 0 | 18.9 |
| 瘦长腹剑水蚤O. tenuis | 87.0 | 95.2 | 66.7 | 88.9 | 84.5 |
| 粗长腹剑水蚤O. robusta* | 0 | 0 | 4.2 | 0 | 1.1 |
| 拟长腹剑水蚤O. similis | 95.7 | 100 | 100 | 66.7 | 90.6 |
| 细长腹剑水蚤O. attenuata | 17.4 | 28.6 | 41.7 | 16.7 | 26.1 |
| 简长腹剑水蚤O. simplex | 4.3 | 0 | 20.8 | 5.6 | 7.7 |
| 坚长腹剑水蚤O. rigida | 30.4 | 23.8 | 25.0 | 27.8 | 26.8 |
| 短角长腹剑水蚤O. brevicornis | 0 | 0 | 4.2 | 0 | 1.1 |
| 长刺长腹剑水蚤O. longispina* | 8.7 | 0 | 12.5 | 11.1 | 8.1 |
| 敏长腹剑水蚤O. vivida | 0 | 0 | 12.5 | 16.7 | 7.3 |
| 长腹剑水蚤属Oithona sp. | 0 | 0 | 4.2 | 5.6 | 2.5 |
| 注: *表示新记录种 | |||||
群落中具有相似的分布特性, 在采样中倾向于同时出现的一些物种可称为物种组群, 鉴别物种组群并探讨其形成的原因, 有助于判明群落结构和物种生态特性, 以及物种之间生态上的相互联系(邱永松, 1990), 对深入了解长腹剑水蚤的生态习性有重要作用。由聚类图可以得出, 南沙群岛海域的长腹剑水蚤可以划分为2个组群(图 2)。组群Ⅰ组成较为简单, 由瘦长腹剑水蚤、拟长腹剑水蚤和羽长腹剑水蚤3种构成, 但种间相似性较高(距离为2.24-3.67);组群Ⅱ由坚长腹剑水蚤、细长腹剑水蚤、刺长腹剑水蚤、伪长腹剑水蚤、简长腹剑水蚤、敏长腹剑水蚤、长刺长腹剑水蚤和线长腹水蚤等8种组成, 其组成较为复杂, 但种间相似性较低(距离为2.65-5.34)。
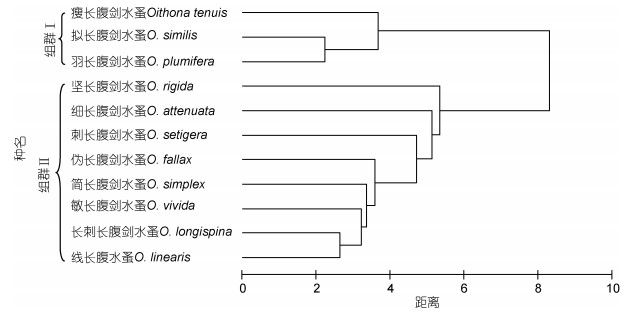 |
| 图 2 南沙群岛海域长腹剑水蚤种类聚类图 Fig. 2 The clusters of concurrent Oithona species groups in Nansha Islands of South China Sea |
从各种出现频率来看, 组群Ⅰ的羽长腹剑水蚤、拟长腹剑水蚤和瘦长腹剑水蚤是南沙群岛海域中全年均有出现, 且出现频率位列前三位的长腹剑水蚤种类。可见, 组群Ⅰ虽然种类少, 但为常见广布类群。组群Ⅱ的种类出现频率均较低(F≤26.8%), 除坚长腹剑水蚤和细长腹剑水蚤周年出现外, 其余6种均为季节性出现种类。因此, 组群Ⅱ为低频类群。
2.3 数量分布 2.3.1 平面分布南沙群岛海域长腹剑水蚤年均栖息密度为30ind./m3, 仅占浮游动物总数的11.6%, 但长腹剑水蚤数量的季节变化较小(SD=15.7)。春季数量为22ind./m3; 夏季增至28ind./m3, 秋季急剧上升至53ind./m3, 冬季降至全年最低, 为18ind./m3。
从长腹剑水蚤总栖息密度的平面分布情况来看, 长腹剑水蚤高数量区主要出现在近岸海域。春、夏和秋季的分布趋势基本相同, 大致呈现西北和东南部高、东北和中部低的趋势。除西北部数量较高外, 在东南部分别还有2个高数量区出现。东北和中部的低密度区除在夏季连为一片外, 春季和秋季为2个相对独立的区域(图 3)。冬季, 长腹剑水蚤栖息密度呈明显的北低、南高的趋势, 海域内除东南部的一个高数量区外, 其余区域数量均较低(图 3i)。
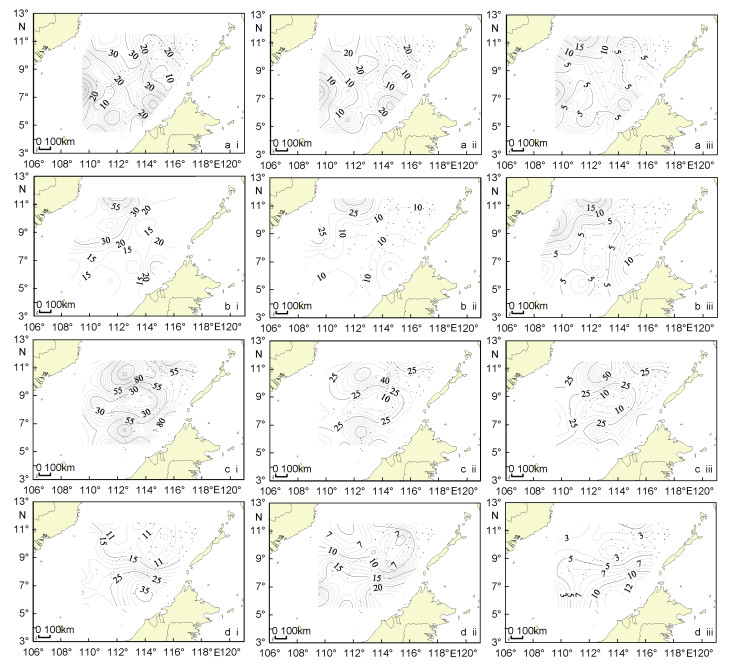 |
| 图 3 南沙群岛海域长腹剑水蚤数量(ind./m3)的平面分布 Fig. 3 The density of Oithona spp. (ind./m3) in Nansha Islands of South China Sea 注: a.春季, b.夏季, c.秋季, d.冬季; i.总密度, ii.组群Ⅰ密度, iii.组群Ⅱ密度 |
春季、夏季和冬季, 南沙群岛海域长腹剑水蚤的组群Ⅰ的栖息密度明显高于组群Ⅱ, 栖息密度比值较为稳定(2-2.4: 1)。而秋季, 2个组群的数量均明显增加, 以组群Ⅱ的增幅较大, 其数量增至与组群Ⅰ相当。从组群Ⅰ和组群Ⅱ各季的平面分布状况来看, 2个组群各季的分布趋势与总栖息密度基本保持一致, 无明显变化(图 3ii、3iii)。
2.3.2 垂直分布垂直分层只采集到拟长腹剑水蚤、坚长腹剑水蚤、羽长腹剑水蚤、瘦长腹剑水蚤、长刺长腹剑水蚤和敏长腹剑水蚤等6种。从种类的出现水层来看, 长腹剑水蚤属种类组成沿水深变化的现象较为明显。拟长腹剑水蚤仅出现于0-30m层, 长刺长腹剑水蚤仅出现于30-75m层, 坚长腹剑水蚤仅出现于75-150m层, 敏长腹剑水蚤仅分布于30-500m层; 瘦长腹剑水蚤虽然各水层均有出现, 但主要分布于150m以浅的水层内。而羽长腹剑水蚤则是在各水层均有较多数量分布的种类, 也是分布在50-500m层的主要种类。
南沙群岛750m以浅海域, 长腹剑水蚤平均栖息密度为9.6ind./m3, 沿水深梯度的垂直变化明显(SD=10.2)。0-30m层长腹剑水蚤栖息密度最高, 平均为21.7ind./m3; 30-75m降至19.3ind./m3, 75-150m、150-500m和500-750m的数量分别为6.1ind./m3、0.6ind./m3和0.3ind./m3。111°30′E断面的平均数量为11.7ind./m3, 高于9°30′N断面的9.6ind./m3。
如图 4所示, 9°30′N和111°30′E两个断面长腹剑水蚤密度的垂直分布, 均呈现由浅至深数量明显减少的趋势。长腹剑水蚤主要集中分布在0-75m的水层中(D0-75m:D75-750m=8.9), 30-75m其数量下降趋势较为平缓, 75-500m数量急剧降低至最低后, 在500-750m基本维持不变。
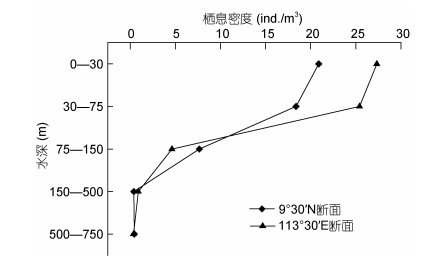 |
| 图 4 南沙群岛海域长腹剑水蚤数量的垂直分布 Fig. 4 Vertical distribution ofOithonadensity in Nansha Islands of South China Sea |
GAM模型的分析结果见表 2和图 5。该模型对长腹剑水蚤密度的总偏差解释率(deviance explained)为52.5%。t检验表明, 纬度与长腹剑水蚤栖息密度呈显著相关关系(P < 0.01), 温度和叶绿素a与长腹剑水蚤呈相关关系(P < 0.05), 盐度与栖息密度的相关性一般(P < 0.1), 而经度与栖息密度没有相关性。
| 影响因子 | 估计自由度df | t检验 | 偏差解释率(%) |
| 温度 | 1.309 | 0.561** | 52.5 |
| 盐度 | 2.004 | 0.476* | |
| 叶绿素a | 1.334 | 0.449** | |
| 纬度 | 6.463 | 2.630*** | |
| 注: *表示P < 0.1, **表示P < 0.05, ***表示P < 0.01 | |||
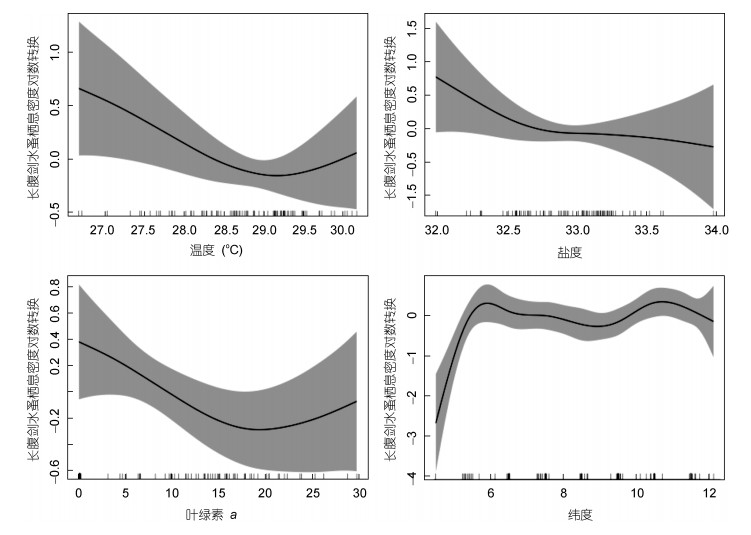 |
| 图 5 各影响因子与南沙群岛海域长腹剑水蚤数量关系的GAM图 Fig. 5 Relationship between impact factors and density of Oithona in Nansha Islands of South China Sea based on generalized additive model |
纬度的变化对长腹剑水蚤数量变化的影响最为显著。6°N以南海域长腹剑水蚤数量较低, 随纬度的增加数量迅速上升, 纬度对数量的影响也最为显著; 接近6°N时, 纬度对长腹剑水蚤数量的影响开始下降; 在6°N以北区域, 纬度对数量的影响程度基本不变。6°N和11°N是长腹剑水蚤属的主要分布区。海水平均温度和盐度分别低于29°C和33时, 随温度和盐度的升高, 其对长腹剑水蚤数量的影响程度逐渐增强; 而海水平均温度和盐度分别高于29°C和33后, 随温度和盐度的继续升高, 其对数量的影响程度逐渐降低。从影响程度可以得出, 长腹剑水蚤属最适温度为28.6-29.2°C、最适盐度为32.6-33.2、最适叶绿素a浓度为510μg/L (图 5)。
3 讨论 3.1 长腹剑水蚤数量及其季节变化与环境因子之间的关系从GAM分析结果来看, 纬度、温度、盐度和叶绿素a浓度均与长腹剑水蚤数量有相关关系。虽然纬度的相关性最为显著, 但在6°N以北的大部分区域, 纬度对数量的影响程度基本不变。因此, 以温度、盐度和叶绿素a浓度为重点, 讨论南沙群岛海域长腹剑水蚤数量及其季节变化与环境因子之间的关系。
春季, 长腹剑水蚤主要栖息水层的温度和叶绿素a浓度在全年中最低, 而盐度最高, 分别为28.21°C、0.13μg/L和33.19。长腹剑水蚤高数量区(≥30ind./m3)以相对低温、低盐和低生产力为主要特征。夏季, 温度达到全年最高值(29.60°C), 全区海水温度超过长腹剑水蚤的最适温度(≥29.2°C)。但随水温的升高和盐度的降低(33.14), 海域生产力水平明显有所提高(Meanchl a=12.54μg/L), 长腹剑水蚤数量也出现小幅上升。高数量区(≥30ind./m3)仍以相对低温、低盐和低生产力为主要特征。秋季是海域生产力水平最高的季节(Meanchl a=16.99μg/L)。此时, 海水温盐降至28.84°C和32.73, 进入长腹剑水蚤的最适温盐区内, 而且全海域91%的区域均在长腹剑水蚤的最适温盐范围之内。长腹剑水蚤的数量也急剧上升, 达到全年最高值。高数量区(≥60ind./m3)以相对低盐和高生产力为主要特征。就长腹剑水蚤的2个组群来看, 春、夏和冬季, 组群Ⅱ的数量均为组群Ⅰ的50%左右。但在环境最为适宜的秋季, 组群Ⅱ的数量急剧上升至与组群Ⅰ相当。可见, 广布的组群Ⅰ对环境的适应性较强, 而低频的组群Ⅱ对环境的敏感程度较高。冬季, 海水温盐和叶绿素a浓度均明显降低, 分别为28.27°C、32.69和15.34μg/L, 除盐度外, 温度和叶绿素a浓度都远不在南沙群岛海域长腹剑水蚤的最适范围内。各季中, 冬季全区温盐的变幅最大(SDT=0.76、SDS=0.33), 长腹剑水蚤数量急剧降至全年最低值, 海域内绝大部分区域的数量低于30ind./m3。高数量区(≥30ind./m3)以相对高温和低盐为主要特征。
南沙群岛海域各季长腹剑水蚤最高数量区主要环境特征的季节差异明显:春季该区域的温度是全海域最低(27.03°C), 夏季叶绿素a浓度是全海域次低(4.42μg/L), 秋、冬季海水盐度均为全海域次低(32.31)。可见, 春、夏和秋冬季, 南沙群岛海域制约长腹剑水蚤分布的重要因素分别为温度、叶绿素a浓度和盐度。同时也反映出南沙群岛海域的长腹剑水蚤属更适于低温、低盐和低生产力的环境, 与GAM分析图所呈现的结果一致(图 5)。
虽然在秋季长腹剑水蚤属高数量区的叶绿素a浓度也较高, 这与秋季的环境最为适宜有关。但从长腹剑水蚤的总体分布情况来看, 其更倾向于低叶绿素a的环境中。首先, 与长腹剑水蚤食性有关。作为小型桡足类, 长腹剑水蚤是海洋食物网中的中间捕食者, 以单细胞生物和桡足类幼虫为食, 也是微食物环中的食屑者(Hwang et al, 2010), 不以浮游植物为食; 其次, 长腹剑水蚤是大型肉食性浮游动物、仔鱼和其他食浮游动物生物的饵料。叶绿素a浓度高的高生产力区域, 也是小型桡足类摄食者的高数量区, 对长腹剑水蚤的捕食压力大, 故长腹剑水蚤的数量也较低。
3.2 长腹剑水蚤数量平面分布与季风和海流的关系长腹剑水蚤与环境因子的GAM分析表明, 其更适于低温和低盐的环境, 反映出南沙群岛海域的长腹剑水蚤与低温低盐的沿岸流有密切的关系。南沙海域上层(0-400m)主要有西部沿岸流、东部沿岸流、北南沙海流和南沙逆(风)流4支流系(方文东等, 1997)。而南沙群岛海域长腹剑水蚤属各季的高数量, 均出现于受西部沿岸流和东部沿岸流影响的海域内。
浮游生物自主游动能力弱, 受海流影响显著。季风是南海表层流场的主要驱动力。南沙群岛海域受季风影响强烈, 该海域上层4支海流, 除东部沿岸流外, 其他3支主要流系均随季风逆转而倒转(方文东等, 1997)。因此, 在受东部沿岸流影响的加里曼丹岛东北近岸海域, 各季均会出现一个长腹剑水蚤的高数量区。春季是东北-西南季风转换期。此时, 西部沿岸流受北南沙反气旋影响, 其影响局限在海区西北部(刘岩松等, 2014), 该区域内的长腹剑水蚤数量较高; 夏季盛行西南季风, 在其作用下西部沿岸流流幅变窄(薛惠洁等, 2001), 大部分海区受南沙上层反气旋环流影响显著(方文东等, 1997), 长腹剑水蚤的高数量区向西北方向有所回缩; 秋季是西南-东北季风转换期, 在南海中部气旋式次海盆环流的作用下, 南沙西部沿岸流(越南沿岸流)为南向, 并形成东向的越南离岸流, 跨越至菲律宾沿岸(巴拉望岛和吕宋岛沿岸)(刘岩松等, 2014), 南沙大部分海域在其影响之下, 长腹剑水蚤的数量急剧上升, 高数量区范围也有明显扩大; 冬季, 在强东北风作用下, 南海基本上由一气旋式环流控制, 整个南海海水表层温度因受环流作用而明显降低。此外, 强东北风作用还使上层海水在南海海盆的西南角堆积。这种堆积在西南角产生一个正压场, 导致强的沿岸流, 再加上15°N以南风应力的作用下, 出现沿西边界向南的高流速边界流(刘秦玉等, 1997)。故在南沙群岛海域东北部的来自南海中部的上层海水堆积区内, 长腹剑水蚤数量较低。由于正压场和风应力的共同作用, 南沙群岛海域沿岸流的势力增强, 控制了南沙西南部的大部分海域, 该区域内长腹剑水蚤密度明显高于上层海水堆积区。因此, 南沙群岛海域长腹剑水蚤数量分布的季节变化与季风驱动的沿岸流势力强弱密切相关。
3.3 长腹剑水蚤数量的垂直变化1984年章淑珍和陈清潮指出, 南海浮游桡足类的垂直分布是不均匀的, 南海北部近海、北部陆架区、大陆坡和中部深海盆海域100m水深是桡足类垂直分布的主要转折点, 桡足类主要密集在100m以上水层, 而在100m至200m水层中, 其数量骤然下降; 200m以深数量递减较为缓慢(章淑珍等, 1984)。南沙西南大陆斜坡区桡足类主要密集出现在100m以上水深, 75-100m处其数量大幅下降, 75-100m水深是南海大部分海域桡足类垂直分布的主要转折点(杜飞雁等, 2014)。从南沙群岛长腹剑水蚤的垂直分布情况来看, 数量主要集中在0-75m层, 75m以深数量急剧下降, 符合南海桡足类垂直分布规律。虽然几次调查的分层有所差异, 但南沙群岛海域长腹剑水蚤数量的垂直变化规律, 与南海西南大陆斜坡区、南沙群岛东南部和南海中部海域浮游动物一致, 均呈0-100m层最高, 越往深层量值越低的分布趋势(陈瑞祥等, 1988; 陈清潮等, 1991; 杜飞雁等, 2014)。
南沙群岛海域终年存在的温跃层是影响浮游生物垂直分布的重要因素之一(邱章等, 1994; 杜飞雁等, 2014), 温跃层对浮游动物的垂直分布具有阻隔作用(郑重等, 1965; 李荣国等, 2004), 温跃层的水温变化梯度太大, 很少种类能穿过温跃层上下移动(Fragopoulu et al, 1990)。我国南黄海夏季和南海西南大陆斜坡区春季的浮游动物, 也主要分布于温跃层中(左涛等, 2004; 杜飞雁等, 2014)。南沙群岛海域水深75m左右是温跃层的下方(中国科学院南沙综合科学考察队, 1989), 现场同步实测数据也表明海水温度在75m层降幅明显增大, 而南沙群岛长腹剑水蚤的数量, 也在75m以深数量急剧下降。综上所述表明, 南沙群岛长腹剑水蚤主要分布于温跃层中, 受其阻隔作用, 长腹剑水蚤在温跃层下方的渐变层内数量较低, 温跃层是影响其数量垂直分布的主要因素。
致谢 样品鉴定得到了中国科学院南海海洋研究所| 中国科学院南沙综合科学考察队, 1989. 南沙群岛及其邻近海区综合调查研究报告(一), 下卷. 北京: 科学出版社, 392 |
| 牛明香, 李显森, 徐玉成, 2010. 基于广义可加模型的时空和环境因子对东南太平洋智利竹筴鱼渔场的影响. 应用生态学报, 21 (4) : 1049–1055 |
| 方文东, 2000.南海南部海洋环流的结构与季节变化.青岛:中国科学院海洋研究所博士学位论文, 1-25 |
| 方文东, 郭忠信, 黄羽庭, 1997. 南海南部海区的环流观测研究. 科学通报, 42 (21) : 2264–2271 |
| 左涛, 王荣, 王克, 等, 2004. 夏季南黄海浮游动物的垂直分布与昼夜垂直移动. 生态学报, 24 (3) : 524–530 |
| 刘佳, 黄清辉, 李建华, 2009. 崇明北湖叶绿素a浓度与环境因子的GAM回归分析. 中国环境科学, 29 (12) : 1291–1295 |
| 刘岩松, 于非, 刁新源, 等, 2014. 越南离岸流跨海盆特征初步分析. 海洋科学, 38 (7) : 95–102 |
| 连光山, 林玉辉, 蔡秉及, 等, 1990. 大亚湾浮游动物群落的特征.见:庄一纯主编.大亚湾海洋生态文集(Ⅱ). 北京: 海洋出版社, 180-186 |
| 刘秦玉, 李薇, 徐启春, 1997. 东北季风与南海海洋环流的相互作用. 海洋与湖沼, 28 (5) : 493–502 |
| 刘瑞玉, 2008. 中国海洋生物名录. 北京: 科学出版社, 624 |
| 杜飞雁, 王雪辉, 谷阳光, 等, 2014. 南沙群岛西南大陆斜坡海域浮游动物的垂直分布. 海洋学报, 36 (6) : 94–103 |
| 李冠国, 范振刚, 2004. 海洋生态学. 北京: 高等教育出版社, 30-31 |
| 杨海军, 刘秦玉, 1998. 南海海洋环流研究综述. 地球科学进展, 13 (4) : 364–368 |
| 邱章, 黄企洲, 1994. 南沙群岛海区温跃层时空分布的分析.见:南沙群岛海区物理海洋学研究论文集Ⅰ. 北京: 海洋出版社, 64-80 |
| 邱永松, 1990. 南海北部大陆架鱼种组群初步分析. 水产学报, 14 (4) : 267–276 |
| 陈清潮, 2003. 南沙群岛海区生物多样性名典. 北京: 科学出版社, 141 |
| 陈清潮, 张谷贤, 尹健强, 等, 1991. 1988年夏季南沙群岛海区东部和南部浮游动物的分布.见:南沙群岛及其邻近海区海洋生物研究论文集(二). 北京: 海洋出版社, 186-193 |
| 陈瑞祥, 蔡秉及, 林茂, 等, 1988. 南海中部海域浮游动物的垂直分布. 海洋学报, 10 (3) : 337–341 |
| 郑重, 郑执中, 王荣, 等, 1965. 烟、威鲐鱼渔场及邻近水域浮游动物生态的初步研究. 海洋与湖沼, 7 (4) : 329–354 |
| 唐浩, 许柳雄, 陈新军, 等, 2013. 基于GAM模型研究时空及环境因子对中西太平洋鲣鱼渔场的影响. 海洋环境科学, 32 (4) : 518–522 |
| 章淑珍, 陈清潮, 1984. 南海浮游桡足类的生态研究I. 数量的分布和变化.热带海洋, 3 (1) : 46–55 |
| 薛惠洁, 柴扉, 徐丹亚, 等, 2001. 南海沿岸流特征及其季节变化.见:中国海洋学文集-南海海流数值计算及中尺度特征研究. 北京:海洋出版社, : 64–74 |
| Bigelow K A, Boggs C H, He X, 1999. Environmental effects on swordfish and blue shark catch rates in the US North Pacific longline fishery. Fisheries Oceanography, 8 (3) : 178–198 DOI:10.1046/j.1365-2419.1999.00105.x |
| Chang J H, Chen Y, Holland D, et al, 2010. Estimating spatial distribution of American lobster Homarus americanus using habitat variables. Marine Ecology Progress Series, 420 : 145–156 DOI:10.3354/meps08849 |
| Fragopoulu N, Lykakis J J, 1990. Vertical distribution and nocturnal migration of zooplankton in relation to the development of the seasonal thermocline in Patraikos Gulf. Marine Biology, 104 (3) : 381–387 DOI:10.1007/BF01314340 |
| Hastie T J, Tibshirani R J, 1990.Generalized Additive Models.London:Chapman and Hall |
| Hwang J S, Kumar R, Dahms H U, et al, 2010. Interannual, seasonal, and diurnal variations in vertical and horizontal distribution patterns of 6 Oithona spp. (Copepoda:Cyclopoida) in the South China Sea.Zoological Studies, 49 (2) : 220–229 |
| Li B, Cao J, Chang J H, et al, 2015. Evaluation of effectiveness of fixed-station sampling for monitoring American lobster settlement. North American Journal of Fisheries Management, 35 (5) : 942–957 DOI:10.1080/02755947.2015.1074961 |
| Maravelias C D, Reid D G, 1997. Identifying the effects of oceanographic features and zooplankton on prespawning herring abundance using generalized additive models. Marine Ecology Progress Series, 147 (1-3) : 1–9 |
| Maravelias C D, 2001. Habitat associations of Atlantic Herring in the Shetland area:influence of spatial scale and geographic segmentation. Fisheries Oceanography, 10 (3) : 259–267 DOI:10.1046/j.1365-2419.2001.00172.x |
| Nakamura Y, Turner J T, 1997. Predation and respiration by the small cyclopoid copepod Oithona similisr:how important is feeding on ciliates and heterotrophic flagellates. Journal of Plankton Research, 19 (9) : 1275–1288 DOI:10.1093/plankt/19.9.1275 |
| Paffenhöfer G A, 1993. On the ecology of marine cyclopoid copepods (Crustacea, Copepoda). Journal of Plankton Research, 15 (1) : 37–55 DOI:10.1093/plankt/15.1.37 |
| Saiz E, Calbet A, Broglio E, 2003. Effects of small-scale turbulence on copepods:the case of Oithona davisae. Limnology and Oceanography, 48 (3) : 1304–1311 DOI:10.4319/lo.2003.48.3.1304 |
| Turner J T, 2004. The importance of small planktonic copepods and their roles in pelagic marine food webs. Zoological Studies, 43 (2) : 255–266 |
| Wood S N, 2006.Generalized Additive Models:An Introduction with R.Boca Raton, FL:Chapman and Hall, CRC Press |
 2016, Vol. 47
2016, Vol. 47


