
中国海洋湖沼学会主办。
文章信息
- 李海波, 吕倩倩, 白冬, 王欢, 关丽萍, 谢超. 2016.
- LI Hai-Bo, LV Qian-Qian, BAI Dong, WANG Huan, GUAN Li-Ping, XIE Chao. 2016.
- 深海鲣鱼(Katsuwonus pelamis)眼窝油中DHA和EPA的提取及其抗抑郁活性研究
- DHA AND EPA FROM ORBITAL FLESH OF TUNA KATSUWONUS PELAMIS: EXTRACTION AND ITS ANTIDEPRESSANT ACTIVITY
- 海洋与湖沼, 47(6): 1214-1220
- Oceanologia et Limnologia Sinica, 47(6): 1214-1220.
- http://dx.doi.org/10.11693/hyhz20160600141
-
文章历史
- 收稿日期:2016-06-30
- 收修改稿日期:2016-07-27
2. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋大学 食品与医药学院 舟山 316022
2. Key Laboratory of Health Risk Factors for Seafood of Zhejiang Province, College of Food and Medicine, Zhejiang Ocean University, Zhoushan 316022, China
抑郁症是主要的精神疾病之一, 它通常伴随着某些相关的症状, 如:定期的消极情绪, 减少体力活动, 产生无助感以及思想和认知功能的迟钝表现。在2000年, 它被世界卫生组织列为第四大造成全球疾病负担的主要原因, 并且可能到2020年将成为第二大引发相关疾病障碍的原因(Lopez et al, 1998; Tian, 2010)。当前大约已有三分之二的抑郁症患者采取了相关的治疗措施, 但其体系完善的幅度仍旧很小。并且, 即便是目前已经开发了许多有疗效的抗抑郁药, 但是仍然有大约三分之一的受试者认为当前的医疗设备不够完善, 其治疗结果也不尽如人意(Thase, 2003)。
二十二碳六烯酸(DHA, C22:6n3)和二十碳五烯酸(EPA, C20:5n3)都是长链多不饱和脂肪酸(PUFA), 也被称为ω-3脂肪酸, 具有降低胆固醇、预防心血管疾病的功能。在过去的十年里, EPA和DHA已经被普遍认为是能够对人类健康和发展产生有益作用的有效膳食成分(Siriwardhana et al, 2012)。其在大脑和视网膜组织结构中也具有重要作用(Bradbury, 2011)。并且有越来越多的证据表明, ω-3多不饱和脂肪酸可以有效的治疗各种精神障碍, 尤其是单极重度抑郁症(MDD)。例如, Mischoulon等(2008)研究了DHA的抗抑郁功效和剂量-响应模式, 其试验结果显示, 较低剂量的DHA就可能对抑郁症产生良好的治疗效果。Mozaffari-Khosravi等(2013)进行了一项运用单中心、随机、双盲、对照等方法的平行试验组, 比较了EPA与DHA分别作为试剂对于依靠药物来维持治疗的轻度到中度抑郁症患者的疗效程度。其结果表明, EPA作为抗抑郁药物的佐剂来治疗轻度到中度的抑郁症患者可能比DHA或安慰剂更有效。
深海鲣鱼(Katsuwonus pelamis)是一类典型的身长60-250 cm, 体重为400磅左右的金枪鱼, 生存于太平洋、大西洋和印度洋的亚热带水域中(Farley et al, 2006)。在食品企业里, 鲣鱼通常被加工成为罐装食品或生鱼片, 而其下脚料则被认为是废弃物而丢弃。因此, 近几年鲣鱼废弃物已经对我国环境造成了严重的威胁。通过提取废料鲣鱼头中的DHA和EPA, 能够有效减少对环境的污染。本实验的目的是研究从鲣鱼眼窝油中提取的DHA和EPA对小鼠的几个中枢神经系统的影响, 再运用动物抑郁模型, 例如强迫游泳实验(Forced swim ming test, FST)和悬尾实验(Tail suspension test, TST)来评估它们的抗抑郁活性效果。
1 材料与方法 1.1 鲣鱼眼窝肉的准备鲣鱼头用40-45 ℃的热水浸泡两天以除去鱼骨和鱼皮。并将洗涤后的头部眼窝肉擦干净, 放置于-20 ℃的冰箱内冷藏。
1.2 碱水解法水解胶原蛋白和其它有机部分。碱水解法的方法如下:首先, 将100 g擦干净的鲣鱼眼窝肉放置于三颈烧瓶中, 并加入1.5倍于原料的水。再将混合物在50 ℃的条件下搅拌均匀, 并用40%的氢氧化钾将pH调至8.0。接着将温度升高到80 ℃, 并持续搅拌50 min。然后再在该混合物中加入5%的氢氧化钾进行水解, 并盐析15 min。最后在6000 r/min在条件下离心5 min, 此时分离出来的油相即为鱼油(Barakat et al, 2009)。
1.3 脂肪酸甲酯的制备脂肪酸甲酯的制取首先需要加入200 μL的乙酰氯并在75 ℃的温度下恒温1 h。接着, 将反应物用4 mL, 7%的K2CO3进行中和, 并用2 mL的己烷来萃取。然后在2500 r/min条件下进行20 min离心分离。此时1.6 mL的己烷层能够在氮气下干燥, 并再次溶解于280 μL的庚烷内并注射进入气相色谱仪(GC)。
1.4 脂肪酸甲酯的气相色谱(GC)将1 μL试样注入SHIMADZU-PLUS-GC系统。进样器的温度为250 ℃, 随后脂肪酸甲酯在30 m的聚乙二醇气相毛细血管柱上被分离。柱的初始温度为160 ℃, 保持5 min; 然后以5 ℃/ min的速度缓慢升温并最终达到230 ℃。气相色谱仪利用萃取的方法能定量测定DHA和EPA的值。通过与真实的标准保留时间比较, 脂肪酸(DHA和EPA)就可被鉴定出来。纯的DHA和EPA的甲酯可被用作标准来分析他们的相对含量。标准溶液的浓度通过蒽酮法测定(注射2 μL标准溶液于气相色谱仪内, 获得标准曲线, 并分析出它的峰值)。
1.5 给药对不同组的健康小鼠进行药物治疗, 并对每一个进行测试。将氟西汀溶解于生理盐水中。并且所有剂量均表示为每kg体重所对应的药物的mg数。食物, 不包括水, 在给动物喂药的前一个小时内不能摄入。将药品以DHA或EPA (50, 100和300 mg/kg), 氟西汀(10 mg/kg), 盐水(15 mg/kg)的配比, 连续21天每天1次的方式给小鼠(每组有10只)口服喂药且进行相关的强迫游泳实验和悬尾实验。并在最后一次的药物治疗后进行1h的行为测试。
1.6 强迫游泳实验(FST)在强迫游泳实验中, 采用本地品种的雄性Balb/e小鼠(18-22 g)(Porsolt, 1981)。将其安置在六个组。在试验当天, 将小鼠逐个在扔进一个装有10 cm高的水, 水温为(22±3) ℃的有机玻璃圆筒内(高25 cm, 直径10 cm), 使它们在水里待上6 min。所有游泳测试的过程都会被圆筒上方直接固定的摄像机所记录。在实验过程期间也还会有两个主要的观察员, 但观察员对每个小鼠的治疗和录像带的得分情况都毫不知晓。在游泳训练结束后, 将小鼠用毛巾擦干, 并带回它们原来的处所。小鼠在这个实验中仅被测验一次。且所有的强迫游泳实验都是在上午12点到下午6点这个时间段内进行。
1.7 悬尾实验(TST)用夹子(长度为2 cm)夹住小鼠尾巴并将其单独悬挂在一个箱子内(25 cm×25 cm×30 cm), 使其头部到箱子的底部约为5 cm。测试在一个黑暗的房间里, 在最小的背景噪音下进行。每只小鼠都悬挂6 min, 并观察其静止不动的时间且在最后的4 min内进行间断测试衡量。所有的测试过程都会被箱子上方直接固定的摄像机所记录。在实验过程期间也会有两个主要的观察员, 但是他们对每个小鼠的治疗和录像带得分情况都毫不知晓。只有当小鼠是被被动悬挂, 或者完全不动的情况下才认为它们是静止不动的。小鼠在这个实验中仅被测验一次。且所有的强迫游泳实验都是在上午11点到下午3点这段时间内进行的(Steru et al, 1985)。
1.8 对5-羟色胺引起小鼠头抽动综合征的增强作用在药物测试过程中, 进行腹腔注射75 mg/kg的5-羟色胺之前应先口服测试药物60 min。然后将小鼠放入玻璃钟罩内, 14 min后5次计数相邻间隔2 min的头部抽动小鼠的数量(包括第14和16 min, 24和26 min, 34和36 min, 44和46 min, 54和56 min)。在这些间隔的时间内小鼠也同时被观察是否存在全身性震颤, 前蹄踩踏或伸展姿势将腹部放置于接近笼子表面的情况。并计算每个小鼠的得分情况(最大的得分情况=25, 包括头抽动症状的存在与否)(Corne et al, 1963; Sánchez-Mateo et al, 2009)。
1.9 旷场试验旷场试验用于评估动物的探究性活动(Elliott et al, 1986)。在实验之前, 所研究的DHA和EPA应先对小鼠给药60 min。这项研究是在Archer的方法上稍作修改对小鼠进行试验的(Archer, 1973)。旷场装置是一个非透明的塑料容器(80 cm×60 cm×30 cm), 其底部被分成了48个尺寸为10 cm×10 cm的单元, 且之间没有围墙。这些动物被轻轻地放在了平台的中心, 被允许去探索周围的环境。在5 min之内, 手动计数该小鼠的水平(横向移动)和竖直得分(后肢站立次数)情况。并且, 观察人员也不知道哪个组的小鼠已经被治疗过, 以及它们在旷场装置内的得分情况。该实验在黑暗的房间内进行, 其光照由装置在中心1 m以上的60瓦电灯泡提供, 能够投射出淡黄色的光。
1.10 高效液相色谱(HPLC)的条件与测定将小鼠断头处置, 迅速将其大脑取出, 放置于冰冷的玻璃板上解剖, 随后分离得到前额叶丘脑, 大脑皮层和海马体。将组织称重, 并放入于0.1 mol/L磷酸二氢钠水溶液中(包括0.85 mmol/L OSA, 0.5 mmol/L EDTA•NA2)进行超声处理, 随后离心(12000 r/min, 30 min)。然后, 通过高效液相色谱-电化学法分析5-羟色胺和去肾上腺素。高效液相色谱系统包括一个微孔反相柱(Shimadzu LC-10ATVP高效液相系统, Shimadzu L-ECD-6A电化学检测器, N2000高效液相操作软件, Hypersil ODS C18色谱柱4.6×150 mm 5 μm) (Thermo, USA)。流动相为0.1 mol/L的磷酸二氢钠水溶液(包括0.8 mmol/L OSA, 0.5 mmol/L EDTA•NA2)和11%的甲醇, 并用磷酸调至pH=3.4, 并经0.45 μm滤膜过滤。通过被量化的5-羟色胺和去肾上腺素来绘制标准工作曲线, 随后再对每一个样品计算其曲线下面积(AUC)。进样量通常为20 μL。且本实验每个样本的检出限为20pg/g。
1.11 统计分析数据采用单向方差分析(ANOVA)并结合Newman-Keuls检验和Turkey检验的方法来进行分析的(Tallarida et al, 1987)。0.05及以下的概率水平可被广泛接受。卡方检验被用于检测由丁苯诱导的运动活性的百分比。由丁苯那嗪引起的眼睑下垂, 和由5-羟色胺诱导的综合征可运用Mann-Whitney检验中的非参数数据来进行分析。
2 结果与分析 2.1 DHA和EPA甲酯的纯化和结构鉴定利用气相色谱仪分析鲣鱼眼窝油中提取的DHA和EPA (图 1)。在样品制备过程之前应先将标准化的DHA和EPA甲酯注入气相色谱系统内。这两种鱼油在气象色谱频谱内产生的两个主峰分别在洗脱的第15.779 min和第21.298 min (图 1C), 这与图 1A和图 1B在第15.779 min (EPA甲酯)和第21.298 min产生(DHA甲酯)的峰相同。由此, 样品溶液中的DHA甲酯和EPA甲酯可以对应标准溶液的峰的保留时间来计算、分析出样品中DHA和EPA的含量, 并可证明鲣鱼眼窝油中确实含有DHA和EPA。
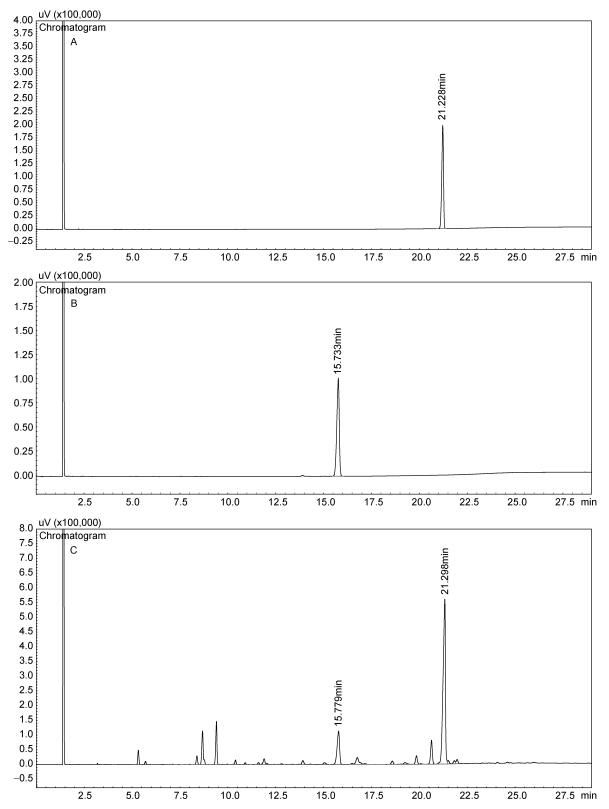 |
| 图 1 脂肪酸气相色谱图 Fig. 1 Gas-chromatogram of fatty acid standard substances and the samples 注: A.标准的EPA甲酯色谱图; B.标准的DHA甲酯色谱图; C.从鲣鱼头眼窝肉中提取的DHA和EPA样品色谱图 |
当DHA和EPA的剂量为50 mg/kg (P < 0.001)时, 能明显地发现小鼠通过对该剂量的依赖使不动状态的时间减少到108.1±10.7 s。然而, 当DHA和EPA的剂量分别为100和300 mg/kg (P < 0.001)时, 其不动状态时间只减少到127.7±17.9 s和124.4±15.3 s。空白对照小鼠的不动状态时间为157.0±16.1 s。因此, 可以得出这三种情况对小鼠不动状态的抑制作用分别为31.15%、18.66%和20.76%。其结果见图 2。
 |
| 图 2 在强迫游泳实验中, 给小鼠口服DHA和EPA后测定的不动状态时间 Fig. 2 Immobility time of DHA and EPA in the FST after oral administration in mice 注:数据为均数±均数标准误差(n=10)。统计分析根据Turkey实验的单向方差分析测得。***P < 0.001 vs. control, #P < 0.05 vs. DHA and EPA (50 mg/kg) |
相比较空白对照小鼠的不动状态时间为127.88±15.68 s, 当DHA和EPA的剂量分别为100 mg/kg和300 mg/kg (P < 0.001)时, 能发现小鼠通过对该剂量的依赖使不动状态的时间减少到89.6±9.1 s和93.5±7.7 s。然而, 当DHA和EPA的剂量为50 mg/kg时, 可使小鼠的不动状态时间发生更大幅度的改变, 减少到70.1±4.8 s (P < 0.001)。因此, 可得出其抑制作用分别为29.93%、26.88%和45.18%。结果见图 3。
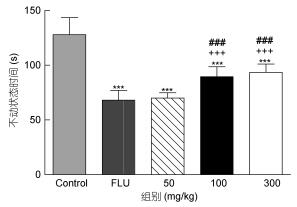 |
| 图 3 在悬尾实验中, 给小鼠口服DHA和EPA后测定的不动状态时间 Fig. 3 Immobility time of DHA and EPA in the TST after oral administration in mice 注:数据为均值±均数标准误差(n=10)。统计分析根据Turkey实验的单向方差分析测得。***P < 0.001; +++ P < 0.001 vs. FLU; ### P < 0.001 vs. DHA and EPA (50 mg/kg) |
表 1展示了旷场试验的实验结果。本次试验研究表明, 作者用DHA和EPA (剂量分别为50, 100和300 mg/kg)治疗的小鼠与空白对照组的小鼠在5 min的旷场试验中表现的无明显区别。在强迫游泳实验中给小鼠口服氯丙咪嗪也不能使它们在旷场试验内显著地改变横向移动及竖立的次数。
| 处理组别 | 剂量(mg/kg) | 横向移动 | 竖立 |
| DHA/EPA | 50 | 129.1±9.12 | 60.1±10.9 |
| DHA/EPA | 100 | 125.9±9.28 | 49.8±7.92 |
| DHA/EPA | 300 | 128.5±8.28 | 58.3±6.28 |
| FLU | 10 | 126.3±6.98 | 55.9±5.90 |
| 对照 | - | 127.4±7.42 | 56.2±6.21 |
| 注:数据为均值±均数标准误差(n=10)。统计分析根据Turkey实验的单向方差分析测得 | |||
表 2展示了DHA和EPA对5-羟色胺引起的小鼠头抽动综合征的结果。可以明显观察到DHA和EPA (50 mg/kg)对药物引起的综合征表现出微弱但却重要的作用(P < 0.05, Mann-Whitney test)。而且, 尽管没有明确的统计学意义, 仍能得出它们能对5-羟色胺引起头抽动综合征有显著效果。然而在任何一种情况下, 它所展示出的增强效应却都比氟西汀(一种抗抑郁药, 能选择性地或优先地抑制5-羟色胺酸的摄入)要弱(P < 0.01)。
| 处理组 | 剂量(mg/kg, p.o.) | 小鼠头抽动数 | 综合征评分a |
| DHA/EPA | 50 | 2.51±0.4 | 1.62±0.29b |
| FLU | 100 | 25.5±2.40* | 24.72±0.13c |
| 对照 | - | 0.65±0.21 | 0.59±0.28 |
| 注:数据为均值±均数标准误差(n=10)。*P < 0.05 (Newman-Keuls test); bP < 0.05 (Mann-Whitney test); cP < 0.01 (Mann-Whitney test) | |||
用高效液相色谱-电化学法同时测定小鼠大脑区域内主要的单胺神经递质及其代谢物。其结果展示在表 3。DHA和EPA的剂量为50 mg/kg, 氟西汀为5 mg/kg。可以明显观察到, 在强迫游泳实验中, DHA和EPA及FLU能够显著增加主要神经递质5-羟色胺和去甲肾上腺素在小鼠海马体、下丘脑及皮质层中的浓度。
| 部位 | 组别 | 5-HT | NE |
| 下丘脑 | 压力对照 | 412.5±11.3z | 247.7±10.5z |
| DHA and EPA | 655.2±35.5a | 402.7±14.6b, z | |
| 氟西汀 | 643.2±58.4a | 385.3±53.6b | |
| 整体对照 | 965.4±102c | 604.4±69.4c | |
| 海马体 | 压力对照 | 386.4±14.8y | 97.5±9.3z |
| DHA and EPA | 403.5±11.6z | 263.8±13.7z | |
| 氟西汀 | 446.6±12.6b, z | 248.1±9.6b, z | |
| 整体对照 | 703.2±47.9b | 309.4±18.4c | |
| 皮质层 | 压力对照 | 318.4±36.3z | 235.5±13.1z |
| DHA and EPA | 549.7±24.8a | 286.4±10.8a | |
| 氟西汀 | 607.8±36.7a, z | 291.1±9.4b | |
| 整体对照 | 786.9±78.8a | 316.4±29.5c | |
| 注: DHA和EPA剂量均为(50 mg/kg), 氟西汀剂量为5 mg/kg。数据为均值±均数标准误差(n=10)。统计分析根据Turkey实验的单向方差分析测得。aP < 0.001, bP < 0.01, cP < 0.05 vs.压力对照, xP < 0.001, yP < 0.01, zP < 0.05 vs.整体对照 | |||
在本次试验中, 作者利用碱水解法来提取深海鲣鱼眼窝肉中的DHA和EPA, 并采用强迫游泳实验和悬尾实验来验证它们的抗抑郁活性。在这两种实验中, 当DHA和EPA的剂量分别为50, 100和300 mg/kg时都能减少小鼠不动状态的时间, 显示其抗抑郁活性。此外, DHA和EPA (50 mg/kg, p.o.)还能增强5-羟色胺诱导的头抽动应答, 说明他们能参与到中枢血清素激活系统内。
强迫游泳实验(Porsolt et al, 1977)和悬尾实验(Willner, 1984)都是一种表现行为绝望的模型, 这与人类的抑郁症十分相似。这项测试是基于对动物的观察, 从最开始的逃离表现, 到后来发现无处可逃后的绝望, 从而使其产生了静止不动的消极状态。这种不动的状态可能是反映了对于坚持直接逃跑的绝望, 也可能是一种被动行为的发展, 使动物想要在紧张刺激的应对活性形式中脱离。通过这两种实验, 可以发现使用DHA和EPA治疗过的小鼠它们在直接逃跑行为过程中会使不动状态时间降到最低, 而这可能是由于它们内源性的抑郁症减弱的效果。而且, 不同剂量处理的DHA和EPA (50, 100和300 mg/kg)对抑制不动状态的效果也有显著差异。低剂量(50 mg/kg)展现出了较好的活性, 而高剂量(100 mg/kg和300 mg/kg)的抗抑郁活性则相对较弱。
旷场试验是用来评估DHA和EPA对自发运动活性的影响的。这是一个经典的用于评估药物和一般动物活性的自主效应实验(Galdino et al, 2009)。该研究结果表明了DHA和EPA并没有显著改变小鼠的运动活性(横向移动和竖立)。因此可以说明, 在强迫游泳实验中所观察到的效果也是不可能由一般的运动活性的刺激而产生的。此外, 作者还发现DHA和EPA都能对由5-羟色胺诱导的头抽动综合征产生轻微的增强作用, 这可能是由于它们中的一部分抗氧化活性参与到了血清素机制里。
综上, 本次研究提供的证据表明从鲣鱼眼窝油中提取的DHA和EPA能够在预测抗抑郁特性的动物模型中(强迫游泳实验, 悬尾实验)明确表明其具有抗抑郁活性效果。这不仅使得DHA和EPA增加了潜在的生物医学应用前景, 而且还减少了对环境污染, 促进了下脚料的开发利用。
| Archer J, 1973. Tests for emotionality in rats and mice:a review. Anim Behav, 21 (2) : 205–235 DOI:10.1016/S0003-3472(73)80065-X |
| Barakat N A M, Khil M S, Omran A M, et al, 2009. Extraction of pure natural hydroxyapatite from the bovine bones bio waste by three different methods. J Mater Process Technol, 209 (7) : 3408–3415 DOI:10.1016/j.jmatprotec.2008.07.040 |
| Bradbury J, 2011. Docosahexaenoic acid (DHA):an ancient nutrient for the modern human brain. Nutrients, 3 (12) : 529–554 DOI:10.3390/nu3050529 |
| Corne S J, Pickering R W, Warner B T, 1963. A method for assessing the effects of drugs on the central actions of 5-hydroxytryptamine. Br J Pharmacol Chemother, 20 : 106–120 DOI:10.1111/(ISSN)1476-5381a |
| Elliott P J, Chan J, Parker Y M, et al, 1986. Behavioral effects of neurotensin in the open field:structure-activity studies. Brain Res, 381 : 259–265 DOI:10.1016/0006-8993(86)90075-2 |
| Farley J H, Clear N P, Leroy B, et al, 2006. Age, growth and preliminary estimates of maturity of bigeye tuna, Thunnus obesus, in the Australian region. Mar Freshwater Res, 57 (7) : 713–724 DOI:10.1071/MF05255 |
| Galdino P M, Nascimento M V M, Sampaio B L, et al, 2009. Antidepressant-like effect of Lafoensia pacari A.St.-Hil.ethanolic extract and fractions in mice St.-Hil.ethanolic extract and fractions in mice. J Ethnopharmacol, 124 (3) : 581–585 DOI:10.1016/j.jep.2009.05.001 |
| Lopez A D, Murray C C J L, 1998. The global burden of disease, 1990-2020. Nat Med, 4 : 1241–1243 |
| Mischoulon D, Catherine B P, Michael L, et al, 2008. A double-blind dose-finding pilot study of docosahexaenoic acid (DHA) for major depressive disorder. Eur Neuropsychopharmacol, 18 (9) : 639–645 DOI:10.1016/j.euroneuro.2008.04.011 |
| Mozaffari-Khosravi H, Yassini-Ardakani M, Karamati M, et al, 2013. Eicosapentaenoic acid versus docosahexaenoic acid in mild-to-moderate depression:A randomized, double-blind, placebo-controlled trial. Eur Neuropsychopharmacol, 23 (7) : 636–644 DOI:10.1016/j.euroneuro.2012.08.003 |
| Porsolt R D, 1981.Behavioral despair.In:Enna S J, Malick J B, Richelson E eds.Antidepressants:Neurochemical Behavioral and Clinical Perspectives.New York:Raven Press, 129-139 |
| Porsolt R D, Bertin A, Jalfre M, 1977. Behavioral despair in mice:a primary screening test for antidepressants. Arch Int Pharmacodyn Ther, 229 (2) : 327–336 |
| Sánchez-Mateo C C, Bonkanka C X, Rabanal R M, 2009. Hypericum grandifolium Choisy:A species native to Macaronesian Region with antidepressant effect. J Ethnopharmacol, 121 (2) : 297–303 DOI:10.1016/j.jep.2008.10.031 |
| Siriwardhana N, Kalupahana N S, Moustaid-Moussa N, 2012. Health benefits of n-3 polyunsaturated fatty acids:eicosapentaenoic acid and docosahexaenoic acid. Adv Food Nutr Res, 65 : 211–222 DOI:10.1016/B978-0-12-416003-3.00013-5 |
| Steru L, Chermat R, Thierry B, et al, 1985. The tail suspension test:a new method for screening antidepressants in mice. Psychopharmacology, 85 (3) : 367–370 DOI:10.1007/BF00428203 |
| Tallarida R J, Murray R B, 1987. Manual of Pharmacologic Calculations with Computer Programs. 2nd ed. New York: Springer-Verlag, 110-134 |
| Thase M E, 2003. Evaluating antidepressant therapies:remission as the optimal outcome. J Clin Psychiatry, 64 (Suppl.13) : 18–25 |
| Tian Y, 2010. Research progress of clinical antidepressant drugs. J China Traditional Chinese Medicine Information, 2 : 175 |
| Willner P, 1984. The validity of animal models of depression. Psychopharmacology, 83 (1) : 1–16 DOI:10.1007/BF00427414 |
 2016, Vol. 47
2016, Vol. 47


