
中国海洋湖沼学会主办。
文章信息
- 谢洁玲, 史晓翀, 史姣霞, 于彤, 李八方, 赵雪. 2017.
- XIE Jie-Ling, SHI Xiao-Chong, SHI Jiao-Xia, Yu Tong, LI Ba-Fang, ZHAO Xue. 2017.
- 人肠道微生物对海带岩藻聚糖硫酸酯及其寡糖的降解利用
- HUMAN GUT MICROBES DEGRADE AND UTILIZE FUCOIDAN AND ITS OLIGOSACCHARIDES FROM LAMINARIA JAPONICA IN VITRO
- 海洋与湖沼, 48(1): 50-56
- Oceanologia et Limnologia Sinica, 48(1): 50-56.
- http://dx.doi.org/10.11693/hyhz20160600138
-
文章历史
- 收稿日期:2016-06-29
- 收修改稿日期:2016-08-09
2. 中国海洋大学海洋生命学院 青岛 266003
2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China
从海带中提取出来的岩藻聚糖硫酸酯(fucoidan)是一种水溶性的杂多糖,硫酸酯化的 α-L-岩藻糖残基是大多数分子的基本组成成分,其具备的抗血栓、抗凝血、抗肿瘤以及调节体内免疫的活性已经得到广泛认可(Pomin et al,2008; 陈安进等,2012;Wijesinghe et al,2012)。口服不同分子量聚糖硫酸酯表现出很好的提高免疫力活性(李芳等,2012)。而岩藻聚糖硫酸酯作为一种非淀粉大分子硫酸多糖,结构较为复杂,由于人体自身缺乏与之相关的消化酶,无法在上消化道被降解利用,几乎全进入大肠中,所以高分子量岩藻聚糖硫酸酯是无法被直接吸收转运到体内的。而口服岩藻聚糖硫酸酯如何发挥其免疫调节活性,是一个未知的难题。因此研究岩藻聚糖硫酸酯的消化吸收对其生物活性的研究具有重要的意义。有研究报道结肠特别是盲肠中的微生物可以降解非淀粉多糖,胃和小肠则不能(Barthe et al,2004),原因是非淀粉多糖不能被人类自身的酶系所消化(Buddington et al,2002),所以非淀粉多糖不易被胃肠消化吸收,几乎全部进入大肠。人体肠道中的微生物种类超过1000 种,菌总数高达1014。Gill等(2006)通过基因测序并构建元基因文库,发现肠道微生物的基因库中富含参与多糖代谢的基因。日本的Czjzek 课题组发现在其本国人的肠道微生物的宏基因组中存在琼胶和紫菜多糖水解酶的基因(Hehemann et al,2010)。经过更深入的研究,该课题组还发现Z.galactanovorans 中含有褐藻胶降解基因的操纵子(Thomas et al,2012)。Li 从中国人的粪便微生物中分离出能够降解琼胶和卡拉胶的菌株(李苗苗,2014; Li et al,2014)。研究证明人肠道微生物可以降解这些海洋硫酸多糖,并对肠道有益菌有促进作用。研究表明,肠道微生物在人体的营养物质代谢过程中起着重要作用,其中酵解多糖的代谢终产物-短链脂肪酸(SCFAs),主要是乙酸、丙酸、丁酸,不仅能为宿主和肠道微生物本身的生长繁殖提供能量,且具有抗病原微生物、改善肠道功能、调节免疫、抗炎、抗肿瘤等重要作用(陈燕等,2006)。但是支链脂肪酸(BCFAs)如异丁酸和异戊酸,只能由支链氨基酸发酵产生。由于人体内的酶不能降解蛋白质产生支链脂肪酸,所以肠道中的支链脂肪酸主要是由肠道微生物对蛋白质进行厌氧发酵所产生的,蛋白质的发酵还会产生氨类、酚类、吲哚等对人体有害的物质,这与大肠癌、溃疡结膜炎等密切相关,因此这个过程总体上被认为是对人体健康不利的(周中凯等,2014)。
海带岩藻聚糖硫酸酯是一种结构复杂的海洋硫酸多糖,主要含有岩藻糖、半乳糖、葡萄糖醛酸、甘露糖和葡萄糖,还含有微量的氨基葡萄糖、鼠李糖、氨基半乳糖和木糖,糖链上还含有大量的半乳糖和岩藻糖支链。人肠道微生物是否能够降解利用复杂的岩藻聚糖硫酸酯,目前还没有研究报道。本文利用体外发酵模型,研究了人体肠道微生物对高、低分子量海带岩藻聚糖硫酸酯的降解,并对降解产物中的多糖组成和短链脂肪酸进行分析,为更深一步地探究岩藻多糖与肠道微生物的相互作用奠定基础。
1 材料与方法 1.1 材料海带岩藻聚糖是本实验室从威海产海带中,采用酸浸泡、水提取和醇沉法获得,采用10kDa 透析袋透析脱盐,冻干后得到高分子量海带岩藻聚糖硫酸酯(HMWF)。
1.2 试剂单糖标准品甘露糖、葡萄糖、岩藻糖、半乳糖、木糖、鼠李糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸和乳糖购自美国 Sigma 公司; 6 种短链脂肪酸标准品(乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸)和二乙基丁酸购自阿拉丁工业公司。
1.3 仪器MLS-3750 高温高压灭菌锅,日本SANYO 株式会社; Agilent 1100 型高效液相色谱仪,美国安捷伦公司; DYY-6C 型电泳仪,北京市六一仪器厂; Agilent 1260 型高效液相色谱仪,美国安捷伦公司; 电喷雾LTQ-Orbitrap XL 质谱,美国thermo 公司; Agilent 6890 型气相色谱仪,美国安捷伦公司。
1.4 实验方法 1.4.1 低分子量海带岩藻聚糖硫酸酯的制备称取1.0g 岩藻聚糖多糖和0.08g 醋酸铜溶于15mL 蒸馏水中,用2mol/L NaOH 调pH 至7.5,以3mL/h 的速度加入4.5%H2O2,60℃ 水浴反应4h(pH 为7.5-8.0),反应结束后用Chelex 100 树脂除去Cu2+。用500Da 透析袋透析除盐,浓缩,冻干后得到低分子量岩藻聚糖硫酸酯(LMWF)(赵雪等,2011)。
1.4.2 培养基的配制在无碳源培养基(蛋白胨、胰蛋白胨、粘液素、3#胆盐、血红素、L-半胱氨酸、微量元素、混合维生素)中分别加入5g/L HMWF 或LMWF 为唯一碳源,调节pH 至6.4-6.5。各自取5mL分装至25mL 厌氧瓶,充氮气后密封,高压灭菌锅115℃ 灭菌40min。
1.4.3 人粪便样品的收集和接种提供实验样本的5 位志愿者(编号为Nos.1-5)身体健康,采样前2个月内无服用益生元、抗生素记录。取志愿者粪便,用0.1mol/L 灭菌的磷酸缓冲液(pH 7.0)配成20%(w/v)的悬浮液,充分混匀后离心去残渣。取0.5mL 粪便菌悬液,分别接种至HMWF和LMWF 培养基中,置于厌氧培养箱中,37℃ 培养48h,并于0h和48h 取样1mL。
1.4.4 低分子量岩藻聚糖硫酸酯分子量的测定低分子量岩藻聚糖硫酸酯用0.2mol/L NaCl 配成10mg/mL 溶液,用高效凝胶色谱来确定分子量的大小。色谱仪: Agilent 1100 高效液相色谱仪; 色谱柱:TSK-gel G2500 PWxl 色谱柱(7.8cm×30cm); 检测器:示差检测器(G1362A RID); 流动相: 0.2mol/L NaCl;流速: 0.5mL/min; 柱温: 40℃; 标准品: 分子量为1kDa 的葡聚糖、岩藻糖(MW164.16)和分子量为5000Da、6000-10000Da 的硫酸葡聚糖,分子量为180Da、2500Da、4600Da、7100aD和10000Da 的右旋糖酐。Agilent GPC 软件计算样品洗脱峰的重均分子量和分散系数。
1.4.5 薄层层析法(TLC)检测降解情况所取样品在12000r/min 离心10min,然后取上清液,在硅胶板上点样1.2μL,以反应0h 的样品作对照,放置于甲酸:正丁醇:水=6:4:1(v:v:v)的展开剂中展开两次后,吹干,用苯胺-二苯胺显色剂(0.2mL 苯胺、0.1mL HCl 、0.2g 二苯胺和1mL 85%磷酸溶于10mL 丙酮中)浸润后吹干,在电炉上加热显色(焦广玲等,2007)。
1.4.6 聚丙烯酰胺凝胶电泳(PAGE)检测降解情况所取样品在12000r/min 离心10min,然后取上清液10μL,与50%蔗糖1︰1 混匀。采用5%的浓缩胶和15%的分离胶来进行电泳分析,电压200V,时间30min。将胶放入5%(w/v)的阿利新蓝溶液中(2%乙酸配制)染色1h,再用2%乙酸脱色两次(郭峰君等,2014)。
1.4.7 高效液相色谱法(HPLC)分析岩藻聚糖硫酸酯的单糖组成所取样品在12000r/min 离心10min,取0.4mL 上清液于5mL 安瓿瓶中,加2mL 2mol/L三氟乙酸后充N2 封瓶,110℃ 消化8h,冷却后空气吹干,加甲醇吹干,重复3 次以确保除尽三氟乙酸,然后用100μL 超纯水溶解,再用0.3mol/L NaOH 调成中性,定容至200μL,6000r/min 离心10min 后取90μL上清液和10μL 20mmol/L 乳糖内标至干净离心管中,另外,10 种浓度均为20mmol/L 的单糖标准品各加10μL 至另一干净离心管中,在相同条件下进行PMP衍生。色谱柱: EC-C18 分离柱(4.6mm×150mm,5μm);检测器: 紫外检测器(245nm); 流速: 0.3mL/min; 柱温: 30℃; 流动相: 流动相A: 磷酸缓冲液(pH 为 6.7的0.1mol/L KH2PO4):乙腈=82:18,流动相B: 磷酸缓冲液(pH 为 6.7 的0.1mol/L KH2PO4):乙腈=65:35; 时间梯度: 0-40min; 浓度梯度: 5%-50%; 进样量10μL(尹利昂等,2009)。
1.4.8 气相色谱法(GC)测定短链脂肪酸取2mL培养液12000r/min 离心10min,取上清液,加入1/10体积50% H2SO4,再加入3 倍体积乙醚,振荡混匀35min,12000r/min 离心10min,收集乙醚层,浓缩,用于气相色谱分析(Zhang et al,2012)。气相色谱条件:载气: N2; 分流比: 20︰1; 流速: 3mL/min; 色谱柱:HP-INNOWAS; 升温程序: 80℃ 保持0.5min,以8℃ /min 升到150℃,保持1min,再以20℃/min 升到200℃,保持5min; 进样口温度: 250℃; 进样量: 1μL;检测器: FID; 检测器温度: 250℃。
1.4.9 统计学处理数据采用 Excel 2007 统计分析,实验结果以平均数±标准偏差(X ± S)表示。
2 结果与分析 2.1 岩藻聚糖硫酸酯化学性质的比较海带岩藻聚糖硫酸酯的分子量很高,大于500kDa,经过自由基氧化降解,多糖的分子量显著下降。图 1 为高效凝胶色谱法测定低分子量岩藻聚糖硫酸酯分子量的色谱图。采用系列分子量的葡聚糖标准品制作标准曲线,计算得到低分子量岩藻聚糖硫酸酯的重均分子量为7.74kDa,分散系数为1.02。在自由基氧化降解过程中,糖链上硫酸根含量低的葡萄糖醛酸、甘露糖、半乳糖容易被降解成单糖和寡糖,在用500Da 的透析袋透析的过程中,部分寡糖和单糖损失,因此,造成高分子量和低分子量岩藻聚糖硫酸酯的单糖组成之间存在差异。
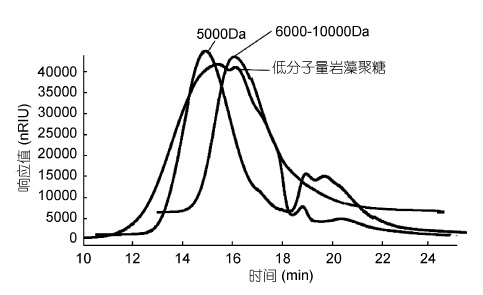 |
| 图 1 低分子量岩藻聚糖硫酸酯分子量测定的高效液相色谱图 Fig. 1 The HPLC chromatogram showing the molecular weight of LMWF 注: 5000Da: 5000Da 的硫酸葡聚糖标准品; 6000-10000Da:6000-10000Da 的硫酸葡聚糖标准品 |
高分子量和低分子量岩藻聚糖硫酸酯经不同人的肠道微生物发酵培养后,采用TLC和PAGE分析岩藻聚糖硫酸酯的降解情况。
图 2 为TLC 分析不同分子量岩藻聚糖硫酸酯在肠道微生物酵解前后其寡糖含量的变化。图 2a 中TLC 分析表明,低分子量岩藻聚糖硫酸酯中含有较多单糖、寡糖和多糖。 被肠道微生物酵解48h 之后,No.1、No.2和No.5 中的寡糖几乎是完全降解,No.3和No.4 中的寡糖被部分降解。而图 2b 中TLC 分析表明,高分子量岩藻聚糖硫酸酯中不含寡糖,但是酵解48h 后,可以看到有少量的寡糖生成,多糖部分降解程度很低,这说明只有少量高分子量岩藻聚糖硫酸酯被肠道微生物降解利用。比较发现,岩藻聚糖硫酸酯寡糖更容易被肠道微生物降解利用,而高分子量岩藻聚糖硫酸酯很难被肠道微生物降解利用。
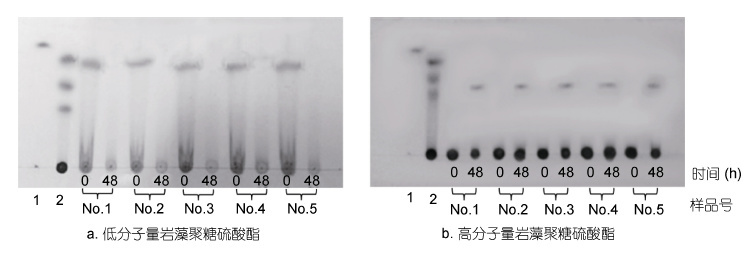 |
| 图 2 TLC 分析Nos.1-5 人肠道微生物降解低分子量和高分子量海带岩藻聚糖硫酸酯 Fig. 2 TLC analysis on the LMWF and HMWF after being degraded by Nos.1-5 human gut microbiota 注: 1: 岩藻糖单糖; 2: 硫酸软骨素酶解产物; Nos.1-5: 依次为Nos.1-5 志愿者的肠道微生物对高、低岩藻聚糖硫酸酯的降解 |
图 3 为 PAGE 分析不同分子量海带岩藻聚糖硫酸酯在肠道微生物酵解前后高分子量部分的降解情况,分子量采用10kDa和40kDa 的硫酸葡聚糖作为标准对照。图 3a PAGE 分析表明,酵解48h 后,低分子量岩藻聚糖硫酸酯分子量分布在10-20kDa 之间的组分显著减少,说明分子量在10-20kDa 的低分子量岩藻聚糖硫酸酯也能够被肠道菌群降解利用。图 3b PAGE 分析表明,高分子量岩藻聚糖硫酸酯分子量大于20kDa,酵解48h 后,高分子量组分的含量有所下降,说明高分子量岩藻聚糖硫酸酯有少量能被肠道微生物降解。
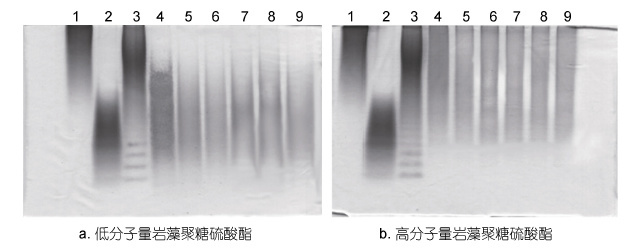 |
| 图 3 PAGE 分析Nos.1-5 肠道微生物降解低分子量和高分子量海带岩藻聚糖硫酸酯 Fig. 3 PAGE analysis on the LMWF and HMWF after being degraded by Nos.1-5 human gut microbiota 注: 1: 40kDa 的葡聚糖; 2: 10kDa 的葡聚糖; 3: 硫酸软骨素酶解产物; a-4: 低分子量岩藻聚糖原糖; b-4: 高分子量岩藻聚糖原糖; 5-9: 依次为Nos.1-5 志愿者的肠道微生物对低分子量岩藻聚糖硫酸酯或高分子量岩藻聚糖硫酸酯的酵解产物 |
结合TLC与PAGE的结果表明,肠道微生物对高分子量岩藻聚糖硫酸酯利用度很低,当岩藻聚糖硫酸酯被自由基降解产生寡糖和10-20kDa 的低分子量多糖时,才能很好地被肠道微生物降解利用。
2.3 发酵前后单糖组成的变化表 1 为岩藻聚糖硫酸酯经人肠道微生物酵解前后的单糖组成比较。高分子量岩藻聚糖硫酸酯中单糖组成复杂,主要含有岩藻糖、半乳糖、葡萄糖醛酸、甘露糖和葡萄糖,还含有微量的氨基葡萄糖、鼠李糖、氨基半乳糖和木糖。酵解48h 后,发酵体系中,高分子量岩藻聚糖硫酸酯中岩藻糖的含量明显升高,半乳糖和甘露糖的含量有所降低,说明人体肠道生物对高分子量岩藻聚糖硫酸酯中的半乳糖和甘露糖成分利用较多。低分子量岩藻聚糖硫酸酯主要是由岩藻糖和半乳糖、葡萄糖和甘露糖组成。发酵48h 后,发酵体系中剩余的低分子量岩藻聚糖硫酸酯的单糖组成基本不变。结合TLC和PAGE 分析结果表明,肠道微生物能够很好地降解利用低分子量岩藻聚糖硫酸酯,但是对低分子量岩藻聚糖硫酸酯的利用没有选择性,剩余组分的单糖仍然保留原糖的结构组成。
| 组分 | 高分子量岩藻聚糖硫酸酯 | 酵解后的高分子量岩藻聚糖硫酸酯 | 低分子量岩藻聚糖硫酸酯 | 酵解后的低分子量岩藻聚糖硫酸酯 |
| 甘露糖 | 3.73 | 2.69 | 2.74 | 3.13 |
| 氨基葡萄糖 | 1.26 | 1.59 | 0.96 | 1.83 |
| 鼠李糖 | 1.49 | — | 1.15 | 1.2 |
| 葡萄糖醛酸 | 12.96 | 10.7 | 6.29 | 6.8 |
| 氨基半乳糖 | 0.52 | — | — | — |
| 葡萄糖 | 3.06 | 3.54 | 2.01 | 3.2 |
| 半乳糖 | 31.27 | 26.54 | 31.57 | 30.27 |
| 木糖 | 1.49 | 1.65 | 0.77 | 0.98 |
| 岩藻糖 | 44.22 | 53.28 | 54.5 | 52.57 |
| 注: 各单糖的比例为单糖占总糖含量的摩尔百分比(%) | ||||
由表 1 可看出,高分子量和低分子量岩藻聚糖硫酸酯的单糖组成之间存在差异,这是由于高分子量藻聚糖硫酸酯在自由基降解制备低分子量岩藻聚糖硫酸酯时,糖链上硫酸根含量低的葡萄糖醛酸、甘露糖、半乳糖容易被降解成单糖和寡糖,这些单糖和寡糖有可能在透析除盐的过程中部分损失。
2.4 发酵前后短链脂肪酸的测定结果表 2 为人肠道微生物厌氧酵解后岩藻聚糖硫酸酯发酵液中短链脂肪酸的变化。肠道微生物在低分子量岩藻聚糖硫酸酯培养基中发酵48h 后,发酵液中主要产生乙酸和丙酸,还有少量的丁酸,说明肠道微生物能将低分子量岩藻聚糖硫酸酯进一步降解为乙酸、丙酸和丁酸。而肠道微生物在高分子量岩藻聚糖硫酸酯培养基中发酵48h 后,乙酸、丙酸、丁酸的含量有明显增加,说明肠道微生物也能将高分子量岩藻聚糖硫酸酯降解为乙酸、丙酸和丁酸,但同时产生了少量的异丁酸、异戊酸、戊酸,说明肠道微生物对蛋白质进行了无氧酵解(周中凯等,2014)。由此可见,低分子量岩藻聚糖硫酸酯和高分子量岩藻聚糖硫酸酯均能被肠道微生物降解生成短链脂肪酸,但是低分子量岩藻聚糖硫酸酯可以特异性地抑制肠道微生物对蛋白质的无氧酵解。
| 组别 | 高分子量岩藻聚糖硫酸酯(µg/mL) | 低分子量岩藻聚糖硫酸酯(µg/mL) | ||
| 0h | 48h | 0h | 48h | |
| 乙酸 | 50.91±4.42 | 399.37±11.69 | 27.17±2.17 | 417.54±19.54 |
| 丙酸 | — | 224.20±9.02 | — | 245.06±12.00 |
| 丁酸 | — | 82.90±8.42 | — | 82.40±6.31 |
| 异丁酸 | — | 41.58±6.40 | — | — |
| 异戊酸 | — | 33.62±4.75 | — | — |
| 戊酸 | — | 38.72±3.26 | — | — |
本实验分别用五个志愿者的肠道微生物降解高分子量海带岩藻聚糖硫酸酯和低分子量海带岩藻聚糖硫酸酯,发现低分子量岩藻聚糖硫酸酯中的寡糖基本被消耗殆尽,且低分子量岩藻聚糖硫酸酯组分中10-20kDa 的岩藻聚糖也部分被消耗,但是发酵体系中剩余的岩藻聚糖硫酸酯的单糖组成基本不变,这说明肠道微生物能够很好地降解利用低分子量岩藻聚糖硫酸酯,对岩藻聚糖硫酸酯中各种单糖的利用没有选择性。推断肠道微生物产生的多糖降解酶种类很多,不仅能降解岩藻糖苷键,而且能降解甘露糖、半乳糖、葡萄糖和糖醛酸等。然而,只有少量分子量大于20kDa 的高分子量岩藻聚糖硫酸酯被降解成为寡糖,且其单糖成分中的半乳糖和甘露糖被利用得较多,这说明肠道微生物对岩藻聚糖硫酸酯降解利用的难易程度与其分子量的大小有关。研究结果与Li(李苗苗,2014; Li et al,2014)研究肠道微生物降解琼胶和卡拉胶结果类似,肠道微生物只能降解利用琼胶和卡拉胶寡糖,而对高分子量琼胶和卡拉胶降解能力很低,肠道微生物中产生了β-琼胶酶和κ-卡拉胶酶。本研究中肠道微生物对复杂的岩藻聚糖硫酸酯的降解进一步证明,肠道微生物也能够产生降解岩藻糖、半乳糖、甘露糖、葡萄糖和糖醛酸的糖苷键的酶。
低分子量岩藻聚糖硫酸酯培养基在被肠道微生物酵解之后产生了乙酸、丙酸、丁酸,研究证明短链脂肪酸(乙酸、丙酸、丁酸)主要是由厌氧菌对不消化的碳水化合物酵解产生的,其不仅为肠道微生物生长繁殖和结肠粘膜提供能量,而且还能维护粘膜免疫细胞,减少促炎症因子生成,修复粘膜炎症,有利于人体的健康(许勤等,1999)。然而高分子量岩藻聚糖硫酸酯发酵液中不仅产生乙酸、丙酸和丁酸,还生成了少量异丁酸和异戊酸,这些支链脂肪酸(异丁酸、异戊酸)并不是糖酵解的产物,而是由支链氨基酸厌氧发酵所产生的,支链氨基酸厌氧发酵还会产生氨类、酚类、吲哚等对人体有害的物质(周中凯等,2014)。
4 结论人体肠道微生物能够很好地降解利用低分子量海带岩藻聚糖硫酸酯,同时经人体肠道微生物发酵后只产生了乙酸、丙酸、丁酸,抑制了蛋白质的厌氧酵解,说明低分子量岩藻聚糖硫酸酯比高分子量岩藻聚糖硫酸酯更有利于人体肠道的健康,为更深一步地探究岩藻多糖与肠道微生物的相互作用奠定了基础。
| 尹利昂, 陈士国, 薛长湖, 等, 2009. 4种海参中含岩藻糖支链的硫酸软骨素化学组成差异的分析. 中国海洋大学学报, 39 (S1) : 63–68 |
| 许勤, 吴文溪, 1999. 短链脂肪酸的代谢及其在肠道外科中的应用. 肠外与肠内营养, 6 (4) : 218–223 |
| 李芳, 李八方, 王景峰, 等, 2012. 海带岩藻聚糖硫酸酯对小鼠的免疫调节作用. 食品科学, 33 (5) : 238–242 |
| 李苗苗, 2014. 人体肠道微生物对琼胶与κ-卡拉胶及其寡糖的降解和利用研究. 青岛:中国海洋大学博士学位论文, 104 |
| 陈燕, 曹郁生, 刘晓华, 2006. 短链脂肪酸与肠道菌群. 江西科学, 24 (1) : 38–40 |
| 陈安进, 赵雪, 张芳, 2012. 不同相对分子质量岩藻聚糖硫酸酯抗血栓活性比较及机制探讨. 中国药学杂志, 47 (6) : 431–434 |
| 周中凯, 杨艳, 郑排云, 等, 2014. 肠道微生物蛋白质的发酵与肠道健康的关系. 食品科学, 35 (1) : 303–309 |
| 赵雪, 李芳, 董诗竹, 等, 2011. 相对低分子质量海带岩藻聚糖硫酸酯的制备及其对纤溶系统的影响. 中国海洋药物杂志, 30 (3) : 25–30 |
| 郭峰君, 胡靖, 赵雪, 2014. 海带岩藻聚糖硫酸酯降解及基本结构分析. 食品工业科技, 35 (18) : 93–97 |
| 焦广玲, 于广利, 赵峡, 2007. 几种寡糖和单糖在不同展开体系中的薄层色谱行为. 中国生化药物杂志, 28 (6) : 372–374 |
| Buddington K K, Donahoo J B, Buddington R K, 2002. Dietary oligofructose and inulin protect mice from enteric and systemic pathogens and tumor inducers. The Journal of Nutrition, 132 (3) : 472–477 |
| Barthe L, Woodley J, Lavit M, et al, 2004. In vitro intestinal degradation and absorption of chondroitin sulfate, a glycosaminoglycan drug. Arzneimittelforschung, 54 (5) : 286–292 |
| Gill S R, Pop M, DeBoy R T, et al, 2006. Metagenomic analysis of the human distal gut microbiome. Science, 312 (5778) : 1355–1359 DOI:10.1126/science.1124234 |
| Hehemann J H, Correc G, Barbeyron T, et al, 2010. Transfer of carbohydrate-active enzymes from marine bacteria to Japanese gut microbiota. Nature, 464 (7290) : 908–912 DOI:10.1038/nature08937 |
| Li M M, Li G S, Zhu L Y, et al, 2014. Isolation and characterization of an agaro-oligosaccharide (AO)-hydrolyzing bacterium from the gut microflora of Chinese individuals. PLoS One, 9 (3) : e91106 DOI:10.1371/journal.pone.0091106 |
| Pomin V H, Mourão P A S, 2008. Structure, biology, evolution, and medical importance of sulfated fucans and galactans. Glycobiology, 18 (12) : 1016–1027 DOI:10.1093/glycob/cwn085 |
| Thomas F, Barbeyron T, Tonon T, et al, 2012. Characterization of the first alginolytic operons in a marine bacterium:from their emergence in marine Flavobacteriia to their independent transfers to marine Proteobacteria, and human gut Bacteroides. Environmental Microbiology, 14 (9) : 2379–2394 DOI:10.1111/emi.2012.14.issue-9 |
| Wijesinghe W A J P, Jeon Y J, 2012. Biological activities and potential industrial applications of fucose rich sulfated polysaccharides and fucoidans isolated from brown seaweeds:a review. Carbohydrate Polymers, 88 (1) : 13–20 DOI:10.1016/j.carbpol.2011.12.029 |
| Zhang X, Zhao Y F, Zhang M H, et al, 2012. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats. PLoS One, 7 (8) : e42529 DOI:10.1371/journal.pone.0042529 |
 2017, Vol. 48
2017, Vol. 48


