
中国海洋湖沼学会主办。
文章信息
- 田伊林, 刘雨薇, 王宏伟. 2017.
- TIAN Yi-Lin, LIU Yu-Wei, WANG Hong-Wei. 2017.
- 披针形蜈蚣藻(Grateloupia lanceolata)的早期发育及其生活史
- EARLY DEVELOPMENT AND LIFE CYCLE OF GRATELOUPIA LANCEOLATA
- 海洋与湖沼, 48(1): 113-121
- Oceanologia et Limnologia Sinica, 48(1): 113-121.
- http://dx.doi.org/10.11693/hyhz20160700164
-
文章历史
- 收稿日期:2016-07-29
- 收修改稿日期:2016-10-18
披针形蜈蚣藻(Grateloupia lanceolata)隶属于红藻门(Rhodophyta)、杉藻目(Gigartinales)、海膜科(Halymeniaceae)、蜈蚣藻属(Grateloupia)。1934 年最初被Okamura. K 发现并命名为Aeodes lanceolata Okamura(Okamura,1934)。1954 年Yamada. Y和Kawabata. S 根据藻体结构和生殖器官将其更名为Pachymeniopsis lanceolata(Okamura)Yamada et Kawabata(Kawabata,1954)。1997 年Kawaguchi. S 根据形态学研究将其移入蜈蚣藻属,更名为Grateloupia lanceolata(Okamura)Kawaguichi(Kawaguchi,1997)。该种的主要特征为: 藻体直立,单生或丛生,深红色或红色带黄色,粘滑,革质,固着器盘状,向上分裂成数片披针形叶片,有的叶片为长广圆形或带状,末端渐尖,长8-30cm,甚至可达60cm,宽3-5cm,边缘全缘或波浪形(夏邦美,2004)。生长在风浪较小的中低潮带的岩石上或石沼中(图 1)。
 |
| 图 1 披针形蜈蚣藻野外生境 Fig. 1 The habitat of Grateloupia lanceolata 注: a. 箭头所指处为披针形蜈蚣藻的雌配子体; b. 箭头所指处为披针形蜈蚣藻的雄配子体 |
近年来,除日本外,披针形蜈蚣藻陆续在法国(Verlaque et al,2005)、美国(Miller et al,2009)、韩国(Kim et al,2014)、地中海沿岸(Verlaque et al,2015)等地被发现。2004 年出版的《中国海藻志》第二卷第三册中记载,该种只在浙江省有分布,为我国新纪录种(夏邦美,2004)。2012 年,Ye等(2012)在山东省荣成市发现该种,认为是来自日本和韩国的外来入侵种,并对其四分孢子的放散和附着做了研究。2015 年10月,经过形态观察和对叶绿体基因组中的核酮糖1,5-二磷酸羟化酶/ 加氧酶大亚基基因(ribulose-1,5-bisphosphate carboxylase/oxygenase,rbcL)的分子鉴定,我们首次在大连发现该种,鉴定结果另文发表。
披针形蜈蚣藻有较高的经济价值,可食用(Seo et al,2013)、药用(Kim et al,2015),但尚未被成功开发为人工栽培品种,原因主要在于人们对其生长、发育等过程还不甚了解。Kawaguchi. S 曾简单观察了披针形蜈蚣藻的发育过程,但没有进行环境因子对其发育影响的研究(Kawaguchi,1997)。Yang等人根据rbcL和COI 分子序列区分了该种和椭圆蜈蚣藻(G. elliptica)的差异(Yang et al,2013)。其他基本生物学特征未见报道。
为了补充相关内容,在实验室条件下,我们详细观察了其早期发育过程和生活史,同时研究了温度与光周期、温度与光照强度的交互作用对披针形蜈蚣藻发育的影响,探讨了适宜盘状体发育及幼苗生长的最优条件,旨在为披针形蜈蚣藻的种质保存、人工育苗、规模化栽培以及可持续开发利用提供理论依据和技术支撑。
1 材料与方法 1.1 标本采集和处理用于实验培养的成熟披针形蜈蚣藻于2015 年10月13 日采自大连市黑石礁、星海公园,于2015 年11月12 日采自大连市金石滩、付家庄,于2016 年4 月8 日采自大连市付家庄。首先,选择成熟囊果比例达到80%左右的雌配子体,用灭菌海水反复冲洗,再用毛笔刷洗藻体以除去表面污垢及其他杂藻。在室温通风处阴干1 小时,以刺激孢子放散。将处理好的雌配子体和四分孢子体放入铺满7 个载玻片的灭菌皮氏培养皿中,加入PES(Provasoli's enriched Seawater Medium)培养液,进行孢子采集。当孢子放散并附着于载玻片上,在显微镜下观察视野(10×10)中附着的孢子数达到20-30 个时,移除藻体。培养液每2 天更换1 次,同时加入GeO2(2mg GeO2/1L PES)以防止硅藻的生长。当生长出直立体后,将其转移至培养缸(10×10×5cm)中进一步培养。
1.2 实验条件设置 1.2.1 预培养将附着有孢子的载玻片于温度(15±2)℃,光照强度80-90μmol/(m2·s),盐度30±1,光周期12L︰12D 条件下预培养,直至盘状体直径达到50μm 左右。
1.2.2 温度与光周期的双因素实验设计将预培养后的盘状体分别置于温度5、10、15、20、25、30℃共6 个梯度,光周期设置为8L︰16D、12L︰12D、16L︰8D 共3 个梯度,共18 个组合,每组设置3 个平行样,其余条件与预培养一致。PES 培养液每2 天更换1 次,从每个实验组中随机抽取10 个盘状体并测量其直径,培养周期14 天。当幼苗高度达到500μm 时,从每个实验组中随机挑选10 个幼苗测量其高度,培养周期21 天。
1.2.3 温度与光照强度的双因素实验设计根据温度与光周期交互实验得出的最佳实验条件用于温度与光照强度的实验中。将预培养后的盘状体分别置于温度5、10、15、20、25、30℃ 共6 个梯度,光照强度设置为50、80、110μmol/(m2·s)共3 个梯度,共18 个组合,每组设置3 个平行样,其余条件同预培养。PES 培养液每2 天更换1 次,每个实验组中随机抽取10 个盘状体并测量其直径,培养周期14 天。当幼苗高度达到500μm 时,每个实验组中随机挑选10个幼苗测量其高度,培养周期21 天。
1.3 发育过程观察和数据统计使用Olympus BH2 显微镜(Olympus Beijing Co.Ltd.,China)进行观察并拍照记录。使用Excel 2010进行数据统计。利用公式RGR(%/d)=(lnWt -lnW0)/t×100%求得盘状体和幼苗的相对生长速率。其中W0 为盘状体初始直径或幼苗初始高度,Wt 为培养t 天(d)后盘状体直径或幼苗高度。用Adobe Photoshop CS4 图像处理,使用Spss 22.0 进行双因素方差分析(two-way ANOVA),若差异显著再用Tukey's 进行多重比较,以P<0.05 作为差异显著水平,本文内数值均为平均值±标准差。
2 结果 2.1 披针形蜈蚣藻早期发育过程披针形蜈蚣藻的囊果突出于雌配子体两面,呈深红色,成熟囊果直径达到200-350μm(图 2a)。随后囊果上形成直径为50-80μm 的囊果孔(图 2b),果孢子经由囊果孔放散出来,并附着在载玻片上(图 2c)。果孢子呈深红色,球形,直径为15μm 左右(图 2d)。在24h 内果孢子的原生质体一侧凹陷(图 2e),并向凹陷对侧移动,同时果孢子的另一端凸起并伸长形成萌发管,原生质体向萌发管移动,并在原地留下半透明胶状物质(图 2f-g)。当原生质全部移动到萌发管后,在凹陷处形成一道隔膜,随后原生质体开始横向分裂形成上下两个大小、形态一致的原生质体,然后纵向分裂成四个呈“十”字形排列的原生质体,直至形成多细胞的团状结构。随着原生质体的分裂,另一端的空泡及其中半透明胶状物质逐渐变小直至消失(图 2h-k)。随后邻近的细胞团融合,形成较大的细胞团(图 2l-m)。当细胞团分化出水平方向分裂的基细胞和垂直方向上分裂的顶细胞时,进入了盘状体时期(图 2n)。盘状体直径逐渐扩大,邻近的盘状体相互融合形成更大的盘状体(图 2o-p),其直径最大可达到300μm 左右(图 2q)。30 天左右,形成直立枝(图 2r); 50天左右直立枝继续生长形成早期幼苗,随后继续发育成披针状或二叉分枝的幼苗; 100 天左右幼苗长到了约0.5cm 高(图 2s); 150 天左右,幼苗达到1cm 高,并且在幼苗叶片的先端有≥2 个披针形的分枝(图 2t)。四分孢子的发育过程与果孢子发育过程几乎一致。
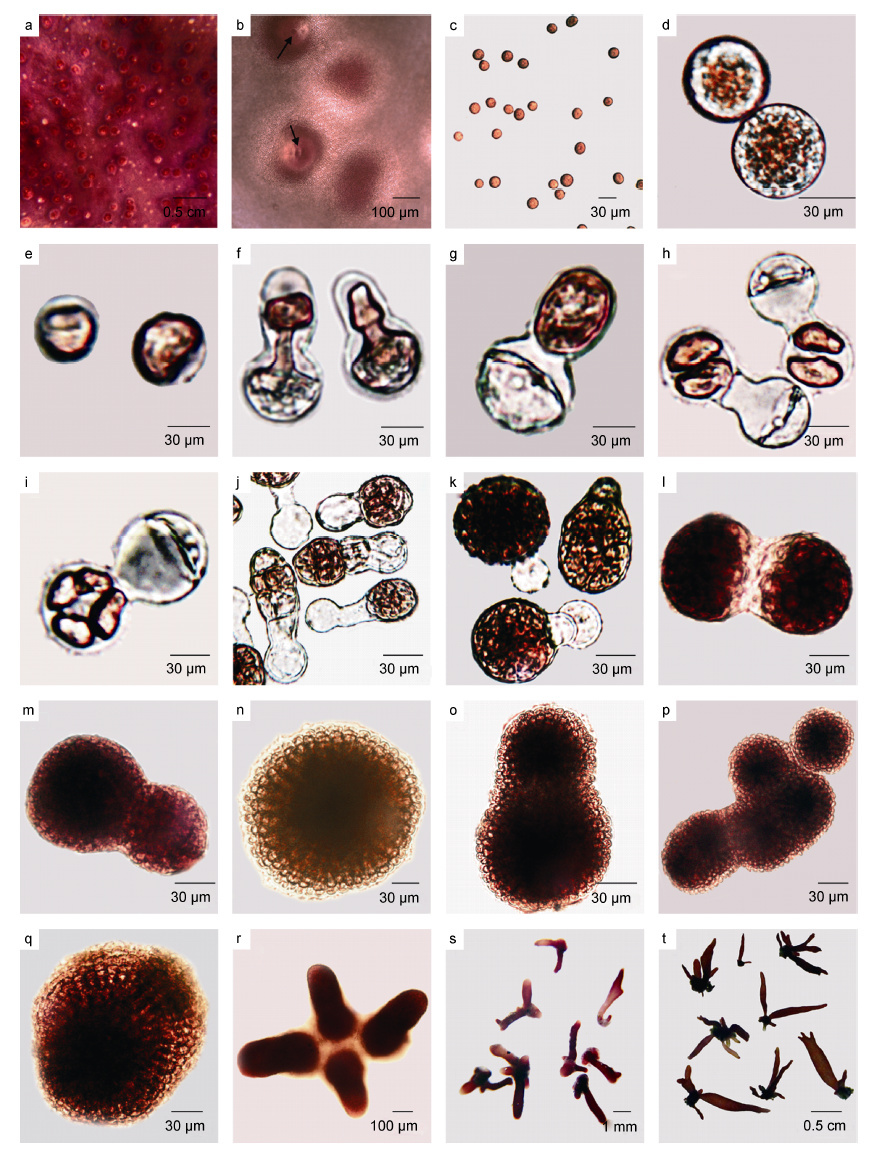 |
| 图 2 披针形蜈蚣藻的早期发育 Fig. 2 The early development of carpospores in G. lanceolata 注: a. 囊果分布在藻体表面; b. 囊果表面观,箭头所指为囊果孔; c-d. 果孢子; e. 果孢子原生质体向一侧凹陷; f. 果孢子内原生质体向萌发管一侧移动; g-j. 果胞子分裂; k. 空泡及内容物逐渐消失; l-m. 细胞团融合; n. 盘状体; o-p. 盘状体融合; q. 融合后形成的较大盘状体; r. 直立枝; s-t. 幼苗 |
图 3 为披针形蜈蚣藻的生活史,由有性世代及无性世代组成。有性世代中,配子体为雌雄异体。雄配子体成熟后由藻体的外表皮细胞形成球形、无色的精子囊。每个精子囊产生一个无色球形的精子。雌配子体成熟后,由藻体的内皮层细胞分化形成果胞枝生殖枝丛和辅助细胞生殖枝丛。果胞枝生殖枝丛由12个以上椭圆形或略扁形细胞组成,果胞枝为2 个细胞,即果胞和下位细胞,果胞末端有一长受精丝。辅助细胞生殖枝丛的主枝由13 个椭圆形或略扁形细胞组成,辅助细胞椭球形,比其他枝丛细胞大,颜色较深。精子进入受精丝,到达果胞内与卵细胞结合为合子。受精后的果胞与下位细胞融合形成融合胞。融合胞与邻近的辅助细胞均产生联络丝,融合胞内的合子通过联络丝进入辅助细胞内继续发育。由辅助细胞产生产孢丝。产孢丝细胞不断分裂,集生成为囊果。成熟囊果突出于藻体表面两侧,呈深红色斑点。果孢子囊成熟后,释放出果孢子,果孢子经过不断分裂形成盘状体,盘状体继续分裂形成直立枝,最终发育成四分孢子体。
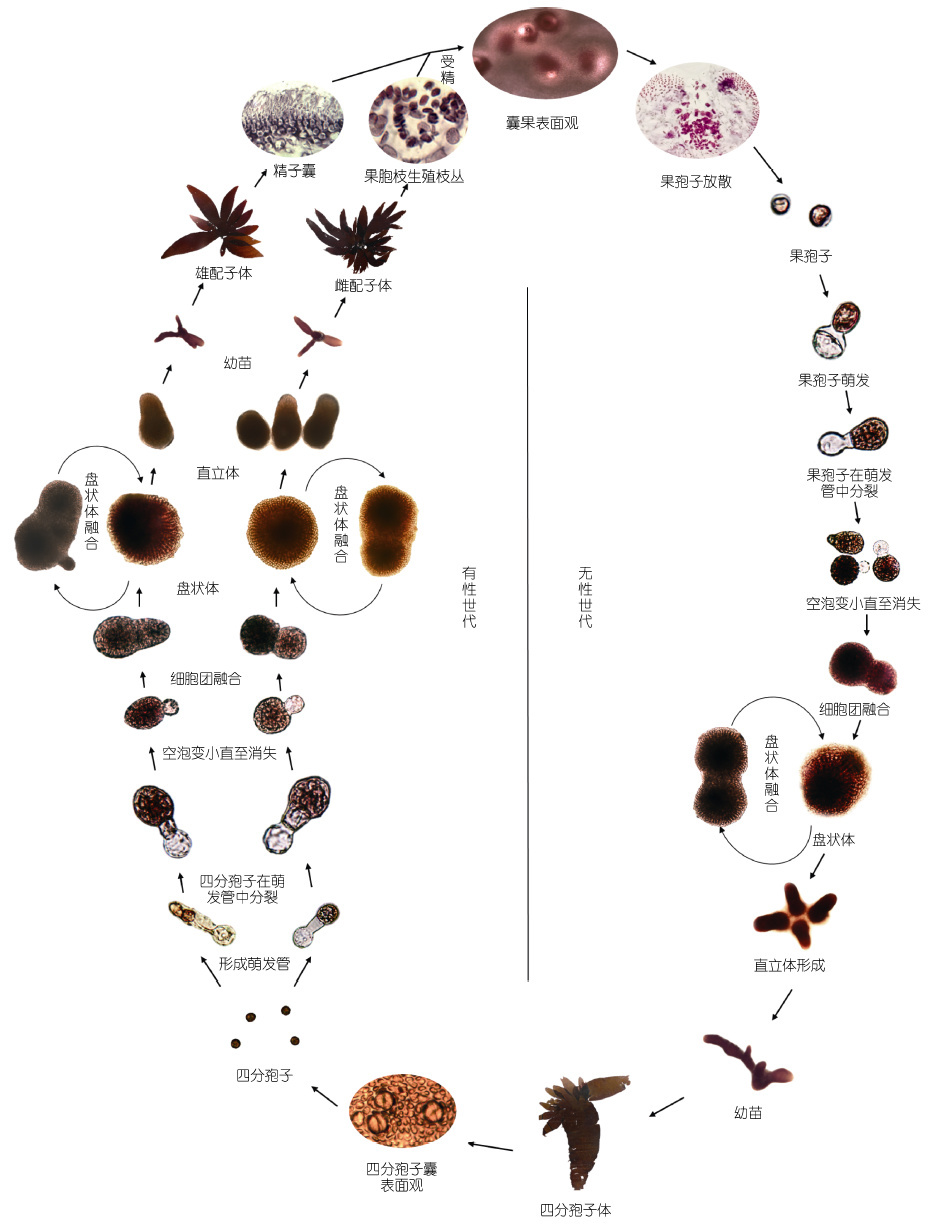 |
| 图 3 披针形蜈蚣藻的生活史 Fig. 3 The life cycle of G. lanceolata |
无性世代中,四分孢子体的皮层细胞分化成椭圆形的四分孢子囊,并散生在皮层内。在囊内经减数分裂产生呈十字形排列的四分孢子,成熟后分别萌发成雌、雄配子体。雌、雄配子体与四分孢子体形态相同,交替出现,为同型世代交替。
2.3 温度与光周期双因素对披针形蜈蚣藻早期发育的影响在温度与光周期双因素实验中,温度在5-30℃范围内时,随着温度的升高,盘状体(图 4a)和幼苗(图 4b)的相对生长速率呈现先升高后降低的趋势。在同一光周期培养条件下,10-25℃ 范围内盘状体及幼苗能较好的生长,15℃ 时二者均达到最大生长速率。
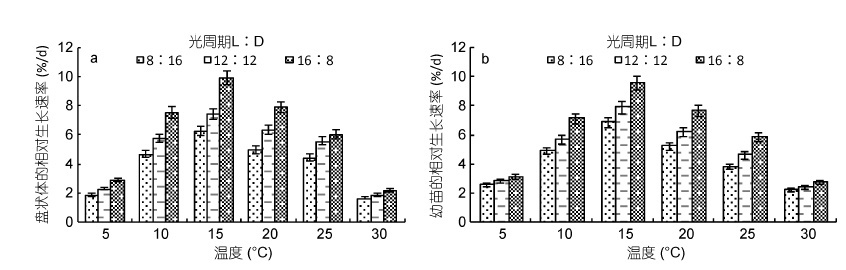 |
| 图 4 不同温度与不同光周期对披针形蜈蚣藻盘状体(a)和幼苗(b)发育的影响 Fig. 4 Effects of temperature and photoperiod on the development of G. lanceolata discoid crust(a)and seedling(b) |
当温度为5℃和30℃ 时,二者均生长缓慢。当温度为15℃、光周期为16L︰8D 时,盘状体在14 天后直径达到(200±10)μm,RGR 为(9.902%±0.51%)/d; 此条件下培养21 天后幼苗高度达到(3.73±0.19)mm,RGR 为(9.569%±0.48%)/d。当温度为15℃、光周期为12L︰12D 时,盘状体在14 天后直径为(141±7.1)μm,RGR 为(7.405%±0.37%)/d; 同一条件下21 天后幼苗高度为(2.61±0.13)mm,RGR 为(7.869%±0.39%)/d。当温度为15℃、光周期为8L︰16D 时,盘状体在14 天后直径为(120±6)μm,RGR 为(6.253%±0.31%)/d; 同一条件下培养21 天后幼苗高度为(2.1±0.11)mm,RGR 为(6.834%±0.34%)/d。
综上所述,温度与光周期对披针形蜈蚣藻盘状体发育及幼苗生长有极显著影响(P<0.01,表 1)。披针形蜈蚣藻适宜发育温度范围为10-25℃,最适发育温度为15℃。最适光周期为16L︰8D。
| 因素 | RGR(盘状体) | RGR(幼苗) | ||||||
| df | F | SS | P | df | F | SS | P | |
| 温度 | 5 | 39.77 | 83.129 | 0 | 5 | 56.889 | 70.101 | 0 |
| 光周期 | 2 | 16.026 | 13.4 | 0 | 2 | 18.913 | 9.322 | 0 |
| 误差 | 10 | 4.18 | 10 | 2.465 | ||||
| 注: df. 自由度; F. 方差分析F 值检验; SS. 方差; P. 显著性 | ||||||||
在温度与光照强度双因素实验中,当温度在5-15℃ 范围时,盘状体(图 5a)及幼苗(图 5b)的相对生长速率随温度的升高而增大,15℃ 时二者相对生长速率达到最大。当温度为15-30℃ 时,随着温度的升高,二者的相对生长速率下降。
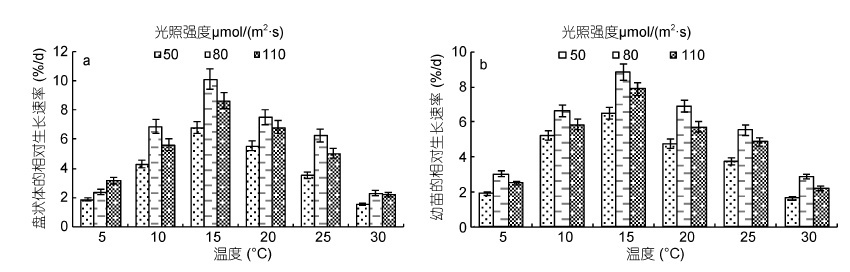 |
| 图 5 不同温度与不同光照强度对披针形蜈蚣藻盘状体(a)和幼苗(b)发育的影响 Fig. 5 Effects of temperature and irradiance on the development of G. lanceolata discoid crust(a)and seedling(b) |
盘状体及幼苗的最适生长条件为温度15℃、光照强度80μmol/(m2·s),此条件下培养14 天后盘状体的直径达到(206±11)μm,RGR 为(10.113%±0.51%)/d;培养21 天的幼苗高度达到(3.20±0.17)mm,RGR 为(8.839%±0.44%)/d。培养条件为温度15℃、光照强度110μmol/(m2·s)时盘状体及幼苗的生长状态较好,培养14 天的盘状体直径为(186±9.3)μm,RGR 为(8.657%±0.43%)/d; 同一条件下培养21 天后幼苗高度为(2.61±0.13)mm,RGR 为(7.869%±0.39%)/d。培养条件为温度15℃、光照强度50μmol/(m2·s)时盘状体及幼苗的生长状态相对最差,培养14 天的盘状体直径为(130±6.5)μm,RGR 为(6.825%±0.34%)/d; 同一条件下培养21 天后幼苗高度为(1.96±0.1)mm,RGR 为(6.505%±0.33%)/d。
综上,温度与光照强度对披针形蜈蚣藻盘状体发育及幼苗生长有极显著影响(P<0.01,表 2)。披针形蜈蚣藻早期发育的最适光照强度为80μmol/(m2·s)。
| 因素 | RGR(盘状体) | RGR(幼苗) | ||||||
| df | F | SS | P | df | F | SS | P | |
| 温度 | 2 | 17.091 | 12.116 | 0 | 5 | 196.912 | 67.518 | 0 |
| 光照强度 | 5 | 52.058 | 92.259 | 0 | 2 | 60.893 | 8.352 | 0 |
| 误差 | 10 | 3.545 | 10 | 0.686 | ||||
| 注: df. 自由度; F. 方差分析F 值检验; SS. 方差; P. 显著性 | ||||||||
对披针形蜈蚣藻孢子的生长发育过程进行研究,发现孢子表面先突出形成萌发管,随后原生质体移动至萌发管内分裂成细胞团,细胞团继续发育成盘状体,同时空泡状结构逐渐消失。因此披针形蜈蚣藻的孢子发育类型为“间接盘状体”型。猪野俊平(1947)对属模蜈蚣藻(G. filicina)、带形蜈蚣藻(G. turuturu)、椭圆蜈蚣藻(G. elliptica)三种蜈蚣藻的孢子发生类型进行了比较研究,认为蜈蚣藻属的孢子发生类型有间接盘状体型或间接丝状体型。有研究表明,繁枝蜈蚣藻(G. ramosissima)(刘凤贤等,1986)、舌状蜈蚣藻(G. livida)(宋志明,2013)、细弱蜈蚣藻(G. tenuis)(曹翠翠等,2015)的孢子发育类型为间接盘状体型或间接丝状体型。大连蜈蚣藻(G. dalianensis)和多枝蜈蚣藻(G. ramosa)的孢子发育类型为间接盘状体型,黄海蜈蚣藻(G. huanghaiensis)的孢子发育类型为间接丝状体型(赵丹,2012)。孢子生长发育过程中丝状体的出现为其大量培养和丝状体采苗提供便利,改变了以往仅从四分孢子、果孢子获得盘状体的单一途径(张泽宇等,2007)。
另外,我们将培养皿内未附着的孢子吸出,放入铺满扇贝壳的培养皿中继续培养。结果表明,附着在贝壳上的果孢子更快地发育成盘状体,而未附着的果孢子生长发育缓慢或者逐渐失去活性,说明孢子的发育须附着在一定的基质上。
实验中观察到了披针形蜈蚣藻的盘状体融合现象,即两个或多个盘状体融合形成一个较大的盘状体。红藻门中许多海藻盘状体发育时期都存在融合的现象(陈美琴等,1985; Vera et al,2008; Li et al,2010;Zhao et al,2010),如同属的带形蜈蚣藻(姜春梅,2011)和舌状蜈蚣藻(宋志明,2013)等。除蜈蚣藻属外,胶黏藻属(Dumontia)的单条胶黏藻(D. simplex)在早期发育过程中也出现了多个盘状体融合成一个超级盘状体的现象(姜朋等,2016)。而且在盘状体融合之前,我们观察到了细胞团的融合,这是其他蜈蚣藻中未发现的过程。同时本研究在幼苗培养的实验中发现,当幼苗的间距大于3-4 mm 时,其生长速率最快。
披针形蜈蚣藻的生活史由单倍的雌雄配子体及二倍四分孢子体组成。配子体与四分孢子体形态一致,为同型世代交替,成熟的雌、雄配子体在外观上可以分辨。披针形蜈蚣藻生活史与属模蜈蚣藻相似,这也为其分类提供了依据。
通过本研究得出,温度和光周期对披针形蜈蚣藻发育均有影响。双因子方差分析表明,温度与光周期的交互作用对盘状体发育及幼苗生长均有极显著性影响(P<0.01)。最适合盘状体发育的条件是温度15℃,光周期16L︰8D。与Ye等(2013)的研究结果,即四分孢子体的最适生长条件为温度16℃,光周期16L︰8D 相似。亚洲蜈蚣藻(G. asiatica)在10-20℃盘状体能较好的生长,20℃ 为其最适温度(Adharini et al,2014)。阳江蜈蚣藻(G. yangjiangensis)盘状体发育适宜温度为20℃(Wang et al,2014)。从单因素角度看,在10-25℃ 范围内披针形蜈蚣藻能较好地生长,其中15℃ 时盘状体和幼苗的相对生长速率最大。在适宜温度范围内孢子附着后能很快地发育成深红褐色的盘状体,其后发育成幼苗,从而可见披针形蜈蚣藻的温度耐受范围较广,为广温种。然而温度在5℃ 以下和30℃ 以上时,孢子的附着率下降,并且发育成的盘状体细胞内色素在一周内流失随后死亡。此培养温度与大连海域10-11 月份海水温度为(15±5)℃,4月份海水温度为(10±3)℃(邵魁双等,2000)的自然条件下的生长温度基本一致。本实验中10-11 月采集的披针形蜈蚣藻上成熟囊果比例较4 月份采集的样本中成熟囊果比例高,从而也可以证明15℃ 为披针形蜈蚣藻的最适发育温度。光周期是通过改变光照时间从而影响藻体生长所需吸收的能量。当温度一定时,在一定范围内,光照时间越长,藻体可获得的能量越多,生长速率越快(姜宏波等,2009)。本实验中16L︰8D 为披针形蜈蚣藻生长的最佳光周期。
光照强度是影响藻类生长繁殖的重要生态因子之一(欧阳峥嵘等,2010)。双因子方差分析表明,温度与光照强度的交互作用对盘状体发育和幼苗生长均有极显著性影响(P<0.01)。盘状体及幼苗的最适光照强度为80μmol/(m2·s)。光照强度为50μmol/(m2·s)和110μmol/(m2·s)时,盘状体和幼苗的生长情况不如光照强度为80μmol/(m2·s)条件下好。可能因为110μmol/(m2·s)光照强度超过了藻类植物光饱和点,使其叶绿素a 含量降低,抑制了一定的光合速率,从而不能获得足够的能量,导致生长缓慢。80μmol/(m2·s)的光照强度没有达到光饱和点,光合速率也较低,同样不能积累足够的能量。研究表明,在适宜温度下,低光照强度培养条件更有利于莺歌海蜈蚣藻(G. yinggehaiensis)盘状体的发育(赵丹,2012),而高光照强度更适合细弱蜈蚣藻盘状体的发育(曹翠翠等,2015)。
4 结论(1) 披针形蜈蚣藻孢子发育过程中形成萌发管,无丝状体的产生,发育类型为“间接盘状体”类型。孢子早期发育过程中出现细胞团融合、盘状体融合现象。
(2) 披针形蜈蚣藻生活史由单倍体的雌、雄配子体,二倍体的果孢子体和四分孢子体组成,配子体与四分孢子体形态一致,为同型世代交替。
(3) 光温的交互作用对披针形蜈蚣藻盘状体的发育和幼苗生长均有极显著影响(P<0.01)。适宜生长发育温度范围为10-25℃,其中温度15℃、光周期16L︰8D、光照强度80μmol/(m2·s)条件下盘状体及幼苗生长发育最快。
| 刘凤贤, 李伟新, 1986. 蜈蚣藻和繁枝蜈蚣藻孢子发生类型的研究. 水产学报, 10 (3) : 281–287 |
| 宋志明, 2013. 舌状蜈蚣藻果孢子早期发育的研究. 汕头:汕头大学硕士学位论文. 24-28 |
| 张泽宇, 魏海霞, 韩余香, 等, 2007. 蜈蚣藻盘状体诱导丝状体及其采苗的初步研究. 大连水产学院学报, 22 (3) : 165–169 |
| 陈美琴, 任国忠, 1985. 江蓠幼苗的早期发育过程. 海洋与湖沼, 16 (3) : 181–187 |
| 邵魁双, 李熙宜, 2000. 大连海区潮间带底栖海藻生物群落的季节变化. 大连水产学院学报, 15 (1) : 29–34 |
| 欧阳峥嵘, 温小斌, 耿亚红, 等, 2010. 光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响. 武汉植物学研究, 28 (1) : 49–55 |
| 赵丹, 2012. 中国海膜科蜈蚣藻属四个新种的生活史研究.大连:辽宁师范大学硕士学位论文, 12-38 |
| 姜朋, 赵树雨, 李芳, 等, 2016. 单条胶黏藻(Dumontia simplex Cotton)孢子早期发育及其生活史的研究. 海洋与湖沼, 47 (1) : 151–157 |
| 姜宏波, 田相利, 董双林, 等, 2009. 温度和光照强度对鼠尾藻生长和生化组成的影响. 应用生态学报, 20 (1) : 185–189 |
| 姜春梅, 2011. 带形蜈蚣藻(Grateloupia turuturu)果孢子及盘状体发育研究. 青岛:中国海洋大学硕士学位论文, 32-33 |
| 夏邦美, 2004. 中国海藻志(第二卷, 红藻门, 第三册). 北京: 科学出版社, 116-117 |
| 曹翠翠, 赵凤琴, 郭少茹, 等, 2015. 主要环境因子对细弱蜈蚣藻(Grateloupia tenuis)孢子发育的影响及生活史的研究. 海洋与湖沼, 46 (2) : 298–304 |
| 猪野俊平, 1947. 海藻的发生. 东京:北隆馆, 95-223 |
| Adharini R I, Kim H G, 2014. Developmental pattern of crust into upright thalli of Grateloupia asiatica (Halymeniaceae, Rhodophyta). Journal of Applied Phycology, 26 (4) : 1911–1918 DOI:10.1007/s10811-013-0218-x |
| Kawabata S J, 1954. On the structure of the frond, and the reproductive organ of Pachymeniopsis lanceolata Yamada(Aeodes lanceolata Okam). Japanese Journal of Phycology(Sôrui), 2 (3) : 67–71 |
| Kawaguchi S, 1997. Taxonomic notes on the Halymeniaceae(Gigartinales, Rhodophyta) from Japan. III. Synonymization of Pachymeniopsis Yamada in Kawabata with Grateloupia C.Agardh. Phycological Research, 45 (1) : 9–21 DOI:10.1111/pre.1997.45.issue-1 |
| Kim C, Kim Y S, Han G C, et al, 2014. New records of three endophytic green algae from Grateloupia spp. (Rhodophyta)in Korea. Algae, 29 (2) : 127–136 |
| Kim D H, Kim M E, Lee J S, 2015. Inhibitory effects of extract from G. lanceolata on LPS-induced production of nitric oxide and IL-1β via down-regulation of MAPK in macrophages. Applied Biochemistry and Biotechnology, 175 (2) : 657–665 |
| Li X, Zhao P, Wang G, et al, 2010. Effects of temperature and irradiance on on early development of Chondrus ocellatus Holm (Gigartinaceae, Rhodophyta). Chinese Journal of Oceanology and Limnology, 28 (3) : 508–513 DOI:10.1007/s00343-010-9043-0 |
| Miller K A, Hughey J R, Gabrielson P W, 2009. Research note:first report of the Japanese species Grateloupia lanceolata(Halymeniaceae, Rhodophyta) from California, USA. Phycological Research, 57 (3) : 238–241 DOI:10.1111/j.1440-1835.2009.00542.x |
| Seo M J, Choi H S, Lee O H, et al, 2013. Grateloupia lanceolata, (Okamura) Kawaguchi, the Edible Red Seaweed, Inhibits Lipid Accumulation and Reactive Oxygen Species Production During Differentiation in 3T3-L1 Cells. Phytotherapy Research, 27 (5) : 655–663 DOI:10.1002/ptr.v27.5 |
| Vera C, Lobos P, Romo H, 2008. Gametophyte-sporophyte coalescence in populations of the intertidal carrageenophyte Mazzaella laminarioides (Rhodophyta). Journal of Applied Phycology, 20 (5) : 883–887 DOI:10.1007/s10811-007-9238-8 |
| Verlaque M, Brannock P M, Komatsu T, et al, 2005. The genus Grateloupia C. Agardh (Halymeniaceae, Rhodophyta) in the Thau Lagoon (France, Mediterranean):a case study of marine plurispecific introductions. Phycologia, 44 (5) : 477–496 |
| Verlaque M, Ruitton S, Mineur F et al, 2015. CIESM Atlas of Exotic Species of the Mediterranean. Macrophytes, Many Photograph and Maps. Monaco:CIESM Publishers, 1-362 |
| Wang H W, Guo S R, Zhang X M, et al, 2014. Re-identifying Grateloupia yangjiangensis (Rhodophyta, Halymeniaceae)based on morphological observations, life history and rbcL sequence analyses. Acta Oceanologica Sinica, 33 (4) : 77–84 DOI:10.1007/s13131-014-0450-5 |
| Yang M Y, Han E G, Kim M S, 2013. Molecular identification of Grateloupia elliptica and G. lanceolata (Rhodophyta)inferred from plastid rbcL and mitochondrial COI genes sequence data. Genes & Genomics, 35 (2) : 239–246 |
| Ye N H, Zhang X W, Wang H X, et al, 2012. Characterization and production of tetraspore-derived seedlings of Grateloupia lanceolata (Halymeniales, Rhodophyta) in northeastern China. Phycologia, 51 (3) : 330–339 DOI:10.2216/11-03.1 |
| Okamura K, 1934. Icones of Japanese algae, vol 7:19-48(English), 17-44(Japanese). Plates CCCXI-CCCXXV, Tokyo |
 2017, Vol. 48
2017, Vol. 48


