
中国海洋湖沼学会主办。
文章信息
- 郑余琦, 郑忠明, 秦文娟. 2017.
- ZHENG Yu-Qi, ZHENG Zhong-Ming, QIN Wen-Juan. 2017.
- 缢蛏(Sinonovacula constricta)生物扰动对养殖废水处理系统中沉积物磷赋存形态垂直分布的影响
- EFFECTS OF BIOTURATION BY RAZOR CLAM SINONOVACULA CONSTRICTA ON VERTICAL DISTRIBUTION OF PHOSPHORUS FORM IN SEDIMENT IN AN AQUACULTURE WASTEWATER TREATMENT ECOSYSTEM
- 海洋与湖沼, 48(1): 161-170
- Oceanologia et Limnologia Sinica, 48(1): 161-170.
- http://dx.doi.org/10.11693/hyhz20160800174
-
文章历史
- 收稿日期:2016-08-18
- 收修改稿日期:2016-09-16
2. 浙江海洋高效健康养殖协同创新中心 宁波 315211
2. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo 315211, China
随着水产养殖模式从传统的粗放型走向可控的集约型,随之带来的环境问题也日益引起人们的关注(谌莉莎等,2012)。集约化养殖模式在大幅度提高养殖产量的同时,人工投饵产生的残饵以及养殖动物代谢产物等的积累,使得大量N、P 营养盐以及有机颗粒进入养殖场附近水域,导致水体富营养化及赤潮频发(Marinho-Soriano et al,2009)。因此,养殖废水处理已被广泛采用,目前养殖废水处理工艺主要采用“生物生态法”,包括三个主要处理过程;(1)沉淀,通过自然沉淀减少水体中颗粒物的浓度;(2)曝气,促进微生物分解有机物,加快微藻生长并吸收营养盐;(3)贝类的生态养殖,通过贝类(如缢蛏)过滤吸收水体中的微藻和有机颗粒,最终使养殖废水中的N、P 营养物质固定到贝类生物体中,达到净化养殖尾水的目的。
在水生环境系统中,沉积物既是水体中营养盐以及有机颗粒的蓄积库,同时又充当上覆水体的营养源(Søndergaard et al,1999)。在外源污染物得到控制的情况下,营养丰富的沉积物在一定条件下影响上覆水体的质量,将在相当长的时间内阻止或延缓水体水质的治理效果(Boström et al,1985)。其中,磷元素被广泛认为是导致水生系统中浮游藻类异常增殖和限制其初级生产力的关键因素,过量的磷含量是引起水体环境中富营养化的主要原因(姚扬等,2004; Conley et al,2009)。沉积物-水界面的磷循环易受沉积物物理化学特性、生物扰动、酸碱度及氧化还原条件等环境因子影响,磷的赋存形态和特性随着这些条件的改变而改变(Qian et al,2011)。研究表明底栖动物通过掘穴、摄食、通风、排泄等生物扰动作用改变沉积物的空间异质性、表面成分组成、粒度分布、孔隙度等物理性质(Thayer,1979),并对沉积物中的营养物质再生,对上覆水中营养盐吸附以及其循环动力学具有重要的作用(孙思志等,2010)。Bates等(1980)提出,在相同其他条件(溶解氧、pH 值等)下,底栖动物的生物扰动可使沉积物中磷释放量增大到2 倍。
缢蛏(Sinonovacula constricta)是中国沿海地区常见的底栖动物,营滤食性埋栖生活,具有较高食用价值(田相利等,2001)。研究表明缢蛏通过自身水管吸食上层水面的有机悬浮物质,提高水体透明度,减少沉积物中有机物含量,当其分布密度较高时,群体清除底泥中有机物的能力明显加强,并使水中溶解氧和初级生产力升高,最终达到净化水质的作用(Tsuchiya et al,1979; 田相利等,2001; 范德朋等,2002)。但国内外有关底栖动物对水生系统中生源要素转移变迁的研究比较缺乏,需要进一步研究补充。本研究通过在养殖废水池贝藻处理区采集不同缢蛏养殖密度下的实验围隔箱内的底泥,分别测定不同垂直方向上底泥的微生物活性(FDA)、碱性磷酸酶(APA)以及不同的磷赋存形态含量,以期揭示缢蛏的生物扰动对养殖废水处理池中底泥磷释放机制的影响,为水产养殖废水生态治理提供理论依据。
1 材料与方法 1.1 实验材料实验所需的底泥取自浙江省宁波市蓝尚海洋科技有限公司的水产养殖场,将底泥充分混匀。底泥由3.2%的沙砾石、25%的沙子和71.2%的淤泥和黏土组成,平均粒径为10.77μm。实验所用的缢蛏采自宁波市蓝尚海洋科技有限公司附近的象山港沿海滩涂,选取贝壳完整、健康的个体(平均体重7.21±0.13g),放入塑料桶内进行适应性培养一周,每天喂以微绿球藻和小球藻。
1.2 实验地点与设计于2016 年5-7 月在浙江省宁波市蓝尚海洋科技有限公司的养殖废水处理池进行了本实验研究。该废水处理池面积约为1956m2,池塘年平均水深约为1.0m,池塘分别有进水口区、物理沉降区、曝气区、贝藻处理区以及出水口区五个部分组成。排入废水来自该对虾养殖场(品种为凡纳滨对虾 Penaeus vannamei Boone),该养殖场每天废水排放3 次,时间分别为; 7:30、12:00和18:00。实验开始时,将12 个聚乙烯塑料培养箱(长×宽×高; 40×30×20cm)放入养殖废水处理池的贝藻处理区。每个塑料培养箱内铺上深度为12cm 上述介绍的底泥,实验设3 个处理组,每组4 个重复; 低密度组,8 个缢蛏/ 箱(相当于66.67ind/m2); 高密度组,36 个缢蛏/箱(300.00ind/m2);对照组(T0),有底泥没有缢蛏。
1.3 实验方法实验共进行50 天,5 月10 日开始,7 月1 日结束。分别于5 月10 日(实验初始),5 月27 日(实验初期),6月14 日(实验中期),7 月1 日(实验末期)的早上9-10点采样一次,共4 次。用无扰动浅水底泥采样器(直径为5cm,高为50cm)采集沉积物。采样时将底泥采样器插到塑料箱底部,缓慢连水带泥拔出采泥器,要求采集时样品表面均无明显的扰动现象。采集后的底泥立即运往实验室并立即进行底泥的分层,溢出上覆水并用粗滤纸吸干,用切板按照表层(0-2cm)、中层(2-6cm)、底层(6-12cm)切开,一部分泥样立即保存在-80 度冰箱,用于之后测定微生物活性(FDA)含量和碱性磷酸酶(APA); 另一部分泥样放入烘箱60°烘干后,研磨过筛(100 目),放入塑封袋后密封保存于低温(4℃)冰箱内待用。
1.4 样品分析方法底泥中总微生物活性采用荧光素双醋酸酯(FDA)法(Adam et al,2001)测定; 沉积物碱性磷酸酶活性(APA)采用对硝基苯磷酸二钠(p-NPP)法(Sayler et al,1979)进行测定; 底泥中磷形态的测定使用SMT 协议法(Ruban et al,1999,2001); 依据土壤中磷活性强弱依次提取5 种磷赋存形态; 总磷(TP)、无机磷(IP)、有机磷(OP)、磷灰石无机磷(AP: 钙磷)以及非磷灰石无机磷(NAIP: 与Fe、Mn、Al 氧化物及其氢氧化物结合的磷),该方法提取液中磷含量通过钼锑抗比色法测定溶解态正磷酸盐含量,换算成单位质量干泥中各磷形态含量。
1.5 数据计算与统计分析碱性磷酸酶(APA)和微生物活性量(FDA)的计算公式(孙芳等,2011);
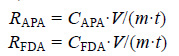
其中,RAPA [μg/(g·h)]为沉积物中碱性磷酸酶(APA)的含量,CAPA(μg/mL)为对硝基苯酚浓度; RFDA [μg/(g·h)]为沉积物中微生物活性量(FDA)的含量,CFDA(μg/mL)为FDA 活性荧光素浓度,V(m2)为反应总体积,m(g)为反应底泥样品质量(干重),t(h)为培养时间。
实验数据先在Microsoft Excel 2007 进行处理,运用SPSS18.0 对数据进行统计分析,沉积物中碱性磷酸酶(APA)、微生物活性量(FDA)以及磷形态含量先进行单因素方差分析(one-way ANOVA),然后进行Tukey 多重比较。方差分析前先进行方差齐性检验,并用Origin 8.0 进行绘图。
2 结果 2.1 沉积物碱性磷酸酶(APA)含量和微生物活性(FDA)含量的变化沉积物中碱性磷酸酶活性(APA)呈现升高的趋势(图 1)。其中在表层沉积物中,随着实验的进行以及缢蛏投放密度的增加,碱性磷酸酶(APA)含量表现出显著上升的趋势(P<0.05),且各实验组在实验末期(7月1 日)时APA 含量达到最高,其中高密度组中APA含量为417.88μg/(g·h),相对于实验初期增加了1.2倍。而中层沉积物中各实验组的APA 含量在实验前期和中期变化为87.84-161.25μg/(g·h),组间无明显差异(P>0.05); 在实验后期时,低密度组的APA 含量显著高于对照组(P<0.05)。在底层沉积物中,低密度组和高密度组的APA 含量除了6 月14 日时均显著高于对照组(P<0.05)。
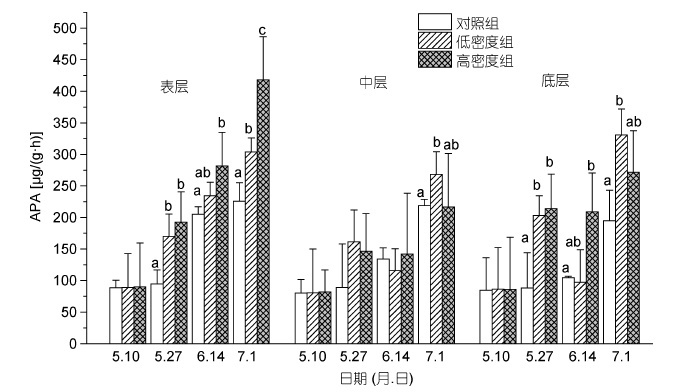 |
| 图 1 不同投放密度处理组对不同层次沉积物碱性磷酸酶含量(APA)的影响 Fig. 1 The effect of culture density on the content of APA in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
沉积物中的微生物活性(FDA)含量与碱性磷酸酶(APA)含量分布趋势大致相同,随着实验的进行,所有处理组的FDA 值均表现出增加的趋势(图 2)。其中以表层沉积物中FDA 含量增长幅度最大,如高密度组的FDA 含量在实验末期时为791.81μg/(g·h),相比于实验处期增加了61.4%。实验期间,高密度组的FDA 值(除了中层沉积物初期时FDA 值)均显著高于对照组(P<0.05),而低密度组在实验后期(7 月1 日)显著高于对照组(P<0.05)。
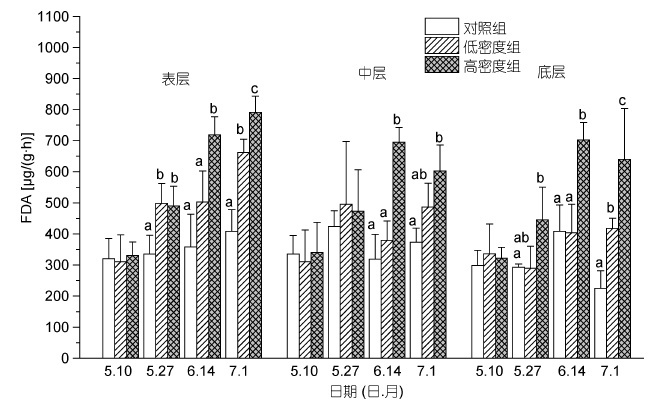 |
| 图 2 不同投放密度处理组对不同层次沉积物微生物活性含量(FDA)的影响 Fig. 2 The effect of culture density on the content of FDA in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
试验初始阶段(5 月10 日),3 个实验组的沉积物中有机磷(OP)、磷灰石态无机磷含量(AP)和非磷灰石态无机磷含量(NAIP)分别为7.62-52.67mg/kg 、34.62-37.74mg/kg、33.02-51.22mg/kg,组间无显著差异(P>0.05)。各实验组的OP 含量随着实验的进行以及缢蛏投放密度的增加而呈现下降趋势,其中底层沉积物在实验末期时的有机磷含量仅为14.83mg/kg,相比于实验初期降低了48.0%(图 3)。低密度组和高密度组的OP含量小于对照组,尤其是高密度组的OP含量在整个实验过程中均显著小于对照组(P<0.05);而低密度组在表层沉积物、中层沉积物的前期和中期以及底层沉积物的中期时的OP值显著小于对照组的OP值(P<0.05)。
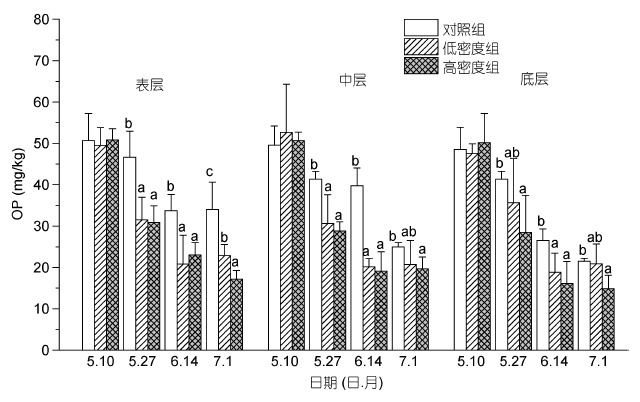 |
| 图 3 不同投放密度处理组对不同层次沉积物有机磷含量(OP)的影响 Fig. 3 The effect of culture density on the content of OP in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
沉积物中磷灰石态无机盐(AP)如图 4 所示,低密度组和高密度组的AP 含量除了低密度组的底层沉积物在实验末期(7 月1 日)的AP值,均高于对照组的AP值。其中表层沉积物中,高密度组的AP值均表现出显著高于对照组(P<0.05),而低密度组在实验中后期(6 月14 日和7 月1 日)显著高于对照组(P<0.05)。而在中层沉积物中,高密度组在实验初期(5 月27 日)和试验后期(7 月1 日)显著高于对照组; 而底层沉积物中,高密度在试验后期(7 月1 日)显著高于对照组和低密度组(P<0.05),且该AP值达到最高值,为79.67mg/kg,相比于实验初期(5 月27 日)增加了74.14%。
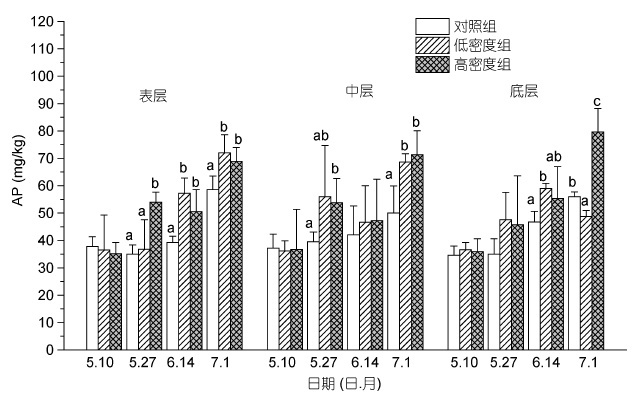 |
| 图 4 不同投放密度处理组对不同层次沉积物磷灰石态无机磷含量(AP)的影响 Fig. 4 The effect of culture density on the content of AP in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
实验初期(5 月27 日),各实验组的非磷石灰态无机磷(NAIP)无显著性差异(P>0.05)(图 5)。实验中后期(6 月14 日和7 月1 日),低密度组和高密度组的NAIP值均大于对照组,其中在表层沉积物,高密度组显著大于对照组(P<0.05)。
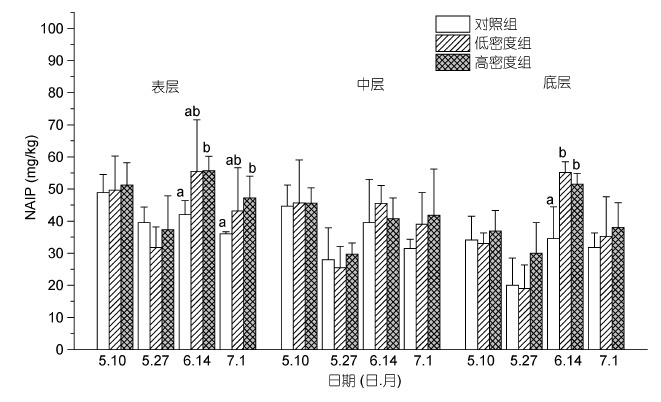 |
| 图 5 不同投放密度处理组对不同层次沉积物非磷灰石态无机磷含量(NAIP)的影响 Fig. 5 The effect of culture density on the content of NAIP in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
实验初始阶段(5 月10 日),缢蛏实验组和对照组沉积物中总磷(TP)和无机磷(IP)含量相近,变化范围分别为134.20-144.76mg/kg和86.58-93.88mg/kg,且无显著差异(P>0.05)。实验过程中,低密度组和高密度组的沉积物中TP 含量(除了底层沉积物在实验末期时的TP 含量)均小于对照组(图 6)。其中在沉积物表层,高密度组在实验中期和后期(6 月14 日和7月1 日)均显著小于对照组(P<0.05); 低密度组则在实验初期显著小于对照组(P<0.05)。在中层沉积物中,高密度组在实验初期和中期均显著小于对照组(P<0.05)。而在沉积物的底层,各处理组的TP 含量范围在87.84-161.25mg/kg,除了实验末期(7 月1 日),各实验组组间无明显差异(P>0.05)。
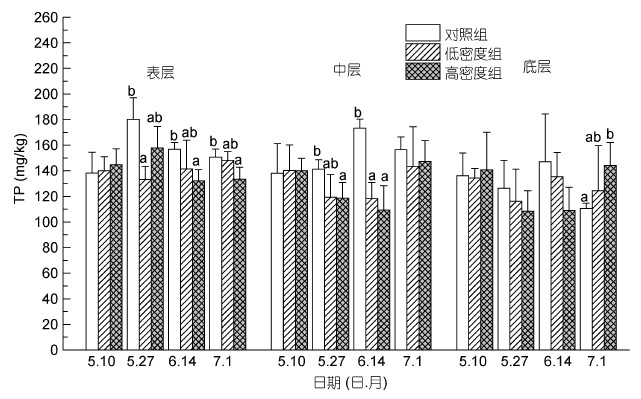 |
| 图 6 不同投放密度处理组对不同层次沉积物总磷含量(TP)的影响 Fig. 6 The effect of culture density on the content of TP in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
在实验的中后期,低密度组和高密度组的IP 含量均大于对照组(图 7),实验末期(7 月1 日),低密度组在表层以及中层沉积物的IP值显著大于对照组(P<0.05),而高密度组在中层以及底层沉积物的IP值显著大于对照组的IP值(P<0.05)。
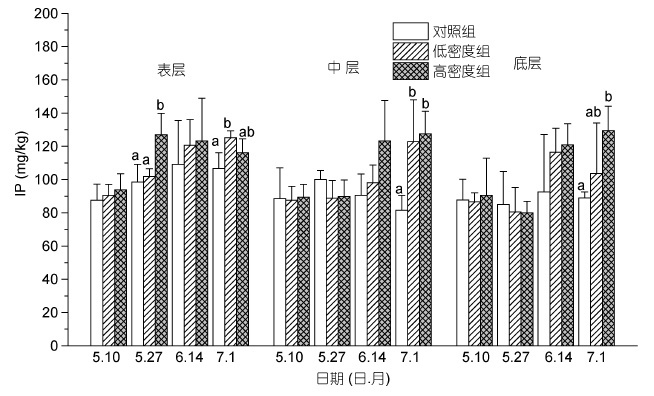 |
| 图 7 不同投放密度处理组对不同层次沉积物无机磷含量(IP)的影响 Fig. 7 The effect of culture density on the content of IP in sediment 注: 同一深度下同一时期内不同的小写字母表示组间差异显著(P<0.05) |
底栖动物通过其摄食、排泄、管道筑建,穴居等生命活动改变沉积物的物理化学特性,进而对微生物产生重要影响(孙刚等,2013)。如底栖动物铜锈环棱螺的生物扰动对沉积物中的微生物的生长和繁殖具有重要的作用(孙芳等,2012); 青蛤的生物扰动下促进了沉积物-水界面N、P 营养盐的释放,加快了海洋水生系统沉积物的矿化反应(Nicholaus et al,2014)。与其他底栖动物一样,缢蛏生物扰动作用同样对沉积物表面造成了强烈的破坏,并在沉积物内部中形成了管状的通道,为沉积物内部中引入更多的氧气和其他电子受体,打破了底泥中的厌氧环境,从而促进了不同种群的微生物大量繁殖,同时存在于不同氧化还原条件以及有氧或无氧的微环境(Aller,1982)。而Papaspyrou等(2006)的研究中也发现,与缺氧的沉积物相比,底栖动物的洞穴管道壁以及氧化表面上附着的活性微生物数量更多。在本实验中,高密度缢蛏组的FDA 值在不同沉积物层均显著大于对照组,而低密度组的FDA 值在实验后期(7 月1 日)也显著大于对照组(图 2)。表明缢蛏的生物扰动能够促进沉积物中微生物的生长,由微生物介导的各类生化反应随着缢蛏的养殖密度而显著增加。
碱性磷酸酶(APA)是专一性磷酸酯水解酶,是微生物分泌的特殊胞外酶。孙芳等(2011)发现在水生系统中沉积物中微生物活性和碱性磷酸酶呈正相关,且微生物活性和碱性磷酸酶活性均随着沉积物的深度的增加而减少,沉积物表面由碱性磷酸酶介导的磷循环较沉积物内部剧烈。在本实验中,各实验组的碱性磷酸酶的变化趋势与微生物活性值相似,随着实验的进行以及缢蛏的密度而显著增加(图 1),尤其是高密度表层沉积物,其在实验后期的APA 值相比去实验初期增加了1.14 倍。因此,实验结果表明; 在底栖动物缢蛏的生物扰动下,沉积物中由碱性磷酸酶介导的磷循环过程异常活跃,其中以表层沉积物的磷循环最为活跃; 缢蛏的生物扰动能显著提高沉积物中各垂直方向上的微生物活性和碱性磷酸酶活性。
微生物的新陈代谢是整个水生生态系统中的物质转换和循环以及沉积物中有机物矿化反应的关键因素,与微生物相关的大量酶是在水生环境中生物元素转换的主要催化剂,而碱性磷酸酶(APA)是迄今为止在水生环境中磷循环中的最重要酶(Barik et al,2001)。较高水平的微生物活性和碱性磷酸酶含量加快了沉积物中有机磷的分解,促进了磷元素主要以可溶性磷酸盐的形式释放出来并进入上覆水,进而直接影响用于初级生产力的溶解态无机磷的含量(Edlund et al,2001)。Qian等(2011)研究中发现相对于沉积物的OP 含量在细菌的作用下显著降低,生物作用加快了沉积物中P 元素的释放。本实验中,缢蛏实验组(低密度和高密度组)中的OP值均实验的进行而呈下降趋势,其中高密度组在整个实验中,其不同沉积物层的OP值均显著小于对照组,而低密度组在表层沉积物、中层沉积物的前期和中期以及底层沉积物的中期时的OP值显著小于对照组的OP值。表明了缢蛏高强度的生物扰动能够加快底泥中有机磷的矿化反应,并将沉积物中的有机磷分解转化成无机态磷,把难溶性转化为可溶性磷。这些可溶性磷一方面可以为自身的生命活动所利用,另一方面将释放到上覆水体或与底泥中Fe、Al等金属离子结合的氢氧化物、氧化物以及无机颗粒进行物理或化学吸附,进而转变为非磷灰石无机磷(NAIP)的一部分(李大鹏等,2008; 汤宝靖,2010)。Ruban等(1999)的研究也表明,沉积物中NAIP和OP 的含量之和可认为是潜在的可释放磷,即生物有效磷。
非磷灰石态无机磷(NAIP)是指以不同形式与Fe、Al、Mn等金属离子结合的磷,是沉积物中生物可利用性磷的主要组成部分。其中铁结合态磷(Fe-P)是非磷灰石态无机磷(NAIP)的主要成分。许多研究表明,湖泊等自然水体中的沉积物向上覆水体中释放的“活性磷”主要来自于有机磷的降解以及与铁氧/氢氧化物结合磷的释磷作用(Holtan et al,1988)。而本实验中,缢蛏实验组(低密度组和高密度组)在实验的中后均大于对照组,其中,在表层沉积物中,高密度组的NAIP 含量在实验中后期均显著大于对照组的NAIP值。研究证明底栖动物的生物扰动(掘穴、冲洗等),破坏了沉积物的表面氧化层,增加了富含氧气的上覆水倒灌下渗,使沉积物内部中有氧区域扩大,导致沉积物内环境趋于氧化性,由此促进了沉积物Fe2+向Fe3+转变,使上覆水和沉积物间隙水中的活性磷大量吸附于水合铁氧化物或铁氢氧化铁(张雷等,2011),造成了沉积物中NAIP 含量增加。Lewandowski等(2005)的室内研究也发现摇蚊幼虫与水丝蚓的生物扰动改变了铁结合态磷在沉积物中的分布。而在中层和底层沉积物中,除了底层沉积物在实验中期时的NAIP 含量外,各实验组的NAIP值均无显著性的差异。可能是中层和底层沉积物中溶解氧含量小于表层沉积物,且这些溶解氧大部分被沉积物内部中有机颗粒等还原性物质所消耗,系统内部还原性增强,促进了沉积物中一部分的三价铁离子还原成二价铁,使得一部分Fe-P 发生释放(李大鹏等,2008)。
磷灰石态无机磷(AP)是指钙结合态磷(Ca-P),包括自生钙磷(Aca-P)、碎屑态磷(Det-P)以及钙离子和磷酸根结合的钙磷酸盐(李大鹏等,2008)。Ca-P 一般被认为是沉积物磷赋存形态中比较惰性的成分,自然条件下,对上覆水体以及沉积物间隙水中P 含量影响比较小(郭建宁等,2007)。本实验中,低密度组和高密度组的AP 含量除了低密度组的底层沉积物在实验末期的AP值,均高于对照组的AP值。其中在表层沉积物中,高密度组的AP值均表现出显著高于对照组,而低密度组在实验中后期显著高于对照组。这可能是由于底栖动物的生物扰动作用,一方面加快了沉积物再悬浮,进而促进底泥中溶解性磷酸根的流出,而沉积物中钙离子和上覆水中的溶解性磷酸根重新结合,形成新的AP(Huang et al,2005); 而另一方面,生物扰动促进了微生物的活性,微生物在促进沉积物中化学反应的同时,释放出有机酸和代谢废物,从而改变了沉积物中PH和氧化还原电位,使AP处于弱酸状态沉积环境中会产生一定的释放(韩璐,2010)。而本实验中,在缢蛏生物扰动作用下形成新的磷灰石态无机磷(AP)含量大于AP 的释放量。李大鹏等(2008)的实验中也证明在再悬浮条件下(风浪,生物扰动等作用),磷灰石态无机磷(AP)呈逐渐上升趋势。
无机磷是沉积物中磷形态主要存在形态,其中包括磷灰石无机磷(AP)、非磷灰石无机磷(NAIP)以及其他无机磷形态。本实验中,在整个实验的中后期低密度组和高密度的IP 含量均大于对照组(如图 7 所示),其中在实验末期,低密度组在表层以及中层沉积物的IP值显著大于对照组,而高密度组在中层以及底层沉积物的IP值显著大于对照组的IP值。这个结果和磷灰石无机磷(AP)和非磷灰石无机磷(NAIP)的变化趋势是一致的,同时沉积物中的有机磷(OP)也显著减少。这表明,在缢蛏的生物扰动下,促进了沉积物中的矿化过程,有机磷被大量降解并释放出溶解态的正磷酸盐,这些正磷酸盐与Fe、Al、Ca等金属离子结合的氢氧化物、氧化物以及无机颗粒发生化学或物理吸附,进而转变称为磷灰石无机磷(AP)、非磷灰石无机磷(NAIP)等无机磷成分(李大鹏等,2008)。总磷含量包括沉积物中所有的无机磷和有机磷的总和。而本实验中总磷(TP)的发展趋势与无机磷的趋势完全相反。除了底层沉积物在实验末期时的TP 含量,低密度组和高密度组的TP 含量均小于对照组(如图 6所示)。其中在表层沉积物中,高密度组在实验中期和后期均显著小于对照组; 低密度组则在实验初期显著小于对照组。这可能是因为在缢蛏的生物扰动下,沉积物中的有机磷被大量降解转变称为溶解性正磷酸盐,这些磷酸盐被大量释放进入上覆水体,造成了沉积物中TP 含量的减少。李大鹏等(2012)研究发现扰动作用下,上覆水体中总磷、颗粒态磷、溶解性总磷的含量均显著增加。
Lewandowski等(2005)的室内研究发现摇蚊幼虫与水丝蚓的生物扰动仅改变了铁结合态磷在沉积物中的分布,而对其他形态磷未有明显影响。而本实验中,底栖动物缢蛏的加入使沉积物中各种磷赋存形态均有明显的变化。究其原因,可能与实验动物有关,缢蛏的生物扰动作用比摇蚊幼虫和水丝蚓剧烈,同时本实验的试验时间持续时间较长。影响沉积物磷释放的环境因子众多,而在生物扰动作用下,这些因素共同作用并相互影响的机制更加复杂,而过量的磷是引起水体富营养化的主要原因。因此,只有深入分析沉积物中磷的赋存特征及迁移转化规律,才能对沉积物中磷的释放有更全面、客观和清晰的认识,为养殖废水水体的生物控制和治理提供更为详尽地理论支持。
4 结论(1) 缢蛏生物扰动作用破坏了沉积物表面的氧化层,为沉积物内部中引入更多的氧气和其他电子受体,改变了沉积物内部的微环境,促进了微生物的生长,增大了沉积物中总微生物活性以及碱性磷酸酶活性,其中以沉积物表面的变化最为明显。
(2) 底栖动物缢蛏的生物扰动促进沉积物中有机磷加快分解,在实验末期,底栖动物的OP值均有所下降,尤其是高密度组不同沉积物层的OP值均显著小于对照组。沉积物中非磷灰石态无机磷(NAIP)含量总体呈现上升趋势,说明底栖动物缢蛏的加入,刺激了生物可利用性磷的增加,进而影响水体环境中水质和营养状况。磷灰石态无机磷(AP)在整个实验中,低密度组和高密度组的AP 含量均高于对照组的AP值。底栖动物生物扰动作用对促进了底泥中磷灰石态无机磷(AP)的形成。OP 的含量显著减少,AP和NAIP 的含量则则相对增加,这表明在缢蛏的生物扰动下OP 可能转变成为AP、NAIP等无机磷成分。在缢蛏的生物扰动下,沉积物中IP 含量略有增加,而沉积物中TP 含量则相反,呈下降趋势。上述结果表明底栖生物缢蛏扰动作用能够改变沉积物垂直方向上的磷赋存形态。
| 田相利, 李德尚, 董双林, 等, 2001. 对虾-罗非鱼-缢蛏封闭式综合养殖的水质研究. 应用生态学报, 12 (2) : 287–292 |
| 汤宝靖, 2010. 巢湖沉积物中磷的赋存形态及迁移转化与水华发生的关系. 吉林:吉林建筑工程学院硕士学位论文 |
| 孙刚, 房岩, 2013. 底栖动物的生物扰动效应. 北京: 科学出版社, 144-145 |
| 孙芳, 郑忠明, 陆开宏, 等, 2011. 底泥微生物活性对蓝藻水华水柱及沉积物间隙水氮磷分布的影响. 生态科学, 30 (3) : 217–222 |
| 孙芳, 郑忠明, 陆开宏, 等, 2012. 铜锈环棱螺(Bellamya aeruginosa)生物扰动对藻华水体沉积物微生物群落结构的影响. 海洋与湖沼, 43 (2) : 357–362 |
| 孙思志, 郑忠明, 2010. 大型底栖动物的生物干扰对沉积环境影响的研究进展. 浙江农业学报, 22 (2) : 263–268 |
| 李大鹏, 黄勇, 2012. 扰动强度对太湖沉积物中磷释放及其形态转化的影响. 环境科学, 33 (8) : 2614–2620 |
| 李大鹏, 黄勇, 李伟光, 2008. 再悬浮条件下底泥中磷赋存形态的转化研究. 环境科学, 29 (5) : 1289–1294 |
| 张雷, 古小治, 邵世光, 等, 2011. 河蚬(Corbicula fluminea)扰动对湖泊沉积物性质及磷迁移的影响. 环境科学, 32 (1) : 88–95 |
| 范德朋, 潘鲁青, 马甡, 等, 2002. 盐度和pH对缢蛏耗氧率及排氨率的影响. 中国水产科学, 9 (3) : 234–238 |
| 姚扬, 金相灿, 姜霞, 等, 2004. 光照对湖泊沉积物磷释放及磷形态变化的影响研究. 环境科学研究, 17 (增刊) : 30–33 |
| 郭建宁, 卢少勇, 金相灿, 等, 2007. 滇池福保湾沉积物不同形态磷的垂向分布. 环境科学研究, 20 (2) : 78–83 |
| 谌莉莎, 海热提, 2012. 生态碳纤维填料用于集约型水产养殖废水处理. 环境科学与技术, 35 (5) : 93–97 |
| 韩璐, 2010. 河流沉积物磷形态分布特征及其释放模拟研究.天津:南开大学博士学位论文 |
| Adam G, Duncan H, 2001. Development of a sensitive and rapid method for the measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils. Soil Biology and Biochemistry, 33 (7-8) : 943–951 DOI:10.1016/S0038-0717(00)00244-3 |
| Aller R C, 1982. The effects of macrobenthos on chemical properties of marine sediment and overlying water animal-sediment relations. In:McCall P L, Tevesz M J S eds.Animal-Sediment Relations. US:Springer, 53-102 |
| Barik S K, Purushothaman C S, Mohanty A N, 2001. Phosphatase activity with reference to bacteria and phosphorus in tropical freshwater aquaculture pond systems. Aquaculture Research, 32 (10) : 819–832 DOI:10.1046/j.1355-557x.2001.00619.x |
| Bates M H, Neafus N J E, 1980. Phosphorus release from sediments from Lake Carl Blackwell, Oklahoma. Water Research, 14 (10) : 1477–1481 DOI:10.1016/0043-1354(80)90013-5 |
| Boström B, Ahlgren I, Bell R, 1985. Internal nutrient loading in a eutrophic lake, reflected in seasonal variations of some sediment parameters. Vreh Int Ver Limnol, 22 (11) : 3335–3339 |
| Conley D J, Paerl H W, Howarth R W, et al, 2009. Controlling eutrophication:nitrogen and phosphorus. Science, 323 (5917) : 1014–1015 DOI:10.1126/science.1167755 |
| Edlund G, Carman R, 2001. Distribution and diagenesis of organic and inorganic phosphorus in sediments of the Baltic proper. Chemosphere, 45 (6-7) : 1053–1061 DOI:10.1016/S0045-6535(01)00155-2 |
| Holtan H, Kamp-Nielsen L, Stuanes A O, 1988. Phosphorus in soil, water and sediment:an overview. Hydrobiologia, 170 (1) : 19–34 DOI:10.1007/BF00024896 |
| Huang Q H, Wang Z J, Wang D H, et al, 2005. Origins and mobility of phosphorus forms in the sediments of Lakes Taihu and Chaohu, China. Journal of Environmental Science and Health Part A, 40 (1) : 91–102 DOI:10.1081/ESE-200033593 |
| Lewandowski J, Hupfer M, 2005. Effect of macrozoobenthos on two-dimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments:a laboratory study. Limnology and Oceanography, 50 (4) : 1106–1118 DOI:10.4319/lo.2005.50.4.1106 |
| Marinho-Soriano E, Nunes S O, Carneiro M A A, et al, 2009. Nutrients' removal from aquaculture wastewater using the macroalgae Gracilaria birdiae. Biomass and Bioenergy, 33 (2) : 327–331 DOI:10.1016/j.biombioe.2008.07.002 |
| Nicholaus R, Zheng Z M, 2014. The effects of bioturbation by the Venus clam Cyclina sinensis on the fluxes of nutrients across the sediment-water interface in aquaculture ponds. Aquaculture International, 22 (2) : 913–924 DOI:10.1007/s10499-013-9716-8 |
| Papaspyrou S, Gregersen T, Kristensen E, et al, 2006. Microbial reaction rates and bacterial communities in sediment surrounding burrows of two nereidid polychaetes (Nereis diversicolor and Nvirens). Marine Biology, 148 (3) : 541–550 DOI:10.1007/s00227-005-0105-3 |
| Qian Y C, Liang X Q, Chen Y X, et al, 2011. Significance of biological effects on phosphorus transformation processes at the water-sediment interface under different environmental conditions. Ecological Engineering, 37 (6) : 816–825 DOI:10.1016/j.ecoleng.2010.12.005 |
| Ruban V, López-Sánchez J F, Pardo P, et al, 1999. Selection and evaluation of sequential extraction procedures for the determination of phosphorus forms in lake sediment. Journal of Environmental Monitoring, 1 (1) : 51–56 DOI:10.1039/a807778i |
| Ruban V, López-Sánchez J F, Pardo P, et al, 2001. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments——a synthesis of recent works. Fresenius' Journal of Analytical Chemistry, 370 (2-3) : 224–228 DOI:10.1007/s002160100753 |
| Sayler G S, Puziss M, Silver M, 1979. Alkaline phosphatase assay for freshwater sediments:application to perturbed sediment systems. Applied and Environmental Microbiology, 38 (5) : 922–927 |
| Søndergaard M, Jensen J P, Jeppesen E, 1999. Internal phosphorus loading in shallow Danish lakes. Hydrobiologia, 408-409 : 145–152 DOI:10.1023/A:1017063431437 |
| Thayer C W, 1979. Biological bulldozers and the evolution of marine benthic communities. Science, 203 (4379) : 458–461 DOI:10.1126/science.203.4379.458 |
| Tsuchiya M, Kurihara Y, 1979. The feeding habits and food sources of the deposit-feeding polychaete, Neanthes japonica (Izuka). Journal of Experimental Marine Biology and Ecology, 36 (1) : 79–89 DOI:10.1016/0022-0981(79)90101-1 |
 2017, Vol. 48
2017, Vol. 48


