中国海洋湖沼学会主办。
文章信息
- 赵本宣, 赵晟, 李汝伟, 刘强, 吴常文. 2017.
- ZHAO Ben-Xuan, ZHAO Sheng, LI Ru-Wei, LIU Qiang, WU Chang-Wen. 2017.
- 舟山海域好氧不产氧光合异养细菌群落结构分析
- STRUCTURE OF AEROBIC ANOXYGENIC PHOTOTROPHIC BACTERIAL COMMUNITY IN ZHOUSHAN ARCHIPELAGO, EAST CHINA SEA
- 海洋与湖沼, 48(1): 171-183
- Oceanologia et Limnologia Sinica, 48(1): 171-183.
- http://dx.doi.org/10.11693/hyhz20160900199
-
文章历史
- 收稿日期:2016-09-19
- 收修改稿日期:2016-10-19
2. 国家海洋设施养殖工程技术研究中心 舟山 316022
2. National Engineering Research Center of Marine Facilities Aquaculture, Zhoushan 316022, China
好氧不产氧光合异养细菌(aerobic anoxygenic phototrophic bacteria,AAPB)作为地球上最古老的细菌类群之一,在严格需氧的前提下,能够利用自身合成的细菌叶绿素a 捕获光能作为辅助为新陈代谢提供部分能量(Yurkov et al,1998a,b; Rathgeber et al,2004; Cooney et al,2006; Koblížek et al,2006; Moran et al,2007),这样就间接地减少了有机碳的消耗,从而就相应地减少了二氧化碳的释放,而且AAPB广泛地分布在海洋真光层,最新研究表明,光可以激发并促进AAPB 的细胞活性,促进碳循环过程的进行(Garcia-Chaves et al,2016); 同时又由于它在海洋生物量中占有重要比重,并在碳和其它生源要素的生物地球化学循环的过程中起着独特的作用(Shiba et al,1982; Hallin et al,2005),具有潜在的重要功能,因此AAPB 就成为了海洋微生物生态研究领域的“新宠”。
AAPB 生存环境极其多样,从海洋到淡水,从盐湖、碱性湖泊、淡水温泉(Nuyanzina-Boldareva et al,2016)到南极湖泊,从酸性矿的排水系统到土壤,甚至在海底热泉和植物叶片上都有它的踪迹(Labrenz et al,2005; Csotonyi et al,2010; Atamna-Ismaeel et al,2012)。在海洋环境中,它们普遍占总原核生物1%-3%的丰度(Schwalbach et al,2005),在沿岸海域和公海都有发现,包括苦咸水中(Cottrell et al,2006,2009,2010)。AAPB 的丰度上下波动很大(Kolber et al,2000; Goericke,2002),在一些沿海的河口区AAPB的丰度戏剧性地超过了10%(Schwalbach et al,2005;Waidner et al,2005),最高竟然达到34%(Waidner et al,2007)。在一些高山湖泊中的比例甚至超过了50%(Mašín et al,2008)。Kolber等(2000,2001)和Beatty(2005)等人率先对海洋中AAPB 的分布规律进行了研究,其研究结果表明AAPB广泛分布在海洋中,此外,其定量结果显示AAPB的光合能力在贫营养的大洋海域更具生存优势,这意味着AAPB的丰度和多样性会随环境中营养丰富程度的提高而降低,反之亦然。而Goericke(2002)等在南加利福尼亚沿岸的富营养、中营养和贫营养水域的对比研究却得出与Kolber等人相反的结论。有人在泥炭沼泽湖泊中研究发现,在pH 为6.7-7.6 之间时,AAPB 的丰度最高(Lew et al,2016)。因此,目前AAPB 在初级生产力中的地位还不能够完全明确,而且影响AAPB分布格局及其在海洋生物生产和物质循环中生态地位的机制或许要比预期的更加复杂(胡耀华,2006),只有从季节、年度尺度上对全球多个典型海区的广泛的自然生态学调查,获取更充分、更具代表性的第一手数据,才能全面、准确地评估AAPB 在海洋中的生态地位。
基于基因组和其它单基因位点的证据表明,AAPB和厌氧光合细菌一样也含有细菌叶绿素,它们是按功能分类的一类属于变形菌门的细菌(Yurkov et al,1998a,b; Bryant et al,2006)。早期发现的大部分AAPB 都来源于海洋环境,在进化上都属于α-Proteobacteria,而唯一属于β-Proteobacteria 的AAPB 来自于淡水环境(Suyama et al,1999),基于环境序列的分析表明海洋未可培养细菌中还存在着类似β-Proteobacteria 的AAPB(Béjà et al,2002)。而最近的研究表明在近岸海洋表层微生物群落中γ-Proteobacteria 也占有相当的比重(Hu et al,2006;Cho et al,2007)。基于可培养和非培养的研究表明AAPB 具有属于α、β、γ 分支的广泛的遗传多样性,这些研究都扩展了AAPB 的多样性(Salka et al,2008)。由于海洋环境中绝大多数细菌都是未可培养的,必然还会存在许多稀有的、目前还不为人知的AAPB 种类。前人研究表明,基于16S rRNA 的基因序列与pufM 基因的序列分析结果所得到的AAPB 系统发育关系不完全一致,这说明光合作用的超级操纵子的侧向迁移产生了高度多样化的AAPB 群落(Nagashima et al,1997; Yurkov et al,1998a,b)。像16SrRNA 基因,pufM 基因存在于所有的AAPB 中,具有保守区和可变区,使其成为一个很好的用于量化的丰度和评估 AAPB 的遗传多样性的分子标记(Achenbach et al,2001; Allgaier et al,2003)。由编码光合反应中心M亚基的pufM 基因所设计出来的引物被广泛地用来扩增来自不同环境的样品,作为研究AAPB 基因多样性的最常用的方法(Yutin et al,2005)。
对整个大西洋和太平洋的观测证据表明,AAPB的丰度和多样性沿环境梯度而改变。例如,沿海和咸水似乎具有独特的AAPB分支,而在开放的海洋中却未发现(Yutin et al,2007)。同样,具有更高生产力的水域,正如高叶绿素a 浓度所指示的,AAPB 多样性比贫营养水域要低(Jiao et al,2007)。相反,在一些主要的出海口定的采样位置自由生活与颗粒附着AAPB 之间不存在显著差异,但采样点之间却存在遗传多样性的显著差异(Cottrell et al,2010)。来自波罗的海不同位置的细菌样本间存在AAPB 实质性的遗传变异,包括两个淡水和咸水分支(Masín et al,2006;Salka et al,2008),进一步表明AAPB 的遗传多样性,并且这种多样性具有与环境变量相关的生物地理和潜在的系统地理格局。已有的结果表明,尽管环境变化可能很重要,但也可能是特有的AAPB与原有岛屿生物地理学的一些假设一致(Losos,1967),即使没有明显限制它们悬浮分散在海洋中,这表明地理的距离可能在这些微生物种群的生态结构中发挥重要作用。而AAPB 群体遗传多样性也与环境变量和位置相关,表明种群数量和遗传多样性是通过环境变量和特有机制的组合进行调节的(Ritchie et al,2012)。
舟山群岛海域是东海地区集旅游、港口、工业、渔业、养殖区等于一体的重要海域。根据舟山市海洋功能区划,结合岛礁分布和行政区划,在基本涵盖舟山所有功能海域的基础上,我们选择了8 个典型站位。本文针对这8 个典型站位的表层海水样品,基于高通量DNA 测序的方法,利用编码光合反应复合中心小亚基的pufM 基因构建文库,对AAPB 分布及其系统发育多样性进行分析,旨在初步探讨舟山群岛海域AAPB 的多样性情况,为今后舟山群岛AAPB 生态学角色及其在碳循环中的贡献奠定科学基础。
1 材料与方法 1.1 样品采集及预处理于2016 年4 月在舟山群岛海域选择8 个代表性站位,采样点的选择依据舟山市海洋功能区划和行政区划相结合的原则,采样站位为东极岛(DJ)(122.69°°E,30.19°N)、岱山(DS)(122.11°E,30.27°N)、沈家门(SJM)(122.32°E,29.94°N)、枸杞岛(GQ)(122.81°E,30.72°N)、金塘岛(JT)(121.85°E,30.07°N)、六横岛(LH)(122.11°E,29.79°N)、桃花岛(TH)(122.30°E,29.81°N)、朱家尖(ZJJ)(122.41°E,29.92°N),见图 1。采集表层(0.5m)海水样品各2L 装入预先灭过菌的聚乙烯采样瓶中,先用真空抽滤装置经3μm 孔径滤膜过滤去除大颗粒杂质,再用0.22μm 孔径滤膜过滤,然后将滤膜取出,放入已灭菌的含有石英砂的5mL 离心管中,于液氮中保存,用于细菌DNA 提取。
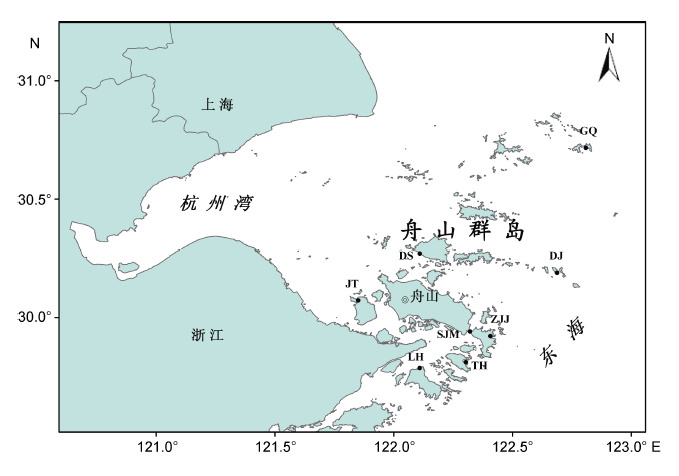 |
| 图 1 调查海区及采样站位(东海舟山群岛海域) Fig. 1 Location of the study area and sampling stations in the Zhoushan Archipelago,the East China Sea 注: 东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ),岱山(DS)。样品采集于2016 年4 月8-30 日 |
在水样采集的同时,利用携带的便携式HQ-30D溶氧仪测定溶解氧和温度,盐度计和pH 计分别测定盐度和pH,总磷使用便携多参数水质分析仪(型号:5B-2H)进行测定,其它一些水质参数,如COD、氨氮、硫酸盐、磷酸盐、硅酸盐、亚硝酸盐和硝酸盐等使用Smartchem-200 全自动间断式化学分析仪进行测定。
1.3 DNA 的提取及检测将保存滤膜的5mL 离心管从液氮中取出,在无菌的条件下,剪碎,加入1mL 提取缓冲液,水样中细菌DNA 具体提取步骤参照美国MOBIO 公司强力水样DNA 提取试剂盒的说明书,并用1.0%琼脂糖凝胶电泳检测。
1.4 AAPB pufM 基因PCR 扩增采样针对不产氧光合细菌pufM 基因扩增引物(Achenbach et al,2001; Béjà et al,2002)pufM-557-f(5′-TACGGSAACCTGTWCTAC-3′)和pufM-750-r(5′-CCATSGTCCAGCGCCAG AA-3′),对样品基因组DNA 进行扩增,PCR 产物片段长度约为193bp。PCR反应体系为95℃预变性4min,95℃变性30s,58℃退火30s,72℃延伸30s,循环35 次,72℃延伸5min。20μL 反应混合液,包括2μL DNA,正反引物各0.7μL,10μL 的PCR mastermix(TaKaRa),用水补齐。扩增产物用1.5%(W/V)的琼脂糖凝胶电泳检测扩增效果。
1.5 样品的高通量测序及数据分析流程将样品的PCR 产物,送至上海翰宇生物科技有限公司在Illumina MiSeqTM 平台上进行高通量测序。为了提高分析结果的质量,在序列充足的同时,也要保证序列的质量,因此,分析前要先对原始数据进行过滤处理,得到优质序列。然后对优质序列进行OTU聚类分析。基于OTU 聚类分析结果,可以进行Alpha 多样性分析,根据OTU 的物种分类结果,可以进行群落结构的统计分析。将OTU和分类学信息结合在一起进行Beta 多样性分析。在提供了环境因子的情况下,可以进行多样性统计分析。
数据预处理,使用Mothur v.1.32.1(Schloss et al,2009)(http://www.mothur.org/wiki/Calculators)对原始数据进行处理,得到优质序列,并进行统计。使用QIIME(Caporaso et al,2010)聚类生成OTU,相似性设为97%,即任意两条reads 的相似度均达到97%以上,将该序列聚类为一个OTU。OTU 代表序列与NCBI nr 数据库BlastX 比对,得到每个OTU 的分类学信息。
本研究中所有的原始数据全部上传到NCBI-SRA数据库(http://www.ncbi.nlm.nih.gov/sra/SRP080714),登录号为ID: SRP080714。
2 实验结果 2.1 环境参数现场进行定位,采集表层海水,采样深度为0.5m,溶解氧(DO)、盐度、pH、温度现场测定,其它水质参数,如COD、总磷、溶解无机氮(DIN)等带回实验室立即进行检测,结果如表 1 所示。从结果可以看出,水温为 13.8-17.2℃; 溶解氧(DO)变化不大,为10.00-11.85; pH 范围在7.65-7.92; 盐度变化较大,20-33,金塘最低,东极最高; COD 含量都符合一类海水的标准; 无机氮含量桃花岛最高,为0.438mg/L,总磷枸杞岛最低,只有0.008mg/L。
| 站点 | 经度 | 纬度 | 温度(℃) | pH | 溶解氧DO(mg/L) | 盐度 | 化学需氧量COD(mg/L) | 无机氮(mg/L) | 总磷TP(mg/L) |
| DJ | 122.69°E | 30.19°N | 14.5 | 7.86 | 10.39 | 33 | 1.14 | 0.061 | 0.03 |
| SJM | 122.32°E | 29.94°N | 13.8 | 7.78 | 10.44 | 30 | 0.97 | 0.174 | 0.038 |
| GQ | 122.81°E | 30.72°N | 14.7 | 7.92 | 11.85 | 32 | 1.04 | 0.053 | 0.008 |
| DS | 122.11°E | 30.27°N | 13.9 | 7.77 | 10.46 | 27 | 0.59 | 0.121 | 0.036 |
| ZJJ | 122.41°E | 29.92°N | 15.4 | 7.65 | 10.61 | 30 | 1.02 | 0.211 | 0.014 |
| JT | 121.85°E | 30.07°N | 15.7 | 7.67 | 10 | 20 | 1.08 | 0.078 | 0.029 |
| LH | 122.11°E | 29.79°N | 17.2 | 7.71 | 10.01 | 26 | 1.09 | 0.088 | 0.02 |
| TH | 122.30°E | 29.81°N | 16.7 | 7.83 | 10.78 | 27 | 1.18 | 0.438 | 0.018 |
| 注: 温度(T), 溶解氧(DO), 盐度(salinity), 化学需氧量(COD), 无机氮(DIN), 总磷(TP)。东极岛(DJ), 枸杞岛(GQ), 金塘岛(JT), 六横岛(LH), 沈家门(SJM), 桃花岛(TH), 朱家尖(ZJJ), 岱山(DS) | |||||||||
经过预处理的原始测序数据,一共得到192633条序列,我们进行了OTU 聚类分析,相似性设为97%,可以看到,所有的数据最后一共分成4051 个OTU,各站点OTU 聚类结果分别是DJ 490 个,GQ670 个,JT 1123 个,LH 883 个,SJM 1526 个,TH 1204个,ZJJ 691 个(表 2)。
| Sample | Cutoffs | OTUs | ACE | Chao 1 | Shannon | Simpson | Coverage |
| DJ | 0.03 | 490 | 2272.419 | 1285.344 | 1.003 | 0.709 | 0.987 |
| GQ | 0.03 | 670 | 2346.805 | 1480.843 | 0.935 | 0.726 | 0.985 |
| JT | 0.03 | 1123 | 2986.873 | 2201.553 | 3.587 | 0.156 | 0.979 |
| LH | 0.03 | 883 | 2517.865 | 1697.963 | 3.686 | 0.132 | 0.981 |
| SJM | 0.03 | 1526 | 4639.57 | 3161.734 | 4.126 | 0.087 | 0.967 |
| TH | 0.03 | 1204 | 3773.191 | 2482.62 | 1.849 | 0.464 | 0.976 |
| ZJJ | 0.03 | 691 | 4008.149 | 2392.211 | 1.661 | 0.502 | 0.971 |
| 注: 东极岛(DJ), 枸杞岛(GQ), 金塘岛(JT), 六横岛(LH), 沈家门(SJM), 桃花岛(TH), 朱家尖(ZJJ) | |||||||
进行Alpha 多样性分析,Alpha 多样性指数(estimator),包括: 丰度评估指数(ACE 指数和Chao 1指数)和多样性评估指数(Shannon 指数、Simpson 指数和Coverage)。从ACE 指数和Chao 1 指数的结果可以看出,各采样站点微生物丰富度排序是: SJM > ZJJ> TH > JT > LH > GQ > DJ,而从Shannon 指数和Simpson 指数来看,各站点微生物多样性从高到低依次是: SJM > LH > JT > TH > ZJJ > DJ > GQ。从Coverage 可以看出,测序深度已经足够,覆盖度较高,文库可用于评估AAPB 多样性。从稀释性曲线(图 2)来看当测序量超过25000 读长时,仍然有新的OTU被发现,但是整个曲线已经趋于平缓,说明测序数据量合理,更多的数据量对发现新OTU 的边际贡献很小,从图中也可以看出相同序列数时,SJM、TH和JT的OTU 数比其它三个位点要高,DJ 最低,说明SJM、TH和JT 的微生物丰富度要高于其它三个位点,DJ 的微生物丰富度最低。
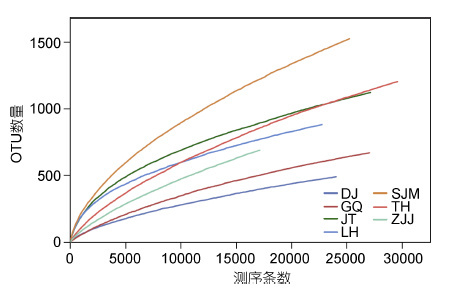 |
| 图 2 稀释性曲线(cutoff=0.03) Fig. 2 The rarefaction curve(cutoff=0.03) 注: 横轴为从某个样品中随机抽取的测序条数,纵轴为基于该测序条数能构建的OTU 数量。每条曲线代表一个样品,用不同颜色标记。东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ) |
根据OTU 聚类分析的结果,各采样站点样品中AAPB 群落结果组成基本相似,大部分序列都属于未明确分类的细菌,明确分类的门主要包括:Planctomycetes 浮霉菌门,Proteobacteria 变形菌门,Firmicutes 厚壁菌门。AAPB 在门水平上的组成分布与前人报道的结果相似(陈晨,2014),但是有关Planctomycetes 的发现还不是很多。其中,Proteobacteria 占已明确分类的细菌类群的绝对优势,各站点中序列数目分别是DJ 150 个,GQ 43 个,JT 230个,LH 819 个,SJM 195 个,TH 89 个,ZJJ 86 个,最多的是LH,其次是JT,最少的是GQ。Firmicutes 只在JT和ZJJ 发现了,Planctomycetes 仅在ZJJ 检测到1条序列。在明确分类的各细菌门中,属于Proteobacteria 的AAPB 占到总体的97%。
各站点聚类分析结果中未明确分类的AAPB 占大多数,一共发现了32 个明确分类的属,明确分类的属分类水平的分布情况见图 3,其中占优势的菌属分别为Roseobacter 、Sphingopyxis 、Loktanella 、Sphingomonas、Methylobacterium和Escherichia,其中前三个是所有站点共有的属。其它还包括Skermanella、Brevundimonas、Thalassobium、Bacillus、Isosphaera、Ahrensia、Maritimibacter、Rhodobacter、Sulfitobacter、Elioraea、Erythrobacter、Blastomonas、Citromicrobium、Novosphingobium、Limnohabitans、Rubrivivax 、Methyloversatilis 、Desulfocapsa 、Thiohalocapsa 、Thiorhodococcus 、Klebsiella 、Amphritea、Cellvibrio、Pseudomonas和Cycloclasticus。有些属只在某一个位点或其中几个位点发现,例如,Isosphaera 、Maritimibacter 、Desulfocapsa 、Thiorhodococcus、Klebsiella和Amphritea 只存在于ZJJ,Ahrensia、Blastomonas和Methyloversatilis 仅在JT 发现。Sulfitobacter和Elioraea 是LH 特有的两个属,而Novosphingobium 是TH 的特有属,Limnohabitans和Rubrivivax 也仅在SJM 检测到。总的来说,各位点明确分类的AAPB 丰度大小顺序是LH>JT>SJM>DJ>TH>ZJJ>GQ。
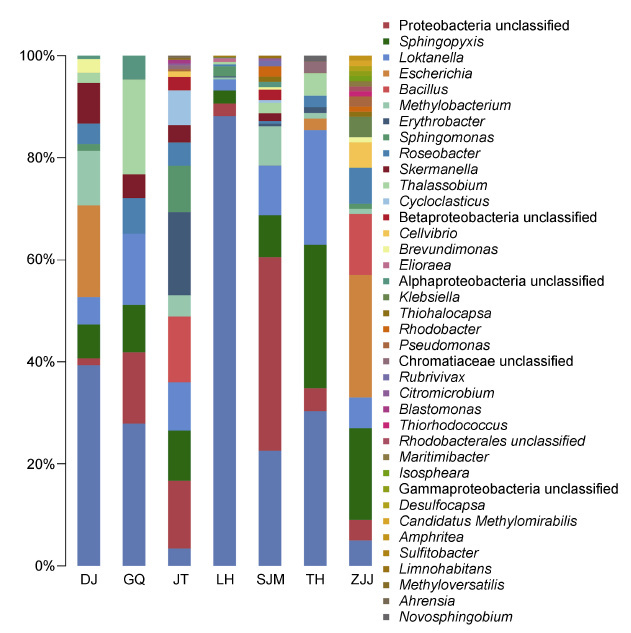 |
| 图 3 明确分类的各属的相对丰度 Fig. 3 Relative abundance of each clear classification genus retrieved from metagenomic samples 注: 东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ) |
| Taxonomy 分类 | DJ | GQ | JT | LH | SJM | TH | ZJJ |
| Bacteria; Planctomycetes 浮霉菌门 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Bacteria; Proteobacteria 变形菌门 | 150 | 43 | 230 | 819 | 195 | 89 | 86 |
| Bacteria; unclassified 未分类的 | 23897 | 27006 | 26880 | 21940 | 25054 | 29500 | 17046 |
| Bacteria; Firmicutes 厚壁菌门 | 0 | 0 | 34 | 0 | 0 | 0 | 12 |
| 注: 数字代表的是各站点对应的各细菌门的序列数量。东极岛(DJ), 枸杞岛(GQ), 金塘岛(JT), 六横岛(LH), 沈家门(SJM), 桃花岛(TH), 朱家尖(ZJJ) | |||||||
从属水平的样品间聚类关系树(图 4)可以看出,各采样位点之间的群落结构相似性,其中LH和SJM相似性较高,DJ和GQ 相似性最高,然后TH和DJ、GQ 两个比较相似,ZJJ 又和DJ、GQ和TH 相似性较高,JT和其它位点相似性是最低的。Heatmap 图可以很直观的反映各位点在AAPB 属水平上群落组成的相似性和差异性(图 5)。横轴代表各采样位点,纵轴代表AAPB各属,在JT 站点,Bacillus和Erythrobacter 丰度较高,而Roseobacter 丰度相对较低,TH 站点,Sphingopyxis、Loktanella和Roseobacter 具有较高丰度,GQ 主要是未明确分类的一些属。可以发现,单独分析某一个属的时候,各站点差别仍然很明显,比如:Roseobacter 相对丰度最高的是LH,DJ和ZJJ 相对丰度比较高的都是Escherichia,在DJ和SJM,Methylobacterium 的丰度相对较高,Bacillus 在JT和ZJJ 的分布则相对较多。同样又印证了LH和SJM 具有较高相似性,ZJJ、DJ、GQ和TH 相似性比较近,而JT 与其它位点差异性是最大的。
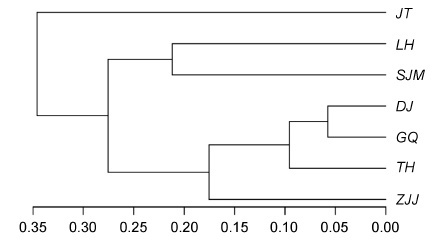 |
| 图 4 样品间聚类关系树(属水平) Fig. 4 The tree of clustering for all samples at genus level 注: 下角的图例为距离标尺,分支距离越长,差异关系越远。东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ) |
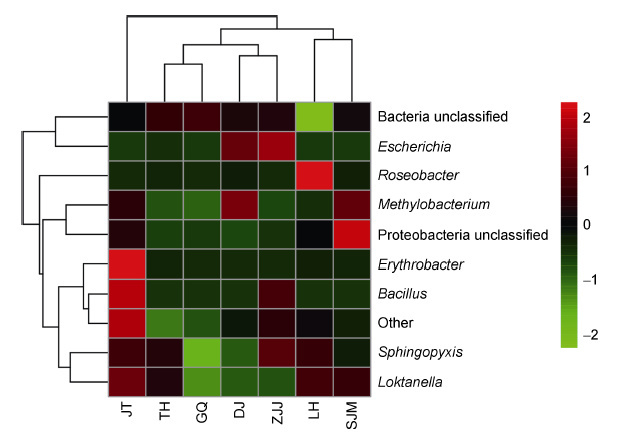 |
| 图 5 AAPB 属水平的Heatmap 图 Fig. 5 The Heatmap of AAPB in the sampling stations at genus level 注: 每小格代表其所在样品中某个物种的相对丰度,颜色对应的是最上面的色阶,不同颜色代表物种所占比例,从绿到红,代表该样本横坐标的丰度越高。东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ) |
RDA 用于探究的AAPB 丰度和环境变量之间的关系。不难发现,溶解氧(DO)和pH 对于除Roseobacter和Escherichia 之外的AAPB 各属细菌均呈正相关性关系,而其它的环境变量如COD、总磷(TP)、温度(T)、无机氮(DIN)和盐度(salinity)对Roseobacter和Escherichia 呈正相关性关系。溶解氧(DO)、总磷(TP)和pH 射线较长,说明这三种因素对相应的AAPB 影响较大,相关性比较明显(图 6)。
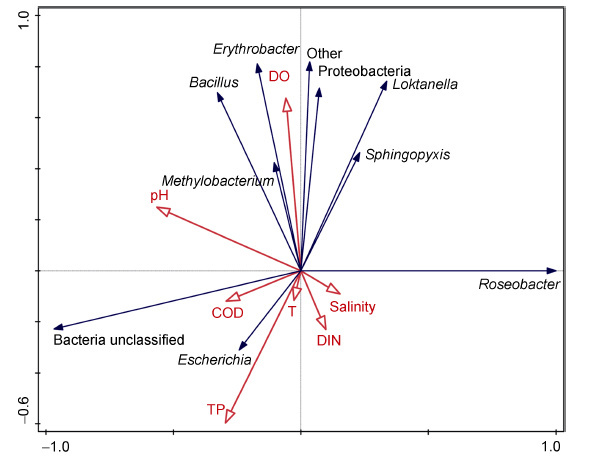 |
| 图 6 AAPB 与环境参数之间关系的RDA 分析 Fig. 6 Ordination plot of redundancy analysis(RDA)for AAPBs with hydrochemical data(environmental variables) 注: 温度(T),溶解氧(DO),盐度(salinity),化学需氧量(COD)无机氮(DIN)总磷(TP)。东极岛(DJ),枸杞岛(GQ),金塘岛(JT),六横岛(LH),沈家门(SJM),桃花岛(TH),朱家尖(ZJJ) |
本研究的目的是确定在舟山群岛海域不同海洋功能区表层海水之间AAPB 群落组成的异同并进一步探究AAPB 与环境因子之间的关系。我们推测舟山群岛AAPB 的组成类型将有可能既表现出特有性又具有世界大同主义的细菌群落的格局。
所有的测序结果按照97%的相似值,一共归为4051 个OTU 中,每个采样站点的OTU 数不等,为490-1526 个。其中,有28 个OTU 是所有站点共有的,并且所含序列数占总测序条数的70%。基于OTU聚类分析的结果,我们计算了每个样品的α 多样性指数(表 2)。 7 个站点独有的OTU 数目分别是DJ 10个、GQ 14 个、JT 14 个、LH 17 个、SJM 33 个、TH24 个、ZJJ 28 个。Chao 1和ACE 指数通常用来计算丰富度情况,而Shannon和Simpson 指数,被用来估计多样性。结果表明,多样性是排名为: SJM > LH >JT > TH > ZJJ > DJ > GQ,而丰富度排名为: SJM >ZJJ > TH > JT > LH > GQ > DJ。在各种样品中OTU的变化中也观察到类似的趋势。稀释性曲线很好地展示了各样品测序的情况,此外结合Alpha 多样性指数,可以得出结论: SJM 微生物丰富度和多样性都是最高的,LH、JT和TH 也都比较高,而DJ和GQ 微生物丰富度和多样性最低(图 2)。
与以往的研究相比(Zhang et al,2007; Yutin et al,2009; Zeng et al,2016; Zhang et al,2016),α-Proteobacteria,γ-Proteobacteria 为优势类群,而我们的样本中细菌群落是由α-Proteobacteria,γ-Proteobacteria,β-Proteobacteria,δ-Proteobacteria,Bacilli和Planctomycetia 为主(图 4)。α-Proteobacteria 已经被广泛研究(Alexandre et al,2008),它们在赤潮的时候有明显的增殖活动,在沿岸和大洋环境中为主流群体(Glöckner et al,1999; Pinhassi et al,2000;Eilers et al,2001; Alonso-Sáez et al,2007)。近年来,赤潮在DJ和GQ 发生的频率比以往更高,可能与它们相对丰度降低有关,特别是当与γ-Proteobacteria 相比较的时候(Teira et al,2007)。另一方面,曾经有几个α-Proteobacteria 丰度增大的情况,例如Roseobacterlike 细菌丰度随着正烷烃的增加而增大(McKew et al,2007)。虽然一些报告已经描述过从烃污染海洋环境中分离α-Proteobacteria 的分类,但还是难以确认这些微生物是否能够降解或利用烃。一项对印度尼西亚海水中烃类降解菌的研究显示,属于Sphingomonadales和Rhodobacterales 的不同的海洋α-Proteobacteria 属的细菌参与了脂肪族和低分子量芳烃的降解过程(Harwati et al,2007)。值得注意的是,在波罗的海北部夏季分层条件下,当细菌的生长受养分可利用性的限制时,Sphingomonas 属种类占浮游细菌的主导地位(Pinhassi et al,2000)。巧合的是这两种类型的细菌在各采样位点均被发现并鉴定出,而最高是LH,其原因可能是因为它位于与许多有机污染物的污水区域。
一些结果表明,属于Rhodobacteraceae 的AAPB在沿岸海域具有非常重要的影响。类似的结果,在贫营养的西太平洋(Zheng et al,2015)和极地沿海地区(Zeng et al,2016)也有发现,这表明AAPB 更喜欢高透光的表层海水。属于Rhodobacteraceae 科的Loktanella和Roseobacter 两个属的AAPB 在所有的采样站点中都处于优势地位,而在细菌属的分类水平上,ZJJ和JT 比其它样本具有更高的多样性(图 3)。Roseobacter 进化枝在海水中的广泛分布已经通过多种分子技术得到证实(Schmidt et al,1991; González et al,1997; Lanoil et al,2000),这些生物体是海洋浮游细菌的一个重要组成部分(Giovannoni,2000)。目前,仍然缺乏足够的知识去了解这一群体在海洋环境中的作用和功能。因此,需要全面的研究以提高我们对α-Proteobacteria 在海洋环境中的烃降解生态位的理解。
在JT和SJM 也被发现了β-Proteobacterial 群体(约占3%),然而很少有在除了淡水环境和河口以外其它环境中发现β-Proteobacterial-like AAPB 序列的报道(Ritchie et al,2012)。Bouvier等(2002)在两个河口发现了沿着盐度梯度变化的细菌群落组成,发现盐度是β-Proteobacteria 额外的控制因素。而伽玛变形菌的成员被认为是海洋表层水中的重要的代表细菌,这也就意味着它们能够快速生长并能迅速降解海洋中更容易被降解的有机成分(Pinhassi et al,2003;Poretsky et al,2005)。与以往的研究一致,它们在大西洋、波罗的海和北太平洋(Hu et al,2006; Masín et al,2006; Boeuf et al,2013)中占主导地位。在高纬度(>60◦N,>60◦S)和极地水域缺乏伽马变形细菌的情况相对于全球性的分布趋势是一个例外,表明其成员无法在冰冷的海水环境中发展壮大(Koh et al,2011;Boeuf et al,2013)。依赖培养的和非培养的研究表明,AAPB 多样性体现在拥有许多α-,β-和γ-Proteobacteria 的成员(Jeanthon et al,2011)。然而δ-Proteobacteria 纲的Desulfocapsa 属在ZJJ 的发现,实属罕见。在先前的研究报道中,在石油污染潮下带沉积物中曾经发现过它的存在(Acosta-González et al,2013)。在AAPB的相关研究中,至今几乎很少有涉及到δ-Proteobacteria 纲细菌的发现。究其原因,这可能与环境有关,ZJJ 属于捕捞区,基于Azam等(1994,2007)提出了海洋微食物环的概念,捕捞区必定具有高丰度的浮游生物,从而相应地微生物种类和丰度也会更多。
基于非培养的分子技术,如荧光原位杂交技术(Fluorescence In Situ Hybridization,FISH),末端限制性片段长度多态性图谱技术(Terminal-Restriction Fragment Length Polymorphism,T-RFLP)和puf 操纵子大量的插入克隆分析,拓展了我们对AAPB多样性和丰度的认识(Grüntzig et al,2002; Cottrell et al,2006)。与传统的基于分离培养的数据相比,在不同类型的功能区,AAPB 含有α-,β-,δ-和γ 类的变形菌,并支持AAPB 多样性远不止两个容易被培养的Erythrobacter和Roseobacter 属这一观点。尽管已经有许多关于AAPB 在不同的地理位置和营养条件下的群落结构的研究(Zeng et al,2009; Lehours et al,2010),但尚未发现有沿着各种类型海洋功能区的AAPB 分布的研究。我们探索了AAPB 在不同功能区域表层海水的分布,利用基于pufM 基因的高通量测序的数据。共得到32 个明确分类的属和7 个属于Proteobacteria 纲未分类的属(图 3),而大多数OTU 属于未明确分类的AAPB 的分支。这些属分别被划分为16 科、15 目、6 纲和3 门。在结果中,丰度和多样性相对较高的是变形杆菌,其中也包含了大多数纲、目和科,其次是厚壁菌门和浮霉菌门(表 3)。尤其是属于δ-Proteobacteria 的pufM 基因的发现,使我们确信AAPB 多样性的复杂程度远远超出目前所了解的情况。
温度是促进AAPB 生长的一个重要环境因素(Masín et al,2006; Ferrera et al,2014; Koblížek,2015;Lew et al,2015)。巴伦支海的数据呈现强烈的线性相关性,在温度最高时AAPB 的丰富度和多样性最高(Lehours et al,2015)。然而,在极度贫营养的寒冷的高山湖泊,电导率、pH 值、硝酸盐含量是影响AAPB群落结构分布和生长的主要因素(Koblížek,2015)。在我们的研究中,Roseobacter 属在LH 的丰度最高,这可能表明温度是某些Roseobacter 属细菌生长的至关重要条件。AAPB 的丰度与pH 值在我们研究的范围内呈正相关,pH 值显著影响阿加西斯泥炭地冰川湖细菌群落的组成和纽约阿迪朗达克公园物种多样性和丰富度(Frischer et al,2008,Lin et al,2012)。AAPB的丰度也可能直接或间接地受到其它因素(如水化学性质和pH 值)的影响。水的pH 值也可能会显著改变原生生物和植食性浮游动物的组成。已有研究证明,AAPB 经常处在激烈的被捕食的压力下,植食性浮游动物群落的改变可能也会严重影响AAPB 的数量(Ferrera et al,2011)。另一个关键的环境因素是盐度,它对海洋微生物的生长也有至关重要的影响。据报道,在特拉华河口和北冰洋西部的AAPB 受到环境盐度变化影响(Waidner et al,2008; Boeuf et al,2013),但这种影响关系在本研究中未发现。虽然盐度变化很大(表 1),在这些变化下的背后可能生存着许多具有相应生理耐受性的AAPB 种群。可能的原因是,不同盐度的水域之间,光线充足时,光合异养可能在温暖、高盐度的水和寒冷、低盐度的水中具有不同的生理作用。除了温度以外,不同的盐度也导致ZJJ 的pufM多样性高于JT和LH。
Zohary和Robarts 得出结论认为,冬季在地中海东部,磷是细菌和浮游植物大面积生长的最主要的限制性营养物质(Zohary et al,1998)。同样,在夏天的地中海西北面水域,磷的限制性作用也很常见(Zweifel et al,1993,Sala et al,2002)。此外,AAPB 是一类快速生长代谢活跃的生物,它们极大地促进了溶解氧的补充。我们可以得出结论认为,DO 是影响许多细菌属分布的一个重要因素(图 6)。另外,从采样站点pufM 基因的OTU 分类结果表明,AAPB 特有分支与特定环境条件有关。这些结果表明观察到的AAPB 丰度的变化往往也会伴随着种群的遗传多样性变化(图 5)。从属的分布情况来看,Isosphaera、Maritimibacter 、Desulfocapsa 、Thiorhodococcus 、Klebsiella和Amphritea 这几个属只在朱家尖(ZJJ)被发现,Ahrensia、Blastomonas和Methyloversatilis 仅属于金塘岛(JT),Sulfitobacter和Elioraea 只在六横岛(LH)存在,而Novosphingobium 也仅在桃花岛被发现(TH),Limnohabitans和Rubrivivax 只存在于沈家门(SJM)(表 4)。它们的生理适应和代谢灵活的本性表明了光能异养为其提供了选择性的优势。所有的物理和化学因素都可能在构建AAPB 种群结构时起到单独或协同作用。数据表明,不同的AAPB 群体被各种复杂的环境因素所控制,这或许可以解释为什么目前很难准确预测水生环境总AAPB 分布的问题。
| 陈晨, 2014. 内蒙古高原湖泊好养不产氧光合细菌的分离及其脱氮活性分析和脱氮功能基因的检测. 呼和浩特:内蒙古农业大学硕士学位论文 |
| 胡耀华, 2006. 代表性海区好氧不产氧光合细菌的光合基因(pufM)生态分布特征, 厦门:厦门大学硕士学位论文 |
| Achenbach L A, Carey J, Madigan M T, 2001. Photosynthetic and phylogenetic primers for detection of anoxygenic phototrophs in natural environments. Applied and Environmental Microbiology, 67 (7) : 2922–2926 DOI:10.1128/AEM.67.7.2922-2926.2001 |
| Acosta-González A, Rosselló-Móra R, Marqués S, 2013. Characterization of the anaerobic microbial community in oil-polluted subtidal sediments:aromatic biodegradation potential after the Prestige oil spill. Environmental Microbiology, 15 (1) : 77–92 DOI:10.1111/emi.2013.15.issue-1 |
| Alexandre A, Laranjo M, Young J P W, et al, 2008. dnaJ is a useful phylogenetic marker for alphaProteobacteria. International Journal of Systematic and Evolutionary Microbiology, 58 (Pt 12) : 2839–2849 |
| Allgaier M, Uphoff H, Felske A, et al, 2003. Aerobic anoxygenic photosynthesis in Roseobacter clade bacteria from diverse marine habitats. Applied and Environmental Microbiology, 69 (9) : 5051–5059 DOI:10.1128/AEM.69.9.5051-5059.2003 |
| Alonso-Sáez L, Balagué V, Sà E L, et al, 2007. Seasonality in bacterial diversity in north-west Mediterranean coastal waters:assessment through clone libraries, fingerprinting and FISH. FEMS Microbiology Ecology, 60 (1) : 98–112 DOI:10.1111/fem.2007.60.issue-1 |
| Atamna-Ismaeel N, Finkel O, Glaser F, et al, 2012. Bacterial anoxygenic photosynthesis on plant leaf surfaces. Environmental Microbiology Reports, 4 (2) : 209–216 DOI:10.1111/emi4.2012.4.issue-2 |
| Azam F, Malfatti F, 2007. Microbial structuring of marine ecosystems. Nature Reviews Microbiology, 5 (10) : 782–791 DOI:10.1038/nrmicro1747 |
| Azam F, Smith D C, Steward G F, et al, 1994. Bacteria-organic matter coupling and its significance for oceanic carbon cycling. Microbial Ecology, 28 (2) : 167–179 DOI:10.1007/BF00166806 |
| Béjà O, Suzuki M T, Heidelberg J F, et al, 2002. Unsuspected diversity among marine aerobic anoxygenic phototrophs. Nature, 415 (6872) : 630–633 DOI:10.1038/415630a |
| Beatty J T, 2005. On the natural selection and evolution of the aerobic phototrophic bacteria. In:Govindjee, Beatty J T, Gest H et al, eds. Discoveries in Photosynthesis.Netherlands:Springer, 1099-1104 |
| Boeuf D, Cottrell M T, Kirchman D L, et al, 2013. Summer community structure of aerobic anoxygenic phototrophic bacteria in the western Arctic Ocean. FEMS Microbiology Ecology, 85 (3) : 417–432 DOI:10.1111/1574-6941.12130 |
| Bouvier T C, del Giorgio P A, 2002. Compositional changes in free-living bacterial communities along a salinity gradient in two temperate estuaries. Limnology and Oceanography, 47 (2) : 453–470 DOI:10.4319/lo.2002.47.2.0453 |
| Bryant D A, Frigaard N U, 2006. Prokaryotic photosynthesis and phototrophy illuminated. Trends in Microbiology, 14 (11) : 488–496 DOI:10.1016/j.tim.2006.09.001 |
| Caporaso J G, Kuczynski J, Stombaugh J, et al, 2010. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7 (5) : 335–336 DOI:10.1038/nmeth.f.303 |
| Cho J C, Stapels M D, Morris R M, et al, 2007. Polyphyletic photosynthetic reaction centre genes in oligotrophic marine GammaProteobacteria. Environmental Microbiology, 9 (6) : 1456–1463 DOI:10.1111/emi.2007.9.issue-6 |
| Cooney M J, Johnston W A, Pohl S, et al, 2006. Influence of photoperiod on pigmentation and metabolic efficiency of the marine aerobic anoxygenic photosynthetic bacterium Erythrobacter longus Strain NJ3Y. Aquatic Microbial Ecology, 43 (3) : 303–309 |
| Cottrell M T, Mannino A, Kirchman D L, 2006. Aerobic anoxygenic phototrophic bacteria in the Mid-Atlantic bight and the North Pacific Gyre. Applied and Environmental Microbiology, 72 (1) : 557–564 DOI:10.1128/AEM.72.1.557-564.2006 |
| Cottrell M T, Kirchman D L, 2009. Photoheterotrophic microbes in the Arctic Ocean in summer and winter. Applied and Environmental Microbiology, 75 (15) : 4958–4966 DOI:10.1128/AEM.00117-09 |
| Cottrell M T, Ras J, Kirchman D L, 2010. Bacteriochlorophyll and community structure of aerobic anoxygenic phototrophic bacteria in a particle-rich estuary. The ISME Journal, 4 (7) : 945–954 DOI:10.1038/ismej.2010.13 |
| Csotonyi J T, Swiderski J, Stackebrandt E, et al, 2010. A new environment for aerobic anoxygenic phototrophic bacteria:biological soil crusts. Environmental Microbiology Reports, 2 (5) : 651–656 DOI:10.1111/j.1758-2229.2010.00151.x |
| Eilers H, Pernthaler J, Peplies J, et al, 2001. Isolation of novel pelagic bacteria from the German bight and their seasonal contributions to surface picoplankton. Applied and Environmental Microbiology, 67 (11) : 5134–5142 DOI:10.1128/AEM.67.11.5134-5142.2001 |
| Ferrera I, Borrego C M, Salazar G, et al, 2014. Marked seasonality of aerobic anoxygenic phototrophic bacteria in the coastal NW Mediterranean Sea as revealed by cell abundance, pigment concentration and pyrosequencing of pufM gene. Environmental Microbiology, 16 (9) : 2953–2965 DOI:10.1111/emi.2014.16.issue-9 |
| Ferrera I, Gasol J M, Sebastián M, et al, 2011. Comparison of growth rates of aerobic anoxygenic phototrophic bacteria and other bacterioplankton groups in coastal Mediterranean waters. Applied and Environmental Microbiology, 77 (21) : 7451–7458 DOI:10.1128/AEM.00208-11 |
| Garcia-Chaves M C, Cottrell M T, Kirchman D L, et al, 2016. Single-cell activity of freshwater aerobic anoxygenic phototrophic bacteria and their contribution to biomass production. The ISME Journal, 10 (7) : 1579–1588 DOI:10.1038/ismej.2015.242 |
| Giovannoni S, Rappé M S, 2000. Evolution, diversity, and molecular ecology of marine prokaryotes. In: Kirchmann D L ed. Microbial Ecology of the Oceans. New York:Liss/Wiley, 47-84 |
| Glöckner F O, Fuchs B M, Amann R, 1999. Bacterioplankton compositions of lakes and oceans:a first comparison based on fluorescence in situ hybridization. Applied and Environmental Microbiology, 65 (8) : 3721–3726 |
| Goericke R, 2002. Bacteriochlorophyll a in the ocean:is anoxygenic bacterial photosynthesis important?. Limnology and Oceanography, 47 (1) : 290–295 DOI:10.4319/lo.2002.47.1.0290 |
| González J M, Moran M A, 1997. Numerical dominance of a group of marine bacteria in the alpha-subclass of the class Proteobacteria in coastal seawater. Applied and Environmental Microbiology, 63 (11) : 4237–4242 |
| Grüntzig V, Stres B, del Río H L A et al, 2002. Improved protocol for T-RFLP by capillary electrophoresis. Michigan:Center for Microbial Ecology, Michigan State University East Lansing |
| Hallin S, Lydmark P, Kokalj S, et al, 2005. Community survey of ammonia-oxidizing bacteria in full-scale activated sludge processes with different solids retention time. Journal of Applied Microbiology, 99 (3) : 629–640 DOI:10.1111/jam.2005.99.issue-3 |
| Harwati T U, Kasai Y, Kodama Y, et al, 2007. Characterization of diverse hydrocarbon-degrading bacteria isolated from Indonesian seawater. Microbes and Environments, 22 (4) : 412–415 DOI:10.1264/jsme2.22.412 |
| Hu Y H, Du H L, Jiao N Z, et al, 2006. Abundant presence of the γ-like Proteobacterial pufM gene in oxic seawater. FEMS Microbiology Letters, 263 (2) : 200–206 DOI:10.1111/fml.2006.263.issue-2 |
| Jeanthon C, Boeuf D, Dahan O, et al, 2011. Diversity of cultivated and metabolically active aerobic anoxygenic phototrophic bacteria along an oligotrophic gradient in the Mediterranean Sea. Biogeosciences, 8 (7) : 1955–1970 DOI:10.5194/bg-8-1955-2011 |
| Jiao N Z, Zhang Y, Zeng Y H, et al, 2007. Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. Environmental Microbiology, 9 (12) : 3091–3099 DOI:10.1111/emi.2007.9.issue-12 |
| Koblížek M, 2015. Ecology of aerobic anoxygenic phototrophs in aquatic environments. FEMS Microbiology Reviews, 39 (6) : 854–870 DOI:10.1093/femsre/fuv032 |
| Koblížek M, Falkowski P G, Kolber Z S, 2006. Diversity and distribution of photosynthetic bacteria in the Black Sea. Deep Sea Research Part II:Topical Studies in Oceanography, 53 (17-19) : 1934–1944 DOI:10.1016/j.dsr2.2006.03.019 |
| Koh E Y, Phua W, Ryan K G, 2011. Aerobic anoxygenic phototrophic bacteria in Antarctic sea ice and seawater. Environmental Microbiology Reports, 3 (6) : 710–716 DOI:10.1111/emi4.2011.3.issue-6 |
| Kolber Z S, Van Dover C L, Niederman R A, et al, 2000. Bacterial photosynthesis in surface waters of the open Ocean. Nature, 407 (6801) : 177–179 DOI:10.1038/35025044 |
| Kolber Z S, Gerald F, Plumley, et al, 2001. Contribution of aerobic photoheterotrophic bacteria to the carbon cycle in the ocean. Science, 292 (5526) : 2492–2495 DOI:10.1126/science.1059707 |
| Labrenz M, Lawson P A, Tindall B J, et al, 2005. Roseisalinus antarcticus gen. nov., sp. nov., a novel aerobic bacteriochlorophyll a-producing α-proteobacterium isolated from hypersaline Ekho Lake, Antarctica. International Journal of Systematic and Evolutionary Microbiology, 55 (Pt 1) : 41–47 |
| Lanoil B D, Carlson C A, Giovannoni S J, 2000. Bacterial chromosomal painting for in situ monitoring of cultured marine bacteria. Environmental Microbiology, 2 (6) : 654–665 DOI:10.1046/j.1462-2920.2000.00148.x |
| Lehours A C, Cottrell M T, Dahan O, et al, 2010. Summer distribution and diversity of aerobic anoxygenic phototrophic bacteria in the Mediterranean Sea in relation to environmental variables. FEMS Microbiology Ecology, 74 (2) : 397–409 DOI:10.1111/fem.2010.74.issue-2 |
| Lehours A C, Jeanthon C, 2015. The hydrological context determines the beta-diversity of aerobic anoxygenic phototrophic bacteria in European Arctic seas but does not favor endemism. Frontiers in Microbiology, 6 : 638 |
| Lew S, Koblížek M, Lew M, 2015. Seasonal changes of microbial communities in two shallow peat bog lakes. Folia Microbiologica, 60 (2) : 165–175 DOI:10.1007/s12223-014-0352-0 |
| Lew S, Lew M, Koblížek M, 2016. Influence of selected environmental factors on the abundance of aerobic anoxygenic phototrophs in peat-bog lakes. Environmental Science and Pollution Research, 23 (14) : 13853–13863 DOI:10.1007/s11356-016-6521-8 |
| Lin X, Green S, Tfaily M M, et al, 2012. Microbial community structure and activity linked to contrasting biogeochemical gradients in bog and fen environments of the Glacial Lake Agassiz Peatland. Applied and Environmental Microbiology, 78 (19) : 7023–7031 DOI:10.1128/AEM.01750-12 |
| Losos J B, 1967. The theory of island biogeography. Bioscience, 18 (3) : 522–542 |
| Mašín M, Nedoma J, Pechar L, et al, 2008. Distribution of aerobic anoxygenic phototrophs in temperate freshwater systems. Environmental Microbiology, 10 (8) : 1988–1996 DOI:10.1111/emi.2008.10.issue-8 |
| Masín M, Zdun A, Ston-Egiert J, et al, 2006. Seasonal changes and diversity of aerobic anoxygenic phototrophs in the Baltic Sea. Aquatic Microbial Ecology, 45 (3) : 247–254 |
| McKew B A, Coulon F, Osborn A M, et al, 2007. Determining the identity and roles of oil-metabolizing marine bacteria from the Thames estuary, UK. Environmental Microbiology, 9 (1) : 165–176 DOI:10.1111/emi.2007.9.issue-1 |
| Moran M A, Miller W L, 2007. Resourceful heterotrophs make the most of light in the coastal ocean. Nature Reviews Microbiology, 5 (10) : 792–800 DOI:10.1038/nrmicro1746 |
| Nagashima K V P, Hiraishi A, Shimada K, et al, 1997. Horizontal transfer of genes coding for the photosynthetic reaction centers of purple bacteria. Journal of Molecular Evolution, 45 (2) : 131–136 DOI:10.1007/PL00006212 |
| Nuyanzina-Boldareva E N, Akimov V N, Takaichi S, et al, 2016. New strains of an aerobic anoxygenic phototrophic bacterium Porphyrobacter donghaensis isolated from a Siberian thermal spring and a weakly mineralized lake. Microbiology, 85 (1) : 77–86 DOI:10.1134/S0026261716010070 |
| Percent S F, Frischer M E, Vescio P A, et al, 2008. Bacterial community structure of acid-impacted lakes:what controls diversity?. Applied and Environmental Microbiology, 74 (6) : 1856–1868 DOI:10.1128/AEM.01719-07 |
| Pinhassi J, Berman T, 2003. Differential growth response of colony-forming α-and γ-Proteobacteria in dilution culture and nutrient addition experiments from Lake Kinneret(Israel), the eastern Mediterranean Sea, and the Gulf of Eilat. Applied and Environmental Microbiology, 69 (1) : 199–211 DOI:10.1128/AEM.69.1.199-211.2003 |
| Pinhassi J, Hagström Å, 2000. Seasonal succession in marine bacterioplankton. Aquatic Microbial Ecology,, 21 (3) : 245–256 |
| Poretsky R S, Bano N, Buchan A, et al, 2005. Analysis of microbial gene transcripts in environmental samples. Applied and Environmental Microbiology, 71 (7) : 4121–4126 DOI:10.1128/AEM.71.7.4121-4126.2005 |
| Rathgeber C, Beatty J T, Yurkov V, 2004. Aerobic phototrophic bacteria:new evidence for the diversity, ecological importance and applied potential of this previously overlooked group. Photosynthesis Research, 81 (2) : 113–128 DOI:10.1023/B:PRES.0000035036.49977.bc |
| Ritchie A E, Johnson Z I, 2012. Abundance and genetic diversity of aerobic anoxygenic phototrophic bacteria of coastal regions of the pacific ocean. Applied and Environmental Microbiology, 78 (8) : 2858–2866 DOI:10.1128/AEM.06268-11 |
| Sala M M, Peters F, Gasol J M, et al, 2002. Seasonal and spatial variations in the nutrient limitation of bacterioplankton growth in the northwestern Mediterranean. Aquatic Microbial Ecology, 27 : 47–56 DOI:10.3354/ame027047 |
| Salka I, Moulisová V, Koblížek M, et al, 2008. Abundance, depth distribution, and composition of aerobic bacteriochlorophyll a-producing bacteria in four basins of the central Baltic Sea. Applied and Environmental Microbiology, 74 (14) : 4398–4404 DOI:10.1128/AEM.02447-07 |
| Schloss P D, Westcott S L, Ryabin T, et al, 2009. Introducing mothur:open-source, platform-independent, communitysupported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 75 (23) : 7537–7541 DOI:10.1128/AEM.01541-09 |
| Schmidt T M, DeLong E F, Pace N R, 1991. Analysis of a marine picoplankton community by 16S rRNA gene cloning and sequencing. Journal of Bacteriology, 173 (14) : 4371–4378 DOI:10.1128/jb.173.14.4371-4378.1991 |
| Schwalbach M S, Fuhrman J A, 2005. Wide-ranging abundances of aerobic anoxygenic phototrophic bacteria in the world ocean revealed by epifluorescence microscopy and quantitative PCR. Limnology and Oceanography, 50 (2) : 620–628 DOI:10.4319/lo.2005.50.2.0620 |
| Shiba T, Simidu U, 1982. Erythrobacter longus gen. nov., sp. nov., an aerobic bacterium which contains bacteriochlorophyll a.International Journal of Systematic Bacteriology, 32 (2) : 211–217 |
| Suyama T, Shigematsu T, Takaichi S, et al, 1999. Roseateles depolymerans gen. nov., sp. nov., a new bacteriochlorophyll a-containing obligate aerobe belonging to the β-subclass of the Proteobacteria. International Journal of Systematic Bacteriology, 49 (Pt 2) : 449–457 |
| Teira E, Lekunberri I, Gasol J M, et al, 2007. Dynamics of the hydrocarbon-degrading Cycloclasticus bacteria during mesocosm-simulated oil spills. Environmental Microbiology, 9 (10) : 2551–2562 DOI:10.1111/emi.2007.9.issue-10 |
| Waidner L A, Kirchman D L, 2005. Aerobic anoxygenic photosynthesis genes and operons in uncultured bacteria in the Delaware River. Environmental Microbiology, 7 (12) : 1896–1908 DOI:10.1111/j.1462-2920.2005.00883.x |
| Waidner L A, Kirchman D L, 2007. Aerobic anoxygenic phototrophic bacteria attached to particles in turbid waters of the Delaware and Chesapeake estuaries. Applied and Environmental Microbiology, 73 (12) : 3936–3944 DOI:10.1128/AEM.00592-07 |
| Waidner L A, Kirchman D L, 2008. Diversity and distribution of ecotypes of the aerobic anoxygenic phototrophy gene pufM in the Delaware estuary. Applied and Environmental Microbiology, 74 (13) : 4012–4021 DOI:10.1128/AEM.02324-07 |
| Yurkov V, Beatty J T, 1998a. Isolation of aerobic anoxygenic photosynthetic bacteria from black smoker plume waters of the Juan de Fuca ridge in the pacific ocean. Applied and Environmental Microbiology, 64 (1) : 337–341 |
| Yurkov V V, Beatty J T, 1998b. Aerobic anoxygenic phototrophic bacteria. Microbiology and Molecular Biology Reviews:MMBR, 62 (3) : 695–724 |
| Yutin N, Suzuki M T, Béjà O, 2005. Novel primers reveal wider diversity among marine aerobic anoxygenic phototrophs. Applied and Environmental Microbiology, 71 (12) : 8958–8962 DOI:10.1128/AEM.71.12.8958-8962.2005 |
| Yutin N, Suzuki M T, Teeling H, et al, 2007. Assessing diversity and biogeography of aerobic anoxygenic phototrophic bacteria in surface waters of the Atlantic and Pacific Oceans using the Global Ocean Sampling expedition metagenomes. Environmental Microbiology, 9 (6) : 1464–1475 DOI:10.1111/emi.2007.9.issue-6 |
| Yutin N, Suzuki M T, Rosenberg M, et al, 2009. BchY-based degenerate primers target all types of anoxygenic photosynthetic bacteria in a single PCR. Applied and Environmental Microbiology, 75 (23) : 7556–7559 |
| Zeng Y X, Dong P Y, Qiao Z Y, et al, 2016. Diversity of the aerobic anoxygenic phototrophy gene pufM in Arctic and Antarctic coastal seawaters. Acta Oceanologica Sinica, 35 (6) : 68–77 DOI:10.1007/s13131-016-0877-y |
| Zeng Y H, Shen W, Jiao N Z, 2009. Genetic diversity of aerobic anoxygenic photosynthetic bacteria in open ocean surface waters and upper twilight zones. Marine Biology, 156 (3) : 425–437 DOI:10.1007/s00227-008-1095-8 |
| Zhang L, Gao G, Tang X M, et al, 2016. Pyrosequencing analysis of bacterial communities in Lake Bosten, a large brackish inland lake in the arid northwest of China. Canadian Journal of Microbiology, 62 (6) : 455–463 DOI:10.1139/cjm-2015-0494 |
| Zhang Y, Jiao N Z, 2007. Dynamics of aerobic anoxygenic phototrophic bacteria in the East China Sea. FEMS Microbiology Ecology, 61 (3) : 459–469 DOI:10.1111/fem.2007.61.issue-3 |
| Zheng Q, Liu Y, Steindler L, et al, 2015. Pyrosequencing analysis of aerobic anoxygenic phototrophic bacterial community structure in the oligotrophic western Pacific Ocean. FEMS Microbiology Letters, 362 (8) : fnv034 DOI:10.1093/femsle/fnv034 |
| Zohary T, Robarts R D, 1998. Experimental study of microbial P limitation in the eastern Mediterranean. Limnology and Oceanography, 43 (3) : 387–395 DOI:10.4319/lo.1998.43.3.0387 |
| Zweifel U L, Norrman B, Hagström Å, 1993. Consumption of dissolved organic carbon by marine bacteria and demand for inorganic nutrients. Marine Ecology Progress Series, 101 (1-2) : 23–32 |
 2017, Vol. 48
2017, Vol. 48


