中国海洋湖沼学会主办。
文章信息
- 冯建祥, 宁存鑫, 朱小山, 林光辉. 2017.
- FENG Jian-Xiang, NING Cun-Xin, ZHU Xiao-Shan, LIN Guang-Hui. 2017.
- 福建漳江口本土红树植物秋茄替代互花米草生态修复效果定量评价
- ECOLOGICAL RESTORATION BY NATIVE-INVASIVE SPECIES REPLACEMENT FOR MANGROVE WETLANDS IN ZHANGJIANG RIVER ESTUARY, FUJIAN
- 海洋与湖沼, 48(2): 266-275
- Oceanologia et Limnologia Sinica, 48(2): 266-275.
- http://dx.doi.org/10.11693/hyhz20160800168
-
文章历史
- 收稿日期:2016-08-08
- 收修改稿日期:2016-10-26
2. 中山大学生命科学学院 广州 510275;
3. 哈尔滨工业大学深圳研究生院土木环境与工程学院 深圳 518055;
4. 清华大学地球系统科学系 北京 100084
2. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, China;
3. School of Civil and Environmental Engineering, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China;
4. Department of Earth System Science, Tsinghua University, Beijing 100084, China
滨海湿地在全球生物地球化学循环中扮演着重要的角色, 同时也承载着丰富的生物多样性和复杂的生态系统服务功能 (Gedan et al, 2009)。因位于海陆交错地带, 滨海湿地是脆弱的生态敏感区 (张晓龙等, 2005), 承受着来自人类活动以及全球环境变化的双重威胁, 不仅导致其面积下降, 生态系统功能也逐渐退化 (Comeaux et al, 2012)。因此, 加强对滨海湿地的保护和已退化滨海湿地的生态修复成为当务之急, 也是当前生态学研究的热点问题 (Spencer et al, 2012)。我国已开展了大量的滨海湿地修复工程 (张悦等, 2013), 然而, 多数生态修复工程完成后, 由于缺乏后续资金投入和人员管理, 导致项目结束便陷入停滞。而且湿地修复中, 其生物多样性和物质循环等生态功能的恢复本身就是一个漫长的过程 (Moreno-Mateos et al, 2012), 而修复的主要目的是使其具有与自然湿地相近的动植物群落结构以及生态服务功能, 因此, 为更科学而有效的管理和修复滨海湿地, 亟需在生态系统层面对已修复滨海湿地的结构和功能进行长期监测。
红树林湿地是位于热带亚热带地区的滨海木本植物群落, 具有重要的生态服务价值 (Alongi, 2014)。近年来, 红树林不仅受到水产养殖、围海造田和生态旅游等人为活动的严重干扰, 还逐渐被入侵种互花米草 (Spartina alterniflora) 所威胁 (Zhang et al, 2012)。利用本土红树植物, 结合物理手段对互花米草进行生态替代, 以抑制互花米草生长和扩张, 恢复原有生境, 可作为互花米草治理的重要手段 (Feng et al, 2014)。而本土红树植物替代互花米草后, 其生物群落结构及物质循环和能量流动等功能特征是否得到修复, 则需要后续的监测和评价。本文在整合生态系统层面指标因子的基础上, 借鉴美国滨海湿地生态系统健康评价方法—快速评价法 (rapid assessment method, RAMs)(Stein et al, 2009), 建立了基于灰色聚类分析的滨海湿地生态修复综合评价方法, 并对福建云霄漳江口的本土红树植物替代入侵种互花米草样地的生态修复效果进行了评价。
1 材料与方法 1.1 研究地点本研究地点位于福建云霄 (23°55.719′N, 117°26.436′E), 地处漳江入海口, 毗邻漳江口红树林国家级自然保护区, 该地区为不规则半日潮, 年平均气温为22.2℃, 年平均降水量为1871.2mm。2010年10月开展了“刈割+高程抬高+本土红树植物替代”的方法防控互花米草, 选取物种为秋茄 (Kandelia obovata), 实施面积为14.7hm2 (4年秋茄种植样地, PKO)。在临近工程样地500m处, 存在左右的面积约为1hm2秋茄替代互花米草修复区 (15年秋茄种植样地, DKO), 约种植于2000年。同时选取修复样地周边未处理的互花米草群落做为负向对照样地 (互花米草群落, SA), 选取红树林保护区的至少50年历史的原生天然秋茄林作为正向对照样地 (天然秋茄林, NKO) (图 1)。
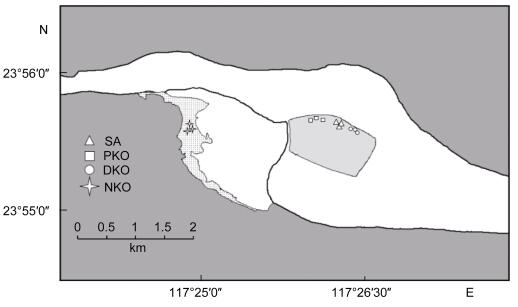 |
| 图 1 福建云霄漳江口红树林替代互花米草生态修复样地示意图 Fig. 1 Sampling sites in mangrove wetlands after replacing S. alterniflora with native K. obovata in Zhangjiang River estuary, Yunxiao, Fujian 注: SA:互花米草; PKO: 4年秋茄种植样地; DKO: 15年秋茄种植样地; NKO:天然秋茄林样地 |
对滨海湿地修复效果进行评价, 首先要明确该修复工程的原初目标、待修复湿地的结构和功能特征以及最显著的退化问题 (黄海萍等, 2015)。本文生态修复目标是利用本土红树植物抑制互花米草生长, 并逐渐修复红树林特有的结构和功能, 成为较为健康的生态系统。因此, 筛选出如下适宜指标对该类型滨海湿地修复进行评价 (表 1):
| 目标层 | 对象层 | 指标层 |
| 生物群落结构 (C) | 植物群落 | 互花米草生物量 (C1)、红树植物高度 (C2)、基径 (C3) |
| 动物群落 | 丰度 (C4)、生物量 (C5)、Shannon-wiener多样性指数 (C6) | |
| 非生物环境质量 (E) | 沉积物 | 有机碳 (E1)、总氮 (E2)、总磷 (E3) |
| 生态系统功能 (F) | 碳库功能 | 植物生物量 (F1)、沉积物碳库 (F2) |
| 食物网支持功能 | 特征动物食物来源比例 (F3) |
植物群落的调查开展于2014年08月, 于互花米草群落中选择50cm×50cm小样方, 刈割地上部分, 烘干后称量干重得到负向对照样地互花米草生物量。修复样地 (PKO、DKO) 和正向对照样地 (NKO) 内, 选择10m×10m的样方, 测量样方内每棵植株的基径、高度、胸径等。
底栖动物采样于各样地内均设三条样线, 每条样线隔200m设一个取样点, 每个样点上挖取25cm×25cm面积内, 深度为20cm的底泥, 用500μm的筛网淘洗底泥, 获取滞留在筛网上的大型底栖动物样品, 利用4%的甲醛固定后, 送至国家海洋局第三海洋研究所底栖动物实验室, 进行大型底栖动物鉴定, 计数和称重, 获取物种, 丰度和生物量数据, 计算Shannon-Wiener指数。
1.2.2 非生物环境质量特征本文选取单因子污染指数法对湿地沉积物生源要素健康风险进行评价:
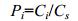 (1)
(1)其中, Pi为单项指标的评价指数, Ci为评价因子i的实测值, 而Cs则为评价因子i的评价标准值。本文采用加拿大安大略省制定的环境质量评价标准 (李任伟, 1998), 稍作修改, 以能引起最低级别生态风险的总有机碳 (TOC, 1%)、总氮 (TN, 550mg/kg) 和总磷 (TP, 600mg/kg) 含量为标准, 根据Pi得分大小, 将评价区域的健康风险划分为五个级别: Ⅰ级表示非常清洁, 即0 < PTOC < 0.5, 0 < PTN < 0.5, 0 < PTP < 0.25;Ⅱ级表示清洁, 即0.5≤PTOC < 1, 0.5≤PTN < 1, 0.25≤PTP < 0.5; Ⅲ级表示轻度污染, 即1≤PTOC < 5, 1≤PTN < 2, 0.5≤PTP < 1, Ⅳ级表示中度污染, 即5≤PTOC < 10, 1≤PTN < 3, 1≤PTP < 1.5; V级表示重度污染, 即PTOC≥10, PTN≥3, PTP≥1.5。
1.2.3 生态系统功能特征红树林植被生物量基于植被群落调查得到的红树高度、基径和胸径数据, 利用如下的异速生长方程方法进行计算 (Tam et al, 1998):
 (2)
(2)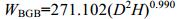 (3)
(3)其中, WAGB和WBGB分别为地上生物量和地下生物量, D为红树植物胸径, H为红树植物高度。
土壤碳库则通过采集0—60cm范围内的沉积物, 将其分为0—10cm, 10—20cm, 20—40cm, 40—60cm四层, 研磨后利用1mol/L的稀盐酸去除土壤无机碳, 用Elementar Macrocube元素分析仪分析土壤TOC含量, 计算0—60cm土壤总碳库:
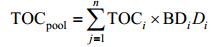 (4)
(4)其中, TOCpool为0—60cm内土壤总碳库, TOCi为第i层的土壤有机碳含量, BDi为第i层的土壤容重 (Bulk density), Di为第i层土壤的深度。
底栖动物食物源贡献比例, 通过测定各食物源 (互花米草、秋茄、底栖微藻SOM及浮游微藻POM) 和所选取的底栖动物的碳稳定同位素 (δ13C), 利用稳定同位素溯源软件MixSIR计算得到。
1.2.4 湿地生态修复评价标准及评分确定评价指标后, 对各评价指标进行分等级并赋予得分。生物群落结构和生态系统功能指标 (表 1) 等级划分, 以正向或负向对照样地状态为标准, 计算修复比例 (restoration ratio, RR), 表示如下:
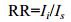 (5)
(5)其中, Ii为修复样地指标i的值, 而Is则为对照样地指标i的值, 递增型指标红树植物高度 (C2)、红树植物基径 (C3)、底栖动物丰度 (C4)、底栖动物生物量 (C5)、底栖动物Shannon-wiener多样性指数 (C6)、植物生物量 (F1)、沉积物碳库 (F2) 和特征动物食物来源比例 (F3) 以正向对照样地NKO进行计算, 而递减型指标互花米草生物量 (C1) 则以负向对照样地SA进行计算。
根据计算所得修复比例, 划分如下等级并予以赋分, 递增性指标等级为0≤RR < 25、25≤RR < 50、50≤RR < 75、75≤RR < 95、95≤RR < 100, 对应得分分别为0、1、2、3、4。递减型指标等级为100≥RR > 75、75≥RR > 50、50≥RR > 25、25≥RR > 5、5≥RR > 0, 对应得分分别为0、1、2、3、4。
对于非生物环境质量指标, 根据单因子污染指数以及等级划分, 分别对重度污染Ⅴ级、中度污染Ⅳ级、轻度污染Ⅲ级、清洁Ⅱ级和非常清洁Ⅰ级赋予得分, 分别为0、1、2、3、4。
完成等级划分后, 借鉴灰色聚类法中灰色白化权函数描述各指标等级分界界限, 确定某一指标对相应等级的隶属度 (周林飞等, 2007):
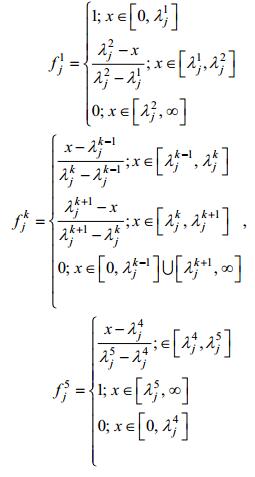 (6)
(6)其中, x为待评价指标值, fjk表示第j个指标被划分为第k个灰类的白化权函数, λjk则表示指标j的k级界限。
利用白化权函数对某一特定指标对不同等级类别的隶属度进行计算, 然后将隶属度得分化, 计算该指标的修复效果评分 (restoration score, RS):
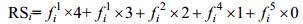 (7)
(7)RSi为指标i的修复效果评分, 为指标i对不同等级的隶属度。
在获得所有指标的修复效果评分之后, 采用如下步骤获得生态系统层次的最终生态修复效果评分 (ecosystem-level restoration score, ERS)。首先, 将每个对象层中所有指标的修复效果评分相加, 然后除以该对象层指标数目, 获取对象层修复效果评分。因滨海湿地生态修复评价中, 每个指标类别都具有相似的生态重要性, 在评价中应被赋予相同的权重 (Stein et al, 2009, Staszak et al, 2012), 因此, 最终生态修复效果评分按公式 (8) 获得:
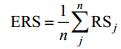 (8)
(8)其中, RSj为第j类对象层的修复效果评分, n为对象层的数目, 本研究RSj包括RSC (生物群落结构层)、RSE (非生物环境质量层) 和RSF (生态系统功能层) 三类。
采用等间距法, 按最大可能总得分4分的20%、40%、60%、80%, 将最终生态修复效果评分划分为五个等级, 其代表的意义如表 2。
| 生态修复效果评价等级 | 最终生态修复评价得分ERS | 生态修复状况描述 |
| 优 | 3.2 < ERS≤4 | 滨海湿地生态修复效果显著, 生态系统达到与自然湿地相当的水平 |
| 良 | 2.4 < ERS≤3.2 | 滨海湿地生态修复效果较为显著, 生态系统状况有所改善, 略逊于自然湿地 |
| 中 | 1.6 < ERS≤2.4 | 滨海湿地生态修复效果有改善, 生态系统状况距自然湿地还有较大差距 |
| 差 | 0.8 < ERS≤1.6 | 滨海湿地生态修复效果改善不明显, 生态系统状况略优于修复前 |
| 劣 | 0≤ERS≤0.8 | 滨海湿地生态修复效果无改善, 生态系统状况与修复前类似 |
自2013年8月—2014年8月, 每半年一次的监测结果显示, PKO样地内秋茄的高度和基径逐渐增大 (图 2), 且样地内未发现互花米草, 表明高密度种植红树秋茄幼苗短期内形成郁闭的红树植物群落,
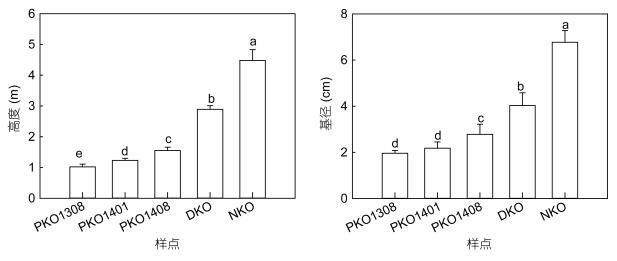 |
| 图 2 秋茄植物高度和基径随修复的变化及其与原生秋茄的比较 Fig. 2 Comparison of height and basal diameter of K. obovata during the restoration 注: PKO1308, PKO1401, PKO1408分别代表PKO样地生长指标于2013年8月, 2014年1月, 2014年8月测量; DKO和NKO为2014年8月测量 |
可成功抑制互花米草生长。2014年8月的调查结果显示, DKO内秋茄高度和基径显著高于PKO, 但依旧显著低于NKO样地 (P < 0.01)。
对于大型底栖动物群落结构特征, 相比修复前互花米草样地SA和天然秋茄样地NKO, 两个修复样地PKO和DKO内大型底栖动物的总丰度与之都不存在显著差异 (P > 0.05, 图 3), 但就平均值而言, 平均总丰度随着修复而逐渐增大; PKO和DKO的总生物量均显著低于SA和NKO (P < 0.05), 而前二者之间和后二者之间均不存在显著差异 (P > 0.05)。四个样地之间大型底栖动物的Shannon-Wiener指数之间差异均不显著。
 |
| 图 3 大型底栖动物群落总丰度、总生物量及Shannon-wiener多样性指数随修复的变化及其与原生红树林的比较 Fig. 3 Comparisonin total density, total biomass, and Shannon-wiener index for benthic macfaunal community under restoration. |
种植前期幼苗阶段, 秋茄生长速度较快, 修复4年后高度和基径的修复比例分别达到34.71%±1.25%和41.07%±3.24%(图 4)。随着修复的进行, 秋茄生长速度逐渐变缓, 修复时间约15年的DKO样地内, 秋茄高度和基径的修复比例仅为64.43%±1.37%和68.31%±11.95%, 这表明作为木本红树植物生长和修复较为缓慢。对于底栖动物群落结构特征, 其修复比例变动较大, 而且PKO与DKO之间差异不显著 (图 4)。
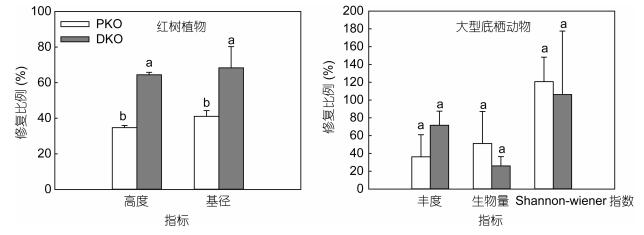 |
| 图 4 修复样地内红树植物群落特征修复比例和大型底栖动物群落结构特征修复比例 Fig. 4 Restoration ratios of community structure characteristics of mangrove and benthic macarofauna |
互花米草被秋茄替代后, 表层沉积物TOC和TN含量均会显著下降, 而两个修复样地之间TOC和TN含量不存在显著差异, NKO样地具有最高的TOC和TN含量 (P < 0.05)。TN含量在各样点之间差异不显著 (P > 0.05)。表层沉积物生源要素生态风险评价结果显示 (表 3), NKO和SA内沉积物严重受到氮污染, 均处于重度污染水平。除PKO和DKO内TOC生态风险等级为清洁外, SA和NKP样地的TOC生态风险等级和所有样地TN的风险等级均为轻度污染, 表明漳江口地区湿地沉积物已受到有机碳污染, 虽然多数仍处在生物尚可承受的范围, 但若红树林内沉积物碳含量进一步增大TOC污染则会有进一步升级的风险。
| 样地 | 含量 | 污染指数 | 生态风险等级 | |
| 有机碳TOC | SA | 1.54±0.06 | 1.54±0.06 | 轻度污染 |
| (%) | PKO | 0.85±0.04 | 0.85±0.04 | 清洁 |
| DKO | 0.94±0.04 | 0.94±0.04 | 清洁 | |
| NKO | 2.10±0.11 | 2.10±0.11 | 轻度污染 | |
| 总氮TN | SA | 1800.00±70.71 | 3.27±0.13 | 重度污染 |
| (mg/kg) | PKO | 1075.00±25.00 | 1.95±0.05 | 轻度污染 |
| DKO | 1075.00±47.87 | 1.95±0.09 | 轻度污染 | |
| NKO | 1666.67±23.57 | 3.03±0.04 | 重度污染 | |
| 总磷TP | SA | 519.18±23.02 | 0.87±0.04 | 轻度污染 |
| (mg/kg) | PKO | 396.39±116.30 | 0.66±0.19 | 轻度污染 |
| DKO | 479.98±11.96 | 0.80±0.02 | 轻度污染 | |
| NKO | 551.18±32.03 | 0.92±0.05 | 轻度污染 |
秋茄的生物量随湿地修复逐渐增大, 按顺序递增PKO < DKO < NKO (P < 0.05, 图 5), PKO和DKO秋茄生物量的修复比例分别为3.81%±0.55%和27.57%± 2.01%, 均处在相当低的水平, 再次表明红树植物秋茄群落修复的缓慢性。
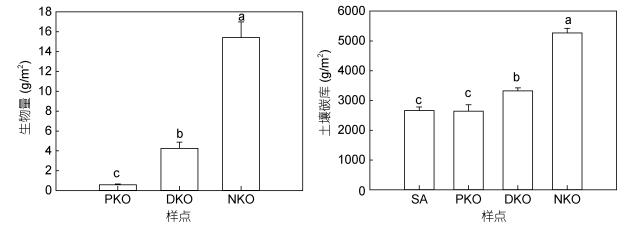 |
| 图 5 秋茄生物量以及各样地土壤碳库随湿地修复的变化 Fig. 5 Comparisonin biomass of K. obovata and organic carbon pool in soil during restoration |
互花米草被去除后表层土壤碳含量表现出下降的趋势, 但其土壤碳库并未下降, 即SA和PKO土壤碳库差异不显著。而随修复进行, 湿地土壤碳库有所增大, 导致DKO土壤碳库显著高于PKO, 但依旧显著低于天然秋茄NKO样地土壤碳库 (P < 0.05)。PKO和DKO土壤碳库的修复比例分别为50.14%±4.04%和63.05%±2.01%, 土壤碳库修复比例明显高于生物量的修复比例。
2.4 湿地食物网功能如图 6所示, 互花米草入侵后, SA内底栖蟹类和螺类的食物有机碳源几乎完全转变为以互花米草为主, 其平均贡献率在80%以上, 对褶痕相手蟹 (Sesarma plicata) 的贡献率甚至达到100%。而PKO内, 互花米草对两种底栖动物的食物有机碳贡献率并未下降, 对珠带拟蟹守螺 (Cerithidea cingulata) 的贡献比例反而出现上升, 达到98%。但随着修复时间的增长, 红树植物秋茄的凋落物产量和地下生物量会逐渐增大, 使得互花米草对底栖动物食物源的贡献度呈现下降趋势, DKO内互花米草对两种底栖动物的平均贡献度分别下降到28.3%和49.5%, 但与NKO相比存在较大差距。
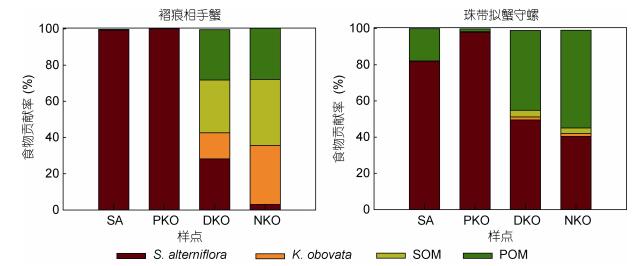 |
| 图 6 各样地内大型底栖动物褶痕相手蟹 (Sesarma plicata) 和珠带拟蟹守螺 (Cerithidea cingulate) 食物有机碳贡献率 Fig. 6 Contribution of different food organic carbon sources to crab Sesarma plicata and gastropod Cerithidea cingulate 注:食物有机碳源包括互花米草S. alterniflora、秋茄K. obovata、表层沉积物SOM和水体颗粒有机物POM |
湿地生态修复效果最终评分显示 (表 4), PKO和DKO的评分等级分别为“差”和“中”, 其生物群落结构得分都超过2.4, 达到了“良”的级别; 而PKO因修复时间短, 红树植物高度和基径得分较低, 但两样地底栖动物Shannon-wiener多样性指数得分别达到了“优”和“良”的级别。非生物环境质量方面, 两个修复样地得分均较低, 处于“差”的等级, 这与整个漳江口红树林生态系统受到了氮和磷污染威胁有关。生态系统功能方面, PKO样地因植被生物量和食物网功能修复比例低, 处于“劣”的等级, 而DKO食物网功能指标修复比例高, 达到了“优”的级别, 因此生态系统功能评分接近“良”的水平。以上结果表明, 从替代互花米草的角度, 该类型湿地生态修复达到了目的, 但是从生态系统层次进行评价, 即使如DKO样地经过了十余年的修复, 与天然红树林生态系统依旧存在很大差距, 木本红树林生态系统修复具有缓慢性和长期性的特点。
| 样点 | 对象层指标 | 单项指标评分 | 对象层评分 | 最终评分 | |||||
| PKO | 生物群落结构C | C1 | C2 | C3 | C4 | C5 | C6 | 2.4 | 1.57 |
| 4 | 1.39 | 1.64 | 1.61 | 2 | 3.77 | ||||
| 非生物环境质量E | E1 3.08 |
E2 0.56 |
E3 1 |
1.55 | |||||
| 生态系统功能F | F1 0.15 |
F2 2.01 |
F3 0.1 |
0.75 | |||||
| DKO | 生物群落结构C | C1 | C2 | C3 | C4 | C5 | C6 | 2.67 | 2.18 |
| 4 | 2.58 | 2.38 | 2.90 | 1.04 | 3.13 | ||||
| 非生物环境质量E | E1 3.16 |
E2 0.56 |
E3 0.9 |
1.54 | |||||
| 生态系统功能F | F1 1.1 |
F2 2.52 |
F3 3.35 |
2.32 | |||||
互花米草作为世界上最成功入侵物种之一, 近年来已成功侵入中国东南沿海红树林生态系统, 并被认为会对红树幼苗的更新和生长造成负面影响 (Zhang et al, 2012, 黄冠闽等, 2013), 因而有必要对互花米草进行防治和管理。为避免化学方法带来的二次污染, 结合物理手段, 对互花米草进行生态替代是抑制其生长和扩散的一个重要手段 (Feng et al, 2014, Zhou et al, 2015)。唐龙 (2008)探讨了采用刈割、淹水和芦苇替代综合途径治理互花米草的可行性, 并有效恢复了本土芦苇植被。在红树林区, Zhou等 (2015)发现无瓣海桑种植可有效抑制互花米草滋生和蔓延, 然而同样作为外来种的无瓣海桑可能会引入新的物种入侵风险。因此本研究探讨了利用本土红树植物秋茄对互花米草进行替代和治理的有效性, 并对其生态修复效果进行了定量评价。
3.1 红树植物群落修复本研究中, 修复样地PKO内互花米草通过刈割方式的去除, 然后高密度 (株距选择为25cm×25cm) 扦插胚轴培植秋茄幼苗。黄冠闽等 (2013)发现, 秋茄幼苗会因互花米草遮阴而生长缓慢, 进而由于互花米草倒伏而导致秋茄幼苗死亡。红树植物生长较为缓慢, 互花米草残存的地下根茎一旦萌发重新生长, 形成的遮阴势必会抑制秋茄幼苗的生长。因此, 秋茄幼苗种植前期, 需要投入较多的人力对修复样地进行维护和管理, 定期刈割去除互花米草排除影响, 高密度种植也是为促使秋茄能够占据生态位空间, 而一旦红树植物形成郁闭群落, 互花米草的生长和扩散将受到抑制 (Zhang et al, 2012)。PKO修复样地中, 秋茄经过4年的生长, 高度已达1.55m, 虽与天然秋茄林相比修复比例仅为34.7%, 评分处于“差”的等级, 但其群落中已无互花米草生长, 达到了抑制入侵种并恢复本土植被群落的修复目的。修复时间约15年的DKO样地, 在红树植物生长指标方面与天然秋茄林NKO依旧存在较大差距, 表明作为唯一生长在滨海潮间带的木本植物, 红树林群落的修复比较缓慢。
3.2 红树林内底栖动物群落修复大型底栖动物因其定居习性以及对环境变化的敏感性, 可以作为潮间带重要生态过程的指示物, 而滨海湿地植被群落的改变势必会对底栖动物群落结构造成影响, 但互花米草入侵后底栖动物群落如何响应当前尚无一致的结论 (Chen et al, 2009)。本研究中, 不同样地之间底栖动物Shannon-Wiener指数不存在显著差异, 总丰度平均值在互花米草被去除后呈现先下降后上升的趋势, 但差异性也不显著。两个修复样地内底栖动物生物量比较天然秋茄林和互花米草均相对较低, 可能原因是修复样地内优势腹足类由大个体的查加拟蟹守螺转变为小个体的短拟沼螺所致 (Feng et al, 2014), 即修复工程开展过程中物理干扰和红树植物种植导致的生境变化, 为底栖动物提供了新的栖息空间和食物源, 会给某些机会主义物种带来生存契机。修复样地和对照天然秋茄林之间多样性水平相近, 导致PKO和DKO在该项评分都达到“优”的等级, 但由于大型底栖动物采样中的局限性, 可能会低估某些运动能力强的蟹类如相手蟹类和某些树栖性螺类如滨螺等在红树林生态修复效果评价中的作用, 而底栖蟹类高多样性是红树林健康状态的重要指示 (Ashton et al, 2003), 因此, 在本文所选取的底栖动物群落指标之外, 在将来的工作中, 适当筛选特征物种如相手蟹类作为评价指标可能更为准确合理。
3.3 漳江口红树林湿地生源要素生态风险PKO和DKO样地非生物环境质量特征评分均较低, 处于“差”的等级, 表明二者沉积物存在一定污染, 具有潜在的生态风险。从沉积物单因子污染指数看, 漳江口滨海湿地, 除PKO和DKO样地TOC为评分等级为“清洁”外, 其他样地各个指标均超出正常范围, 尤其是SA和NKO样地的TN已达到重度污染级别, 表明漳江口红树林湿地和入侵后形成的互花米草湿地均受到了较严重的氮污染。湿地沉积物内氮素主要来源于动植物残体归还以及外源氮的输入, 除互花米草和红树林群落内自身凋落物输入外, 漳江口湿地周边大量水产养殖池塘养殖废水和清淤沉积物的排放, 也可能是导致其氮污染严重的重要原因。互花米草群落沉积物氮污染指数评分最高, Peng等 (2011)在崇明东滩的研究发现互花米草会通过从潮水中吸收无机氮而提升沉积物内无机氮含量, 这可能也是漳江口互花米草沉积物氮污染较为严重的原因。互花米草入侵和定居会增大滨海湿地沉积物氮污染风险, 而红树替代互花米草会在一定程度上缓解这一趋势, 从而利于滨海湿地生态系统健康维持。
3.4 红树林湿地生态系统功能修复滨海湿地生态修复中, 生态系统结构尤其是植被群落结构的修复效果最受关注, 而生态系统功能指标如湿地对食物网的支持功能同样应该予以考虑。红树林湿地具有相当高的初级生产力和丰富的沉积物碳储量, 同时为大量滨海水生动物提供庇护和栖居场所, 也成为滨海生态系统复杂食物网的重要能量基础 (Alongi, 2014; Feng et al, 2014)。互花米草的生长为其群落内的底栖动物提供了食物来源, 但也显著限制了其他高质量食物源如底栖微藻的能量供应, 大大降低了底栖动物食物源多样性水平, 不利于食物网稳定性 (Howe et al, 2011)。生态修复开展初期, 由于互花米草生物量残体的存在以及周边互花米草来源物质输入的影响, 底栖动物食物有机碳源并未发生变化, 依旧以互花米草为主。而随着红树植物的生长和互花米草来源物质输入的下降, 底栖动物的食物源已逐渐修复, 本土食物有机碳源如微藻类物质等的贡献水平增大, 提高了底栖动物食物源多样性水平, DKO样地的食物网功能评分已达到“优”的等级。
与食物网功能高评分相反, DKO碳库功能得分依旧较低, 这说明红树植物的生长和湿地土壤碳库的积累是缓慢而漫长的过程。Moreno-Mateos等 (2012)综述了湿地生态修复工程开展多年以后, 生物群落结构尤其是植物群落以及以碳为代表的生源要素的变化, 发现即便是生态修复实施几十年后, 修复湿地这两个方面与原生湿地差距依旧明显。湿地生态修复中生态系统功能指标的恢复具有缓慢性, 这提醒我们要加强现有湿地的保护和管理, 尤其对于受互花米草入侵威胁的滨海湿地生态系统, 更要提高警惕, 预防为主, 及时发现, 尽早处理, 以避免互花米草对本土生物群落和生态系统功能产生危害。
滨海湿地类型复杂多样, 通常评价指标应该根据待评价湿地的特点以及退化的原因和修复的目标, 并遵循科学性、合理性以及可操作性等原则进行筛选 (张悦等, 2013), 同时应该注重评价指标的全面性和整体性。红树林生态系统具有复杂的生境异质性、丰富的生物多样性和多样的生态系统服务功能 (Alongi, 2014)。本文在滨海红树林湿地修复评价指标和方法方面做了探索, 但所选取的指标显然不能全面反映红树林湿地生态系统结构和功能修复状况, 因此, 将来的工作中需要予以改进, 增加诸如微生物群落结构变化和红树林防风消浪生态功能等指标, 以提升评价结果的准确性和可信度。
4 结论本文针对互花米草对红树林生态系统的入侵和修复状况, 构建了相应的滨海湿地生态修复效果的评价指标体系, 并基于灰色聚类分析对各单项指标进行了分值量化, 实现了在生态系统层面对滨海湿地生态修复效果的快速评价。对福建云霄漳江口本土红树植物秋茄替代互花米草生态修复样地的评价显示, 利用本土红树植物可以有效抑制互花米草生长, 并促进本土植被群落和底栖动物多样性的恢复, 但工程实施前期管理维护是修复工作成功的重要保证, 从而需要在修复过程中投入大量的人力物力。而且由于红树林自身生长特性, 其植物群落结构和生态系统功能的修复均较为缓慢, 可能需要数十年时间才能达到原生天然红树林湿地的水平。因此, 当前中国滨海红树林湿地对互花米草的管理中, 预防入侵仍是关键, 而对入侵后的治理方式, 我们建议采取物理手段结合本土红树植物替代的综合治理措施, 尽量降低对湿地结构和功能的破坏。而从环境质量评价指标的角度, 当前漳江口红树林生态系统, 尤其是被入侵种互花米草所占据的区域, 面临着氮、磷污染的生态风险, 尤其是氮的污染达到“重度污染”等级, 因此在加强湿地资源保护, 推进湿地修复工作开展的同时, 也要合理规划红树林湿地周边养殖产业发展, 控制漳江上游工农业和生活污染物质的排放, 以降低对漳江口红树林湿地的环境威胁, 维护滨海湿地生态系统健康。
致谢 感谢漳江口红树林自然保护区黄冠闽和吴秋城在采样过程中的协助; 感谢国家海洋局第三海洋研究所江锦祥研究员对大型底栖动物鉴定和分析提供的帮助。| 李任伟, 1998. 沉积物污染和环境沉积学. 地球科学进展, 13(4): 398–40 |
| 张悦, 刘长安, 宋永刚, 等, 2013. 滨海湿地植物修复效果监测与评价方法研究. 海洋环境科学, 32(4): 544–54 |
| 张晓龙, 李培英, 李萍, 等, 2005. 中国滨海湿地研究现状与展望. 海洋科学进展, 23(1): 87–9 |
| 周林飞, 许士国, 孙万光, 2007. 基于灰色聚类法的扎龙湿地水环境质量综合评价. 大连理工大学学报, 47(2): 240–24 |
| 唐龙, 2008. 刈割、淹水及芦苇替代综合控制互花米草的生态学机理研究. 上海: 复旦大学博士学位论文, 50-5. |
| 黄冠闽, 张宜辉, 方柏州, 等, 2013. 互花米草对红树植物秋茄幼苗更新的影响. 福建林业科技, 40(4): 93–95 |
| 黄海萍, 陈彬, 俞炜炜, 等, 2015. 厦门五缘湾滨海湿地生态恢复成效评估. 应用海洋学学报, 34(4): 501–50 |
| Alongi D M, 2014. Carbon cycling and storage in mangrove forests. Annual Review of Marine Science, 6: 195–21 DOI:10.1146/annurev-marine-010213-135020 |
| Ashton E C, Hogarth P J, Macintosh D J, 2003. A comparison of brachyuran crab community structure at four mangrove locations under different management systems along the Melaka Straits-Andaman sea coast of Malaysia and Thailand. Estuaries, 26(6): 1461–147 DOI:10.1007/BF02803654 |
| Chen Z B, Guo L, Jin B S, et al, 2009. Effect of the exotic plant Spartina alterniflora on macrobenthos communities in salt marshes of the Yangtze River Estuary, China. Estuarine, Coastal and Shelf Science, 82(2): 265–27 DOI:10.1016/j.ecss.2009.01.014 |
| Comeaux R S, Allison M A, Bianchi T S, 2012. Mangrove expansion in the Gulf of Mexico with climate change:implications for wetland health and resistance to rising sea levels. Estuarine, Coastal and Shelf Science, 96: 81–9 DOI:10.1016/j.ecss.2011.10.003 |
| Feng J X, Guo J M, Huang Q, et al, 2014. Changes in the community structure and diet of benthic Macrofauna in invasive Spartina alterniflora wetlands following restoration with native mangroves. Wetlands, 34(4): 673–68 DOI:10.1007/s13157-014-0533-2 |
| Gedan K B, Silliman B R, Bertness M D, 2009. Centuries of human-driven change in salt marsh ecosystems. Annual Review of Marine Science, 1: 117–14 DOI:10.1146/annurev.marine.010908.163930 |
| Howe E R, Simenstad C A, 2011. Isotopic determination of food web origins in restoring and ancient estuarine wetlands of the San Francisco Bay and Delta. Estuaries and Coasts, 34(3): 597–61 DOI:10.1007/s12237-011-9376-8 |
| Moreno-Mateos D, Power M E, Comín F A, et al, 2012. Structural and functional loss in restored wetland ecosystems. PLoS Biology, 10(1): e100124 |
| Peng R H, Fang C M, Li B, et al, 2011. Spartina alterniflora invasion increases soil inorganic nitrogen pools through interactions with tidal subsidies in the Yangtze Estuary, China. Oecologia, 165(3): 797–80 DOI:10.1007/s00442-010-1887-7 |
| Spencer K L, Harvey G L, 2012. Understanding system disturbance and ecosystem services in restored saltmarshes:integrating physical and biogeochemical processes. Estuarine, Coastal and Shelf Science, 106: 23–3 DOI:10.1016/j.ecss.2012.04.020 |
| Staszak L A, Armitage A R, 2012. Evaluating salt marsh restoration success with an index of ecosystem integrity. Journal of Coastal Research, 29(2): 410–41 |
| Stein E D, Fetscher A E, Clark R P, et al, 2009. Validation of a wetland rapid assessment method:use of EPA's level 1-2-3 framework for method testing and refinement. Wetlands, 29(2): 648–66 DOI:10.1672/07-239.1 |
| Tam N F Y, Wong Y S, Lan C Y, et al, 1998. Litter production and decomposition in a subtropical mangrove swamp receiving wastewater. Journal of Experimental Marine Biology and Ecology, 226(1): 1–1 DOI:10.1016/S0022-0981(97)00233-5 |
| Zhang Y H, Huang G M, Wang W Q, et al, 2012. Interactions between mangroves and exotic Spartina in an anthropogenically disturbed estuary in southern China. Ecology, 93(3): 588–597 DOI:10.1890/11-1302.1 |
| Zhou T, Liu S C, Feng Z L, et al, 2015. Use of exotic plants to control Spartina alterniflora invasion and promote mangrove restoration. Scientific Reports, 5: 12980 DOI:10.1038/srep12980 |
 2017, Vol. 48
2017, Vol. 48


