中国海洋湖沼学会主办。
文章信息
- 王涛, 李琪. 2017.
- WANG Tao, LI Qi. 2017.
- 不同盐度和温度对熊本牡蛎 (Crassostrea sikamea) 稚贝生长与存活的影响
- EFFECTS OF SALINITY AND TEMPERATURE ON GROWTH AND SURVIVAL OF JUVENILE OF KUMAMOTO OYSTER (CRASSOSTREA SIKAMEA)
- 海洋与湖沼, 48(2): 297-302
- Oceanologia et Limnologia Sinica, 48(2): 297-302.
- http://dx.doi.org/10.11693/hyhz20160800169
-
文章历史
- 收稿日期:2016-08-11
- 收修改稿日期:2016-11-01
熊本牡蛎 (Crassostrea sikamea) 是自然分布于中国长江以南沿海、日本有明海、韩国沿海地区的固着型贝类, 具有形状规则、壳质坚硬、肉味清甜等特点, 是我国巨蛎属牡蛎中重要经济种之一 (滕爽爽等, 2010)。熊本牡蛎于20世纪40年代末期从日本引进美国西海岸 (Woelke, 1955), 随着其分类地位的确定及在牡蛎市场表现出的优良品质, 目前已成为美国重要的牡蛎养殖种类之一 (Elston et al, 1999)。长牡蛎 (Crassostrea gigas) 的繁殖季节在每年的7—8月, 由于繁殖的缘故, 牡蛎肥满度极低, 口感极差, 不能满足此时牡蛎市场的要求。但熊本牡蛎的产卵期较长牡蛎晚, 这一时期熊本牡蛎的肉质依旧可口细腻, 因此熊本牡蛎能够在长牡蛎 (C. gigas) 不能上市的夏季弥补市场空缺 (Gordon et al, 2001; 吕晓燕, 2013), 具有较高的市场价格和广阔的市场前景, 因此日益受到世界各国牡蛎养殖业的重视。熊本牡蛎虽然在我国有自然分布, 但目前还没有进行规模化人工养殖。因此, 开展熊本牡蛎人工繁育技术研究, 开发牡蛎养殖新品种, 既可以满足夏季人们对牡蛎的消费需求, 也能够丰富我国的牡蛎养殖品种, 对于我国牡蛎养殖业的健康发展具有重要意义。
贝类具有复杂的生活史, 在人工繁育和自然海域养成期间, 贝类的生长存活易受到环境因素的影响。Kinne等 (1964)认为环境因素能够显著影响双壳贝类的发育、生长和存活, 尤其是作为“主导因子”的盐度和温度对许多海洋生物都有影响作用。不适宜的盐度会引起双壳贝类封闭外套膜, 抑制与外界水环境的交换, 影响双壳贝类的生长和存活 (Berger et al, 1997); 不适宜的温度会影响贝类的摄食和能量代谢, 对生长和存活产生消极的影响 (王芳等, 1998; Ivanina et al, 2013)。因此优化贝类生长发育的环境因子, 是确保人工苗种繁育和养成成功的关键。
目前, 关于熊本牡蛎的性腺发育、人工苗种培育等方面的研究已有报道 (Robinson, 1992; Xu et al, 2011)。自然海区熊本牡蛎的性成熟一般在每年的7—10月, 浮游幼虫的适宜生长温度为26—28℃, 适宜生长盐度为20—25(吕晓燕, 2013)。然而, 关于盐度和温度对熊本牡蛎稚贝生长和存活影响的研究尚未见报道。本研究通过研究不同温度和盐度对熊本牡蛎稚贝生长和存活的影响, 旨在阐明熊本牡蛎稚贝生长发育的适宜盐度和温度范围, 提高稚贝存活率, 为熊本牡蛎养殖产业化提供基础数据。
1 材料和方法 1.1 实验材料2015年7月以从美国俄勒冈州采集的熊本牡蛎成贝作为繁育群体, 在烟台海益苗业有限公司进行人工繁育, 幼虫附着变态后转移到威海海域养殖。2016年2月从养殖海域采集熊本牡蛎稚贝, 在室内暂养5d, 暂养温度2—3℃, 盐度32。实验开始前随机抽取300个稚贝, 分别测定壳高和壳长指标。
1.2 实验设计实验在80L水体的水族箱中进行, 每个水族箱中放入稚贝30个。采取渐进方式调整实验盐度和温度, 盐度日升降幅度不大于2, 温度日升降幅度不大于2℃, 达到实验设定的海水盐度、温度后稳定3d。
为探讨盐度对熊本牡蛎生长发育的影响, 设置6个盐度梯度 (15、20、25、30、35和40), 每个梯度设3个重复。自然海水的盐度为32, 低盐度海水通过向自然海水中添加充分曝气的淡水配制而成, 高盐度海水通过向充分曝气的自然海水中添加海盐, 再经过脱脂棉过滤配制而成。进行盐度实验时, 各实验组温度相同, 均保持在22—24℃。为探讨温度对熊本牡蛎生长发育的影响, 设置5个温度梯度 (16、20、24、28和32℃), 每个梯度设3个重复, 温差控制在±0.5℃以内。进行温度实验时, 各实验组盐度32, 均使用过滤的天然海水。
1.3 日常管理实验持续时间为5周, 实验期间混合投喂新月菱形藻Nschia closterium和球等鞭金藻Isochrysis galbana, 每日投饵3次。连续充气, 每2d全量换水1次。每5d测量稚贝壳高和壳长, 记录稚贝的存活情况。
1.4 指标测定 1.4.1 存活率的测定存活率 (Rs)=成活个体数/初始个体数× 100%,
死亡的界定是稚贝的贝壳张开, 对外界轻微刺激不做出反应为标准。发现死亡个体立即清除, 其生长指标的增长率视为0。
1.4.2 壳高、壳长日增长率的测定实验结束时, 测量各实验组剩余稚贝的平均壳高 (H1)、平均壳长 (L1) 并与初始生长指标相比较。
平均壳高日增率:
RH(mm/d)=(H1-H0)/(t1-t0),
平均壳长日增率:
RL(mm/d)= (L1-L0)/(t1-t0),
式中, t1和t0分别为实验结束和实验开始日期。
1.5 数据处理使用软件SPSS16.0进行单因子ANOVA分析不同盐度、温度对熊本牡蛎稚贝生长存活的影响, 利用LSD多重比较分别检测各盐度、温度处理组之间的差异。显著性水平设定P < 0.05。
2 结果 2.1 盐度对熊本牡蛎稚贝生长存活的影响 2.1.1 盐度对稚贝生长的影响熊本牡蛎稚贝壳高在盐度15 ((16.36±0.48) mm)、20 ((19.80±0.25) mm) 和25 ((20.84±0.11) mm) 组中高于盐度35 ((15.02± 0.64) mm) 和40 ((13.72±0.27) mm) 组, 熊本牡蛎稚贝壳高和壳长壳长在盐度20 ((14.60±0.61) mm) 和25 ((15.75±0.72) mm) 组中显著高于盐度15 ((11.81± 0.34) mm)、35 ((11.63±0.50) mm) 和40 ((10.57±0.54) mm), 且随盐度增加, 各组稚贝的壳高、壳长表现为先升高后降低。与盐度25组相比, 盐度30组的稚贝壳高、壳长显著下降 (P < 0.05)。
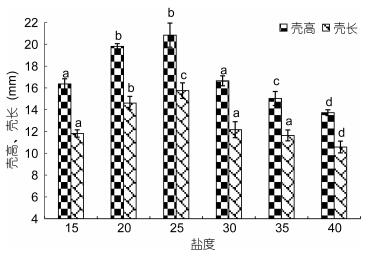 |
| 图 1 不同盐度下稚贝壳高和壳长的生长 Fig. 1 The shell height and shell length of juvenile Crassostrea sikamea under different salinity 注:同一日龄时, 柱头上字母相同者表示实验组间差异不显著 (P > 0.05), 下同 |
不同盐度对熊本牡蛎稚贝壳高和壳长的日增长率有显著的影响 (P < 0.05)(图 2)。盐度25组壳高、壳长日增长率最高, 分别为246.1和179. 9μm/d, 且除盐度20组外与其他盐度组差异极显著 (P < 0.01)。盐度40组壳高、壳长日增长率最低, 分别为42.9和28.6μm/d, 与其他各组差异显著 (P < 0.05)。盐度15和30组差异不显著 (P > 0.05), 但与盐度35组差异显著 (P < 0.05)。熊本牡蛎稚贝壳高、壳长的适宜生长盐度为20—25。
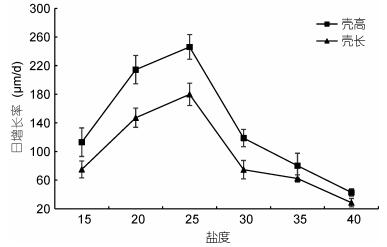 |
| 图 2 不同盐度下稚贝壳高和壳长的日增长率 Fig. 2 Daily growth rate of shell height and shell length of juvenile C. sikamea under different salinity |
随时间延长, 各盐度组存活率逐渐下降 (表 1)。熊本牡蛎稚贝在各盐度组下存活率均高于50%。单因素方差分析结果显示, 在第20d时不同盐度对稚贝存活的影响达到显著水平 (P < 0.05), 盐度20组的存活率最高 (91.1%), 与盐度15和20组差异不显著 (P > 0.05), 与盐度30组和盐度40组差异显著 (P < 0.05)。盐度40组的存活率最低 (72.2%), 与盐度30和35组差异不显著 (P > 0.05)。多重比较分析表明, 熊本牡蛎稚贝适宜存活盐度为15—25。
| 盐度 | 存活率 (%) | |||
| 5d | 10d | 15d | 20d | |
| 15 | 95.6±5.1a | 92.2±5.1ab | 86.7±6.7ab | 85.6±5.1a |
| 20 | 98.9±1.9a | 95.6±5.1a | 92.2±6.9a | 91.1±5.1a |
| 25 | 94.4±5.1a | 93.3±5.8ab | 91.1±5.1ab | 88.9±1.9a |
| 30 | 95.6±1.9a | 88.9±1.9ab | 80.0±8.8ab | 77.8±8.4b |
| 35 | 91.1±5.1a | 86.7±10.0ab | 84.4±13.5ab | 78.9 ±11.7b |
| 40 | 93.3±3.3a | 82.2±5.8b | 76.7±5.8b | 72.2±5.1b |
| 注:同一列中上标具有相同字母表示没有显著性差异 (P > 0.05), 下同 | ||||
稚贝的壳高、壳长在温度28℃组达到最大 ((17.98±0.69) mm, (15.20± 0.47) mm) 随温度的降低, 壳高、壳长逐渐减小。32℃组与28℃组相比, 稚贝的壳高、壳长显著降低 (P < 0.05)。
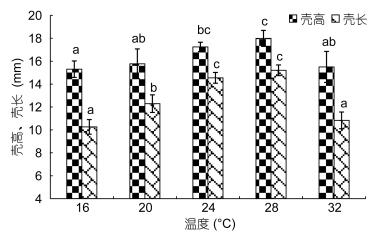 |
| 图 3 不同温度下稚贝壳高和壳长的生长 Fig. 3 The shell height and shell length of juvenile C. sikamea under different temperature |
熊本牡蛎稚贝在所有温度组均能生长 (图 4)。稚贝壳高和壳长的日增长率在温度24℃组和28℃组最高, 分别为142.5和163.7μm/d, 两组间差异不显著 (P > 0.05), 但与其余各组差异显著 (P < 0.05)。稚贝壳高的日增长率在温度16℃组最低, 为91.0μm/d, 且除温度24和28℃组外, 与其余各组差异不显著 (P > 0.05)。壳长的日增长率在温度24和28℃组最高, 分别为142.5和163.7μm/d, 与温度16、20和32℃组差异显著 (P < 0.05)。多重比较分析表明, 温度24和28℃组稚贝壳高、壳长日增长率差异不显著 (P > 0.05), 因此24—28℃可作为稚贝壳高、壳长适宜生长温度。
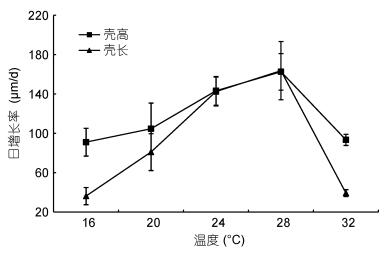 |
| 图 4 不同温度下稚贝壳高、壳长的日增长率 Fig. 4 Daily growth rate of shell height and shell length of juvenile C. sikamea under different temperature |
随着实验时间的延长, 各温度组稚贝存活率逐渐降低 (表 2)。方差分析表明, 各实验组稚贝存活率在第10—20d达到显著差异水平 (P < 0.05)。在第10d, 温度32℃组稚贝存活率最低 (84.4%), 与其他各组差异极显著 (P < 0.01)。在第15d时, 温度28和20℃组存活率最高, 分别为94.4%和90.0%, 显著高于温度32℃组 (P < 0.05), 但与其他各组差异不显著 (P > 0.05)。第20d时, 温度20、24和28℃组存活率显著高于温度16和32℃组 (P < 0.05)。温度16和32℃组在第20d时存活率最低, 分别为82.2%和73.3%, 两组差异不显著 (P > 0.05)。多重比较表明, 熊本牡蛎稚贝适宜存活温度为20—28℃。
| 温度 (℃) | 存活率 (%) | |||
| 5d | 10d | 15d | 20d | |
| 16 | 96.7±3.3 | 94.4±1.9a | 84.4±12.6ab | 82.2±7.7ab |
| 20 | 96.7±3.3 | 94.4±1.9a | 90.0±3.3ab | 85.6±3.8a |
| 24 | 97.8±1.9 | 97.8±1.9a | 88.9±5.1ab | 86.7±6.7a |
| 28 | 97.8±1.9 | 95.6±1.9a | 94.4±3.8b | 92.2±6.1a |
| 32 | 95.6±1.9 | 84.4±1.9b | 76.7±5.8b | 73.3±6.7b |
稚贝的快速生长和健康发育是贝类高产高收的重要前提, 因此稚贝培育期间需要严格控制环境因素的变化。然而贝类生活在海洋环境中, 其生长发育必然会受到海水盐度、温度等环境因素的影响, 尤其是贝类栖息的沿海河口地区, 会经常因为潮汐、降雨和海水蒸发引起盐度、温度的剧烈变化 (曹伏君等, 2009)。由于不同的贝类种类生活的海水环境不同, 所以造成了对不同海水盐度、温度的适应性。
贝类对盐度的耐受力与渗透压调节能力、营养状况和遗传变异 (包括抗逆基因的表达) 有关, 其中渗透压调节能力直接决定了贝类适宜生长和存活的环境 (Verbrugge et al, 2012)。当海水盐度的变化超过了稚贝的渗透压调节能力, 就会降低稚贝的代谢速率, 影响代谢效率, 引起稚贝的大量死亡 (刘海涛等, 1992)。本研究结果表明熊本牡蛎属于广盐性贝类, 适宜生长盐度为20—25, 适宜存活盐度为15—25。之前许多有关牡蛎盐度耐受性的研究结果都表明巨砺属种类多数是广盐性贝类, 并且适宜的盐度有利于贝类生长存活 (李孝绪等, 1994; 刘志刚等, 2006)。例如:长牡蛎C. gigas稚贝适宜生长盐度为25—35, 适宜存活盐度为15—35(Guo et al, 2008); 近江牡蛎C. ariakensis适宜存活盐度为5—25(姚托等, 2015); C. rhizophorae胚胎适宜发育盐度为25—37 (Dos Santos et al, 1985); C. belcheri幼虫适宜存活盐度为6—30, 适宜生长存活盐度为12—18(Tan et al, 1996); 黄唇巨牡蛎C. iredalei幼虫适宜生长存活盐度为10—35(Sudrajat, 1990)。
熊本牡蛎对低盐的耐受能力及在低盐下的生长速度都显著高于高盐。其原因可能是熊本牡蛎长期生活在有淡水注入的河口及潮间带海域, 逐渐适应了低盐环境。另外, 过低和过高盐度 (15、40) 会引起稚贝生长缓慢。相似的现象还在同为广盐性贝类的青蛤Cyclina sinensis(王丹丽等, 2005)、珠母贝Pinctada margaritifera(谢仁政等, 2013)、彩虹明樱蛤Moerella iridescens(顾晓英等, 1998) 也有报道。海洋双壳贝类在极端盐度中出现生长缓慢的主要原因可能是机体的能量利用效率降低 (Berger et al, 1986)。当盐度剧烈变化时, 海洋贝类会封闭外套膜, 抑制与外界环境的水交换, 调节体腔液渗透压、降低呼吸代谢等机体活动抵抗外界盐度变化 (Berger et al, 1986; Berger et al, 1997)。这些反应会减弱稚贝摄食, 增加能量消耗, 导致用于生长的能量降低, 最终导致稚贝生长缓慢。因此适宜稳定的盐度有利于稚贝的快速生长。
温度是影响海洋无脊椎动物生长发育及成活的另一个主要环境因子。不适或剧烈的温度变化能降低双壳贝类血细胞和酶的活性, 减弱机体免疫防御能力, 对呼吸摄食、生长发育产生消极的影响 (Gagnaire et al, 2006)。本研究结果表明熊本牡蛎适宜生长温度为24—28℃, 适宜存活温度为20—28℃, 且在适宜温度范围内高温更有利于熊本牡蛎的生长存活。这可能与熊本牡蛎的夏季繁殖习性有关。分布在自然海区的熊本牡蛎雌雄的性成熟时间一般在每年的7—8月份, 这一时期正是一年中水温最高的时期。相似的现象在同为夏季繁殖习性贝类的悉尼岩牡蛎Saccostrea glomerata(Parker et al, 2009)、彩虹明樱蛤Moerella iridescens(顾晓英等, 1998)、泥蚶Tegillarca granosa (尤仲杰等, 2001) 有报道。因此熊本牡蛎稚贝的耐高温能力是与其生态环境相适应的。
此外研究发现, 稚贝在32℃下生长速度和存活率都显著低于28℃, 表明熊本牡蛎稚贝最适生长存活的临界温度介于28和32℃。在稚贝养成期间, 升高水温能促进稚贝生长存活, 但温度过高, 会显著降低生长速度和存活率。有学者认为温度过高导致贝类呼吸急促而不规律, 缺氧窒息, 还能造成蛋白质凝固, 以至于昏迷死亡 (王如才等, 2008); 另外高温能加速水中致病原生动物及细菌的滋生, 残饵粪便败坏水质, 增加耗氧 (Gruffydd et al, 1972), 导致稚贝摄食率下降, 存活率降低 (Velasco et al, 2008)。因此, 为提高熊本牡蛎的生长速度和存活率, 水温应控制在24—28℃。然而我国大部分养殖海区, 都在离岸边不远的水域, 这些海区水温易受气候和大陆径流的影响而发生剧烈变化, 极易造成稚贝的大量死亡 (王昌勃, 2013)。因此适宜稳定的温度有利于提高稚贝的生长速率, 促进熊本牡蛎增产增收。
4 结论总之, 本文研究了不同盐度和温度对熊本牡蛎稚贝生长与存活的影响。结果发现, 熊本牡蛎稚贝的适宜生长盐度为20—25, 适宜存活盐度为15—25;适宜生长温度为24—28℃, 适宜存活温度为20—28℃, 低盐高温的环境有利于熊本牡蛎稚贝的生长存活。
| 王芳, 董双林, 张硕, 等, 1998. 海湾扇贝 (Argopecten irradians) 和太平洋牡蛎 (Crasostreagigas) 呼吸和排泄的研究. 青岛海洋大学学报, 28(2): 66–72 |
| 王如才, 王昭萍, 2008. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 8-9 |
| 王丹丽, 徐善良, 尤仲杰, 等, 2005. 温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响. 水生生物学报, 29(5): 495–501 |
| 王昌勃, 2013. 熊本牡蛎单体苗种生产和养殖技术的研究. 青岛: 中国海洋大学硕士学位论文, 39-43 |
| 尤仲杰, 徐善良, 边平江, 等, 2001. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响. 海洋学报, 23(6): 108–113 |
| 吕晓燕, 2013. 熊本牡蛎人工繁育与长牡蛎单体苗种培育技术研究. 青岛: 中国海洋大学硕士学位论文, 30-34 |
| 刘志刚, 刘建勇, 王辉, 等, 2006. 墨西哥湾扇贝稚贝盐度适应性的研究. 湛江海洋大学学报, 26(6): 12–16 |
| 李孝绪, 齐钟彦, 1994. 中国牡蛎的比较解剖学及系统分类和演化的研究. 海洋科学集刊, 35: 143–178 |
| 刘海涛, 董占武, 徐志明, 1992. 盐度对大连湾牡蛎胚胎发育及幼虫生长的影响. 水产学报, 16(1): 31–39 |
| 姚托, 王昭萍, 闫喜武, 等, 2015. 盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响. 生态学报, 35(5): 1581–1586 |
| 顾晓英, 尤仲杰, 王一农, 1998. 几种环境因子对彩虹明樱蛤Moerella iridescens不同发育阶段的影响. 东海海洋, 16(3): 41–48 |
| 曹伏君, 刘志刚, 罗正杰, 2009. 海水盐度、温度对文蛤稚贝生长及存活的影响. 应用生态学报, 20(10): 2545–2550 |
| 谢仁政, 初庆柱, 黄海立, 等, 2013. 盐度对珠母贝幼虫和稚贝存活和生长的影响. 广东海洋大学学报, 33(6): 57–61 |
| 滕爽爽, 李琪, 李金蓉, 2010. 长牡蛎 (Crassostrea gigas) 与熊本牡蛎 (C.sikamea) 杂交的受精细胞学观察及子一代的生长比较. 海洋与湖沼, 41(6): 914–922 DOI:10.11693/hyhz201006018018 |
| Berger V J, Kharazova A D, 1997.Mechanisms of salinity adaptations in marine molluscs.In:Naumov A D, Hummel H, Sukhotin A A, et al eds.Interactions and Adaptation Strategies of Marine Organisms.Netherlands:Springer, 115-126 |
| Berger V J, Sergievskii S O, 1986. Differences in adaptive reactions on salinity changes of individuals of Littorina obtusata with different shell colour. Biologia Moria, 1: 36–41 |
| Dos Santos A E, Nascimento I A, 1985. Influence of gamete density, salinity and temperature on the normal embryonic development of the mangrove oyster Crassostrea rhizophorae Guilding. 1828.Aquaculture, 47(4): 335–352 |
| Elston R A, Cheney D, Frelier P, et al, 1999. Invasive orchitophryid ciliate infections in juvenile Pacific and Kumomoto oysters, Crassostrea gigas and Crassostrea sikamea. Aquaculture, 174(1-2): 1–14 DOI:10.1016/S0044-8486(98)00512-2 |
| Gagnaire B, Frouin H, Moreau K, et al, 2006. Effects of temperature and salinity on haemocyte activities of the Pacific oyster, Crassostrea gigas(Thunberg). Fish&Shellfish Immunology, 20(4): 536–547 |
| Gordon D G, Blanton N E, Nosho T Y, 2001. Heaven on the Half Shell:The Story of the Northwest's Love Affair with the Oyster. Portland, USA: West Winds Press, 119 |
| Gruffydd L D, Beaumont A R, 1972. A method for rearing Pecten maximus larvae in the laboratory. Marine Biology, 15(4): 350–355 DOI:10.1007/BF00401395 |
| Guo X M, Wang H Y, Qian L, et al, 2008. Genetic and ecological structures of oyster estuaries in China and factors affecting success of Crassostrea ariakensis:clues from a reclassification. Final Report to US NOAA CBO Non-native Oyster Research Program, |
| Ivanina A V, Dickinson G H, Matoo O B, et al, 2013. Interactive effects of elevated temperature and CO2 levels on energy metabolism and biomineralization of marine bivalves Crassostrea virginica and Mercenaria mercenaria. Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology, 166(1): 101–111 |
| Kinne O, 1964. The effects of temperature and salinity on marine and brackish water animals. Ⅱ.Salinity and temperature-salinity combinations.Oceanography Marine Biology Annual Review, 2: 281–339 |
| Parker L M, Ross P M, O'Connor W A, 2009. The effect of ocean acidification and temperature on the fertilization and embryonic development of the Sydney rock oyster Saccostrea glomerata(Gould 1850). Global Change Biology, 15(9): 2123–2136 DOI:10.1111/gcb.2009.15.issue-9 |
| Robinson A, 1992. Gonadal cycle of Crassostrea gigas kumamoto(Thunberg) in Yaquina Bay, Oregon and optimum conditions for broodstock oysters and larval culture. Aquaculture, 106(1): 89–97 DOI:10.1016/0044-8486(92)90252-G |
| Sudrajat A, 1990. Studies on the reproductive biology and culture of the rock oyster, Saccostrea cucullata(Born) and slipper oyster, Crassostrea iredalei(Faustino). Wales, UK: Doctor Dissertation of University College of Swansea, |
| Tan S H, Wong T M, 1996. Effect of salinity on hatching, larval growth, survival and settling in the tropical oyster Crassostrea belcheri(Sowerby). Aquaculture, 145(1-4): 129–139 DOI:10.1016/S0044-8486(96)01338-5 |
| Velasco L A, Barros J, 2008. Experimental larval culture of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture Research, 39(6): 603–618 DOI:10.1111/j.1365-2109.2008.01917.x |
| Verbrugge L N H, Schipper A M, Huijbregts M A J, et al, 2012. Sensitivity of native and non-native mollusc species to changing river water temperature and salinity. Biological Invasions, 14(6): 1187–1199 DOI:10.1007/s10530-011-0148-y |
| Woelke C E, 1955. Introduction of the Kumamoto oyster Ostrea (Crassostrea) gigas to the Pacific coast. Washington Department of Fisheries, Fisheries Research Papers, 1: 41–50 |
| Xu F, Guo X M, Li L, et al, 2011. Effects of salinity on larvae of the oysters Crassostrea ariakensis, Csikamea and the hybrid cross. Marine Biology Research, 7(8): 796–803 DOI:10.1080/17451000.2011.569555 |
 2017, Vol. 48
2017, Vol. 48


