中国海洋湖沼学会主办。
文章信息
- 左涛, 王俊, 王秀霞. 2017.
- ZUO Tao, WANG Jun, WANG Xiu-Xia. 2017.
- 莱州湾桡足类胸刺水蚤 (Centropages) 的种类季节更替和生态分布
- SEASONAL SPECIES SUCCESSION AND ECOLOGICAL DISTRIBUTION OF COPEPOD CENTROPAGES IN LAIZHOU BAY
- 海洋与湖沼, 48(2): 327-335
- Oceanologia et Limnologia Sinica, 48(2): 327-335.
- http://dx.doi.org/10.11693/hyhz20160900209
-
文章历史
- 收稿日期:2016-09-28
- 收修改稿日期:2016-11-24
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 农业部海洋渔业可持续发展重点实验室 青岛 266071;
4. 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Key Laboratory for Developmental Utilization of Marine Fisheries, Ministry of Agriculture, P. R. China, Qingdao 266071, China;
4. Key Laboratory for Fishery Resources and Eco-Environment, Shandong Province, Qingdao 266071, China
胸刺水蚤 (Centropages) 广布于世界各个海洋陆架区, 是浅海近岸水域浮游动物桡足类中重要类群。在一些区域, 它们在浮游动物数量组成中占有绝对优势, 如北大西洋陆架区的Centropages typicus (Carlotti et al, 2007), 同时也是许多鱼类由稚鱼向幼鱼生长转换过程中重要的饵料来源 (郑严等, 1965; 孟田湘, 2001)。该属很多种类为杂食性或肉食性, 可捕食桡足类、鱼类的卵和幼体 (Turner et al, 1985; Boersma et al, 2014), 因此, 胸刺水蚤在许多桡足类和鱼类的种群补充过程中起着重要的影响作用, 它是海洋生态系统 (特别是浅海近岸生态系统) 中不可忽视的浮游动物类群。
莱州湾是中国陆架浅海--渤海的三大海湾之一, 其东侧紧邻渤海海峡, 西侧为中国第二大河--黄河的入海口, 具有独特的理化和生物特征, 是中国北部传统的渔业生物产卵、孵育和索饵场。但受人类活动和气候变化影响, 莱州湾内生物群落结构和格局已发生重大改变。20世纪50年代至90年代, 在包括莱州湾在内的渤海和北黄海, 冬、春季最为常见的胸刺水蚤是腹胸刺水蚤 (C. abdominalis), 秋季为瘦尾胸刺水蚤 (C. tenuiremis)(中科院海洋所浮游生物组, 1964; 郑重等, 1978; 白雪娥等, 1991; 张武昌等, 2002)。但根据近年调查资料, 瘦尾胸刺水蚤已被取代, 背针胸刺水蚤 (C. dorsispinatus) 成为上述区域秋季常见胸刺水蚤 (王文杰等, 2013; Sun et al, 2013)。如何理解莱州湾浮游动物胸刺水蚤种类组成变化, 需要深入开展相关的生态研究, 以评估莱州湾生境变化对其的影响。
腹胸刺水蚤曾被定名为墨氏胸刺水蚤 (C. mcmurrichi)(陈清潮等, 1965), 它的中文名又名腹针胸刺水蚤, 本文采用刘瑞玉 (2008)编录所定的种名。腹胸刺水蚤广泛分布于北太平洋北温带水域, 在渤、黄、东、南海极为常见 (刘瑞玉, 2008)。有关腹胸刺水蚤种群生态研究的报道略多, 包括生态分布和昼夜移动 (郑重等, 1965)、生殖和发育 (Kasahara et al, 1975; Liang et al, 1994; Slater et al, 2005) 以及种群动态和生产力估算 (Liang et al, 1996)、种群结构特征 (武文魁, 1991; Sun et al, 2013)。背针胸刺水蚤主要分布于南海、太平洋和印度洋 (刘瑞玉, 2008), 在南黄海和东海沿岸都有分布 (徐韧等, 2009), 但有关该种的种群生态研究却鲜有报道。
本研究基于2011年和2012年的野外调查, 采集9个航次的莱州湾胸刺水蚤样品, 分析了湾内种类组成, 以及各组成种类的桡足幼体和成体的丰度相对组成、个体大小的相关资料, 估算其生物量和生产力。目的在于了解莱州湾胸刺水蚤的种群结构及生态分布主要特征, 明确莱州湾浮游动物种类更替规律。本研究不仅有助于细致刻画莱州湾内胸刺水蚤类群的生态特征, 有益于补充我国近海近岸生态类型的浮游动物种群生态学资料, 还可为探讨莱州湾浮游动物种类更替对水文的生物指示作用提供参考。
1 材料与方法 1.1 样品采集和分析2011年5-11月、2012年3-4月用渔船“鲁昌渔4193号”(额定功率为350kw) 逐月在莱州湾 (37.25°N-38.75°N, 119°E-120.75°E) 进行了9个航次的定点综合调查。胸刺水蚤使用网孔径为160μm的浮游生物网从底至表垂直拖网采集获得。全部采样均在白天进行。胸刺水蚤样固定保存于5%的甲醛海水溶液中。同期测定的环境参数有各站表层 (水深1-2m) 海水温度和海水盐度、溶解氧和pH, 其水平分布见左涛等 (2016)的报道。
在实验室内Nikon SMZ1500体式显微镜下 (20×), 参考李松等 (1990)的方法镜检和计数胸刺水蚤的桡足幼体和成体, 记录发育期和性别以及头胸甲部的前体长 (prosome length, PL)(精确至0.01mm)。发育期包括桡足幼体各期 (CⅠ、CⅡ、CⅢ、CⅣ和CⅤ) 及雌体 (F) 和雄体 (M)。考虑网具采集的有效粒级, 无节幼体期未列入本研究。
1.2 数据处理各发育期的相对数量密度用丰度 (ind./m3) 表示, 用各发育期的个体计数值除以滤水量体积来计算。生物量 (B, μgC/m3) 是单位水体内所有个体含碳量的总和。腹胸刺水蚤个体生物量 (Bi) 根据经验公式Bi=PL2.97×10-8.19(Uye, 1982) 计算, 其中PL为前体长。腹胸刺水蚤桡足幼体和成体的日生产力[P, μgC/(m3·d)]由生物量和水温 (T, ℃) 估算得到, 估算公式为: P/B=0.086e0.064T(Liang et al, 1996)。因未收集到相关的基础参数, 本研究中背针胸刺水蚤桡足幼体和成体的生物量和生产力的估算参数参考腹胸刺水蚤的相应值。
各发育期前体长-频数 (丰度) 分布利用混合分布法 (Macdonald et al, 1979) 拟合正态曲线。拟合后曲线经方差分析 (ANOVA) 检验后优化和确定拟合参数与原观测值的差异不显著 (P > 0.05), 方可接受。平面图和线条图采用Surfer 10.0和Graph 8.0(Golden software, Inc.) 绘制。
2 结果 2.1 总丰度、性比的季节变化9个航次中, 观察到两种胸刺水蚤, 分别是腹胸刺水蚤和背针胸刺水蚤。
腹胸刺水蚤出现季节以冬、春季为主。它从上一年的11月开始出现, 5月丰度达到最高 (2411ind./m3), 7月逐渐消失 (图 1)。9个调查月的丰度月均值为435ind./m3。背针胸刺水蚤出现季节以夏、秋季为主, 自6月开始出现, 9月丰度值达最高 (472ind./m3), 11月逐渐消失 (图 1), 9个调查月的丰度月均值为76ind./m3。
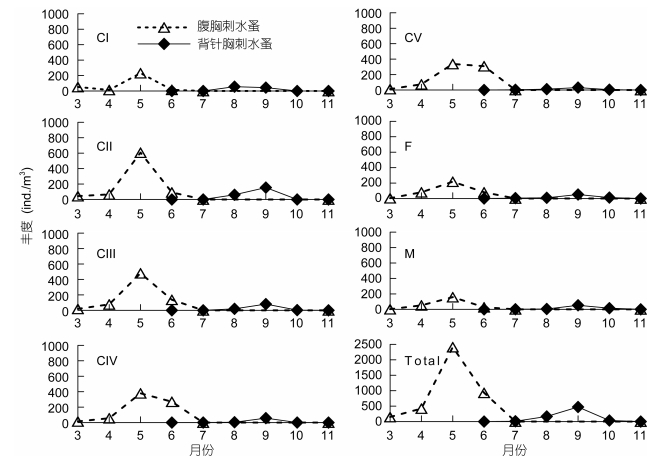 |
| 图 1 莱州湾腹胸刺水蚤和背针胸刺水蚤桡足幼体各发育期和成体丰度 (ind./m3) 的月变化 Fig. 1 Monthly abundance (ind./m3) of stage-specific copepodites of Centropages abdominalis and C. dorsispinatus in Laizhou Bay 注: CⅠ、CⅡ、CⅢ、CⅣ:代表桡足幼体各期; F为雌体; M为雄体; Total:所有发育期. |
各发育期丰度变化 (图 1) 表现为, 腹胸刺水蚤3-6月各期桡足幼体均有出现, 7月和11月早期桡足幼体不出现, 仅有后期桡足幼体和成体出现, 各期桡足幼体的丰度都以5月丰度最高。背针胸刺水蚤7-10月各期桡足幼体均有出现, 除CⅠ期以8月丰度最高外, 其他桡足幼体各发育期和成体的丰度都以9月最高。
成体中, 腹胸刺水蚤的性比 (雌/雄) 以11月最高 (5), 其次为6月 (2.98), 其他月份该值则在1.11-1.71间。背针胸刺水蚤的性比以7月和8月较高, 分别为3.14和1.92, 9-11月则在0.8-1间。两种胸刺水蚤的雌体和雄体丰度差异都未达显著水平 (配对t-test, P > 0.05)
2.2 前体长-频数分布腹胸刺水蚤桡足幼体各发育期和成体的相对组成中 (图 2), 3月前体长为0.4-0.55mm的CⅠ-CⅡ早期桡足幼体个体略多; 4月除CⅠ期外, 其他幼体发育期的个体所占比例相近; 5月则以前体长 < 0.6mm的CⅡ-CⅢ期所占比例最高; 6月种群组成由前体长为0.7-0.8mm的后期桡足幼体CⅣ和CⅤ期占主导; 7月和11月均以成体占主导, 但7月出现个体的前体长多集中于0.95-1mm, 11月出现个体的前体长介于1-1.2mm。
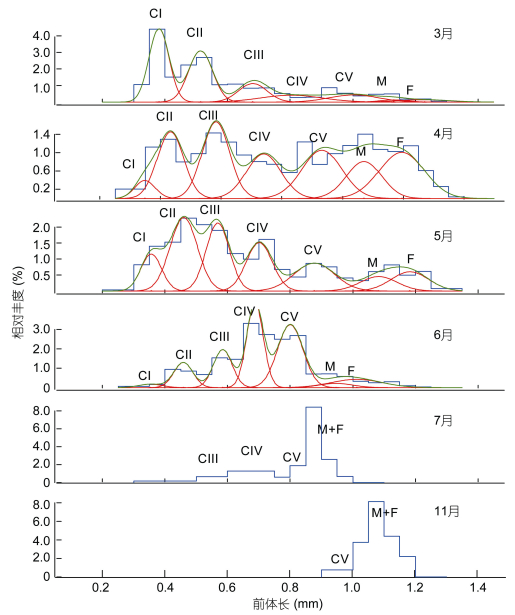 |
| 图 2 莱州湾腹胸刺水蚤桡足幼体和成体的前体长-相对丰度混合分布 Fig. 2 Mixture distributions of relative abundance along prosome length of stage-specific copepodites of Centropages abdominalis in Laizhou Bay 注:图中蓝线和绿线分别代表所有桡足幼体和成体的前体长-相对丰度的分布和拟合曲线, 红线代表各发育期的前体长-相对丰度的拟合正态分布曲线, CⅠ、CⅡ、CⅢ、CⅣ代表桡足幼体各期, F和M分别代表雌体和雄体. |
背针胸刺水蚤桡足幼体各发育期和成体的相对组成中 (图 3), 7月整体丰度值很低, 以前体长 > 0.8mm的成体居多; 8月和9月, 整个种群以早期桡足幼体CⅠ和CⅡ期为丰度主体; 10月和11月, 前体长 > 0.9mm的成体是种群丰度构成的主体。11月各发育期都出现, 但丰度极低, 不能拟合混合正态分布曲线。
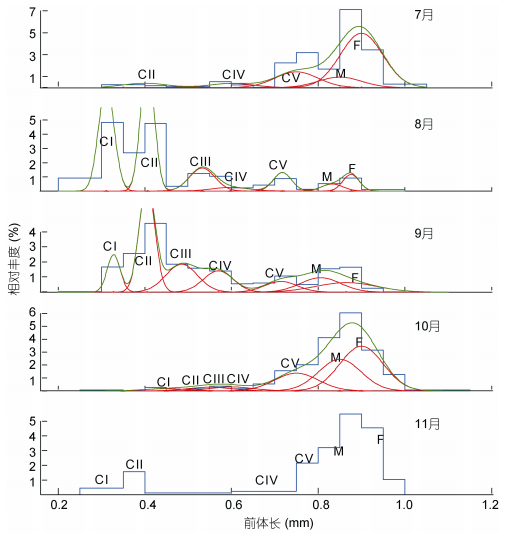 |
| 图 3 莱州湾背针胸刺水蚤桡足幼体和成体的前体长-相对丰度混合分布 Fig. 3 Mixture distributions of relative abundance along prosome length of stage-specific copepodites of Centropages dorsispinatus in Laizhou Bay 注:图中蓝线和绿线分别代表所有桡足幼体和成体的前体长-相对丰度的分布和拟合曲线, 红线代表各发育期的前体长-相对丰度的拟合正态分布曲线, 图中CⅠ、CⅡ、CⅢ、CⅣ代表各桡足幼体期, F和M分别代表雌体和雄体. |
图 4中, 除CⅠ、CⅡ期外, 腹胸刺水蚤各桡足幼体发育期和成体的前体长在3-7月期间, 都表现了下降趋势, 11月前体长又增加至春季3-5月期间的水平。在7-9月期间, 背针胸刺水蚤前体长呈下降趋势, 而后又开始增加。两种桡足类的前体长季节变化与水温呈相反趋势, 水温越高, 其前体长反而越小。
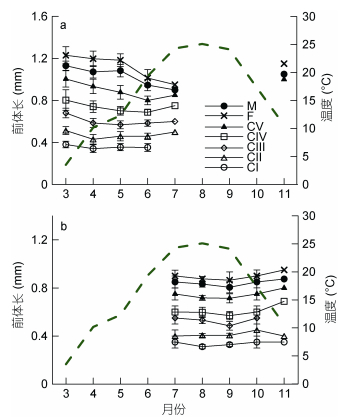 |
| 图 4 莱州湾腹胸刺水蚤 (a) 和背针胸刺水蚤 (b) 各桡足幼体发育期和成体的前体长 (mm) 与表层水温 (℃) 的月变化 Fig. 4 Monthly mean values of prosome length (mm) of stage-specific copepodites of Centropages abdominalis (a) and C. dorsispinatus (b) in Laizhou Bay with surface water temperature (broken line) 注:虚线为温度月变化曲线, 图中CⅠ、CⅡ、CⅢ、CⅣ代表各桡足幼体期, F和M分别代表雌体和雄体. |
腹胸刺水蚤和背针胸刺水蚤桡足幼体和成体的生产力季节变化与生物量、丰度相应的季节变化相同 (图 5)。腹胸刺水蚤的生物量以5月最高 (2500μg/m3), 其次为6月和4月。9个调查月的平均生物量为471μg/m3; 背针胸刺水蚤的生物量以9月最高 (310μg/m3), 其次为8月和10月 (图 5), 9个调查月的平均生物量为50μg/m3。腹胸刺水蚤的生产力最高值426μg/(m3·d) 出现在5月, 9个调查月的平均值为89μg/(m3·d); 背针胸刺水蚤的生产力最高值96μg/(m3·d) 出现在9月, 9个调查月的平均值为15μg/(m3·d)。
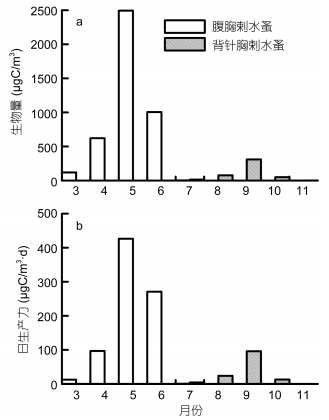 |
| 图 5 莱州湾腹胸刺水蚤和背针胸刺水蚤桡足幼体和成体的生物量 (a) 和日生产力月均值 (b) Fig. 5 Monthly mean values of biomass (a) and daily production (b) of stage-specific copepodites of Centropages abdominalis and C. dorsispinatus in Laizhou Bay. |
3-6月, 腹胸刺水蚤密集区主要分布于湾口东北侧, 湾内西侧近岸一般很少或不出现, 4月腹胸刺水蚤的密集区向湾内扩展范围最大。7-11月, 背针胸刺水蚤密集区主要分布于湾口西侧近岸, 以38.5°E、119.25°N为中心向外周逐渐减少, 湾口及湾内东侧是相对低值区 (图 6)。
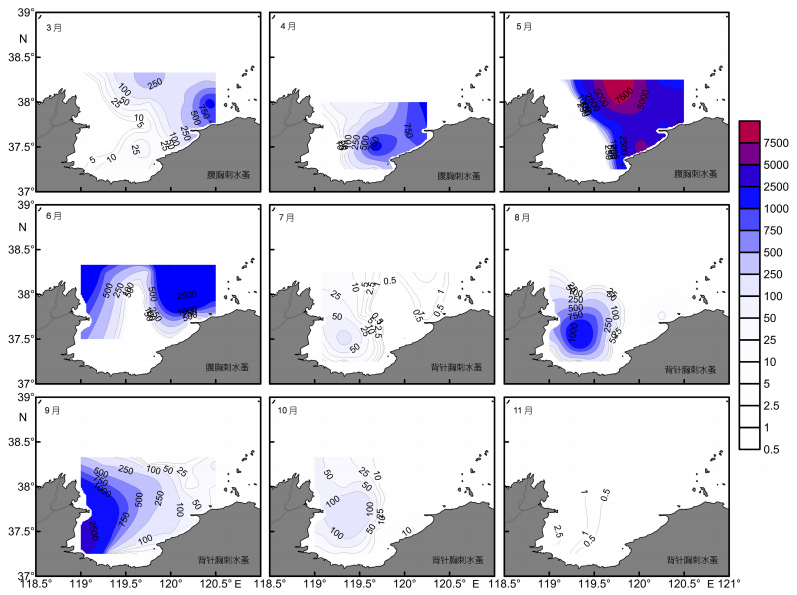 |
| 图 6 莱州湾腹胸刺水蚤 (3-6月) 和背针胸刺水蚤 (7-11月) 总丰度 (ind./m3) 平面分布 Fig. 6 Spatial abundance (ind./m3) distributions of Centropages abdominalis from March to June, and C. dorsispinatus from July to November in Laizhou Bay |
腹胸刺水蚤密集区 ( > 100ind./m3) 的水温低于20℃, 盐度介于30-34;背针胸刺水蚤出现的水温高于10℃, 密集区出现的水温为21-25℃, 盐度介于30-34(图 7)。
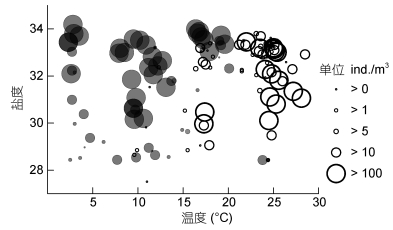 |
| 图 7 莱州湾腹胸刺水蚤 (●) 和背针胸刺水蚤 (○) 丰度与表层水温、盐度的相对分布 Fig. 7 Abundance distribution of Centropages abdominalis (solid circle) and C. dorsispinatus(circle) in relation to the surface water temperature and salinity in Laizhou Bay. |
莱州湾常见的胸刺水蚤是腹胸刺水蚤和背针胸刺水蚤, 两个种类都是季节性出现。腹胸刺水蚤出现季节为冬、春季, 5月丰度最高; 背针胸刺水蚤出现季节为夏、秋季, 9月丰度最高。它们周年间歇性出现特性与其自身的滞育机制有关。胸刺水蚤属的很多种类种群的补充是依靠底质中存留的休眠卵 (Marcus, 1996)。有报道证实, 在腹胸刺水蚤桡足幼体和成体较少或不出现的季节, 底质中的腹胸刺水蚤休眠卵数量往往最高; 而在水层中腹胸刺水蚤桡足幼体增多的季节, 底质中腹胸刺水蚤的卵的数量则较少 (Kasahara et al, 1975)。莱州湾腹胸刺水蚤和背针胸刺水蚤种群消失前, 种群主体都是由成体组成 (图 2和图 3)。成体中雌、雄体丰度较为接近。这是因为胸刺水蚤属多数种类的雌体没有纳精囊, 需要持续与雄体交配, 形成较高的产卵率 (Kiørboe, 2006)。
在丰度空间总体分布上, 腹胸刺水蚤和背针胸刺水蚤表现出明显的互补性。腹胸刺水蚤的分布水域表现为偏低温, 分布中心位于河口区外围或离岸稍远, 在渤海并没有形成越冬群体 (毕洪生等, 2001)。莱州湾内的腹胸刺水蚤种群可能更多依赖于湾外补充群体, 局部水域也可能是依靠休眠卵实现补充。背针胸刺水蚤的分布水域略偏高温, 分布中心在湾内且紧邻河口区, 其种群的增长可能更多来自于当地休眠卵的补充。
在河口近岸分布的胸刺水蚤往往有较广的适盐范围。水温与腹胸刺水蚤和背针胸刺水蚤的生长和分布相关更为明显。温度越高, 发育成熟需要的时间越短, 易导致个体较小 (Liang et al, 1996)。腹胸刺水蚤和背针胸刺水蚤个体大小季节变化也是如此。就空间分布而言, 本研究中腹胸刺水蚤丰度分布为: 4月水温为10℃左右时在莱州湾扩展范围最大, 5月水温为15℃左右时形成丰度峰值, 但在水温升至20℃的6月其丰度急剧下降, 7月水温近25℃时, 该种基本不出现。腹胸刺水蚤是偏冷水性的近岸种, 出现的温度范围为8.9-21.1℃(Liang et al, 1996), 卵孵化所需温度介于10-20℃(Kasahara et al, 1975), 在4.6℃以下基本停滞发育和生长 (Slater et al, 2005)。该种丰度峰值出现季节的区域性差异可能与当地水温状况有关。如日本濑户内海福山港其峰期为2月 (Liang et al, 1996), 而在我国黄海海域其丰度峰值期为4月 (武文魁, 1991)。
如前言所述, 近年来背针胸刺水蚤可能已取代了20世纪50-90年代常见种--瘦尾胸刺水蚤, 成为秋季莱州湾内的常见种。本研究图 7显示, 背针胸刺水蚤在水温高于10℃时出现, 水温达21-25℃时其丰度最高。从已有的报道来看, 2000年以前, 背针胸刺水蚤并没有广泛出现于渤海以及莱州湾内, 而是更多地分布于南黄海、东海沿岸 (如长江口等水域), 是这些水域夏季8月的优势种 (纪焕红等, 2006; 徐韧等, 2009)。而瘦尾胸刺水蚤广泛分布于我国沿海各海域 (郑重等, 1978; 刘瑞玉, 2008)。在东、南海沿岸及海湾、港口, 如厦门港 (刘光兴等, 1998)、珠江口 (陈亮东等, 2015) 等, 主要出现于温度较低的冬、春季 (12月-翌年5月)。在34.5°N左右的日本濑户内海福山湾口, 它出现于水温高于14.5℃的夏、秋季, 并在水温为21℃时达到最高丰度 (Liang et al, 1996)。本研究调查中, 暂未发现瘦尾胸刺水蚤个体。比较而言, 背针胸刺水蚤和瘦尾胸刺水蚤对水温和盐度的适宜范围相近, 两个种类的生态习性相似, 都可被认为是略偏高温的近岸种。在过去50年中, 特别是2000年后, 莱州湾受到最为强烈的人类活动干扰, 黄河口入海径流锐减和数次断流, 冲淡水从湾口西北方向向渤海中央扩展程度降低, 河口低盐区缩小, 受盐度梯度驱动的物理潮汐和湾口环流退化并开始转向 (吴德星等, 2004; 王永刚等, 2014; 毕聪聪等, 2015), 外海水入侵加强, 因此背针胸刺水蚤等许多广布性暖温带近岸种完全有可能进入湾内, 并通过其自身特有滞育机制 (如产生滞育卵下沉至底泥中) 存留下来, 在当地形成固定的种群。但背针胸刺水蚤如何取代瘦尾胸刺水蚤, 成为莱州湾秋季胸刺水蚤优势种?这其中可能涉及水文的长期变化, 以及两种胸刺水蚤种间竞争或其他外在复杂因素, 这些在现有资料基础上, 还无法深入探讨和加以解释。
4 结语本研究结果显示, 莱州湾最为常见的胸刺水蚤是腹胸刺水蚤和背针胸刺水蚤, 均为季节性出现种, 出现的季节分别为11月-翌年7月和6-11月, 丰度最多的月份分别为5月和9月。它们种群结构的季节变化具有一定相似性, 即在种群出现和消失前的时期, 成体是种群组成的主体; 繁盛期则以桡足幼体为主; 在水温最高的季节个体前体长最小。两种胸刺水蚤成体中的雌体和雄体的丰度差异不明显, 性比 (雌/雄) 值介于1-2。
莱州湾胸刺水蚤种类组成具有明显的季节间和可能的年代际间更替。季节性种类更替表现在冬、春季的腹胸刺水蚤和夏、秋季的背针胸刺水蚤间; 年代际更替则可能发生在2000年之前的瘦尾胸刺水蚤和2000年之后的背针胸刺水蚤间。瘦尾胸刺水蚤不再是秋季莱州湾胸刺水蚤优势种类。本研究只采集了表层水温、盐度数据, 缺乏捕食者及营养盐、叶绿素以及饵料生物等资料, 因此要深入诠释引起莱州湾胸刺水蚤种类更替及种群结构变化的外在影响机制, 还需要继续开展进一步工作。
致谢 陈峻峰、吴强、孙坚强、李忠义、陈瑞盛参与海上样品采集分析, 海上航次得到农业部黄渤海渔业资源环境重点野外科学观测试验站支持, 谨致谢忱。| 王文杰, 刘光兴, 2013. 2010年秋季黄河口及其邻近海域中小型浮游动物的群落特征. 海洋科学, 37(11): 9–15 |
| 王永刚, 魏泽勋, 方国洪, 等, 2014. 黄河口及其邻近海域水深和岸线变化对M2分潮影响的数值研究. 海洋科学进展, 32(2): 141–147 |
| 中科院海洋所浮游生物组, 1964. 中国近海浮游生物的研究. 见: 全国海洋综合调查报告 (第八册1959. 1-1960. 6). 北京: 中华人民共和国科学技术委员会海洋组海洋综合调查办公室, 51-53 |
| 左涛, 吴强, 王俊, 等, 2016. 莱州湾水母种类多样性及群集结构的季节变化. 生态学报, 36(18): 5646–5656 |
| 白雪娥, 庄志猛, 1991. 渤海浮游动物生物量及其主要种类数量变动的研究. 海洋水产研究,(12): 71–92 |
| 毕洪生, 孙松, 高尚武, 等, 2001. 渤海浮游动物群落生态特点Ⅱ. 桡足类数量分布及变动.生态学报, 21(2): 177–185 |
| 毕聪聪, 鲍献文, 万凯, 2015. 渤海盐度年代际变异对环流结构的影响. 中国海洋大学学报, 45(1): 1–8 |
| 刘光兴, 李松, 1998. 厦门港瘦尾胸刺水蚤体长、体重与摄食率的季节变化. 海洋学报, 20(3): 104–109 |
| 刘瑞玉, 2008. 中国海洋生物名录. 北京: 科学出版社, 1-614 |
| 纪焕红, 叶属峰, 2006. 长江口浮游动物生态分布特征及其与环境的关系. 海洋科学, 30(6): 23–30 |
| 李松, 方金钏, 1990. 中国海洋浮游桡足类幼体. 北京: 海洋出版社, 57-67 |
| 吴德星, 万修全, 鲍献文, 等, 2004. 渤海1958年和2000年夏季温盐场及环流结构的比较. 科学通报, 49(3): 287–292 |
| 张武昌, 王克, 高尚武, 等, 2002. 渤海春季和秋季的浮游动物. 海洋与湖沼, 33(6): 630–639 |
| 陈亮东, 栾磊磊, 王庆, 等, 2015. 珠江口桂山岛海域桡足类休眠卵对浮游种群的潜在补充及其影响因素. 生态学报, 35(10): 3373–3381 |
| 陈清潮, 章淑珍, 1965. 黄海和东海的浮游桡足类Ⅰ.哲水蚤目. 海洋科学集刊, 7: 20–131 |
| 武文魁, 1991. 墨氏胸刺水蚤在黄海的生态特点. 动物学杂志, 26(3): 1–5 |
| 郑严, 杨纪明, 1965. 浙江近海大黄鱼仔、稚、幼鱼的食性. 海洋与湖沼, 7(4): 355–372 |
| 郑重, 郑执中, 王荣, 等, 1965. 烟、威鲐鱼渔埸及邻近水域浮游动物生态的初步研究. 海洋与湖沼, 7(4): 329–354 |
| 郑重, 李松, 李少菁, 1978. 我国海洋浮游桡足类的种类组成和地理分布. 厦门大学学报,(2): 51–63 |
| 孟田湘, 2001. 山东半岛南部鳀鱼产卵场鳀鱼仔、稚鱼摄食的研究. 海洋水产研究, 22(2): 21–25 |
| 徐韧, 李亿红, 李志恩, 等, 2009. 长江口不同水域浮游动物数量特征比较. 生态学报, 29(4): 1688–1696 |
| Boersma M, Wesche A, Hirche H J, 2014. Predation of calanoid copepods on their own and other copepods' offspring. Marine Biology, 161(4): 733–743 DOI:10.1007/s00227-013-2373-7 |
| Carlotti F, Harris R, 2007. The biology and ecology of Centropages typicus:an introduction. Progress in Oceanography, 72(2-3): 117–120 DOI:10.1016/j.pocean.2007.01.012 |
| Kasahara S, Uye S, OnbéT, 1975. Calanoid copepod eggs in sea-bottom muds. Ⅱ.Seasonal cycles of abundance in the populations of several species of copepods and their eggs in the Inland Sea of Japan.Marine Biology, 31(1): 25–29 |
| Kiørboe T, 2006. Sex, sex-ratios, and the dynamics of pelagic copepod populations. Oecologia, 148(1): 40–50 DOI:10.1007/s00442-005-0346-3 |
| Liang D, Uye S I, Onbé T, 1994. Production and loss of eggs in the calanoid copepod Centropages abdominalis Sato in Fukuyama harbor, the Inland Sea of Japan. Bulletin of Plankton Society of Japan, 41(2): 131–142 |
| Liang D, Uye S, Onbé T, 1996. Population dynamics and production of the planktonic copepods in a eutrophic inlet of the Inland Sea of Japan. I.Centropages abdominalis.Marine Biology, 124(4): 527–536 |
| Macdonald P D M, Pitcher T J, 1979. Age-groups from size-frequency data:a versatile and efficient method of analyzing distribution mixtures. Journal of the Fisheries Research Board of Canada, 36(8): 987–1001 DOI:10.1139/f79-137 |
| Marcus N H, 1996. Ecological and evolutionary significance of resting eggs in marine copepods:past, present, and future studies. Hydrobiologia, 320(1-3): 141–152 DOI:10.1007/BF00016815 |
| Slater L M, Hopcroft R R, 2005. Development, growth and egg production of Centropages abdominalis in the eastern subarctic Pacific. Journal of Plankton Research, 27(1): 71–78 |
| Sun X H, Liang Z L, Zou J X, et al, 2013. Seasonal variation in community structure and body length of dominant copepods around artificial reefs in Xiaoshi Island, China. Chinese Journal of Oceanology and Limnology, 31(2): 282–289 DOI:10.1007/s00343-013-2088-0 |
| Turner J T, Tester P A, Hettler W F, 1985. Zooplankton feeding ecology:a laboratory study of predation on fish eggs and larvae by the copepods Anomalocera ornata and Centropages typicus. Marine Biology, 90(1): 1–8 DOI:10.1007/BF00428208 |
| Uye S I, 1982. Length-weight relationships of important zooplankton from the Inland Sea of Japan. Journal of the Oceanographical Society of Japan, 38(3): 149–158 DOI:10.1007/BF02110286 |
 2017, Vol. 48
2017, Vol. 48

