中国海洋湖沼学会主办。
文章信息
- 徐革锋, 牟振波, 陈怀发, 黄天晴, 王炳谦, 谷伟, 户国, 韩英. 2017.
- XU Ge-Feng, MOU Zhen-Bo, CHEN Huai-Fa, HANG Tian-Qing, WANG Bing-Qian, GU Wei, HU Guo, HAN Ying. 2017.
- 三倍体虹鳟 (Oncorhynchus mykiss) 卵巢分化及滞育的调控机制研究
- THE REGULATORY MECHANISM OF OVARY DIFFERENTIATION AND ABORTION OF TRIPLOID FEMALE RAINBOW TROUT ONCORHYNCHUS MYKISS
- 海洋与湖沼, 48(2): 358-367
- Oceanologia et Limnologia Sinica, 48(2): 358-367.
- http://dx.doi.org/10.11693/hyhz20161000221
-
文章历史
- 收稿日期:2016-10-14
- 收修改稿日期:2016-10-25
2. 西藏自治区农牧科学院水产科学研究所 拉萨 850032;
3. 黑龙江省水生动物资源增殖保护站 哈尔滨 150018;
4. 东北农业大学动物科技学院水产系 哈尔滨 150030
2. Tibet Academy of Agricultural and Animal Husbandry Sciences Institute of Fishery Sciences, Lasa 850032, China;
3. Enhancement and Conservation Station of Aquatic Animal Resources of Heilongjiang Province, Harbin 150018, China;
4. College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China
雌雄异体鱼类的性别决定是由基因 (遗传)、环境或是两者共同作用驱动 (Devlin et al, 2002; Volff et al, 2007; Penman et al, 2008)。在绝大多数哺乳动物中, 雄性都是通过Y染色体遗传的。Sry是第一个在哺乳动物Y染色体上发现的基因, 已被证明是精巢分化与发育的必要条件 (Koopman et al, 1990; Sinclair et al, 1990), 在该基因被确定为主要性别决定基因的同时, 也发现其他基因参与了性别分化的级联调节 (Brennan et al, 2004), 但Sry基因在其他物种的性别决定机制中尚未被发现 (Capel, 2000; Graves, 2002), 这表明性别决定机制在不同种类脊椎动物间不具有明显的进化保守性。与性别决定相反, 决定鱼类性别分化的相关基因和基因网络显示出高度的保守性, 即使是不同种类 (Munger et al, 2009; Herpin et al, 2011; Piferrer, 2011)。与其他脊椎动物一样, 鱼类性腺有两大功能, 即配子发生和类固醇激素合成, 性腺主要的合成产物是性甾体, 雄性激素包括睾酮 (T)、11B-羟雄烯二酮和11-酮基睾酮, 雌性激素主要是雌二醇 (E2)。雄性激素和雌性激素分别与雄性和雌性的性腺分化有关。但雌激素主要是性分化和保持雌性特征的必要条件, 而雄激素目前认为是雄性分化的结果 (Piferrer et al, 2012)。值得注意的是, 很多基因在两性性腺分化中都存在, 只是表达程度不同。另外, 统计近些年的研究成果可知, 鱼类性腺分化期大部分调控因子主要可以归为以下几类:类固醇生成酶、性类固醇激素受体、转录因子和生长因子, 但随着研究的深入还发现其他因子存在 (Penman et al, 2008)。这些基因中, 类固醇性腺芳香化酶 (Cyp19a1a) 和转录因子Foxl2占据显著地位。芳香化酶可催化雄激素转化为雌激素, 该生理过程不可逆, 由此确保两种激素的平衡。目前研究认为, 大部分非哺乳脊椎动物的雌性分化依赖Cyp19a1a定向诱导, 该反应通过一个正反馈回路实现, 主要调控基因为转录因子Foxl2; 而在雄性分化中Cyp19a1a的表达会被抑制 (Guiguen et al, 2010)。Wang等 (2010) 的研究认为, 抑制Cyp19a1a是通过增加Dmrt1实现的; 而转录因子在鱼类种群间相对保守, 是Cyp19a1a的调节器。大多遗传型性别决定种类脊椎动物具有单一性别决定机制, 而Dmrt1的增量调节主要通过以下这个途径实现:包括一个雄性主要决定基因或一个联合基因Sox9, 或者在多因子机制中通过几种雄性促进基因的叠加效应来实现 (Piferrer et al, 2012)。
雄性虹鳟的三倍体 (Lincoln et al, 1984; 韩英等, 2010a) 与二倍体性腺有相同的功能和形态, 然而, 雌性三倍体虹鳟是一个例外, 尽管它们能够存活, 但它们卵巢滞育。与二倍体卵巢相比, 三倍体虹鳟卵巢呈线状, 并且缺少相应数量的初级卵母细胞 (Lincoln et al, 1984; Krisfalusi et al, 1996)。这说明三倍体虹鳟卵巢与精巢的发育存在着本质区别。早期研究认为, 由于第三套染色体在配子形成过程中扰乱了初始减数分裂, 阻滞了卵原细胞的发育, 因此导致了三倍体虹鳟卵巢发育停滞 (Krisfalusi et al, 1999)。韩英等 (2010b)的研究还发现, 在17月龄左右时三倍体雌性虹鳟呈现类雄性化发育趋势 (卵巢出现了去分化、再分化的异常现象), 但该特殊现象与普遍认为的鱼类在性腺分化后, 其生殖细胞已失去了性别可塑性的观点相悖。因此, 认为是三倍体虹鳟的卵原细胞胞囊化扰乱了雌性生殖细胞与其体细胞之间的互作, 导致滤泡细胞发育及其性类固醇激素合成通路受阻, 进而中断了睾酮转变为雌二醇的芳香化途径, 最终由于雌激素的缺失开启了卵巢转向雄性化的调控通路。然而, 对于三倍体虹鳟卵巢滞育的这种生理学解释仍无法令人满意, 尤其在三倍体虹鳟卵巢分化及滞育过程中, 雌性化通路的性腺特异基因与性类固醇激素间的联合调控机制, 以及相关基因的级联调控模式是怎么样的, 到目前为止仍不得而知。目前, 一些与性别决定和分化相关的基因已经在虹鳟中被鉴定出来, 包括Cyp19a1a、Foxl2、Dmrt1、Amh和Sox9等 (Marchand et al, 2000; Vizziano et al, 2007, 2008a, b; Orrego et al, 2010)。尽管Xu等 (2016)初步报道了不同发育阶段三倍体雌性虹鳟的上述基因的级联调控关系, 但对于其卵巢分化及早期滞育的调控机制尚未进行报道。我们检测了卵巢分化及其滞育早期三倍体雌性虹鳟的Cyp19a1a、Foxl2、Dmrt1、Amh和Aox9的相对表达量, 并分析了各基因间的级联调控模式以及在雌性化通路中的作用机制。
1 材料与方法 1.1 实验动物分组和采样遗传上全雌性三倍体 (XXX) 虹鳟和正常雌性二倍体 (XX) 虹鳟从黑龙江水产研究所获得。30dpf (Days post fertilization) 发眼卵放置在10℃水温中, 溶解氧为8mg/L, 然后转入到实验设备中即0.3m3的水族箱内, 具有再循环给水系统, 水温10±0.2℃, 恒定光周期 (12L:12D)。在65-68dpf时期, 仔鱼开始集中上浮, 开口摄食后分组 (每日饱和投喂商业饵料):实验组全为雌性三倍体 (XXX), 对照组为雌性二倍体 (XX), 各试验组均设三个平行组。从上浮仔鱼至4月龄, 每14d采集样本一次, 用于确定性腺分化时间, 每次采集仔鱼30尾, 放于液氮罐内冻存后, –80℃超低温冰箱保存, 用于RNA提取和real time RT-PCR分析; 幼鱼期 (5-10月龄) 每次采集样品10尾, 分5尾放于液氮罐内冻存, 用于RNA提取和real time RT-PCR分析, 5尾分别用Bouin’s固定 (用于组织学切片观察) 和2.5%戊二醛固定 (用于电镜观察), 7-10月龄采集血液。
1.2 RNA提取与转录用TRIzol试剂提取RNA。RNA数量和质量是通过紫外吸光度在260和280nm的Evolution 260 BIO分光光度计 (Thermo, 美国) 测定。吸光度比值为260/280nm, 超出1.7-2.1范围的样品将被排除。样品RNA的完整性通过生物分析仪2100专家系统 (安捷伦科技公司, 圣克拉拉, 美国) 验证, 所有的样本RIN值都在8-10。根据制造商的说明, 500ng, 总RNA 30μL反应体系, 使用反向转录核心工具酶 (98℃, 10s; 52℃, 30s; 72℃, 1min), 反转录成cDNA, 用10倍的核酸酶自由水将cDNA稀释。
1.3 实时PCR根据二倍体虹鳟的Cyp19a1a、Foxl2、Dmrt1、sox9和Amh序列作为模板, 利用Primer 5.0软件分别设计特异引物 (表 1), 检测二倍体虹鳟和雌性三倍体虹鳟性腺组织中基因的表达量情况, 并根据GenBank中二倍体虹鳟的β-actin基因序列设计内参引物 (表 1)。实时荧光定量PCR (ddCt法) 结果测定, 用ABI 7500 Realtime PCR仪 (Applied Biosystems, USA) 进行相对定量分析。使用SYBR® Premix Ex TaqTM Ⅱ (TaKaRa, Japan) 试剂盒, 依照说明书反应为20μL体系, 包括: SYBR® Premix Ex TaqTMⅡ(2×), 10μL; PCR Forward Primer (10μmol/L), 0.4μL; PCR Reverse Primer (10μmol/L), 0.4μL; ROX Reference Dye Ⅱ(50×)×3, 0.4μL; cDNA模板, 2.0μL; dH2O, 6.8μL。反应程序为95℃ 30s; 95℃ 5s, 60℃ 34s, 40个循环; 95℃ 15s, 60℃ 1min, 95℃ 15s。每个引物的效率 (Baron et al, 2005a, b, c), 由cDNA样本 (RNA反转录得到) 连续稀释测得, 重复3次。各基因转录水平通过β-actin (内参) 的表达量进行评定。将荧光定量PCR检测结果导出, 采用2–ΔΔCt法计算得到基因定量表达结果 (Bogerd et al, 2001)。
| 基因符号 | 基因名称 | GenBank序列号 | Forward Sequence | Reverse Sequence |
| Cyp19a1a | Cytochrome P450, family 19, subfamily a, polypeptide 1a | BX083177 | CTCTCCTCTCATACCTCAGGTT | AGAGGAACTGCTGAGTATGAAT |
| Foxl2 | Forkhead box L2 | CA341688 | TGTGCTGGATTTGTTTTTTGTT | GTGTCGTGGACCATCAGGGCCA |
| Dmrt1 | Doublesex and mab-3-related transcription factor 1 | AF209095 | GGACACCTCCTACTACAACTTCT | GTTCGGCATCTGGTATTGTTGGT |
| Sox9 | SRY-box containing gene 9 | AB006448.1 | ATGCAGGTGCCCAAGGCTCA | CTCTGGCTGGGGCTCATATA |
| Amh | Anti-Mullerian hormone | BX865284 | GCCACCATCTACAACTGCCAGG | TGCTCATCCAACTCCACCACCT |
| β-actin | Beta-actin | AJ438158 | ATCCTGACGGAGCGCGGTTACAGC | TGCCCATCTCCTGCTCAAAGTCCA |
尾椎静脉采血, 制备血清, –80℃保存待测。根据解剖和切片结果, 对照标记, 选取雌性血样, 采用放射免疫法测定Estradiol-17β (E2) 和Testosterone (T) 含量, 放免试剂盒为北京华英生物技术研究所生产 (125I-Na为英国Amersham公司生产, 17β-E2和T抗原及抗体为美国SIGMA公司生产)。
2 结果与分析 2.1 三倍体虹鳟卵巢分化在98dpf时期, 三倍体虹鳟已分化出卵巢结构 (图 1a), 其中具有明显的卵原细胞 (图 1b, 细胞核:三角符号) 和鞘膜细胞 (图 1a, 箭头); 卵原细胞胞质中具有大量圆形和带形的线粒体, 偶见高尔基体 (图 1c), 且细胞核较小, 具有2个核仁。在84dpf时期, 二倍体虹鳟卵巢分化速度较快, 卵巢中具有大量典型的卵泡结构 (图 1d), 卵原细胞大量增殖, 且具有多个核仁 (图 1e), 胞质细胞器大量增殖, 高尔基体较为发达 (箭头), 线粒体多位长带状 (图 1f, 三角形)。但随后的发育对三倍体虹鳟卵泡形成和卵细胞增殖均非常不利, 在154dpf (4月龄), 雌性三倍体虹鳟性腺整体表现为Ⅰ期卵巢结构 (图 1g), 卵泡结构明显 (图 1h, 箭头), 但卵巢组织间存在大量空隙, 绝大部分区域为无法区分的体细胞组织。在4月龄时期, 二倍体虹鳟卵巢已进入到卵母细胞发育时期 (Ⅱ-Ⅲ时期卵巢), 细胞核变小 (图 1i, 三角形), 核仁清晰 (图 1i, 箭头), 滤泡层内层为扁平的滤泡细胞 (图 1j, 三角形), 外层为鞘膜细胞 (图 1j, 箭头)。
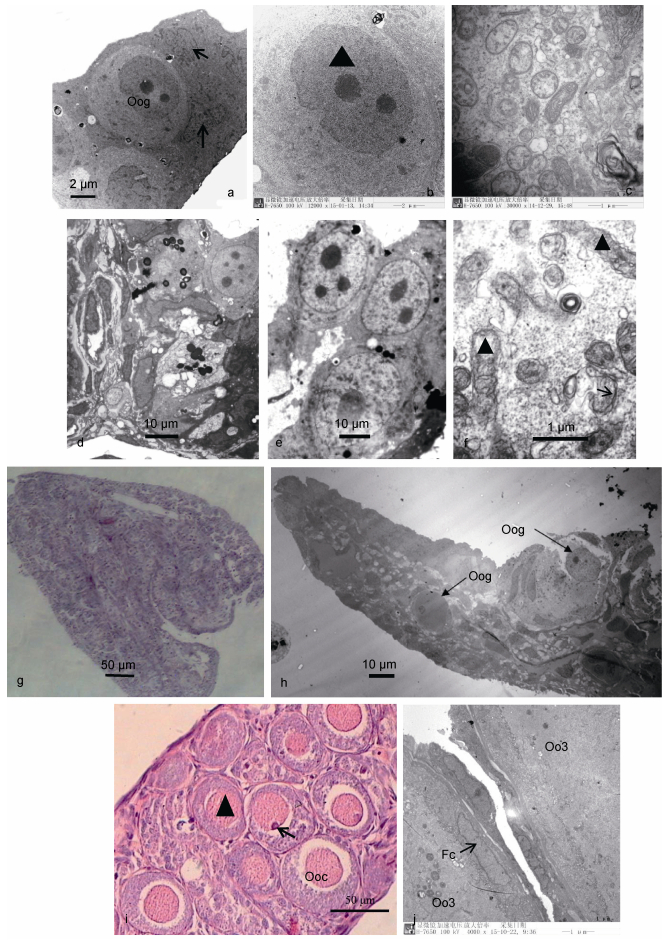 |
| 图 1 二倍体和三倍体虹鳟卵巢分化期结构 Fig. 1 The gonadal morphology of diploid and triploid female rainbow trout in developmental period 注: Oog: oogonium; Ooc: oocyte; Fc: follicle cells; Oo3: phase Ⅲ oocyte |
在5-7月龄时期, 三倍体雌性虹鳟卵巢组织发育停滞 (图 2a), 卵细胞始终停留在卵原细胞时期, 且核仁数量较少, 细胞形态不规则, 卵巢组织间隙充满了大量鞘膜细胞。8-9月龄时期, 三倍体虹鳟卵巢结构开始疏松化, 有大面积的空隙出现 (图 2b), 超微结构显示, 个别的空隙存有大量微绒毛, 而有些空隙间有膜状物存在 (图 2c)。10月龄时期, 三倍体虹鳟卵巢发生了退化, 卵巢结构空泡化更加明显, 间质空隙较大 (图 2d, 箭头)、卵原细胞开始重吸收 (图 2e, 箭头), 胞质内线粒体大量瓦解, 鞘膜细胞不断萎缩 (图 2e, 三角形), 甚至消失, 卵巢组织进入衰败期, 结缔组织发达, 出现了大量不能区分性质的生殖细胞群。该时期后期, 绝大部分空隙均被微绒毛所占据 (图 2f), 卵巢组织内存在庞大的膜系统 (图 2g, 三角形), 具有大量深染致密颗粒 (图 2g, 箭头), 类似于蛋白物质在性腺外周聚集。在5-10月龄时期, 二倍体虹鳟卵巢具有典型的产卵小板结构, 每个产卵板上分布有数量不等的卵原细胞, 其数量在短时期内大量增殖 (图 2h), 并不断发育成初级卵母细胞和次级卵母细胞 (Ⅲ实相卵母细胞)(图 2i)。该时期的最主要特征--卵母细胞发育及其滤泡细胞层的形成。
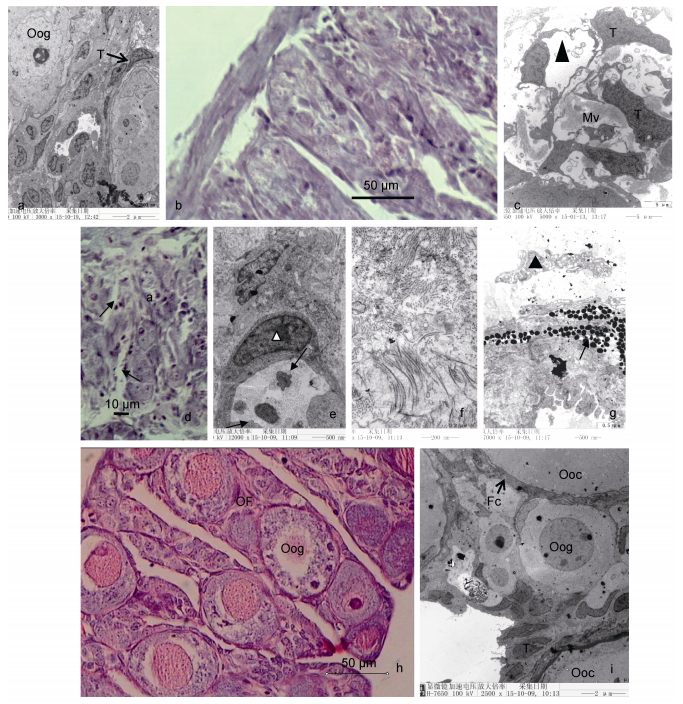 |
| 图 2 三倍体虹鳟滞育期卵巢形态结构 Fig. 2 The gonadal morphology of triploid female rainbow trout in development arrest period 注: Oog: oogonium; T: theca cells; Mv: microvilli; Ooc: oocyte; Fc: follicle cells; Oo3: phase Ⅲ oocyte; OF: ovigerous fold |
Foxl2和Cyp19a1a在二倍体虹鳟卵巢和精巢中均有表达, 它们在卵巢中表达量均呈逐渐升高趋势, 但精巢中的表达量非常低 (图 3a, 图 3b); 这两个基因在雌性三倍体虹鳟性腺中的表达呈先升高后降低趋势, 其表达量均在8月龄时期达到最大 (图 3a, 图 3b)。Dmrt1、Amh和Sox9在二倍体精巢和雌性三倍体性腺中的表达均呈不断上调的趋势, 但这些基因在二倍体精巢中的表达量显著高于在雌性三倍体中的表达 (图 3c, 图 3d, 图 3e), 这三个基因在二倍体虹鳟卵巢中的表达呈下调趋势 (图 3c, 图 3d, 图 3e)。
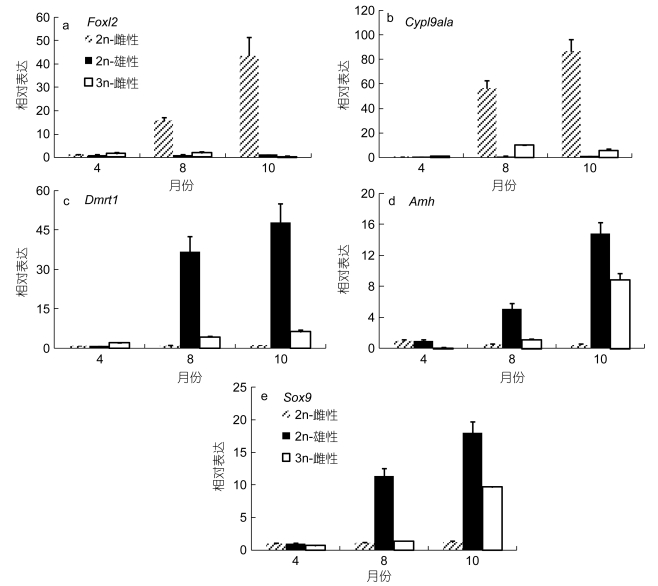 |
| 图 3 雌性3n体 (XXX) 虹鳟和2n体 (XX, XY) 虹鳟不同月龄的基因表达结果 Fig. 3 The gene expression profiles in gonads of 3n (XXX) and 2n (XX, XY) rainbow trout |
在10月龄时期, 雌性二倍体与三倍体虹鳟的血液E2差异不显著 (P > 0.05), 但雄性二倍体血液E2显著低于前两者 (P < 0.05);雄性二倍体虹鳟显著高于雌性三倍体虹鳟的血液T含量, 且雌性二倍体虹鳟的血液T含量显著低于前两者 (P < 0.05)(图 4a, 图 4b)。
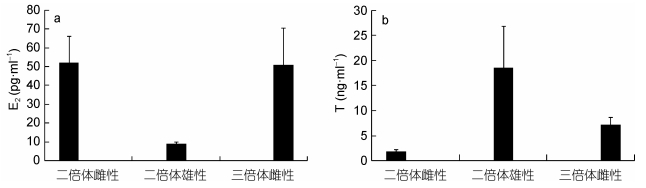 |
| 图 4 10月龄雌性3n体 (XXX) 虹鳟和2n体 (XX, XY) 虹鳟血液E2和T含量对照结果 Fig. 4 Sex steroid levels of 3n (XXX) and 2n (XX, XY) rainbow trout at 334dpf |
众所周知, 虹鳟的性别分化由性染色体所决定, 其自仔鱼首次接受外源性食物之时即开始进入性腺分化时期 (Thorgaard et al, 1979; Van Den Hurk et al, 1981)。但鱼类与哺乳动物的性别决定机制存在极大不同, 而且具有重塑机制, 因为早期大量研究表明, 性类固醇激素对于鲑科鱼类性别分化及性腺发育起关键调节作用, 外源性类固醇激素能将性分化期鱼类的遗传性别表型所逆转 (Johnstone et al, 1978; Goetz et al, 1979; Donaldson et al, 1982; Yamazaki, 1983)。本研究发现, 虹鳟的二倍体与三倍体卵巢分化时间前后相差不大, 但分化速度存在差异, 三倍体虹鳟卵巢分化速度较慢, 其卵细胞及其滤泡细胞的数量远远低于二倍体的, 且三倍体的卵细胞及其滤泡细胞形态不规则。尽管三倍体雌性虹鳟能够分化出典型卵巢结构, 但卵原细胞及其滤泡细胞数量有限。早期研究认为, 雌性三倍体虹鳟卵巢分化失常与第三套染色体干扰了初级卵母细胞第一次减数分裂有关 (Thorgaard et al, 1979; Chourrout et al, 1986)。显然这个结果无法令人满意, 尽管在三倍体卵巢败育过程中确实发生了生殖细胞与性腺体细胞互作机制失常的情况, 但在该过程性腺特异基因的调控以及与性类固醇激素的协同作用并未被考虑到, 可能基因调控在发生性逆转过程中起到了更为关键作用。
虹鳟即便多出一套染色体也能够生存和繁殖, 这一点是其他脊椎动物做不到的, 四倍体 (Carrasco et al, 1998) 和三倍体 (Lincoln et al, 1984; Benfey et al, 1986) 虹鳟精巢与二倍体虹鳟的有相同功能和形态, 然而, 三倍体雌性虹鳟是一个例外, 尽管它们能够存活, 且卵巢可以正常分化, 但幼鱼发育至5-7月龄时, 三倍体虹鳟卵巢仍停滞在Ⅰ期, 形态呈线状, 颜色透明; 而同时期二倍体卵巢已经发育至Ⅱ-Ⅲ期, 卵巢中聚集这大量卵母细胞和滤泡细胞。该时期三倍虹鳟卵巢中缺乏卵母细胞, 鞘膜细胞不断减少, 且形态不规则, 卵巢组织间隙出现大量微绒毛, 个别卵泡开始空泡化。本研究通过大量观察中发现, 从仔鱼上浮开始至5月龄阶段, 三倍体卵巢发育非常缓慢, 几乎维持在分化末期形态, 但卵原细胞及其附属滤泡细胞结构退化严重, 这与Krisfalusi等 (1999)关于三倍体雌性虹鳟性腺发育的研究结果相一致。虹鳟三倍体与二倍体卵巢形态相比, 三倍体卵巢呈线状, 并且缺少初级卵母细胞, 这与早期研究结果相一致 (Thorgaard et al, 1979; Lincoln et al, 1984; Krisfalusi et al, 1996)。本研究发现, 在4月龄之前, 三倍体雌性虹鳟卵巢就未见清晰可辨认的滤泡细胞层, 这说明卵巢组织只有鞘膜细胞在发挥功能, 由于缺少滤泡细胞, 导致卵细胞与脑垂体性腺轴的联系被切断, 因而使得其卵巢始终停滞在早期发育阶段。
有研究报道, 在尼罗罗非鱼 (Oreochromis niloticus) (Ijiri et al, 2008)、虹鳟 (Baron et al, 2005a, b, c; Vizziano et al, 2007, 2008b)、
总之, 在所有脊椎动物研究中, CYP19a是一种典型体细胞酶, 且维持着性腺中Cyp19a1a表达和内源性血清雌二醇合成, 并与体细胞分化状态直接相关。而影响体细胞分化状态的因素可能也依次调控了雌激素合成和卵巢分化结果。在对老鼠卵巢分化的研究发现, 雌激素是维持卵巢体细胞分化的必要条件 (Britt et al, 2003)。因此, 维持卵巢分化需要持续高水平的雌激素, 这可能是脊椎动物进化过程中的一个保守特征。可以推断雌性三倍体虹鳟卵巢滞育将导致其体细胞去分化, 这对于Cyp19a1a表达及雌二醇的合成存在抑制作用。因为这些雌激素是用来维持它们分化和继续发育的, 这可能产生一个负反馈圈, 之后去分化会增强。最近有研究表明, 通过芳香化酶抑制剂 (ATD) 处理雌鱼, 可使已经分化成雌性的鱼发生雄性化逆转 (Nakamura et al, 2003; Bhandari et al, 2006; Ogawa et al, 2008), 这清楚的表明持续高水平雌激素对于维持卵巢分化所起到的决定性作用 (或妨碍自生的精巢分化)。
| 韩英, 刘蔓, 张澜澜, 等, 2010a. 三倍体雄性虹鳟 (Oncorhynchus mykiss) 生殖发育研究. 东北农业大学学报, 41(7): 94–99 |
| 韩英, 刘蔓, 张澜澜, 等, 2010b. 三倍体雌性虹鳟卵巢发育的类雄性化趋势. 中国水产科学, 17(4): 739–744 |
| Baron D, Cocquet J, Xia X H, et al, 2004. An evolutionary and functional analysis of FoxL2 in rainbow trout gonad differentiation. Journal of Molecular Endocrinology, 33(3): 705–715 DOI:10.1677/jme.1.01566 |
| Baron D, Batista F, Chaffaux S, et al, 2005a. Foxl2 gene and the development of the ovary:a story about goat, mouse, fish and woman. Reproduction Nutrition Development, 45(3): 377–382 DOI:10.1051/rnd:2005028 |
| Baron D, Fostier A, Breton B, et al, 2005b. Androgen and estrogen treatments alter steady state messengers RNA (mRNA) levels of testicular steroidogenic enzymes in the rainbow trout, Oncorhynchus mykiss. Molecular Reproduction and Development, 71(4): 471–479 DOI:10.1002/mrd.v71:4 |
| Baron D, Houlgatte R, Fostier A, et al, 2005c. Large-scale temporal gene expression profiling during gonadal differentiation and early gametogenesis in rainbow trout. Biology of Reproduction, 73(5): 959–966 DOI:10.1095/biolreprod.105.041830 |
| Baron D, Houlgatte R, Fostier A, et al, 2008. Expression profiling of candidate genes during ovary-to-testis trans-differentiation in rainbow trout masculinized by androgens. General and Comparative Endocrinology, 156(2): 369–378 DOI:10.1016/j.ygcen.2008.01.016 |
| Baron D, Montfort J, Houlgatte R, et al, 2007. Androgen-induced masculinization in rainbow trout results in a marked dysregulation of early gonadal gene expression profiles. BMC Genomics, 8: 357 DOI:10.1186/1471-2164-8-357 |
| Benfey T J, Solar I I, De Jong G, et al, 1986. Flow-cytometric confirmation of aneuploidy in sperm from triploid rainbow trout. Transactions of the American Fisheries Society, 115(6): 838–840 DOI:10.1577/1548-8659(1986)115<838:FCOAIS>2.0.CO;2 |
| Bhandari R K, Nakamura M, Nagahama Y, 2006. Estrogen is essential for the maintenance of female sex in fish. Journal of Experimental Zoology A, 305A: 111 |
| Bogerd J, Blomenröhr M, Andersson E, et al, 2001. Discrepancy between molecular structure and ligand selectivity of a testicular follicle-stimulating hormone receptor of the African catfish (Clarias gariepinus). Biology of Reproduction, 64(6): 1633–1643 DOI:10.1095/biolreprod64.6.1633 |
| Brennan J, Capel B, 2004. One tissue, two fates:molecular genetic events that underlie testis versus ovary development. Nature Reviews Genetics, 5(7): 509–521 DOI:10.1038/nrg1381 |
| Britt K L, Findlay J K, 2003. Regulation of the phenotype of ovarian somatic cells by estrogen. Molecular and Cellular Endocrinology, 202(1-2): 11–17 DOI:10.1016/S0303-7207(03)00055-8 |
| Cao M X, Duan J D, Cheng N N, et al, 2012. Sexually dimorphic and ontogenetic expression of dmrt1, cyp19a1a and cyp19a1b in Gobiocypris rarus. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 162(4): 303–309 |
| Capel B, 2000. The battle of the sexes. Mechanisms of Development, 92(1): 89–103 DOI:10.1016/S0925-4773(99)00327-5 |
| Carrasco L A P, Doroshov S, Penman D J, et al, 1998. Long-term, quantitative analysis of gametogenesis in autotriploid rainbow trout, Oncorhynchus mykiss. Journal of Reproduction & Fertility, 113(2): 197–210 |
| Chourrout D, Chevassus B, Krieg F, et al, 1986. Production of second generation triploid and tetraploid rainbow trout by mating tetraploid males and diploid females-potential of tetraploid fish. Theoretical and Applied Genetics, 72(2): 193–206 DOI:10.1007/BF00266992 |
| Devlin R H, Nagahama Y, 2002. Sex determination and sex differentiation in fish:an overview of genetic, physiological, and environmental influences. Aquaculture, 208(3-4): 191–364 DOI:10.1016/S0044-8486(02)00057-1 |
| Donaldson E M, Hunter G A, 1982. Sex control in fish with particular reference to salmonids. Canadian Journal of Fisheries and Aquatic Sciences, 39(1): 99–110 DOI:10.1139/f82-012 |
| Goetz F W, Donaldson E M, Hunter G A, et al, 1979. Effects of estradiol-17β and 17α-methyltestosterone on gonadal differentiation in the coho salmon, Oncorhynchus kisutch. Aquaculture, 17(4): 267–278 DOI:10.1016/0044-8486(79)90083-8 |
| Graves J A M, 2002. The rise and fall of SRY. Trends in Genetics, 18(5): 259–264 DOI:10.1016/S0168-9525(02)02666-5 |
| Guan G J, Kobayashi T, Nagahama Y, 2000. Sexually dimorphic expression of two types of DM (Doublesex/Mab-3)-domain genes in a teleost fish, the Tilapia (Oreochromis niloticus). Biochemical and Biophysical Research Communications, 272(3): 662–666 DOI:10.1006/bbrc.2000.2840 |
| Guiguen Y, Fostier A, Piferrer F, et al, 2010. Ovarian aromatase and estrogens:a pivotal role for gonadal sex differentiation and sex change in fish. General and Comparative Endocrinology, 165(3): 352–366 DOI:10.1016/j.ygcen.2009.03.002 |
| Haugen T, Almeida F F L, Andersson E, et al, 2012. Sex differentiation in Atlantic cod (Gadus morhua L.):morphological and gene expression studies. Reproductive Biology and Endocrinology, 10: 47 DOI:10.1186/1477-7827-10-47 |
| Herpin A, Schartl M, 2011. Dmrt1 genes at the crossroads:a widespread and central class of sexual development factors in fish. FEBS Journal, 278(7): 1010–1019 DOI:10.1111/j.1742-4658.2011.08030.x |
| Hudson Q J, Smith C A, Sinclair A H, 2005. Aromatase inhibition reduces expression of FOXL2 in the embryonic chicken ovary. Developmental Dynamics, 233(3): 1052–1055 DOI:10.1002/(ISSN)1097-0177 |
| Ijiri S, Kaneko H, Kobayashi T, et al, 2008. Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish, the Nile tilapia Oreochromis niloticus. Biology of Reproduction, 78(2): 333–341 DOI:10.1095/biolreprod.107.064246 |
| Johnstone R, Simpson T H, Youngston A F, 1978. Sex reversal in salmonid culture. Aquaculture, 13(2): 115–134 DOI:10.1016/0044-8486(78)90106-0 |
| Koopman P, Loffler K A, 2003. Sex determination:the fishy tale of Dmrt1. Current Biology, 13(5): R177–R179 DOI:10.1016/S0960-9822(03)00117-9 |
| Koopman P, Münsterberg A, Capel B, et al, 1990. Expression of a candidate sex-determining gene during mouse testis differentiation. Nature, 348(6300): 450–452 DOI:10.1038/348450a0 |
| Krisfalusi M, Cloud J G, 1996. Effects of exogenous estradiol-17β on early growth and gonadal development of diploid and triploid female rainbow trout (Oncorhyncus mykiss). Developmental Genetics, 19(4): 302–303 DOI:10.1002/(ISSN)1520-6408 |
| Krisfalusi M, Cloud J G, 1999. Gonadal sex reversal in triploid rainbow trout (Oncorhynchus mykiss). Journal of Experimental Zoology Part A, 284(4): 466–472 DOI:10.1002/(ISSN)1097-010X |
| Lincoln R F, Scott A P, 1984. Sexual maturation in triploid rainbow trout, Salmo gairdneri Richardson. Journal of Fish Biology, 25(4): 385–392 DOI:10.1111/jfb.1984.25.issue-4 |
| Marchand O, Govoroun M, D'Cotta H, et al, 2000. DMRT1 expression during gonadal differentiation and spermatogenesis in the rainbow trout, Oncorhynchus mykiss. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1493(1-2): 180–187 DOI:10.1016/S0167-4781(00)00186-X |
| Munger S C, Aylor D L, Syed H A, et al, 2009. Elucidation of the transcription network governing mammalian sex determination by exploiting strain-specific susceptibility to sex reversal. Genes & Development, 23(21): 2521–2536 |
| Nakamoto M, Matsuda M, Wang D S, et al, 2006. Molecular cloning and analysis of gonadal expression of Foxl2 in the medaka, Oryzias latipes. Biochemical and Biophysical Research Communications, 344(1): 353–361 DOI:10.1016/j.bbrc.2006.03.137 |
| Nakamura M, Bhandari R K, Higa M, 2003. The role estrogens play in sex differentiation and sex changes of fish. Fish Physiology and Biochemistry, 28(1-4): 113–117 DOI:10.1023/B:FISH.0000030495.99487.17 |
| Ogawa S, Akiyoshi M, Higuchi M, et al, 2008. 'Post-sex differentiational' sex reversal in the female common carp (Cyprinus carpio). Cybium, 32(S2): 102–103 |
| Orrego R, McMaster M, Van Der Kraak G, et al, 2010. Effects of pulp and paper mill effluent extractives on aromatase CYP19a gene expression and sex steroid levels in juvenile triploid rainbow trout. Aquatic Toxicology, 97(4): 353–360 DOI:10.1016/j.aquatox.2010.01.002 |
| Penman D J, Piferrer F, 2008. Fish gonadogenesis. Part Ⅰ:genetic and environmental mechanisms of sex determination.Reviews in Fisheries Science, 16(S1): 16–34 |
| Piferrer F, 2011.Endocrine control of sex differentiation in fish.In:Farrell A P ed.Encyclopedia of Fish Physiology, from Gene to Environment, Vol.2.San Diego:Academic Press, 1490-1499 |
| Piferrer F, Ribas L, Díaz N, 2012. Genomic approaches to study genetic and environmental influences on fish sex determination and differentiation. Marine Biotechnology, 14(5): 591–604 DOI:10.1007/s10126-012-9445-4 |
| Raghuveer K, Senthilkumaran B, 2009. Identification of multiple dmrt1s in catfish:localization, dimorphic expression pattern, changes during testicular cycle and after methyltestosterone treatment. Journal of Molecular Endocrinology, 42(5): 437–448 DOI:10.1677/JME-09-0011 |
| Sinclair A H, Berta P, Palmer M S, et al, 1990. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature, 346(6281): 240–244 DOI:10.1038/346240a0 |
| Thorgaard G H, Gall G A E, 1979. Adult triploids in a rainbow trout family. Genetics, 93(4): 961–973 |
| Van Den Hurk R, Slof G A, 1981. A morphological and experimental study of gonadal sex differentiation in the rainbow trout, Salmo gairdneri. Cell and Tissue Research, 218(3): 487–497 DOI:10.1007/BF00210109 |
| Vizziano D, Randuineau G, Baron D, et al, 2007. Characterization of early molecular sex differentiation in rainbow trout, Oncorhynchus mykiss. Developmental Dynamics, 236(8): 2198–2206 DOI:10.1002/dvdy.v236:8 |
| Vizziano D, Baron D, Randuineau G, et al, 2008a. Rainbow trout gonadal masculinization induced by inhibition of estrogen synthesis is more physiological than masculinization induced by androgen supplementation. Biology of Reproduction, 78(5): 939–946 DOI:10.1095/biolreprod.107.065961 |
| Vizziano D, Baron D, MahèS, et al, 2008b. Estrogen treatment up-regulates female genes but does not suppress all early testicular markers during rainbow trout male-to-female gonadal transdifferentiation. Journal of Molecular Endocrinology, 41(5): 277–288 DOI:10.1677/JME-08-0039 |
| Volff J N, Nanda I, Schmid M, et al, 2007. Governing sex determination in fish:regulatory putsches and ephemeral dictators. Sexual Development, 1(2): 85–99 DOI:10.1159/000100030 |
| Wang D S, Kobayashi T, Zhou L Y, et al, 2007. Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with Ad4 binding protein/steroidogenic factor 1. Molecular Endocrinology, 21(3): 712–725 DOI:10.1210/me.2006-0248 |
| Wang D S, Zhou L Y, Kobayashi T, et al, 2010. Doublesex-and Mab-3-related transcription factor-1 repression of aromatase transcription, a possible mechanism favoring the male pathway in tilapia. Endocrinology, 151(3): 1331–1340 DOI:10.1210/en.2009-0999 |
| Xu G F, Huang T Q, Jin X, et al, 2016. Morphology, sex steroid level and gene expression analysis in gonadal sex reversal of triploid female (XXX) rainbow trout (Oncorhynchus mykiss). Fish Physiology and Biochemistry, 42(1): 193–202 DOI:10.1007/s10695-015-0129-7 |
| Yamaguchi T, Yamaguchi S, Hirai T, et al, 2007. Follicle-stimulating hormone signaling and Foxl2 are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder, Paralichthys olivaceus. Biochemical and Biophysical Research Communications, 359(4): 935–940 DOI:10.1016/j.bbrc.2007.05.208 |
| Yamazaki F, 1983. Sex control and manipulation in fish. Aquaculture, 33(1-4): 329–354 DOI:10.1016/0044-8486(83)90413-1 |
 2017, Vol. 48
2017, Vol. 48


