
中国海洋湖沼学会主办。
文章信息
- 吴海燕, 郭萌萌, 邴晓菲, 郑关超, 彭吉星, 谭志军, 翟毓秀. 2017.
- WU Hai-Yan, GUO Meng-Meng, BING Xiao-Fei, ZHENG Guan-Chao, PENG Ji-Xing, TAN Zhi-Jun, ZHAI Yu-Xiu. 2017.
- 液相色谱-四极杆/线性离子阱复合质谱测定双壳贝类中麻痹性贝类毒素
- SIMULTANEOUS IDENTIFICATION AND DETECTION OF PARALYTIC SHELLFISH TOXIN IN BIVALVE MOLLUSKS BY LIQUID CHROMATOGRAPHY COUPLED WITH QUADRUPOLE/LINEAR ION TRAP TANDEM MASS SPECTROMETRY
- 海洋与湖沼, 48(3): 508-515
- Oceanologia et Limnologia Sinica, 48(3): 508-515.
- http://dx.doi.org/10.11693/hyhz20161000229
-
文章历史
- 收稿日期:2016-10-26
- 收修改稿日期:2017-01-13
2. 国家水产品质量监督检验中心 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. National Center for Quality Supervision and Test of Aquatic Products, Qingdao 266071, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
麻痹性贝类毒素(paralytic shellfish toxins, PSTs)是分布最广、危害最严重的海洋生物毒素之一, 多次造成消费者中毒甚至死亡事件。世界卫生组织(WHO)规定贝类可食部分的PSTs限量为800μg STX eq/kg。目前, PSTs已成为海产贝类国际贸易壁垒主要的限制对象, 重点加以监控。鉴于PSTs毒素可由亚历山大藻属(Alexandrium)、膝沟藻属(Gonyaulax)和裸甲藻属(Gymnodinium)等双鞭甲藻类产生, 其风险性又因产毒藻种类、藻株、地理位置以及蓄积贝类等因素而存在很大差异(Zou et al, 2014), 给监控监管工作带来一定的困难。
现有检测方法中, 小鼠生物法(Mouse Bioassay, MBA)和液相色谱检测法是目前应用最多, 也是欧盟官方指定PSTs标准检测方法。而两种检测方法均有其局限性。MBA特异性、重现性和灵敏度都很差(Turner et al, 2012), 且仅能提供毒素总量的检出情况。液相方法前处理复杂需要经过柱前或者柱后衍生化, 检测过程中存在目标物共流出现象, 导致定性、定量不准确。不仅如此, 两种方法检测结果之间存在较大差异(Ben-Gigirey et al, 2012; Harju et al, 2015; Burrell et al, 2016)。因此, 欧盟、CAC等国际组织经过多轮磋商, 初步商定以液质联用技术作为标准方法, 以提升国际社会对PSTs监控的一致性, 确保消费者健康安全。目前, 国内外已建立了多种PSTs液质联用检测技术(Zhuo et al, 2013; 周磊等, 2014; 于慧娟等, 2015), 其主要缺点是:多残留折算毒力当量因子后的检出限总量与小鼠生物法比较不存在明显优势; 为了降低基质干扰, 在前处理过程中引入高倍数的稀释过程(Boundy et al, 2015), 使检测方法检出限偏高; 国家标准GB/T 5009.213-2016仅检测10种毒素, 而N-磺酰氨甲酰基类毒素在我国海域有广泛分布, 且该毒素可转化成其他高毒性物质。因此, 亟需建立包含全部13种限量毒素的检测方法。
针对上述问题, 本研究通过优化前处理条件, 降低前处理过程稀释倍数, 提高方法灵敏度; 采用Qtrap质谱的多反应监测(MRM)-信息依赖采集(IDA)-增强子离子扫描(EPI)模式, 建立了13种PSTs的同时定量检测与定性确证方法, 并用于渤海湾双壳贝类样品中PSTs的检测。
1 材料与方法 1.1 仪器、试剂与材料AB-5500 QTRAP液相色谱-四极杆/离子阱复合质谱(美国AB SCIEX公司), 配有电喷雾离子源(ESI); XW-80A旋涡混合器(上海医大仪器厂); Himac CR 22GⅡ高速离心机(日立Hitachi公司); Milli-Q超纯水仪(美国Millipore公司); 固相萃取装置(美国Supelco公司); 恒温水浴锅(上海蓝凯仪器仪表有限公司)。甲醇、乙腈(HPLC级, 美国Merk公司); 甲酸、乙酸铵(HPLC级, 瑞士Fluka公司); 超纯水(18.2 MΩ. cm); 石墨化碳黑固相萃取柱(ENVI-CarbTM, 250mg/3mL, 美国Supelco公司), 其他未作特殊说明的试剂均为分析纯。
PSTs标准溶液:石房蛤毒素STX, 新石房蛤毒素NEO, 膝沟藻毒素GTX1、GTX2、GTX3、GTX4, N-磺酰氨甲酰基类毒素GTX5、C1、C2, 脱甲酰基类毒素dcSTX、dcNEO、dcGTX2、dcGTX3标准品(加拿大国家海洋研究中心), 用75%乙腈水(含0.25%甲酸)稀释配制成混合溶液, 其中各组分浓度分别为: GTX5、NEO、STX、dcNEO、dcSTX为500ng/mL; GTX3、GTX4、dcGTX3、C2为200ng/mL; GTX1, GTX2为606ng/mL; C1为650ng/mL; dcGTX2为711ng/mL。
1.2 样品预处理 1.2.1 试样制备用清水将贝壳外表洗净。切断闭壳肌, 用重蒸馏水淋洗内部去除泥沙及其它异物, 仔细取出贝肉, 切勿割破贝体, 在筛子上平铺沥水5min, 然后将贝肉均质、混匀。冷冻贝类:在室温下, 使冷冻的样品(带壳或脱壳的)呈半冷冻状态, 按上述步骤开壳、淋洗取肉、均质。样品量约200g。如样品不能及时检测, 应-18℃以下保存备用。
1.2.2 提取称取5g试样于50mL离心管中, 加入5mL 1%乙酸水溶液, 涡旋混合90s。将离心管密封置于沸水中煮沸5min, 取出置于流水下冷却至室温。4500r/min离心10min, 待净化。
1.2.3 净化移取上述提取液1mL于2mL离心管中, 加入5μL氨水, 涡旋混匀。依次用2mL乙腈, 2mL 20%乙腈水溶液(含1%乙酸)、2mL 0.1%氨水溶液活化Supelco ENVI-Carb固相萃取柱, 加入500μL提取液, 再用700μL超纯水淋洗, 正压挤干, 最后用1mL 75%乙腈水(含0.25%甲酸)洗脱混匀, 过0.22μm滤膜于进样小瓶中, 4℃下保存, 供液相色谱-串联质谱分析。
1.3 液相色谱-串联质谱分析条件液相色谱条件: TSK-Amide-80(3μm, 2mm×15cm); 柱温: 40℃; 流速: 0.35mL/min; 进样量: 10µL; 流动相: A:水(含2mmol/L甲酸铵, 50mmol/L甲酸), B: 95%乙腈水溶液(含2mmol/L甲酸铵, 50mmol/L甲酸); 洗脱梯度: 0—3.0min, 80% B; 3.1—5.0min, 80%— 40% B; 5.1—10.0min, 40% B; 10.1—11.0min, 40%— 80% B; 11.1—13.0min, 80% B。
质谱条件:电喷雾离子源(ESI), 多反应监测(MRM), 正负离子切换模式; 喷雾电压: 5.5kV, -4.5kV; 离子源温度550℃; 碰撞气压力: Medium; 气帘气压力: 30psi; 雾化气压力GS1: 50psi; 辅助加热气压力GS2: 50psi。其他参数见表 1。
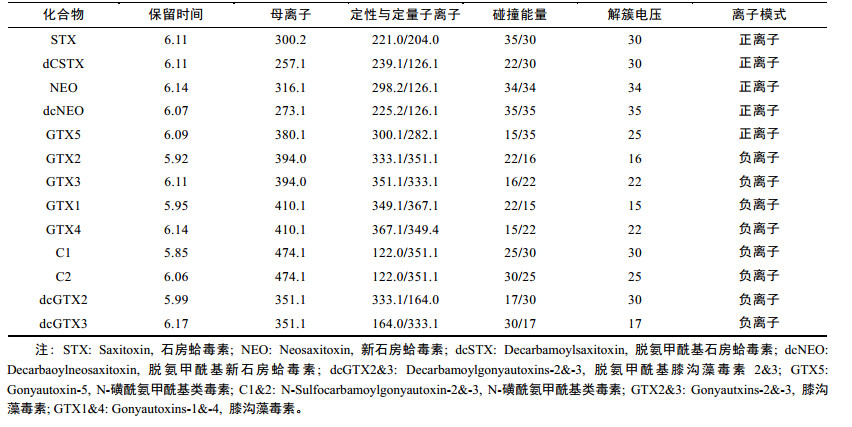
|
在电喷雾离子源下, 通过针泵进样, 正/负离子模式下进行母离子和碎片子离子的扫描, 以确定最佳MRM离子对。结果表明: STX类毒素, 包括STX, dcSTX, NEO, GTX5以及dcNEO在正离子模式下灵敏度高, 获得碎片信息丰富; 其他含硫麻痹性贝类毒素GTX以及C在负离子模式下分子离子峰[M-H]–有更好的离子响应, 较正离子模式灵敏度提高2—10倍, 所有的同分异构体可通过二级质谱进行区分。其中GTX1—4二级谱图中碎片峰较少, 主要为[M-H-H2O]–、[M-H-NHCO]–和[M-H-NHCO-H2O]–(李兆永等, 2014)。dcGTX和C类毒素, 二级谱图碎片峰较多, 但相对丰度低, 其中包括中性丢失-SO3碎片。而GTX5在负离子模式下响应更佳, 但无稳定碎片离子, 因此采用正离子模式下扫描, 以MRM离子对定性。
同时, 为了完善PSTs的定量检测与高精确度定性分析, 采用MRM检测结合IDA-EPI的采集模式, 在检测过程中通过预设条件, 对疑似检测结果触发EPI增强子离子扫描, 分别采集碰撞能量为(20, 35, 50, 35)±15eV的全扫描二级质谱图。如图 1所示, 同分异构体在相同的能量下, 离子丰度比有明显差异。该质谱图可与预采集的标准物质质谱谱库进行匹配(IF > 85%), 同时参考保留时间偏差( < 3%), 共同确证目标化合物, 提高分析结果可靠性。
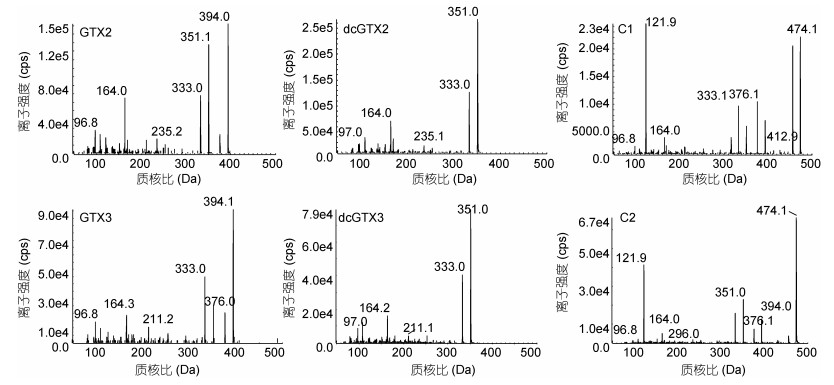 |
| 图 1 PSTs的二级质谱图(以C1, C2, dcGTX2, dcGTX3, GTX2, GTX3为例, CE为35±15eV) Fig. 1 The secondary mass spectra of paralytic shellfish toxins (C1, C2, dcGTX2, dcGTX3, GTX2, GTX3, CE 35±15eV) |
PSTs是强极性生物碱, 在13种目标化合物中, 8种化合物存在同分异构体, 包括GTX2与GTX3, GTX1与GTX4, dcGTX2与dcGTX3以及C1与C2。通过优化的色谱条件(Andrew, 2015; Boundy et al, 2015), 将同分异构体化合物分别选择正/负离子通道进行分析, 虽然可以解决部分离子响应差的问题, 但色谱条件较为苛刻, 稳定性差且对仪器要求较高。为了达到同分异构体化合物基线分离的目的, 本研究选用两种规格HILIC色谱柱: Acquity UPLC BEH Amide(1.7μm, 2.1×150mm)与TSK-Amide-80(3μm, 2.1× 150mm)。其中小粒径Waters色谱柱灵敏度优于TSK色谱柱, 但在普通高效液相色谱上分离度较差, 适用性不强。比较而言, 采用75%的乙腈水(含0.25%甲酸)作为标准品稀释溶液, 通过TSK色谱柱的分离, 即满足检测灵敏度要求且可将同分异构体达到基线分离, 故选用该色谱柱。如图 2中所示, 由于PSTs结构与极性相近, 出峰时间较为集中, 但采用本方法优化的色谱条件, 目标物在各自离子通道达到完全分离。根据同分异构体化合物标准品浓度差异结合其离子响应, 可明显区分出峰先后顺序, 通过保留时间进行定性。
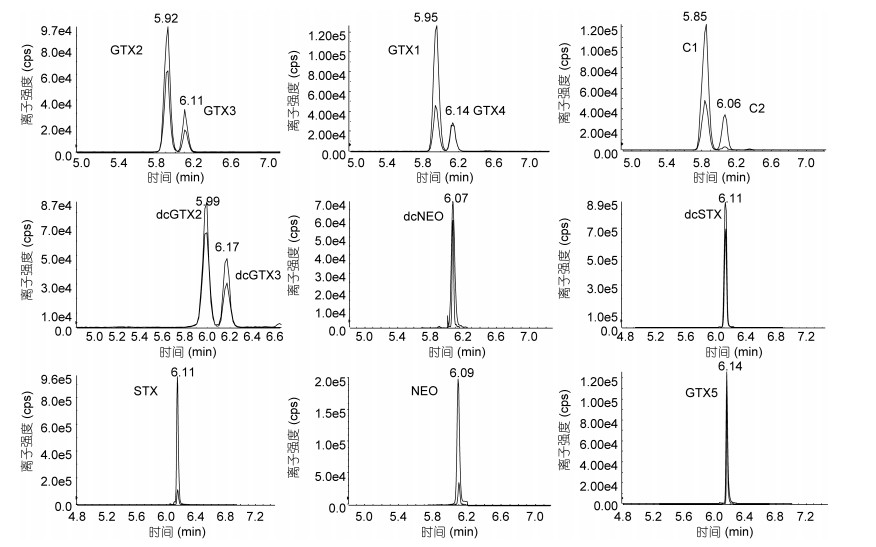 |
| 图 2 13种PSTs标准溶液提取离子色谱图(STX浓度为20.0ng/mL的混合标准溶液) Fig. 2 The extracted ion chromatograms of 13 PSTs standard solution ((mixed standard solution containing STX 20.0ng/mL)) |
为了提高PSTs的提取效率, 方法对比了四种常用PSTs提取试剂的提取效果, 分别为1%乙酸水溶液、0.1mol/L盐酸水溶液(EURLMB, 2014)、90%乙腈水溶液(Zhuo et al, 2013)以及80%乙腈水溶液(Sayfritz et al, 2008)(含0.1%甲酸)。每组实验设6个平行, 在扇贝基质中添加混合标准溶液200μL, 通过测试各组分含量折算回收率, 以确定最佳提取溶剂。
结果表明, 乙腈水溶液提取效率最差不足70%。1%乙酸水溶液提取效率优于0.1mol/L盐酸水溶液, 其回收率81.8%—108%之间。这是因为PSTs在酸性条件下稳定(pH < 4.50), 最佳pH为3.00。1%乙酸水溶液pH为2.90, 更有利于PSTs的提取。且N-磺酰氨甲酰基类毒素GTX5、C1、C2在盐酸提取液的加热过程中, 可发生转化(Botana, 2008)形成STX、GTX2、GTX3, 从而影响检测结果。本研究选用1%乙酸水溶液作为提取剂, 结合沸水浴加热5min的方式, 可模拟食物在胃中消化过程(Botana, 2008), 能较好地拟合毒素在人体中的作用方式, 是目前应用较为广泛的PSTs前处理方法。
2.3.2 固相萃取小柱的对比双壳贝类样品基质复杂, 其中对检测结果造成影响的主要包括盐和金属离子(Mg2+, Cu2+)等, 其基质抑制率在30.0%— 50.0%之间(于慧娟等, 2015)。方法比较了C18、HLB(Zhuo et al, 2013)以及石墨化炭黑固相萃取柱(Turner et al, 2015)对PSTs的净化与回收率影响。如图 3所示, 三种固相萃取小柱中, C18对于部分毒素化合物如GTX5保留性差, 而石墨化炭黑柱能更好地去除贝肉基质干扰, 显著提高目标物回收率。这是因为ENVI-Carb包含高强度的大表面积球形粒子, 可回收70%以上的强极性化合物。通过优化的洗脱液75%乙腈水(含0.25%甲酸), 保证目标化合物洗脱完全, 且显著降低前处理过程中的稀释倍数, 提高检测方法的灵敏度。
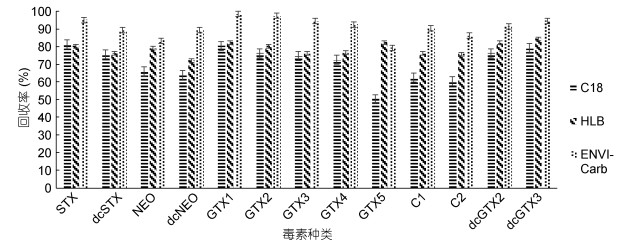 |
| 图 3 不同固相萃取小柱对回收率的影响(n=6) Fig. 3 Influence of solid phase extraction column on the ratio of recovery (n=6) 注: C18、HLB和ENVI-Carb为三种固相萃取小柱型号。 |
取适量PSTs混合标准溶液配制一系列浓度梯度的标准溶液依次测定(表 2)。以各组分的面积比值为纵坐标, 质量浓度为横坐标进行线性回归分析。采用空白扇贝基质添加相应混合标准溶液的方式, 以信噪比(S/N≥3) 确定各组分检出限(LOD), 以信噪比(S/N≥10) 确定各组分定量限(LOQ)。结果表明, 13种PSTs的线性良好, 其相关系数(R2)均大于0.99。13种PSTs在检出限下按毒性因子转换后相当于62.0µg STX eq/kg, 满足目前PSTs限量要求。
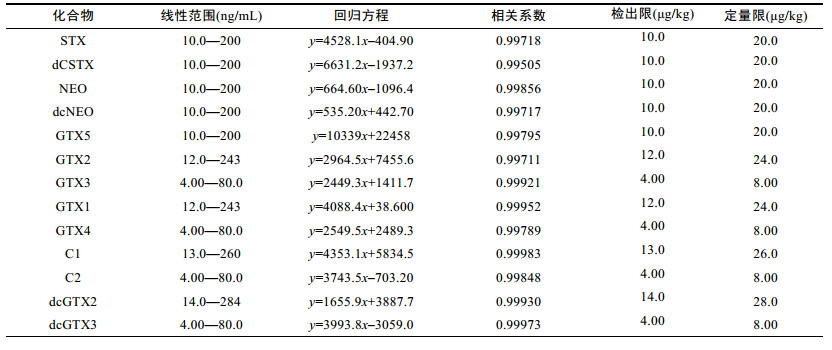
|
选取栉孔扇贝、贻贝、波纹巴非蛤和太平洋牡蛎四种贝类基质, 分别通过添加STX浓度为10.0、20.0、50.0μg/kg混合标准溶液进行测定, 设定每个浓度测试6个平行样本。结果见表 3, PSTs在四种贝类基质中的平均回收率与相对标准偏差分别为:栉孔扇贝(79.6±10.4)%—(98.6±6.40)%, 贻贝(81.4±4.67)%— (97.6±4.39)%, 波纹巴非蛤(82.6±6.33)%—(99.4± 6.38)%, 太平洋牡蛎(80.4±13.8)%—(98.8±6.54)%。方法的准确度与精密度良好, 能满足双壳贝类样品检测过程中13中PSTs的准确测量要求。
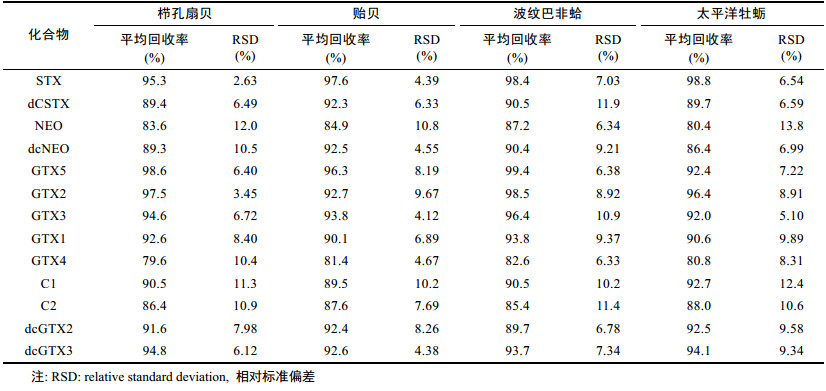
|
分别采集2016年5月渤海湾海域贝类样品10份, 包括贻贝、太平洋牡蛎、栉孔扇贝、毛蚶和波纹巴非蛤各2份, 发现部分样品PSTs总量较高, 最高达到627µg STX eq/kg(表 4), 接近PSTs限量标准800 µg STX eq/kg。对检出样品进行谱库检索, 匹配度 > 85.0%。主要的毒素种类为STX、GTX1、GTX2、GTX3、GTX4以及C1、C2。其中以贻贝中毒素蓄积含量最高, 扇贝次之, 且蚶样品所有毒素均未检出。
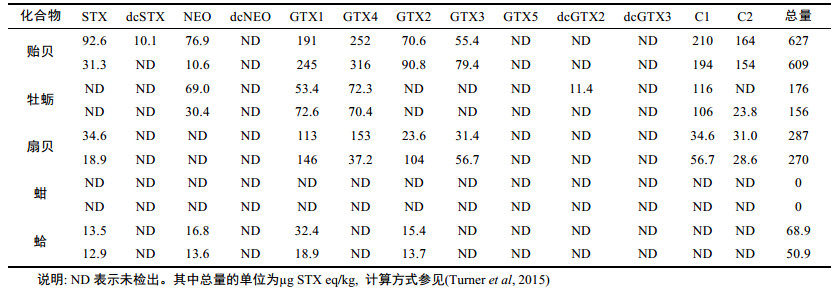
|
在实际样品检测过程中, 应用方法中的定性功能发现其中STX疑似阳性样品。如图 4所示, 目标峰的液相保留时间偏差 < 3%, 虽MRM离子对离子比率差异明显, 但在实际检测过程中容易发生误判, 定性为STX检出。应用本研究中检测方法, 将样品中STX的EPI谱图与谱库中STX相同高能量下的EPI谱图比对, 其匹配度IF值为52.6% < 85.0%判定值, 故可判定样品中未检出STX。综上所述, 本方法适用于复杂样品基质条件下的PSTs定性检测, 可提高检测结果的可信度。
 |
| 图 4 标准样品中STX与实际样品中疑似STX的提取离子流图与二级碎片谱图 Fig. 4 XIC and EPI chromatography of STX in standard sample and actual sample 注: XIC: extracted ion chromatogram, 总离子流图; EPI: enhanced product ion chromatography, 增强子离子扫描谱图 |
本研究建立了适用于双壳贝类中13种PSTs的液相色谱-四级杆/离子阱复合质谱检测方法。本方法灵敏度高, 稳定性好。在实际样品检测中, 检出高含量阳性样品, 并对疑似阳性样品进行了准确的定性判定。本方法为进一步开展全国贝类中PSTs的监测, 保障消费者的食用安全以及实现贝类出口贸易复关, 提供了有效的技术手段。
| 于慧娟, 蔡友琼, 黄宣运, 等, 2015. 10种麻痹性贝类毒素的固相萃取及液相色谱-串联质谱测定法. 海洋渔业, 37(4): 364–371 |
| 李兆永, 陈军辉, 王帅, 等, 2014. 麻痹性贝毒素电喷雾质谱负离子模式分析特征. 质谱学报, 35(1): 8–15 DOI:10.7538/zpxb.2014.35.01.0008 |
| 周磊, 杨宪立, 武爱波, 等, 2014. 麻痹性贝类毒素的安全评价与检测技术研究进展. 世界科技研究与发展, 36(3): 336–342 |
| Ben-Gigirey B, Rodríguez-Velasco M L, Otero A, et al, 2012. A comparative study for PSP toxins quantification by using MBA and HPLC official methods in shellfish. Toxicon, 60(5): 864–873 DOI:10.1016/j.toxicon.2012.05.022 |
| Botana L M, 2008. Seafood and Freshwater Toxins:pharmacology, physiology, and detection. New York: CRC Press, 167 |
| Boundy M J, Selwood A I, Harwood D T, et al, 2015. Development of a sensitive and selective liquid chromatography-mass spectrometry method for high throughput analysis of paralytic shellfish toxins using graphitised carbon solid phase extraction. Journal of Chromatography A, 1387: 1–12 DOI:10.1016/j.chroma.2015.01.086 |
| Burrell S, Crum S, Foley B, et al, 2016. Proficiency testing of laboratories for paralytic shellfish poisoning toxins in shellfish by QUASIMEME:A review. TrAC Trends in Analytical Chemistry, 75: 10–23 DOI:10.1016/j.trac.2015.09.004 |
| EURLMB, 2014. Standard Operating Procedure for PSP toxins by Mouse Bioassay. Vigo, Spain: European Union Reference Laboratory for Marine Biotoxins, |
| Harju K, Rapinoja M, Avondet M, et al, 2015. Results of a saxitoxin proficiency test including characterization of reference material and stability studies. Toxins, 7(12): 4852–4867 DOI:10.3390/toxins7124852 |
| Sayfritz S J, Aasen J A B, Aune T, 2008. Determination of paralytic shellfish poisoning toxins in Norwegian shellfish by liquid chromatography with fluorescence and tandem mass spectrometry detection. Toxicon, 52(2): 330–340 DOI:10.1016/j.toxicon.2008.06.001 |
| Turner A D, Dhanji-Rapkova M, Algoet M, et al, 2012. Investigations into matrix components affecting the performance of the official bioassay reference method for quantitation of paralytic shellfish poisoning toxins in oysters. Toxicon, 59(2): 215–230 DOI:10.1016/j.toxicon.2011.11.013 |
| Turner A D, McNabb P S, Harwood D T, et al, 2015. Single-laboratory validation of a multitoxin ultra-performance LC-hydrophilic interaction LC-MS/MS method for quantitation of paralytic shellfish toxins in bivalve shellfish. Journal of AOAC International, 98(3): 609–621 DOI:10.5740/jaoacint.14-275 |
| Zhuo L Y, Yin Y C, Fu W S, et al, 2013. Determination of paralytic shellfish poisoning toxins by HILIC-MS/MS coupled with dispersive solid phase extraction. Food Chemistry, 137(1-4): 115–121 DOI:10.1016/j.foodchem.2012.10.010 |
| Zou C, Ye R M, Zheng J W, et al, 2014. Molecular phylogeny and PSP toxin profile of the Alexandrium tamarense species complex along the coast of China. Marine Pollution Bulletin, 89(1-2): 209–219 DOI:10.1016/j.marpolbul.2014.09.056 |
 2017, Vol. 48
2017, Vol. 48


