中国海洋湖沼学会主办。
文章信息
- 彭松耀, 李新正, 徐勇, 王洪法, 张宝琳. 2017.
- PENG Song-Yao, LI Xin-Zheng, XU Yong, WANG Hong-Fa, ZHANG Bao-Lin. 2017.
- 十年间黄海大型底栖动物优势种的变化
- VARIATION OF MACROBENTHOS IN YELLOW SEA IN PAST 10 YEARS
- 海洋与湖沼, 48(3): 536-542
- Oceanologia et Limnologia Sinica, 48(3): 536-542.
- http://dx.doi.org/10.11693/hyhz20160900200
-
文章历史
- 收稿日期:2016-09-20
- 收修改稿日期:2017-01-04
2. 中国科学院海洋研究所 青岛 266071
2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
底栖动物是指生活史的全部或大部分时间生活于水体底部的水生动物类群, 是水生生态系统的重要组成部分。大型底栖动物是其中个体大于0.5mm的类群。大型底栖动物种类多, 生活周期长; 对逆境逃避相对迟缓, 易于采集; 不同种类对水质的敏感性差异大, 受外界干扰后群落结构的变化趋势可以预测(Ponti et al, 2004; Munari et al, 2008); 在水生态系统的物质和能量流动中起着重要作用(Masero et al, 1999)。大型底栖动物优势种是对群落结构的形成有明显控制作用的物种, 是底栖生态系统物质循环和能量流动中主要的消费者和转移者(Day et al, 1989), 其变化能够准确地反映所处环境长期、宏观变化(Fukumori et al, 2008), 是表征大型底栖动物群落结构特征的重要参数。
黄海是我国建国后开展大型底栖动物生态学研究最早、最多、最深入的海域。近60年来几乎所有涉及黄海海域的国内和国际合作项目均包括了大型底栖动物部分, 在其野外调查和实验室研究中积累了大量原始数据和样品, 发表了大量阶段性研究成果(李新正, 2011)。但迄今为止, 尚没有针对这一海域大型底栖动物优势种长期变化的研究。国内仅针对渤海湾大型底栖动物优势种的演变及物种的分类多样性进行过较全面的研究(Zhou et al, 2012; 蔡文倩等, 2013)。本研究基于2000年至2011年6个航次黄海大型底栖动物的调查数据, 对大型底栖动物优势种的演变进行研究, 旨在为黄海生物多样性及黄海生态动力学过程研究提供基础数据和资料。
1 材料和方法 1.1 调查区域和时间本研究于2000年10月、2001年3月、2003年6月、2004年1月、2011年4月和8月分别搭乘“北斗号”和“科学三号”科学考察船对黄东海大型底栖动物进行调查采样。调查站位的设置见图 1。
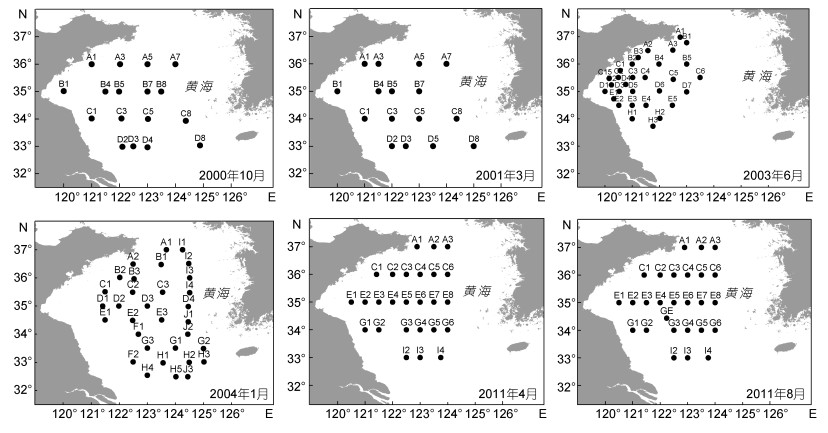 |
| 图 1 6个航次采样站位图 Fig. 1 Deployment of sampling sites in six cruises |
每个站位用0.1m2 Gray-O’Hara箱式采泥器重复采样2次, 用底层孔径为0.5mm的套筛筛选, 两次取样获得的样品合并作为该站该次采样样品, 所获样品用75%的酒精固定后带回实验室, 随后进行种类鉴定、个体计数、称重(使用0.001g精度天平)。2011年2个航次每个采样站底层水温(bottom water temperature, Temp)、水深(depth)和盐度(salinity)用多功能温盐深仪(Sea bird CTD)现场同步测定。
1.3 数据分析运用优势度计算公式对大型底栖动物优势种进行分析。优势度计算公式如下: Y=(ni/N)fi, 式中N为样品中所有种类的总个体数目, ni为第i种的个体数; fi为该种在各站位出现的频率; 当物种优势度Y > 0.02时, 该种即为优势种(徐兆礼等, 1989)。
选取2011年2个航次底层水温、盐度以及水深等环境因子, 运用指示种分析(indicator species analysis, ISA)对不同深度范围大型底栖动物群落进行分析, 根据反应物种指示作用的指示值(Indicator value, Ⅳ)筛选不同深度大型底栖动物指示种。指示值的统计显著性用蒙特卡洛检验P值来决定。其计算公式为: Ⅳ=100(RA×RF)(Dufrêne et al, 1997; Dai et al, 2006)。其中RA为物种的相对丰度(relative abundance, RA), RF为相对频度(relative frequency, RF)。
调查水域被划分为A组(0—30m水深)、B组(30—50m水深)、C组(50—70m水深)和D组(70m以下水深)。
指示种分析在R语言环境中完成。采样站位图由Surfer 7绘制。
2 结果 2.1 黄海大型底栖动物优势种对2000年10月至2011年8月共6个航次黄东海大型底栖动物群落优势种进行分析(表 1)。结果表明, 2000年10月航次黄海大型底栖动物优势种为薄索足蛤Thyasira tokunagai, 优势度为0.0211。
2001年3月无优势种。2003年6月优势种为寡鳃齿吻沙蚕Nephtys oligobranchia和薄索足蛤, 优势度分别为0.0215和0.0208。2004年1月优势种为橄榄胡桃蛤Nucula tenuis、薄索足蛤、角海蛹Ophelina acuminata和蜈蚣欧努菲虫Onuphis geophiliformis, 优势度分别为0.0293、0.0244、0.0224和0.0213。
2011年4月优势种为掌鳃索沙蚕、浅水萨氏真蛇尾Ophiura sarsii vadicola、角海蛹和薄索足蛤, 优势度分别为0.062、0.0401、0.0258和0.0247。长叶索沙蚕Lumbrineris longiforlia优势度较高, 为0.0182。
2011年8月优势种为背蚓虫Notomastus latericeus、掌鳃索沙蚕、紫蛇尾Ophiopholis mirabilis和浅水萨氏真蛇尾, 优势度分别为0.0859、0.0441、0.0288和0.0229。对6个航次黄海大型底栖动物群落优势种进行分析, 环节动物多毛纲为优势种的大型底栖动物有5种, 分别为角海蛹、寡鳃齿吻沙蚕、掌鳃索沙蚕、背蚓虫和蜈蚣欧努菲虫。软体动物为优势种大型底栖动物的有2种, 分别为薄索足蛤、橄榄胡桃蛤。棘皮动物为优势种的大型底栖动物2种, 分别为浅水萨氏真蛇尾和紫蛇尾。
黄海大型底栖动物优势种的时空分布见图 2。寡鳃齿吻沙蚕分布在黄海近岸水域, 蜈蚣欧努菲虫分布在黄海冷水团中部, 薄索足蛤和角海蛹分布在黄海冷水团的外缘, 橄榄胡桃蛤和浅水萨氏真蛇尾分布在黄海冷水团区域, 掌鳃索沙蚕和背蚓虫分别为2011年4月和8月航次广布种, 分布在黄海大部分调查水域。紫蛇尾分布在海州湾水域。
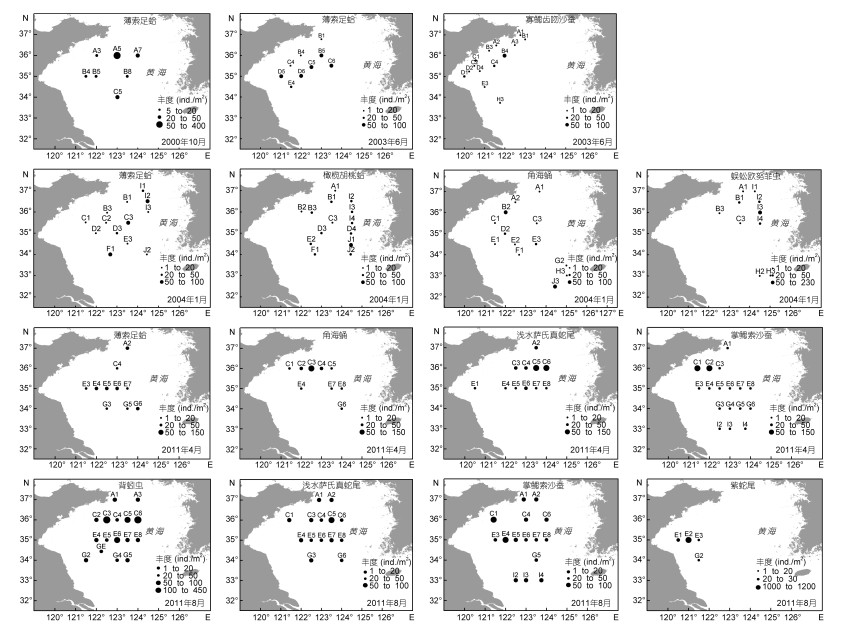 |
| 图 2 黄海优势种时空分布 Fig. 2 Distribution of macrobenthos dominant species in the Yellow Sea in six cruises |
以水深、底层水温和盐度为环境因子对2011年2个航次黄海大型底栖动物指示种进行分析(表 2), 结果表明:黄海30—50m水深范围, 由一些小型多毛类和端足类组成, 如寡节甘吻沙蚕、日本角吻沙蚕Goniada japonica、双眼钩虾一种和美人虾一种; 50m以下水域主要由双壳类软体动物和棘皮动物组成, 如浅水萨氏真蛇尾、日本短吻蛤Periploma japonicum、日本梯形蛤Portiandia japonica、奇异指纹蛤、拟节虫Praxillella praetermissa和背蚓虫组成。2011年4月和8月航次, 黄海不同水深指示种组成存在差异, 仅50m以下水深指示种组成较稳定, 主要的指示种为浅水萨氏真蛇尾。
生物群落中不同种群在群落的性质和功能上的地位和作用均不同(覃林等, 2004)。优势种通常控制群落中的能量流动和物质循环(Roy, 1998), 并且通过数量上的优势及种间关系(竞争、捕食和他感作用)来增强对生境资源的利用程度。优势种在群落中占有较大的生境范围, 具较高的生产力(戈峰, 2008), 其分布主导着同一群落中其他生物的分布格局。时间尺度上优势种的变化与生物群落的演变密切相关(Santos et al, 1983)。
本研究黄海大型底栖动物优势种主要由多毛类和棘皮动物组成。与中国近海大型底栖动物优势种的研究结果进行比较发现(表 3), 南北黄海(刘录三等, 2003; 曲方圆等, 2009)、黄海近岸(胡颢琰等, 2000; 徐勤增等, 2009)优势种的组成与本研究结果较一致。黄海近岸大型底栖动物优势种主要由一些小型多毛类组成, 这些优势种均生活在软泥底质, 与沉积物有机质含量密切相关, 如胶州湾水域大型底栖动物优势种不倒翁虫多分布在沉积物有机质程度较丰富区域(王金宝等, 2006)。受黄海冷水团控制, 黄海冷水团区域主要由一些冷水种组成, 近十年优势种组成较稳定, 如紫蛇尾Ophiopholis mirabilis和奇异指纹蛤Acila mirabilis等太平洋温带种在北黄海种类数上占一定优势(胡颢琰等, 2000)。本研究与渤海(李荣冠, 2003)、长江口(李宝泉等, 2007; 刘录三等, 2008)和浙江近岸大型底栖动物优势种的组成相比差异明显。导致这种差异的主要原因是, 渤海、长江口水域调查范围集中在局部水域, 一些物种具有群居生物学特性, 丰度和优势度较高, 如渤海湾北部(刘录三等, 2008)光滑河蓝蛤Potamocorbula laevis和豆形胡桃蛤。此外大型底栖动物区系差异(李荣冠, 2003; 李新正, 2011)、沿岸及入海径流(李宝泉等, 2007; Zhou et al, 2007)、人类活动(刘录三等, 2008)等导致底栖生境异质性也是不同水域大型底栖动物优势种组成差异的主要原因。
根据6个航次黄海大型底栖动物优势种空间分布结果(图 2), 可以看出寡鳃齿吻沙蚕分布在黄海近岸水域。蔡立哲等(2001)和王金宝等(2006)研究表明寡鳃齿吻沙蚕的分布与底质类型、饵料的丰富程度和沉积物有机质丰富状况有关。蜈蚣欧努菲虫分布在黄海冷水团中部。属于北温带冷水种(吴旭文, 2013)。薄索足蛤和角海蛹分布在黄海冷水团外缘, 时空分布受黄海冷水团变化的影响。胡颢琰等(2000)认为北黄海近岸海域, 由于黄海冷水团的影响, 底层水温较低, 冷水种明显增多。刘录三等(2003)研究表明南黄海春秋季黄海刺梳鳞虫、蜈蚣欧努菲虫、长吻沙蚕、掌鳃索沙蚕、角海蛹、不倒翁虫、橄榄胡桃蛤、薄索足蛤、日本美人虾和浅水萨氏真蛇尾分布较广、数量较多、优势度较高。本研究黄海大型底栖动物优势种薄索足蛤、角海蛹、橄榄胡桃蛤和浅水萨氏真蛇尾分布主要受黄海冷水团影响。掌鳃索沙蚕和背蚓虫分别为2011年4月和8月航次广布种, 分布在黄海大部分调查水域。紫蛇尾分布在海州湾水域, 是局部优势种。
沉积物状况(Zhou et al, 2007; Como et al, 2009)、水团(Zhang et al, 2012)、洋流(刘录三等, 2002)和入海径流(王金辉等, 2004; Zhou et al, 2012) 与大型底栖动物空间分布密切相关。本研究发现冷水性的优势种薄索足蛤、橄榄胡桃蛤和浅水萨氏真蛇尾通常分布在黄海冷水团范围内, 与曲方圆等(2009)和Zhang等(2012)的研究结果相一致。Haedrich等(1980)曾经报道过浅水萨氏真蛇尾广泛分布于北半球冷水区域, 喜群居, 局部数量较高, 优势地位明显。此外, 多毛类优势种背蚓虫、掌鳃索沙蚕和角海蛹多分布于南黄海冷水团区域、南黄海北部近岸海域及长江口附近海域, 这些区域沉积物有机质和叶绿素的含量较高(Meng et al, 2007; 于培松等, 2011)。背蚓虫和掌鳃索沙蚕分属小头虫科和索沙蚕科, 多分布在有机质程度较高的软底质中, 被用于指示环境的状况(Pearson et al, 1978; Belan, 2003)。其中背蚓虫在2011年8月黄海冷水团和长江口海域的分布范围明显扩大, 这一现象可能与沉积物有机质随水团的扩散及丰水期入海径流的大量补充有关。背蚓虫生长周期较短, 幼体补充速度较快也是重要的影响因素。本研究另一优势种寡鳃齿吻沙蚕主要分布在黄海沿岸水域。沿岸海域通常受沿岸流及人类活动的影响, 沉积物有机质丰富程度较高。本研究同时运用指示种分析, 结合水深、水温和盐度等环境因子分析, 黄海0—30m水深区域指示种为日本角吻沙蚕、寡节甘吻沙蚕、美人虾和双眼钩虾。这些物种主要是一些近岸物种, 分布与有机质饵料丰富程度有关。30m水深以上区域的指示种主要是背蚓虫、奇异指纹蛤、掌鳃索沙蚕和浅水萨氏真蛇尾, 这一结果与优势种的结果较一致; 表明水深、水温和盐度是影响黄海优势种分布的主要因素, 但是其他环境因素如沉积物粒径、沉积物有机质和水文因素应被加入指示种分析。
从时间角度来看, 2000年至2011年黄海大型底栖动物优势种发生了改变, 优势种主要类群为多毛类, Zhou等(2007)研究表明过渡捕捞导致底层鱼类锐减以及沉积物有机质含量增加是大型底栖动物群落小型化主要的影响因素。冷水团水域优势种组成较稳定, 薄索足蛤和浅水萨氏真蛇尾处于优势地位, 优势种的稳定性可能与冷水团海域较深、水温较低、受人类影响较小有关; 而沿岸水域一些优势种如豆形短眼蟹Xenophthalmus pinnotheroides、角管虫属种类Ditrupa sp.和哈氏刻肋海胆Temnopleurus hardwickii减少或消失(Zhang et al, 2012), 可能反映沿岸沉积物环境受扰动程度较大(Zhou et al, 2007, 2012), 这与长江口底栖动物演变的研究结果(刘录三等, 2008)相一致。
4 结论根据2000年10月、2001年3月、2003年6月、2004年1月、2011年4月和8月黄海大型底栖动物调查资料, 十年间黄海共出现优势种9种, 其中多毛类5种, 分别为寡鳃齿吻沙蚕、背蚓虫、掌鳃索沙蚕, 角海蛹和蜈蚣欧努菲虫, 软体动物2种, 为薄索足蛤和橄榄胡桃蛤。棘皮动物2种, 分别为浅水萨氏真蛇尾和紫蛇尾。其中薄索足蛤为4个航次黄海大型底栖动物优势种, 浅水萨氏真蛇尾、角海蛹和掌鳃索沙蚕分别为2个航次黄海大型底栖动物的优势种。2011年8月航次背蚓虫优势度最高为0.0859。
对2011年2个航次调查区域深度进行划分, 结合底层水温度和盐度等环境因子进行指示种分析, 结果表明:黄海0—30m水深区域指示种为日本角吻沙蚕、寡节甘吻沙蚕、美人虾和双眼钩虾; 30m水深以上区域的指示种主要为背蚓虫、奇异指纹蛤、掌鳃索沙蚕和浅水萨氏真蛇尾。指示种组成与优势种的组成较一致, 表明水深、底层水温度和盐度是影响黄海大型底栖动物优势种分布的主要因素。
时间尺度上黄海近岸水域底栖动物优势种发生了变化, 小型的多毛类如背蚓虫和掌鳃索沙蚕等成为近岸主要的优势种。冷水团水域优势种较稳定, 优势种主要为浅水萨氏真蛇尾和薄索足蛤。
致谢 中国科学院海洋研究所海洋生物分类和系统演化实验室王金宝、董栋、马林、孙德海、寇琦、隋吉星、甘志彬、黄慧等参加了野外调查和实验室样品分析工作, 在此一并致以衷心的感谢。| 于培松, 薛斌, 潘建明, 等, 2011. 长江口和东海海域沉积物粒径对有机质分布的影响. 海洋学研究, 29(3): 202–208 |
| 戈峰, 2008. 现代生态学. 2版. 北京: 科学出版社, 276-290 |
| 王瑜, 刘录三, 刘存岐, 等, 2010. 渤海湾近岸海域春季大型底栖动物群落特征. 环境科学研究, 23(4): 430–436 |
| 王金宝, 李新正, 王洪法, 2006. 胶州湾多毛类环节动物优势种的生态特点. 动物学报, 52(1): 63–69 |
| 王金辉, 黄秀清, 刘阿成, 等, 2004. 长江口及邻近水域的生物多样性变化趋势分析. 海洋通报, 23(1): 32–39 |
| 冯剑丰, 王秀明, 孟伟庆, 等, 2011. 天津近岸海域夏季大型底栖生物群落结构变化特征. 生态学报, 31(20): 5875–5885 |
| 刘录三, 李新正, 2002. 东海春秋季大型底栖动物分布现状. 生物多样性, 10(4): 351–358 |
| 刘录三, 李新正, 2003. 南黄海春秋季大型底栖动物分布现状. 海洋与湖沼, 34(1): 26–32 DOI:10.11693/hyhz200301004004 |
| 刘录三, 孟伟, 田自强, 等, 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027–3034 |
| 曲方圆, 于子山, 刘卫霞, 等, 2009. 北黄海春季大型底栖生物群落结构. 中国海洋大学学报(自然科学版), 39(S1): 109–114 |
| 吴旭文, 2013.中国海矶沙蚕科和欧努菲虫科的分类学和地理分布研究.北京:中国科学院大学博士学位论文, 27-32 |
| 李宝泉, 李新正, 王洪法, 等, 2007. 长江口附近海域大型底栖动物群落特征. 动物学报, 53(1): 76–82 |
| 李荣冠, 2003. 中国海陆架及邻近海域大型底栖生物. 北京: 海洋出版社, 21-28 |
| 李新正, 2011. 我国海洋大型底栖生物多样性研究及展望:以黄海为例. 生物多样性, 19(6): 676–684 |
| 周然, 覃雪波, 彭士涛, 等, 2014. 渤海湾大型底栖动物调查及与环境因子的相关性. 生态学报, 34(1): 50–58 |
| 胡颢琰, 黄备, 唐静亮, 等, 2000. 渤、黄海近岸海域底栖生物生态研究. 东海海洋, 18(4): 39–46 |
| 贾海波, 胡颢琰, 唐静亮, 等, 2011. 浙江南部近岸海域大型底栖生物生态. 应用海洋学学报, 30(4): 132–137 |
| 徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13–15 |
| 徐勤增, 李瑞香, 王宗灵, 等, 2009. 南黄海夏季大型底栖动物分布现状. 海洋科学进展, 27(3): 393–399 |
| 覃林, 余世孝, 王永繁, 2004. 广东黑石顶不同森林类型的优势种分析. 中山大学学报(自然科学版), 43(5): 83–85 |
| 蔡文倩, 孟伟, 刘录三, 等, 2015. 渤海湾大型底栖动物群落优势种长期变化研究. 环境科学学报, 33(8): 2332–2340 |
| 蔡立哲, 厉红梅, 刘俊杰, 等, 2001. 深圳河口泥滩三种多毛类的数量季节变化及污染影响. 生态学报, 21(10): 1649–1653 |
| Belan T A, 2003. Benthos abundance pattern and species composition in conditions of pollution in Amursky Bay (the Peter the Great Bay, the Sea of Japan). Marine Pollution Bulletin, 46(9): 1111–1119 DOI:10.1016/S0025-326X(03)00242-X |
| Como S, Magni P, 2009. Temporal changes of a macrobenthic assemblage in harsh lagoon sediments. Estuarine, Coastal and Shelf Science, 83(4): 638–646 DOI:10.1016/j.ecss.2009.05.024 |
| Dai X, Page B, Duffy K J, 2006. Indicator value analysis as a group prediction technique in community classification. South African Journal of Botany, 72(4): 589–596 DOI:10.1016/j.sajb.2006.04.008 |
| Day J W, Hall C A S, Kemp W M et al, 1989. The estuarine bottom and benthic subsystem. In:Day J W, ed. Estuarine Ecology. New York:John Wiley & Sons, 338-376 |
| Dufrêne M, Legendre P, 1997. Species assemblages and indicator species:the need for a flexible asymmetrical approach. Ecological Monographs, 67(3): 345–366 |
| Fukumori K, Oi M, Doi H, et al, 2008. Bivalve tissue as a carbon and nitrogen isotope baseline indicator in coastal ecosystems. Estuarine, Coastal and Shelf Science, 79(1): 45–50 DOI:10.1016/j.ecss.2008.03.004 |
| Haedrich R L, Rowe G T, Polloni P T, 1980. The megabenthic fauna in the deep sea south of New England, USA. Marine Biology, 57(3): 165–179 DOI:10.1007/BF00390735 |
| Masero J A, Pérez-González M, Basadre M, et al, 1999. Food supply for waders (Aves:Charadrii) in an estuarine area in the Bay of Cádiz (SW Iberian Peninsula). Acta Oecologica, 20(4): 429–434 DOI:10.1016/S1146-609X(99)00125-3 |
| Meng Z C, Xu K D, Lei Y L, 2011. Community composition, distribution, and contribution of microbenthos in offshore sediments from the Yellow Sea. Continental Shelf Research, 31(14): 1437–1446 DOI:10.1016/j.csr.2011.06.008 |
| Munari C, Mistri M, 2008. The performance of benthic indicators of ecological change in Adriatic coastal lagoons:Throwing the baby with the water?. Marine Pollution Bulletin, 51(1): 95–105 |
| Pearson T H, Rosenberg R, 1978. Macrobenthic succesion in relation to organic enrichment and pollution of the marine environment. Oceanography and Marine Biology:An Annual Review, 16: 229–311 |
| Ponti M, Abbiati M, 2004. Quality assessment of transitional waters using a benthic biotic index:the case study of the Pialassa Baiona (northern Adriatic Sea). Aquatic Conservation:Marine and Freshwater Ecosystems, 14(S1): S31–S41 DOI:10.1002/(ISSN)1099-0755 |
| Santos S L, Bloom S A, 1983. Evaluation of succession in an estuarine macrobenthic soft-bottom community near Tampa, Florida. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 68(5): 617–632 DOI:10.1002/(ISSN)1522-2632 |
| Zhang J L, Xu F S, Liu R Y, 2012. Community structure changes of macrobenthos in the South Yellow Sea. Chinese Journal of Oceanology and Limnology, 30(2): 248–255 DOI:10.1007/s00343-012-1076-0 |
| Zhou H, Zhang Z N, Liu X S, et al, 2007. Changes in the shelf macrobenthic community over large temporal and spatial scales in the Bohai Sea, China. Journal of Marine Systems, 67(3-4): 312–321 DOI:10.1016/j.jmarsys.2006.04.018 |
| Zhou H, Zhang Z N, Liu X S, et al, 2012. Decadal change in sublittoral macrofaunal biodiversity in the Bohai Sea, China. Marine Pollution Bulletin, 64(11): 2364–2373 DOI:10.1016/j.marpolbul.2012.08.014 |
 2017, Vol. 48
2017, Vol. 48