中国海洋湖沼学会主办。
文章信息
- 唐盟, 周进. 2017.
- TANG Meng, ZHOU Jin. 2017.
- 福建三沙湾网箱养殖对多毛纲动物群落结构的影响
- IMPACTS OF CAGE FARMING ON POLYCHAETE COMMUNITY IN SANSHA BAY, FUJIAN PROVINCE
- 海洋与湖沼, 48(3): 543-552
- Oceanologia et Limnologia Sinica, 48(3): 543-552.
- http://dx.doi.org/10.11693/hyhz20160900205
-
文章历史
- 收稿日期:2016-09-26
- 收修改稿日期:2017-01-03
2. 上海海洋大学 上海 201306
2. Shanghai Ocean University, Shanghai 201306, China
针对海水养殖活动对于区域内大型底栖动物群落结构的影响已有较多研究, 如国外(爱琴海Hios岛附近水域、澳大利亚塔西玛利亚邻近水域和地中海东岸邻近水域)及国内部分海湾内(大亚湾、三沙湾、象山港和乐清湾)鱼类、贝类、海带等养殖活动的影响(高爱根等, 2003; 黄洪辉等, 2005; Edgar et al, 2005; Klaoudatos et al, 2006; 杨俊毅等, 2007; Zhou, 2012; 麻骜等, 2014; Tomassetti et al, 2016)。底栖动物所含门类较多, 包括多毛纲动物(Polychaeta)、甲壳动物(Crustaceans)、软体动物(Mollusca)、棘皮动物(Echinodermata)、腔肠动物(Coelenterata)等, 且不同类群对于环境胁迫的响应特征存在差异。近年来部分研究聚焦于特定底栖类群, 如针对棘皮动物(李新正等, 2004)、多毛纲动物(王金宝等, 2006a, b; Del-Pilar-Ruso et al, 2011; Carvalho et al, 2013; Zan et al, 2015) 和软体动物(李宝泉等, 2005; Bergquist et al, 2005)等。目前此类研究总体数量较少。
多毛纲动物(或称多毛类动物)是海洋无脊椎动物中习见类群, 数量优势明显, 在海洋沉积物扰动及有机物埋藏等方面作用独特(Hutchings, 1998), 部分物种为环境指示生物(吴宝铃, 1981; Samuelson, 2001; Cardoso et al, 2007), 是研究人类活动环境影响效应的理想实验类群(Tomassetti et al, 2005; Sukumaran et al, 2011; Martinez-Garcia et al, 2013)。三沙湾位于福建省东北部沿海(26°30′—26°58′N, 119°26′—120°10′E), 是我国近海最为典型的养殖海湾之一。海湾内大黄鱼养殖网箱数量众多, 近年来年产量约为12.8万吨(2015年宁德市统计年鉴, http://www.stats-fjnd.gov.cn)。已有部分研究表明网箱养殖活动可以从一定程度上改变水域底栖环境(黄标等, 2002; 吴芳等, 2005; 朱峰等, 2013)和大型底栖动物群落结构(Zhou, 2012; 纪炜炜等, 2012; 周进等, 2011a, 2012), 而关于养殖活动对于多毛类群落结构的影响知之甚少。
本文拟基于群落结构时间(不同采样时间)和空间(网箱养殖和非网箱养殖水域)差异, 阐释网箱养殖活动对多毛纲动物群落影响, 包括群落物种组成、典型群落参数、群落结构及其和典型环境因子关系。本研究旨在了解三沙湾多毛纲群落结构的现状和网箱养殖活动对其影响, 为阐释大黄鱼网箱养殖活动的环境效应提供基础资料。
1 材料与方法 1.1 样品采集与计数三沙湾养殖活动主要包括网箱(大黄鱼)和非网箱(海带和龙须菜)养殖(图 1)。本研究于2009年5月至2010年1月期间对三沙湾进行9个航次调查。调查水域内共设置20个采样站位(1—20号站位), 包括两种类型:网箱养殖站位(水域)和非网箱养殖站位(水域)。其中, 12个站位(1、3、5—7、9—12、15—17号站位)位于网箱养殖水域(采样站位和养殖网箱距离小于15m); 8个站位(2、4、8、13—14、18—20号站位)位于非网箱养殖水域(采样站位和养殖网箱距离大于600m, 包括无养殖水域和海藻养殖水域)。部分已有研究表明三沙湾内海藻养殖对底栖群落无显著影响(Zhou, 2012; 纪炜炜等, 2012), 故本研究选择部分海藻养殖站位作为对照站位。
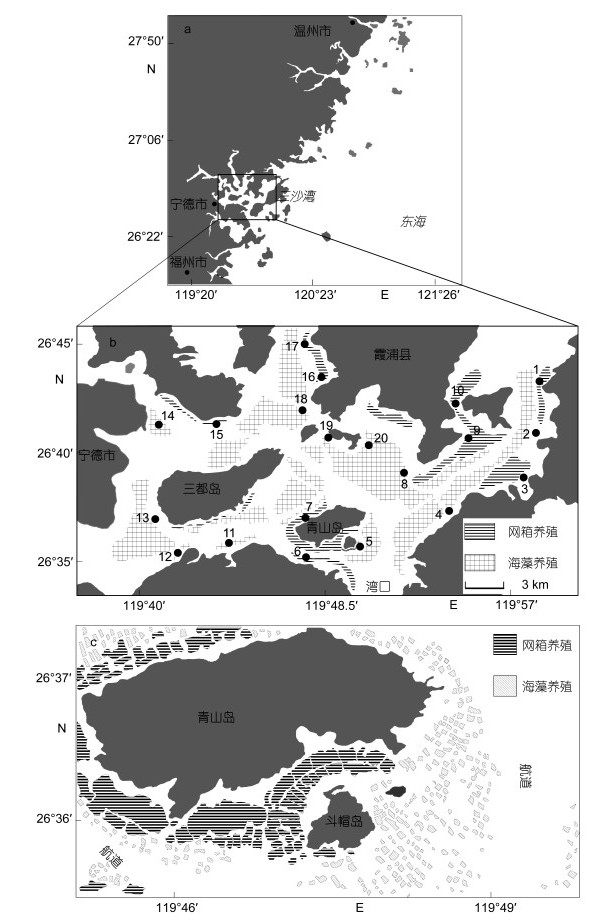 |
| 图 1 三沙湾采样站位(a、b)和典型水产养殖活动模式图(c) Fig. 1 Sampling stations (a、b) and conceptual figure of mariculture activities (c) in Sansha Bay |
样品采集使用底面积为0.1m2的抓斗式采泥器, 重复取样2次合并为1个样品。使用0.5mm孔径筛网进行筛捡, 多毛纲动物标本用75%的酒精固定, 带回实验室, 鉴定、称重和计数。温度(temperature)、盐度(salinity)、pH、溶解氧(dissolved oxygen)、水深(depth)和氧化还原电位(redox potential)现场测定, 化学需氧量(chemical oxygen demand)和总氮(total nitrogen)在实验室内测定。底栖动物采集及环境因子测定的具体方法依据《国家海洋监测规范(2007)》。
1.2 数据分析分析网箱养殖活动和时间两种因素对三沙湾多毛纲群落参数的影响时, 本文选取最为典型的6种群落参数:物种数(S)、丰度(N)、生物量(B)、Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)、Margalef丰富度指数(d)。使用Primer软件(6.0版本, 下同)中DIVERSE程序计算上述参数。
为检验多毛纲动物群落参数在不同水域和时间上的组间差异, 首先使用SPSS软件(16.0版本, 下同)中的Shapiro-wilk和Kolmogorov-Smirnov分析方法检验群落参数数据是否符合正态分布, 再使用Levene分析方法检验数据方差在组间是否具有齐性。因本文群落参数数据呈正态分布且方差在组间具有齐性, 因此采用SPSS软件中双因素方差分析方法(two-way ANOVA)。
为分析三沙湾多毛类动物的群落相似性, 采用Primer软件中双因素相似性分析(two-way ANOSIM)方法检验不同航次、不同水域多毛类动物群落的相似性(数据选取多毛类动物丰度值)。数据经平方根转换后根据Bray-Curtis相似性系数构建相似性矩阵, 采用类平均法进行等级聚类分析。利用CLUSTER聚类和多维标度分析(multi dimensional scaling, MDS)方法对其进行群落划分, 并使用SIMPER分析研究各群落中关键物种及其贡献率。
研究多毛纲动物分布特征和环境因子关系时, 本文选取8种典型环境因子, 即温度、盐度、pH、溶解氧、水深、氧化还原电位、化学需氧量和总氮。使用CANOCO 4.5软件中典型对应分析(canonical correspondence analysis, CCA)方法分析多毛类动物群落中优势物种(丰度值位于前20位的物种)的分布格局与上述环境因子之间的关系。因采样条件所限, 本研究仅在网箱养殖活动高峰季节(6月份)较为完整地采集了环境因子数据。分析时首先对两种水域物种变量进行除趋势对应分析(detrended correspondence analysis, DCA), 以确定群落数据分布类型(单峰型分布或线性分布)。因本研究数据DCA分析结果显示四个轴中梯度最大值超过4, 因此后续分析选择基于单峰模型的CCA方法。同时采用向前引入法逐步筛选出显著的环境变量, 并使用Monte Carlo方法进行置换检验(Leps et al, 2003)。
2 结果 2.1 群落组成三沙湾两种水域(网箱养殖和非网箱养殖)多毛类动物包含科、物种数量相当, 网箱养殖区共采集多毛类动物28科65种, 非网箱养殖区共采集多毛类动物28科69种。但两者的物种组成存在差异, 丝鳃虫科(Cirratulidae)(共7种, 占总物种数10.77%)和海稚虫科(Spionidae)(共6种, 占总物种数9.23%)在网箱养殖水域具数量优势, 而非网箱养殖水域中优势类群则为多鳞虫科(Polynoidae)和海稚虫科, 两科同为6种, 各占总物种数8.70%。
网箱养殖水域多毛纲优势物种的丰度及丰度比均高于非网箱养殖区, 例如前20位优势物种平均丰度在两种水域分别是104.06和48.29ind./m2, 丰度比分别是57.59%和46.96%。各航次前5位丰度优势物种组成特点如图 2所示, 网箱养殖水域优势物种主要包括不倒翁虫(Sternaspis scutata)(2009年8月、12月以外航次均具较高丰度及丰度比, 变化范围分别为1.67—55.00ind./m2和5.71%—20.00%)、蜇龙介科一种(Terebellides sp.)(2009年5月、7—11月航次具较高丰度及丰度比, 变化范围分别为1.67—111.67ind./m2和13.33%—36.12%)和欧努菲虫(Onuphis geographis)(2009年8—10月、12月和2010年1月航次具较高丰度及丰度比, 变化范围分别为3.33—10.83ind./m2和6.56%—22.22%)。非网箱养殖水域优势物种主要包括不倒翁虫(2009年6月、10月以外航次均具较高丰度及丰度比, 变化范围分别为2.50—20.00ind./m2和5.21%—22.22%)和异足索沙蚕(Lumbrineris heteropoda)(2009年5—7月、10月、11月航次具较高丰度及丰度比, 变化范围分别为3.75ind./m2—30.00ind./m2和6.30%—25.01%) (图 2)。
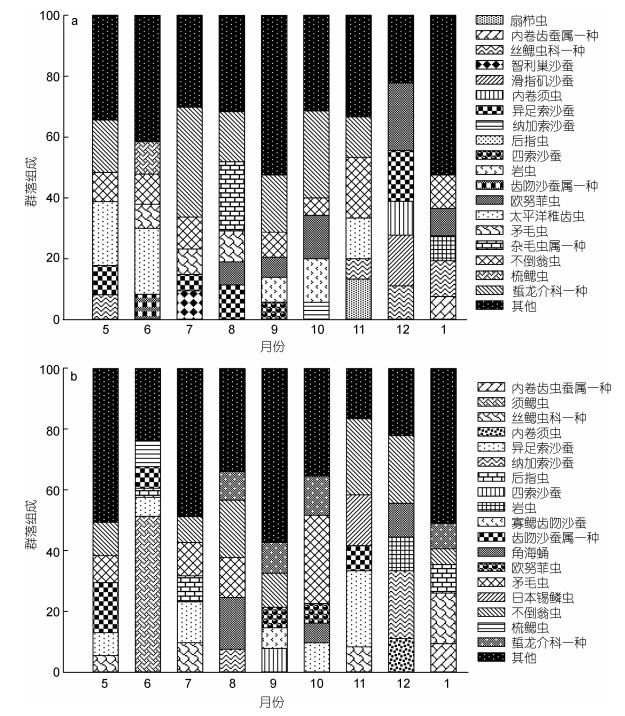 |
| 图 2 网箱养殖(a)和非网箱养殖(b)水域优势物种丰度占群落总丰度百分比(%)(丰度值位居前5位物种) Fig. 2 The occupation (%) of the top five most-abundant species in fauna in cage farming to those in non-cage farming waters in nine cruises |
在研究的6种典型群落参数中, 仅栖息密度在网箱养殖和非网箱养殖水域间略有差异, 两者分别为180.54和124.83ind./m2。两水域生物量分别为8.67和10.69g/m2, Shannon-Wiener多样性指数分别为1.63和1.51, Pielou均匀度指数分别为0.68和0.60, Margalef丰富度指数分别为0.61和0.66。除生物量在7月航次网箱养殖水域出现最高值外, 两水域其他参数均在6月或9月出现最高值, 且在10—12月份间出现较低值。
双因素(养殖方式和采样时间两个因素)方差分析结果显示两个因素交互作用不显著(P > 0.05), 故在此仅考虑两个因素独立效应。就两个因素独立效应而言, 各群落参数在网箱养殖和非网箱养殖水域间无显著差异(P > 0.05), 表明三沙湾网箱养殖活动尚未对多毛纲典型群落参数产生明显影响; 但不同采样时间内各群落参数存在极显著差异(P < 0.01), 表明研究水域多毛纲群落参数时间变化明显(表 1)。
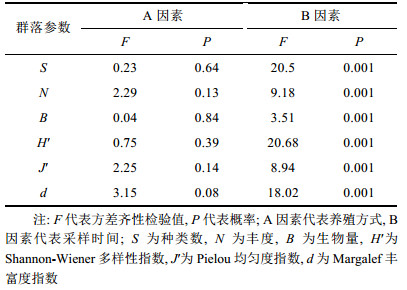
|
群落结构相似性双因素方差分析(two-way ANOSIM)显示, 群落结构仅在时间上存在极显著差异(R=0.329, P < 0.01);在所有两两比较结果(共36组, 图 3)中, 除5月和6月(R=0.06, P > 0.05)、5月和7月(R=0.09, P > 0.05)、6月与7月(R=0.06, P > 0.05)、10月和12月(R=0.06, P > 0.05) 共4组群落结构不存在显著差异外(P > 0.05), 其他各时间组之间的多毛纲动物群落结构均存在显著差异(P < 0.05)。群落结构在网箱养殖和非网箱养殖水域间无显著差异(R=0.051, P > 0.05)。
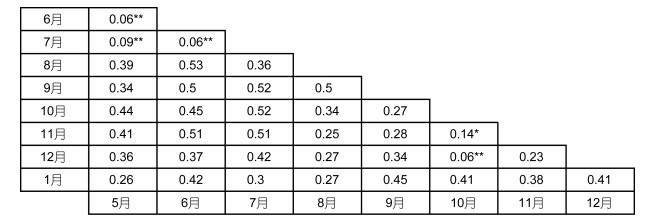 |
| 图 3 三沙湾多毛纲动物群落结构相似性方差分析(two-way ANOSIM)在时间上两两比较结果矩阵图 Fig. 3 Correlation matrix of two-way ANOSIM multiple temporal comparison in polychaete community structure in Sansha Bay 注:图内数值为相关性系数R值; **代表P > 0.05, 不存在显著差异, *代表P < 0.05, 存在显著差异, 其他代表P < 0.01, 存在极显著差异 |
在本研究9个航次采集样品中, 2009年5月航次站位间相似性最高, 此航次聚类分析结果22%相似性水平显示, 研究水域多毛纲动物可分为两个群落(图 4), 群落Ⅰ包括4个站位(13—15和17站位), 群落Ⅱ包括15个站位(1—12、16、19和20站位); 网箱养殖和非网箱养殖站位较为均匀地分布于两群落, 群落间无显著差异(R=-0.009, P > 0.05)。SIMPER分析结果显示, 群落Ⅰ关键种包括丝鳃虫属一种(Cirratulus sp.)(贡献率51.04%)、沙蚕属一种(Nereis sp.)(贡献率16.81%)、吻沙蚕属一种(Glycera sp.)(贡献率16.02%)和滑指矶沙蚕(Eunice indicus)(贡献率10.02%); 群落Ⅱ关键种包括异足索沙蚕(贡献率24.30%)、齿吻沙蚕属一种(Nephtys sp.)(贡献率22.76%)和杂毛虫属一种(Poecilochaetus sp.)(贡献率19.07%)。
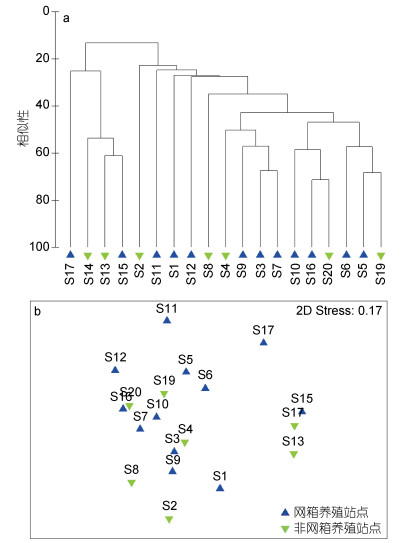 |
| 图 4 三沙湾2009年5月多毛纲动物群落Cluster聚类图(a)和MDS排序图(b) Fig. 4 Cluster (a) and non-metric MDS (b) analyses on polychaete community structure in Sansha Bay in May, 2009 |
因研究水域多个月份的群落聚类结果均表明网箱养殖和非网箱养殖水域群落结构差异不显著, 故合并两水域数据分析三沙湾多毛纲动物群落与典型环境因子之间的关系。优势物种(丰度值位于前20位)丰度值的除趋势对应分析结果显示最长轴长度为7.57, 故采用典型对应分析方法, 结果显示前两轴特征值分别为0.88和0.49, 种类和环境因子排序轴的相关系数高达0.95和0.83, 物种和环境关系累计百分比显示前两轴环境因子对物种分布特征的解释量可达82.70%, 说明排序轴较好地反映了多毛类动物与环境因子之间的关系。Monte Carlo置换检验结果显示pH(F=4.72, P < 0.01)、水深(F=4.01, P < 0.01) 和溶解氧(F=2.28, P < 0.05) 是影响三沙湾水域多毛纲动物分布格局的主要驱动因子(图 5)。大部分优势物种和溶解氧及pH值呈现较为显著的正相关关系(组1和组2), 仅须鳃虫(Cirriformia tentaculata)和智利巢沙蚕(Diopatra chiliensis)呈现负相关关系。不同物种对于水深呈现出不同相关性。
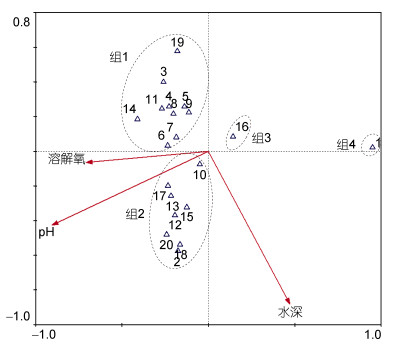 |
| 图 5 三沙湾多毛纲动物与环境因子典型对应分析排序图 Fig. 5 Ordination diagrams of species (abundance data) and typical environmental factors in Sansha Bay based on the canonical correspondence analyses 注: 1:须鳃虫(Cirriformia tentaculata); 2:太平洋稚齿虫(Prionospio pacifica); 3:梳鳃虫(Terebellides stroemii); 4:齿吻沙蚕属一种(Nephtys sp.); 5:不倒翁虫(Sternaspis scutata); 6:异足索沙蚕(Lumbrineris heteropoda); 7:矛毛虫属一种(Phylo sp.); 8:蜇龙介科一种(Terebellides sp2.); 9:丝鳃虫科一种(Cirratulidae unidentified species); 10:杂毛虫属一种(Poecilochaetus sp.); 11:豆维虫(Dorvillea pseudorubrovittata); 12:蜇龙介科一种(Terebellides sp1.); 13:多毛纲一种(Polychaeta unidentified species); 14:后指虫属一种(Laonice sp.); 15:多鳞虫科一种(Polynoidae unidentified species); 16:智利巢沙蚕(Diopatra chiliensis); 17:扇栉虫(Amphicteis gunneri); 18:寡节甘吻沙蚕(Glycinde gurjanovae); 19:吻沙蚕属一种(Glycera sp.); 20:细须鳃虫(Cirratulus filiformis) |
本研究主要基于三沙湾网箱养殖和非网箱养殖水域多毛纲动物群落的对比研究, 故对照站位(非网箱养殖水域)的选择对于本文非常重要。三沙湾无养殖水域多为航道, 其底栖环境(水深、底质类型等)和网箱养殖水域差异较大, 故本研究在航道水域中未设置对照站位。基于此种客观情况, 本研究仅能在三沙湾无养殖水域中选择极少数对照站位(2个)。本研究实际使用对照站位中包括部分海藻养殖站位。海藻可通过自身的光合作用进行有机物合成, 不需要依赖外源有机物质输入, 故海藻养殖和网箱养殖方式差异较大, 此种养殖方式被认为对区域底栖环境影响较小。且在三沙湾水域, 部分前期研究成果已证实此水域内海藻养殖活动对于底栖环境的影响较小(Zhou, 2012; 纪炜炜等, 2012)。养殖污染物质的扩散距离虽被认为和研究区域地形、潮流和海水絮凝作用等较为相关(Milligan et al, 1997; Sutherland et al, 2001), 但已有相关研究结论显示此距离通常限于200m范围以内(Holmer, 1991; Findlay et al, 1995, 1997)。三沙湾水域面积较为宽广(约405km2), 本研究选定对照站位和养殖网箱之间距离均大于600m, 此种情况下应可排除网箱养殖污染物质对对照站位的影响。本研究选择的对照站位多位于10—25m水深范围, 沉积物类型多为泥沙质和软泥质, 底栖环境条件和网箱养殖水域相当, 此种情况下应可排除自然底栖环境异质性造成的多毛类动物分布差异的问题。
3.2 三沙湾多毛纲动物群落长周期变化特征三沙湾水域多毛纲动物物种数、丰度和生物量等历史数据最早可追溯至上世纪90年代初(海湾普查中的记录)(中国海湾志编纂委员会, 1994)。本研究数据和历史资料对比显示, 目前多毛纲物种数呈下降趋势(分别为82种和95种), 但丰度和生物量均已显著提升(约3倍高于历史数据)(表 2)。目前三沙湾网箱养殖水域底质多为粘性软泥, 粉粒和粘粒百分比为23.21%—99.61%(作者尚未发表数据), 长周期的网箱养殖活动致使底质类型发生了一定程度的改变(上世纪90年代记录泥沙质较多)。目前三沙湾水域内多毛纲动物较高的丰度和生物量应与区域内底质环境发生的改变相关, 此种规律在其他类似研究中已被证实, 例如蔡立哲等(1998)认为深圳河口潮间带泥滩多毛纲动物的高生物量和丰度与底质中高含量黏土和有机质相关。三沙湾水域目前多毛纲动物物种数下降、丰度和生物量大于历史资料, 表明多毛纲对于其栖息环境具较强抗逆作用。就水域内优势物种而言, 不倒翁虫、梳鳃虫、短叶索沙蚕和丝异须虫为水域内曾经的优势种, 上述物种中目前仅极少数(如不倒翁虫和梳鳃虫)仍为区域内优势种(本研究9个航次平均丰度值位于前20位), 区域内其他优势种均已发生更替。

|
本研究显示, 网箱养殖活动对群落组成产生一定影响, 表现在群落中不同的优势的科和物种。研究同时显示网箱养殖活动并未对三沙湾水域多毛类动物物种数、丰度、生物量和多样性等群落参数产生显著影响, 这与国外部分研究较为相似(Klaoudatos et al, 2006)。考虑到三沙湾养殖产量(年均产量约6.6×105t)和历史(可追溯至上世纪90年代), 本文认为网箱养殖对底栖生态具相当程度影响, 但三沙湾典型的混合养殖模式(图 1)及较为优越的水动力水平(落潮期最大流速大于涨潮期, 分别为1.90和1.40m/s)和潮汐特点(涨落潮期潮差较大, 平均潮高分别为6.59和1.24m)有利于养殖衍生有机物的积累, 从而降低养殖活动对底栖生物胁迫程度(叶海桃等, 2007)。同时, 统计意义上的不显著影响并不可否认生态学差异。本研究网箱养殖区出现的高生物量和高栖息密度, 主要原因在于部分机会种类的出现, 如在网箱养殖区内, 5月和6月太平洋稚齿虫(Prionospio pacifica)种群密度可达1200ind./m2, 7月份异足索沙蚕种栖息密度可达1000ind./m2。这些机会种类在网箱养殖水域异常高的丰度值是否预示着网箱养殖活动对于底栖环境的严重影响, 尚待进一步研究。
经典群落演替理论认为适量有机物质的输入有利于提高群落生物多样性(图 6, 矩形框线范围以内), 但有机物质的过量输入则会使底栖群落呈现物种数降低、生物量降低等现象(Pearson et al, 1978; Yokoyama, 2005)。三沙湾网箱养殖活动强度较高, 海湾内网箱养殖水域物种多样性水平低于非养殖水域, 但生物量和栖息密度在两种水域大致相当, 此现象说明三沙湾水域处于轻度污染阶段(Zhou, 2012; 纪炜炜等, 2012; 周进等, 2012)。但本研究结果显示网箱养殖活动尚未对多毛纲动物群落结构产生显著影响, 此现象说明多毛类动物对于网箱养殖等外界胁迫的响应机制较为独特。单纯应用多毛纲群落特征分析养殖胁迫需要慎重, 可能存在一定偏面性, 应辅以长期、大量原位观测和模拟实验数据以得出更为科学、客观的结论。
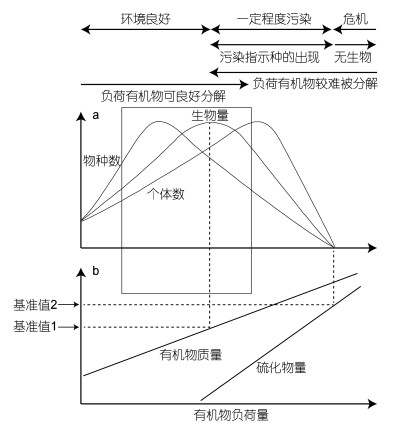 |
| 图 6 典型网箱养殖水域底栖动物群落演替图(仿Yokoyama, 2005) Fig. 6 Typical pattern of macrobenthic community succession in cage farming waters (after Yokoyama, 2005) 注: a底栖动物群落参数图, b有机物输入图.矩形框线以内代表适量有机物质的输入有利于提高群落生物多样性 |
本研究结论之一在于多毛纲动物群落参数在两水域之间无显著差异, 但在时间(月份)上具显著差异。此种现象也曾被部分学者提及, 例如部分学者认为群落参数差异主要与季度月(Pitta et al, 1999)或沉积物性质(Sukumaran et al, 2011)有关, 而不是人类活动干扰。6种典型群落参数在6或9月份出现了最高值, 其原因应与多毛纲群落年龄结构较为相关, 夏秋两季的幼体补充等可能会对群落结构产生较大影响(纪莹璐等, 2012)。
3.4 多毛纲环境指示物种筛选的潜力和意义本研究表明, 特定群落参数如丰度和生物量等并不能很好地表征环境胁迫效应, 而群落中的某些优势物种的出现与否却和外源扰动较为契合。已有部分文献表明, 多毛纲动物中部分物种种群数量的变动情况可作为网箱密集养殖水域、工业和生活用水排污口等水域海洋污染程度的指标(Tomassetti et al, 2005; 周进等, 2011b)。以本研究最具优势物种(如蜇龙介科一种、太平洋稚齿虫、不倒翁虫等)为例, 其中部分种类的环境指示功能已被证实, 如不倒翁虫已被学者提及可作为我国近岸水域的污染指示物种(Zan et al, 2015)。围绕多毛纲动物的环境指示功能已有部分较为深入的应用性研究, 例如利用其评估鱼类养殖的影响等(Martinez-Garcia et al, 2013)。
3.5 多毛纲动物群落结构和环境因子关系探究底栖动物与环境因子关系的研究方法较多, 如目前较常被使用的Pearson相关性分析、Spearman相关性分析、RDA冗余分析、CCA典型对应分析和BIOENV分析等。上述各种方法在应用原理上存在一定差异, 本研究使用典型对应分析方法, 该方法首先计算出一组样方排序值和种类排序值(同对应分析), 然后将样方排序值与环境因子用回归分析方法结合起来, 此种方法所获取样方排序值可较为客观反映样方种类组成及生态重要值对群落的作用, 同时也反映了环境因子的影响, 再用样方排序值加权平均求种类排序值, 使种类排序坐标值也间接地与环境因子相联系。因该方法是基于对应分析发展而来的一种排序方法, 综合应用了对应分析与多元回归分析相结合, 故相关结论应较为客观。针对三沙湾5月份多毛纲动物群落结构的分析结果显示, 两群落结构存在差异。在自然条件下, 各种环境因子之间协同和拮抗作用复杂, 使得关键环境因子难以鉴定。目前认为影响多毛纲分布主要因素包括沉积物结构变量或栖息地复杂性等, 涉及环境要素较多(Serrano et al, 2007; Del-Pilar-Ruso et al, 2011; Carvalho et al, 2013)。因采样条件等客观因素限制, 本研究选取的环境因素虽较为典型, 但数量有限(共8个环境因子), 已得出的水深、DO和pH分别是影响三沙湾多毛纲分布格局主要环境因子的结论较为初步。特别是在研究网箱养殖活动对多毛纲动物群落的影响时, 应该加强对于与网箱养殖活动紧密相关环境因子的研究, 如沉积物有机质和硫化物含量等(Han et al, 2015)。
4 结论网箱养殖和非网箱养殖水域多毛纲物种组成存在差异, 丝鳃虫科和多鳞虫科分别是两种水域最占优势的类群; 网箱养殖水域多毛纲优势物种的丰度及丰度比值略高于非网箱养殖区(104.06ind./m2 > 48.29ind./m2, 57.59% > 46.96%)。双因素方差分析(采样时间和养殖方式)结果表明, 6种典型群落参数均无显著空间差异(P > 0.05), 但存在极显著时间差异(P < 0.01)。双因素群落结构相似性分析表明群落结构无显著空间差异(P > 0.05), 但存在极显著时间差异(P < 0.01)。典型对应分析显示pH、水深和溶解氧是影响三沙湾多毛纲动物分布格局的主要环境因子。三沙湾网箱养殖活动对多毛纲动物群落结构已产生一定影响, 主要表现在群落组成方面, 群落结构和部分典型底栖环境因子具较强相关性。
| 王金宝, 李新正, 王洪法, 2006a. 胶州湾多毛类环节动物优势种的生态特点. 动物学报, 52(1): 63–69 |
| 王金宝, 李新正, 王洪法, 等, 2006b. 胶州湾多毛类环节动物数量分布与环境因子的关系. 应用与环境生物学报, 12(6): 798–803 |
| 中国海湾志编纂委员会, 1994. 中国海湾志第7分册福建省北部海湾. 北京: 海洋出版社, 86-92 |
| 叶海桃, 王义刚, 曹兵, 2007. 三沙湾纳潮量及湾内外的水交换. 河海大学学报:自然科学版, 35(1): 96–98 |
| 朱峰, 石志洲, 凌信文, 等, 2013. 宁德三沙湾网箱养殖与环境质量的关系. 海洋通报, 32(2): 171–177 DOI:10.11840/j.issn.1001-6392.2013.02.008 |
| 纪炜炜, 周进, 2012. 三都澳大型底栖动物群落结构及其对水产养殖的响应. 中国水产科学, 19(3): 491–499 |
| 纪莹璐, 拓宁, 刘志强, 等, 2012. 我国沿海多毛类研究的现状. 水产科学, 31(5): 306–310 |
| 李宝泉, 李新正, 于海燕, 等, 2005. 胶州湾底栖软体动物与环境因子的关系. 海洋与湖沼, 36(3): 193–198 |
| 李新正, 王洪法, 于海燕, 等, 2004. 胶州湾棘皮动物的数量变化及与环境因子的关系. 应用与环境生物学报, 10(5): 618–622 |
| 杨俊毅, 高爱根, 宁修仁, 等, 2007. 乐清湾大型底栖生物群落特征及其对水产养殖的响应. 生态学报, 27(1): 34–41 |
| 吴芳, 郭卫东, 郑佩如, 等, 2005. 三都澳养殖海域沉积物中P的形态分布特征. 海洋环境科学, 24(4): 24–27 |
| 吴宝铃, 1981. 中国海首次发现的海洋污染研究实验动物——毛轮沙蚕. 环境科学学报, 1(2): 190–192 |
| 周进, 纪炜炜, 2011a. 三都澳大型底栖动物种类组成特点. 海洋渔业, 33(4): 378–388 |
| 周进, 纪炜炜, 2012. 三都澳大型底栖动物次级生产力. 海洋渔业, 34(1): 32–38 |
| 周进, 李新正, 2011b. 中国海多毛纲动物研究现状及展望. 海洋科学, 35(6): 82–89 |
| 高爱根, 杨俊毅, 陈全震, 等, 2003. 象山港养殖区与非养殖区大型底栖生物生态比较研究. 水产学报, 27(1): 25–31 |
| 黄标, 钱鲁闽, 刘家富, 2002. 福建三都澳水产养殖区水体氮磷含量及潜在性富营养化程度分析. 台湾海峡, 21(4): 411–415 |
| 黄洪辉, 林钦, 林燕棠, 等, 2005. 大亚湾网箱养殖海域大型底栖动物的时空变化. 中国环境科学, 25(4): 412–416 |
| 麻骜, 刘晓收, 李梁, 等, 2014. 胶州湾菲律宾蛤仔养殖水域内外大型底栖动物群落特征的比较研究. 海洋湖沼通报,(1): 122–128 |
| 蔡立哲, 林鹏, 佘书生, 等, 1998. 深圳河口泥滩多毛类动物的生态研究. 海洋环境科学, 17(1): 41–47 |
| Bergquist D C, Fleckenstein C, Knisel J, et al, 2005. Variations in seep mussel bed communities along physical and chemical environmental gradients. Marine Ecology Progress Series, 293: 99–108 DOI:10.3354/meps293099 |
| Cardoso P G, Bankovic M, Raffaelli D, et al, 2007. Polychaete assemblages as indicators of habitat recovery in a temperate estuary under eutrophication. Estuarine Coastal and Shelf Science, 71(1-2): 301–308 DOI:10.1016/j.ecss.2006.08.002 |
| Carvalho R, Wei C L, Rowe G, et al, 2013. Complex depth-related patterns in taxonomic and functional diversity of polychaetes in the Gulf of Mexico. Deep Sea Research Ⅰ:Oceanographic Research Papers, 80: 66–77 DOI:10.1016/j.dsr.2013.07.002 |
| Del-Pilar-Ruso Y, De-La-Ossa-Carretero J A, Gimenez-Casalduero F, et al, 2011. Polychaete distribution pattern on the Valencian Community coast, Spanish Mediterranean. Ciencias Marinas, 37(3): 261–270 DOI:10.7773/cm |
| Edgar G J, Macleod C K, Mawbey R B, et al, 2005. Broad-scale effects of marine salmonid aquaculture on macrobenthos and the sediment environment in southeastern Tasmania. Journal of Experimental Marine Biology and Ecology, 327(1): 70–90 DOI:10.1016/j.jembe.2005.06.003 |
| Findlay R H, Watling L, Mayer L M, 1995. Environmental impact of salmon net-pen culture on marine benthic communities in Maine:A case study. Estuaries, 18(1A): 145–179 |
| Findlay R H, Watling L, 1997. Prediction of benthic impact for salmon net-pens based on the balance of benthic oxygen supply and demand. Marine Ecology Progress Series, 155: 147–157 DOI:10.3354/meps155147 |
| Han Q X, Jiang X M, Wang X B, 2015. The polychaete feeding guild composition in the Sishili Bay, the northern Yellow Sea, China. Journal of the Marine Biological Association of the UK, 96(5): 1–10 |
| Holmer M, 1991. Impacts of aquaculture on surrounding sediments:generation of organic-rich sediments. In:DePauw N, Joyce J eds. Aquaculture and the environment. European Aquaculture Society. Ghent, Belgium:Special Publication, 1991, 16:155-176 |
| Hutchings P, 1998. Biodiversity and functioning of polychaetes in benthic sediments. Biodiversity and Conservation, 7(9): 1133–1145 DOI:10.1023/A:1008871430178 |
| Klaoudatos S D, Klaoudatos D S, Smith J, et al, 2006. Assessment of site specific benthic impact of floating cage farming in the eastern Hios Island, Eastern Aegean Sea, Greece. Journal of Experimental Marine Biology and Ecology, 338(1): 96–111 DOI:10.1016/j.jembe.2006.07.002 |
| Leps J, Smilauer P, 2003. Multivariate Analysis of Ecological Data Using CANOCO. Cambridge:Cambridge University Press,: 43–60 |
| Martinez-Garcia E, Sanchez-Jerez P, Aguado-Giménez F, et al, 2013. A meta-analysis approach to the effects of fish farming on soft bottom polychaeta assemblages in temperate regions. Marine Pollution Bulletin, 69(1-2): 165–171 DOI:10.1016/j.marpolbul.2013.01.032 |
| Milligan T G, Loring D H, 1997. The effect of flocculation on the size distributions of bottom sediment in coastal inlets:implications for contaminant transport. Water, Air, and Soil Pollution, 99(1): 33–42 |
| Pearson T H, Rosenberg R, 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment. Oceanography and Marine Biology:Annual Review, 16: 229–311 |
| Pitta P, Karakassis I, Tsapakis M, et al, 1999. Natural vs.mariculture induced variability in nutrients and plankton in the eastern Mediterranean.. Hydrobiologia, 391(1-3): 179–192 |
| Samuelson G M, 2001. Polychaetes as indicators of environmental disturbance on subarctic tidal flats, Iqaluit, Baffin Island, Nunavut Territory. Marine Pollution Bulletin, 42(9): 733–741 DOI:10.1016/S0025-326X(00)00208-3 |
| Serrano A, Preciado I, 2007. Environmental factors structuring polychaete communities in shallow rocky habitats:role of physical stress versus habitat complexity. Helgoland Marine Research, 61(1): 17–29 DOI:10.1007/s10152-006-0050-7 |
| Sukumaran S, Bhokepode K C, Telavane M, et al, 2011. Benthic polychaetes in the Ratnagiri bay, India:influence by anthropogenic factors?. Journal of Environmental Biology, 32: 719–724 |
| Sutherland T F, Martin A J, Levings C D, 2001. Characterization of suspended particulate matter surrounding a salmonid net-pen in the Broughton Archipelago, British Columbia. ICES Journal of Marine Science, 58(2): 404–410 DOI:10.1006/jmsc.2000.1043 |
| Tomassetti P, Porrello S, 2005. Polychaetes as indicators of marine fish farm organic enrichment. Aquaculture International, 13(1-2): 109–128 DOI:10.1007/s10499-004-9026-2 |
| Tomassetti P, Gennaro P, Lattanzi L, et al, 2016. Benthic community response to sediment organic enrichment by Mediterranean fish farms:Case studies. Aquaculture, 450: 262–272 DOI:10.1016/j.aquaculture.2015.07.019 |
| Yokoyama H, 2005. What does the aquaculture industry expect from benthic studies? In:Benthos in Fisheries Science, Kaseisha-Kouseikaku publisher, Tokyo:132-149 |
| Zan X X, Zhang C L, Xu B D, et al, 2015. Distribution of polychaete assemblage in relation to natural environmental variation and anthropogenic stress. Journal of Ocean University of China, 14(4): 749–758 DOI:10.1007/s11802-015-2650-9 |
| Zhou J, 2012. Impacts of mariculture practices on the temporal distribution of macrobenthos in Sandu Bay, South China. Chinese Journal of Oceanology and Limnology, 30(3): 388–396 DOI:10.1007/s00343-012-1150-7 |
 2017, Vol. 48
2017, Vol. 48


