中国海洋湖沼学会主办。
文章信息
- 刘迅, 王莉, 顾晓英, 蔡林婷, 焦海峰, 王一农, 尤仲杰. 2017.
- LIU Xun, WANG Li, GU Xiao-Ying, CAI Lin-Ting, JIAO Hai-Feng, WANG Yi-Nong, YOU Zhong-Jie. 2017.
- 浙江檀头山岛周围海域夏、秋季大型底栖动物群落结构特征
- CHARACTERISTICS OF THE COMMUNITY STRUCTURE OF MACROBENTHOS AROUND ZHEJIANG TANTOUSHAN ISLAND WATERS IN SUMMER AND AUTUMN
- 海洋与湖沼, 48(3): 553-567
- Oceanologia et Limnologia Sinica, 48(3): 553-567.
- http://dx.doi.org/10.11693/hyhz20161100262
-
文章历史
- 收稿日期:2016-11-29
- 收修改稿日期:2016-12-12
2. 中国科学院城市环境研究所 城市环境与健康重点实验室 厦门 361021;
3. 中国科学院大学 北京 100049;
4. 宁波市海洋与渔业研究院 宁波 315012
2. Key Laboratory of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Ningbo Academy of Oceanology and Fisheries, Ningbo 315012, China
檀头山岛位于东海之滨的浙江省象山县东南38km, 该岛周围海域北起象山港入海口、南至三门湾外侧海域。该海域年均水温约为17.6℃, 8月份水温最高(平均28.1℃), 2月份水温最低(平均9.6℃), 水温四季变化明显, 属于亚热带海洋性季风气候, 盐度四季变化不大, 年均盐度约为26.8。由于受到台湾暖流、大陆沿岸径流及长江入海河流等水系影响, 造就了该海域独特的生境, 丰富的饵料与良好的生物栖息环境, 以及较为丰富的海洋生物资源。
近年来, 随着沿岸经济和社会的发展, 人类活动如过度捕捞、水产养殖、火电厂运行、滩涂围垦及航运等对海洋生态环境产生了很大的影响, 该海域内的生物正常生长和繁殖受到干扰, 一些经济种类资源严重衰退甚至消失, 如大黄鱼(胡银茂, 2006)、乌贼(徐开达等, 2008)等。底栖动物是海洋生态系统的重要组成部分, 有些种类是经济鱼类的优质饵料, 其资源的多少影响着渔业资源储量(郑新庆等, 2014; 任彬彬, 2015; 张鹏弛等, 2016), 有些种类对特定污染物敏感因而可以筛选出来作为指示生物用于环境监测(Zhang et al, 2016)。此外, 大型底栖动物迁移能力弱, 种类多, 一些种类生命周期长, 对水环境变化反应灵敏, 可以用于海洋环境评价(杞桑等, 1982; 龙华等, 2008)。
自20世纪80年代至今, 象山港、三门湾大型底栖动物相关研究均有报道, 王金辉等对象山港内的底栖生物多样性和次级生产力进行了研究(王金辉等, 2006), 廖一波等对象山港不同养殖类型海域大型底栖动物群落结构进行过比较(廖一波等, 2011a), 尤仲杰等(2011)对象山港大型底栖功能群进行了研究, 廖一波等(2011b)对三门湾大型底栖动物分布特征及其与环境因子的相关性进行了研究, 江锦祥等(1985)则对东海大陆架底栖生物数量分布及群落结构特点进行了报道。这些底栖动物相关研究集中在象山港、三门湾这两个半封闭式港湾内和本研究所处的外侧海域, 且较为全面的描述了本研究邻近海域底栖动物群落结构及其生态学特征, 但是在象山县东部近岸海域(主要是乱礁洋海域、韭山列岛周围海域、檀头山岛周围海域以及南田岛南部海域)底栖动物群落研究方面, 韭山列岛(孙立辉等, 2014)、南田岛(刘迅等, 2015)周围海域大型底栖动物研究已有论文报道, 象山县东南部具有代表性的海域——檀头山岛周围海域未见报道, 因此本研究对该海域进行了大型底栖动物生态调查, 分析了大型底栖动物种类组成与分布、生物量与丰度、群落结构以及其与环境因子的关系, 以期为后续的底播增殖、资源恢复提供基础数据。
1 材料与方法 1.1 调查站位设置与采样时间在檀头山岛周围海域(121°59′43.34″—122°12′ 14.10″E, 29°10′24.83″—29°21′51.32″N)设置20个采样站位, 分别是近岸站位S01、S02、S03、S04、S05、S06、S07、S08、S09、S10和远岸站位S11、S12、S13、S14、S15、S16、S17、S18、S19、S20。分别于2013年7月(夏季)、11月(秋季)为代表月, 进行了2个航次大型底栖动物生态调查, 采样站位分布见图 1。
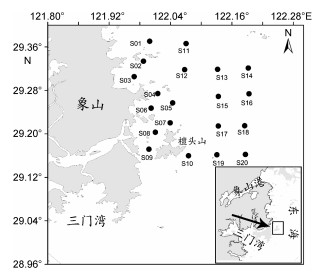 |
| 图 1 檀头山岛周围海域调查站位分布 Fig. 1 Study area and sampling stations in sea area adjacent to Tantoushan Island |
拖网作业因扫海面积大, 操作便捷, 在东海捕捞业中被广泛应用。同时, 拖网也能够高效的采集到表层沉积物内以及沉积物表层上的生物, 适宜于初步调查底栖生物分布状况、种类组成、分层分类规律及底播增殖的适宜性等。故本研究使用定性/半定量采样工具阿氏网(Agassiz trawl)采集大型底栖动物样本, 阿氏网网口长1.5m、宽0.5m, 网身长5m, 网囊网目为25mm, 每个站位有效拖网1次, 拖网时间10min, 船速设定为2节。每次阿氏网到达海底和开始拖离海面这段拖曳距离使用GPS记录。网获物放置在孔径为0.5mm的套筛中筛洗, 滞留的生物样本用5%—7%福尔马林现场固定, 带回实验室进行称湿重、计数、物种鉴定与分析。
每个站位使用HNM抓斗式采泥器采集沉积物, 采集的沉积物低温保存, 带回实验室进行粒径分析。海上样本采集及室内样本处理分析按照《海洋调查规范》(中华人民共和国国家质量监督检验检疫总局等, 2007)执行。各站位采集的沉积物带回实验室, 使用丹东百特激光粒度分析仪(BT-9300ST)进行粒径测定与分析。根据沉积粒度组成, 将沉积物分成三类:黏土(clay, < 4µm)、粉砂(silt, 4—63µm)、砂(sand, > 63µm) (Flemming, 2000; Jaleel et al, 2014)。表层水温(WT)、盐度(SAL)、pH及溶解氧(DO)现场使用便携式水质分析仪(哈希TSS portable)测定, 水深(Depth)使用超声波测深仪(SQ-SX100) 进行测定。
1.3 数据分析 1.3.1 丰度与生物量计算拖网属于定性/半定量采样, 不能准确计算采样面积, 因此本文对檀头山岛周围海域大型底栖动物数量的分析均以“ind/网”或“ind/Agt”和“g/网”或“g/Agt”为单位。具体计算公式如下:
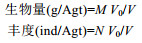
其中, M、N分别为底栖动物质量与数量, V为实际拖过水体体积(实际拖曳距离×网口长×网宽), V0 (463m3)为航速2节、时间10min标准情况下拖过的标准水体体积。
1.3.2 种类更替及优势种运用种类更替率(杜飞雁等, 2013)计算大型底栖动物种类更替情况, 根据物种优势度指数(陈亚瞿等, 1995)筛选优势种, 具体计算公式如下:
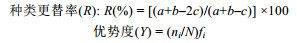
其中, a与b分别为相邻两个季节的种类数, c为相邻两个季节的共同种类数; ni为第i个物种的个体数, N为总个体数, fi为该种在各站位出现的频率, 当物种优势度(Y)≥0.02时, 该种即为优势种。
1.3.3 统计分析本研究使用香农多样性指数(Shannon-Weiner index) (H', log2为底)、Margalef物种丰富度指数(d)与Pielou’s evenness均匀度指数(J')对檀头山岛周围海域大型底栖动物的多样性进行分析, 使用PRIMER 6.0软件中“DIVERSE”模块计算。
此外, 利用PRIMER 6.0软件中的Bray-Curtis相似性系数聚类对群落结构进行分析。利用丰度/生物量比较曲线, 即ABC曲线来观察人类活动或环境污染对大型底栖动物群落的扰动情况。栖息密度数据经过二次方根转化(Square root transform)后, 在Bray-Curtis相似性的基础上, 使用等级聚类(Cluster)累计法来分析群落结构的相似性, 使用多维排序尺度方法(MDS)分析群落结构。排序分析和聚类分析一般在群落结构多变量分析中联合使用以相互验证分析结果是否正确, 这一群落结构分析技术在生态学上的应用被证明非常有用(Schiel et al, 2004)。根据各站位大型底栖动物丰度矩阵, 采用非度量相似性百分比分析(SIMPER)每个聚类组组内中累计贡献率超过70%的大型底栖动物。使用Canoco 5软件进行典型相关分析CCA (Canonical correlation analysis), 以解析大型底栖动物与环境因子的关系。本研究中所使用到的其他相关的统计分析, 如单因素方差分析(One-Way ANOVA)、相关性分析(Spearman rank correlations)使用SPSS 19.0软件。
2 结果与分析 2.1 种类组成与分布本研究区域主要位于水深20m以内的东海大陆架浙江檀头山岛周围海域, 由于阿氏网本身只能采集到海底沉积物表层及以上区域底栖动物, 因此本节叙述的是采泥器难以采集到的且活动能力较强的底上动物和活动能力较弱的栖息于表层沉积物中(0—10cm)底栖动物的种类组成情况。在檀头山岛海域进行的2个航次拖网调查共获得大型底栖动物55种, 其中甲壳动物最多, 有18种(占32.73%), 其次是底栖鱼类(17种, 占30.91%)、软体动物(16种, 占29.09%), 腔肠动物3种(5.45%), 环节动物最少, 只有1种(1.82%)。
夏季调查共获得大型底栖动物46种, 隶属于5门10纲18目33科。其中甲壳动物和鱼类最多, 软体动物次之, 其他类群大型底栖动物(腔肠动物3种及环节动物1种)最少(图 2)。夏季各类群空间种类数分布情况:近岸海域(38种) > 远岸海域(36种), 其中近岸海域的甲壳动物有15种, 多于远岸海域的13种, 近岸海域与远岸海域的软体动物种类数相同, 均为6种, 鱼类种类数近岸海域有15种, 多于远岸海域的14种, 而其他类群的大型底栖动物种类数, 近岸海域多于远岸海域(图 3)。
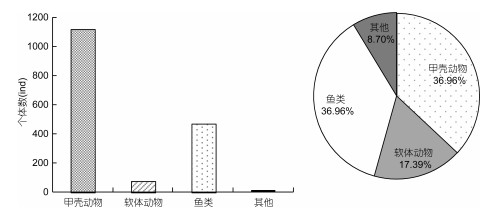 |
| 图 2 檀头山岛周围海域夏季大型底栖动物种类数及种类组成 Fig. 2 The species number and members of macrobenthos in sea area adjacent to Tantoushan Island in summer |
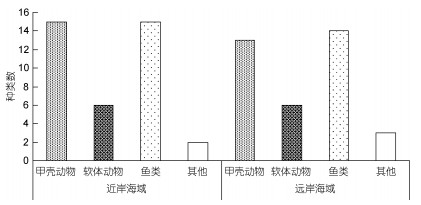 |
| 图 3 檀头山岛周围海域夏季大型底栖动物类群分布 Fig. 3 The species number and distribution of macrobenthos in in sea area adjacent to Tantoushan Island in summer |
秋季调查共获得大型底栖动物34种, 隶属于4门6纲13目25科。其中软体动物最多, 其次是甲壳动物、鱼类、其他类群1种(腔肠动物) (图 4)。秋季各类群空间种类数分布情况:近岸海域(33种) > 远岸海域(22种), 其中近岸海域的甲壳动物有13种, 多于远岸海域的10种, 近岸海域的软体动物有14种, 远多于远岸海域的5种, 近岸海域与远岸海域的鱼类及其他类群大型底栖动物种类数相同(图 5)。
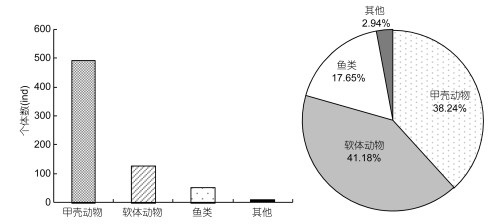 |
| 图 4 檀头山岛周围海域秋季大型底栖动物个体数及种类组成 Fig. 4 The species number and members of macrobenthos in sea area adjacent to Tantoushan Island in autumn |
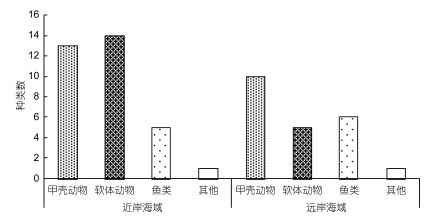 |
| 图 5 檀头山岛周围海域秋季大型底栖动物类群分布 Fig. 5 The species number and distribution of macrobenthos in in sea area adjacent to Tantoushan Island in autumn |
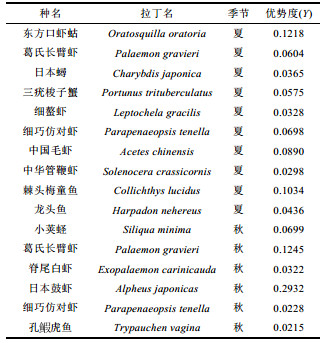
数量或生物量所占比例较多的物种称为优势种(物种优势度Y≥0.02), 其也是能够反映群落特征的种类。2航次大型底栖动物优势种合计有14种, 其中夏季航次(2013年7月)优势种最多, 有10种, 其次是秋季航次(2013年11月), 有6种。有2种为2航次共有优势种, 分别是葛氏长臂虾Palaemon gravieri、细巧仿对虾Parapenaeopsis tenella, 其余均为单一航次优势种。夏、秋两季共有26种, 两季间种类更替率为51.85%。
平均生物量夏季航次最高, 为168.71g/Agt, 其次是秋季, 为57.82g/Agt。丰度变化规律与生物量一致, 即夏季航次丰度最高为84.25ind/Agt, 其次是秋季航次为33.95ind/Agt。以季节为因子的单因素方差分析(One-Way ANOVA)表明, 生物量(F=14.343, P=0.001 < 0.01)、丰度(F=11.574, P=0.002 < 0.01) 两航次间存在极显著差异。夏、秋两季生物量和丰度在远近岸间均不存在显著差异(P > 0.05)。
夏季(2013年7月航次)各类群生物量与丰度如图 6所示, 甲壳动物生物量最高, 为116.20g/Agt, 占总生物量的66.69%;其次是鱼类, 生物量为44.03g/Agt, 占总生物量的27.85%;软体动物和其他类群大型底栖动物(环节动物、腔肠动物)生物量较低, 分别为4.15g/Agt和3.42g/Agt, 占2.47%和2.04%。丰度变化情况和生物量一致, 即甲壳动物丰度最高为56.15ind/Agt, 占69.25%;其次是鱼类, 为23.45ind/ Agt, 占26.24%;软体动物丰度为3.95ind/Agt, 占4.69%;其他类群大型底栖动物丰度值最低, 为0.65ind/Agt, 占0.77%。檀头山岛周围大型底栖动物夏季生物量与丰度空间分布如图 7所示, S01站位生物量最高, 为419.01g/Agt, 其次是S02、S07、S10、S11、S15站位生物量较高, 均大于200g/Agt, S05、S08、S09、S13、S16、S18站位生物量较低, 在30—100g/Agt之间, 在檀头山岛东部及北部海域生物量值较高。丰度最高值出现在S01站位, 为211ind/Agt, 其次是S19站位, 为197ind/Agt, S05、S12站位丰度值较高, 分别为111ind/Agt、146ind/Agt, S02、S03、S04、S06、S07、S08、S09、S13、S14、S15等站位的生物量较低, 在20—100ind/Agt之间。
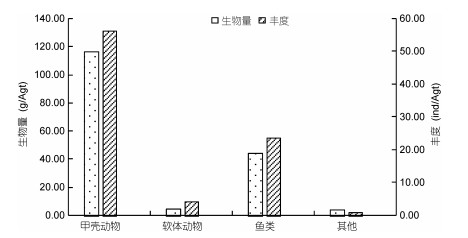 |
| 图 6 檀头山岛周围海域夏季不同类群大型底栖动物生物量与丰度 Fig. 6 Abundance and biomass of different assemblages of macrobenthos in sea area adjacent to Tantoushan Island in summer |
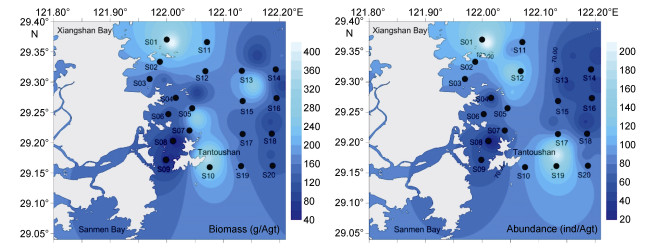 |
| 图 7 檀头山岛周围海域夏季大型底栖动物生物量与丰度分布 Fig. 7 Spatial distributions of abundance and biomass of macrobenthos in sea area adjacent to Tantoushan Island in summer |
秋季(2013年11月航次)各类群生物量与丰度如图 8所示, 甲壳动物生物量最高为26.41g/Agt, 占总生物量的45.66%;其次是软体动物, 生物量为16.26g/Agt, 占总生物量的28.12%;鱼类生物次之, 为12.49g/Agt, 占总生物量的21.60%;其他类群的大型底栖动物生物量最低, 为2.67g/Agt, 占4.62%。各类群丰度值变化和生物量变化一致, 即甲壳动物丰度值最高, 为24.55ind/Agt, 占72.31%;其次是软体动物, 为6.35ind/Agt, 占18.70%;鱼类和其他类群大型底栖动物丰度值较低, 分别为2.65ind/Agt、0.40ind/Agt, 占7.81%、1.18%。檀头山岛周围大型底栖动物夏季生物量与丰度空间分布如图 9所示, S02站位生物量值最高, 为357.25g/Agt, S03、S09站位生物值较高, 分别为188.06g/Agt、113.10g/Agt, S19站位生物量较低, 为1.73g/Agt, S13、S14、S16、S20站位未采集到大型底栖动物, 生物量在檀头山岛周围海域分布相对比较均匀; 丰度最高值出现在S01站位, 为147ind/Agt, 其次是S03站位, 为136ind/Agt, S02站位丰度值也较高, 为99ind/Agt, S04、S05、S06、S07、S08、S09、S11、S12、S15、S17、S18等站位丰度值在20—50ind/Agt之间, S10和S19站位丰度值低, 分别为3ind/Agt和2ind/Agt。
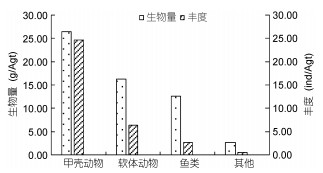 |
| 图 8 檀头山岛周围海域秋季不同类群大型底栖动物生物量与丰度 Fig. 8 Abundance and biomass of different assemblages of macrobenthos in sea area adjacent to Tantoushan Island in autumn |
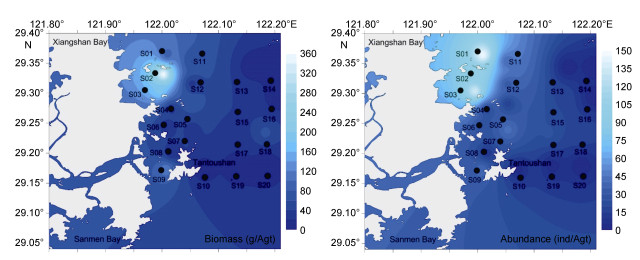 |
| 图 9 檀头山岛周围海域秋季大型底栖动物生物量与丰度分布 Fig. 9 Spatial distributions of abundance and biomass of macrobenthos in sea area adjacent to Tantoushan Island in autumn |
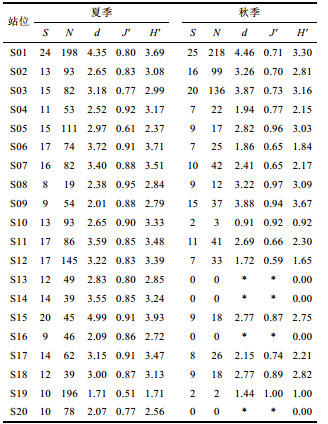
夏、秋季檀头山岛周围海域香农多样性指数(Shannon-Weiner index) (H')、Margalef物种丰富度指数(d)与Pielou’s evenness均匀度指数(J')见表 2。以季节为因子的单因素方差分析(One-Way ANOVA)表明, H'两航次间存在极显著差异(F=15.092, P=0.004 < 0.01), J' (F=5.607, P=0.02 < 0.05)、d (F=6.249, P=0.01 < 0.05) 两航次间差异显著。
|
夏季S15站位H'值最高, 为3.93, S01、S02、S04、S06、S07、S08、S10、S11、S12、S14、S17、S18等站位的H'值较高, 在2.84—3.71之间, S19站位H'值最低, 为1.71, H'值分布较均匀, 檀头山岛西侧海域H'值偏低, S08站位Pielou’s evenness均匀度指数(J')值最高, 为0.95, S01、S02、S06、S07、S09、S10、S11、S12、S13、S14、S15、S16、S17、S18等站位的J'值较高, 在0.80—0.91之间, S19站位J'值最低, 为0.51, 总体上J'值在各站位分布较均匀; S15站位d值最高, 为4.99, S01、S03、S05、S06、S07、S11、S12、S14、S17、S18等站位的d值较高, 在2.97—4.35之间, S19站位d值最低, 为1.71, 檀头山岛北部海域d值较高, 单因素方差分析表明H'、J'、d远近岸间差异均不存在显著差异(P > 0.05)。
秋季S09站位H'值最高, 为3.67, S03、S05及S08站位H'值较高, 分别为3.16、3.03、3.09, S02、S04、S07、S11、S15、S17、S18等站位H'值次之, 在2.15—2.82之间, S10站位H'值较低, 为0.92, 在檀头山岛J'值近岸海域高于远岸海域, 在檀头山岛西侧及东北方向J'值较低, d值在S09站位最高, 为3.88, H' (F=8.339, P=0.01 < 0.05)、J' (F=8.339, P=0.03 < 0.05)、d (F=8.339, P=0.01 < 0.05) 远近岸间差异显著。
2.5 群落结构檀头山岛周围海域大型底栖动物丰度数据进行开平方转换后, 根据群落Bray-Curtis相似性矩阵变换进行聚类分析(Cluster)和非度量多维尺度分析(nMDS), 根据排序图中Stress参数值判断分析结果是否可信, 值小于0.2(周红等, 2003), 认为其图形具有解释意义, 夏季和秋季Stress值分别为0.16、0.01, 均小于0.2, 分析结果可信(图 10)。夏季基于聚类分析(Cluster)和非度量多维尺度分析(nMDS), 在45%相似性水平下(Similarity level)檀头山岛周围夏季航次20个调查站位可以划分成5个组(图 10), a组包含1个站位(S09)、b组包含6个站位(S05、S07、S16、S18、S19、S20)、c组包含1个站位(S08)、d组包含1个站位(S01)、e组包含11个站位(S02、S03、S04、S06、S10、S11、S12、S13、S14、S15、S17)。秋季在20%相似性水平下(Similarity level)檀头山岛周围秋季航次20个调查站位可以划分成6个组(图 10), a组包含1个站位(S20)、b组包含1个站位(S16)、c组包含1个站位(S14)、d组包含1个站位(S13)、e组包含2个站位(S10、S19)、f组包含14个站位(S01、S11、S02、S12、S03、S05、S04、S06、S07、S08、S09、S15、S17、S18)。
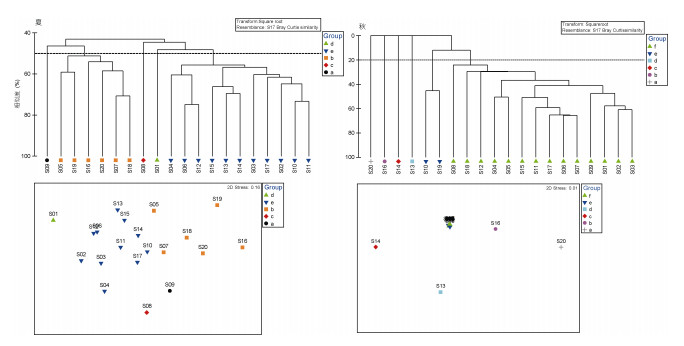 |
| 图 10 檀头山岛周围海域夏季和秋季大型底栖动物群落聚类分析和nMDS排序 Fig. 10 Cluster and nMDS analysis of macrobenthos assemblages in sea area adjacent to Tantoushan Island in summer autumn |
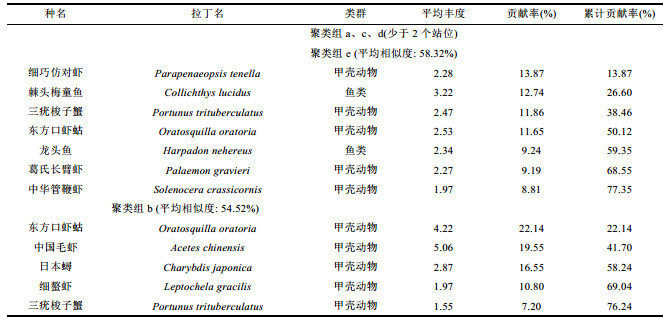
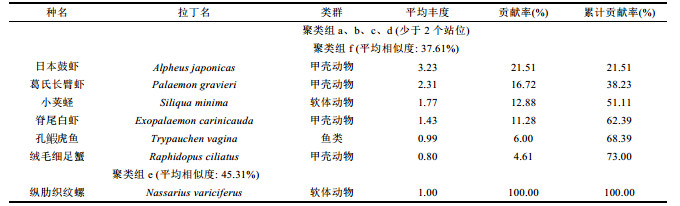
运用PRIMER 6.0软件, 根据各站位大型底栖动物丰度矩阵, 采用非度量相似性百分比分析(SIMPER)每个聚类组组内中累计贡献率超过70%的大型底栖动物。夏季, 聚类组b组内平均相似度为54.52%, 对组内平均相似度贡献较大的种有东方口虾蛄Oratosquilla oratoria、中国毛虾Acetes chinensis、日本蟳Charybdis japonica、细螯虾Leptochela gracilis、三疣梭子蟹Portunus trituberculatus, 聚类组e组内平均相似度为58.32%, 对组内平均相似度贡献较大的种有细巧仿对虾Parapenaeopsis tenella、棘头梅童鱼Collichthys lucidus、三疣梭子蟹Portunus trituberculatu、东方口虾蛄Oratosquilla oratoria、龙头鱼Harpadon nehereus、葛氏长臂虾Palaemon gravieri、中华管鞭虾Solenocera crassicornis, 聚类组a、c、d中样本数少于2 (表 3)。秋季, 聚类组f组内平均相似度为37.61%, 对组内平均相似度贡献较大的种有日本鼓虾Alpheus japonicas、葛氏长臂虾Palaemon gravieri、小荚蛏Siliqua minima、脊尾白虾Exopalaemon carinicauda、孔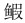
|
|
ABC曲线, 即丰度/生物量(Abundance-Biomass Comparison)比较曲线, 可以对污染或干扰造成的大型底栖动物群落变化做出灵敏的反应。檀头山岛夏季生物量曲线在丰度曲线之上, 且W > 0, 表明群落基本未受到人类活动或自然环境变化所引起的扰动, 秋季大型底栖动物丰度生物量曲线在尾部均出现了交叉, 表明该海域大型底栖动物均受到明显的扰动(图 11)。
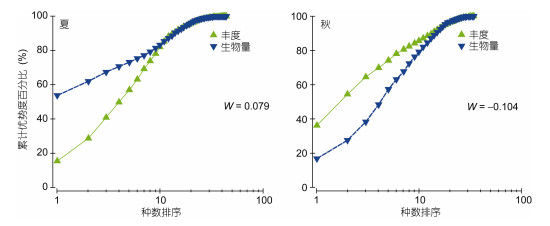 |
| 图 11 檀头山岛周围海域夏、秋季大型底栖动物丰度/生物量比较曲线 Fig. 11 The ABC plots in the abundance and biomass in sea area adjacent to Tantoushan Island in summer autumn |
夏、秋季平均表层水温(WT)分别为(26.02± 0.28)℃、(16.53±0.10)℃, pH平均值分别为8.07±0.03、8.01±0.02, 盐度(SAL)分别为27.48±0.11、25.86±0.12, 溶解氧(DO)分别为(7.66±0.09) mg/L、(6.71±0.05) mg/L, 沉积物中值粒径(MGS)分别为(9.03±0.38)µm、(8.89±0.28)µm。单因素方差分析(One-Way ANOVA)表明表层水温(WT)、盐度(SAL)及溶解氧(DO)夏、秋季节间差异显著(P < 0.05), pH、中值粒径差异不显著(P > 0.05)。秋季表层水温(WT)、盐度(SAL)、溶解氧(DO)、pH、中值粒径(MGS)在远近岸间差异不显著(P > 0.05), 夏季水温(WT)、盐度(SAL)在远近岸间差异显著(P < 0.05), 中值粒径(MGS)、溶解氧(DO)、pH在远近岸间差异不显著(P > 0.05)。沉积物组成划分:黏土(Clay, < 4µm)、粉砂(Silt, 4—63µm)、砂(Sand, > 63µm), 檀头山岛周围海域沉积物主要是由较细颗粒的黏土和粉砂组成, 各组分远近岸间差异不显著(P > 0.05)。
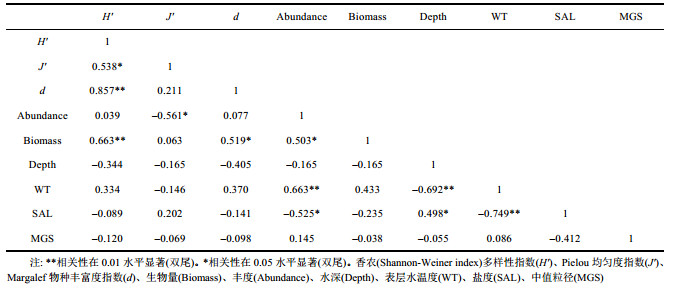
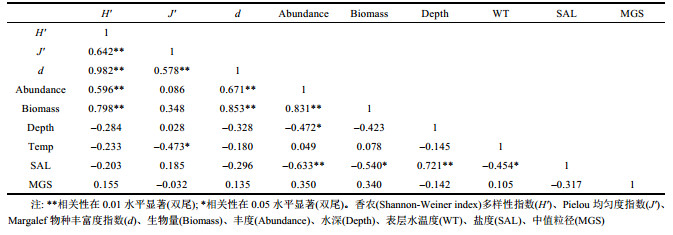
对檀头山岛周围海域夏、秋航次的大型底栖动物香农多样性指数(Shannon-Weiner index) (H')、Pielou均匀度指数(J')与Margalef物种丰富度指数(d)、生物量(Biomass)及丰度(Abundance)与水深(Depth)、表层水温度(WT)、盐度(SAL)及中值粒径(MGS)等环境因子进行Spearman相关性分析, 以期了解不同环境因子对檀头山岛周围海域大型底栖动物生物多样性的影响(表 5, 表 6)。夏季(2013年7月航次), 丰度(Abundance)与表层水温度(WT)呈显著正相关(rs=0.663, P < 0.05, n=20), 与盐度(SAL)呈显著负相关(rs= –0.525, P < 0.05, n=20), 表明随着温度升高丰度也随着升高, 而随着盐度升高丰度降低。秋季(2013年11月航次), Pielou均匀度指数(J)与表层水温度(WT)呈显著负相关(rs= –0.473, P < 0.05, n=20), 盐度(SAL)与丰度(Abundance)呈显著负相关(rs= –0.633, P < 0.05, n=20), 与生物量(Biomass)呈显著负相关(rs= –0.540, P < 0.05, n=20), 盐度(SAL)与水深(Depth)呈显著正相关(rs=0.721, P < 0.05, n=20)。
|
|
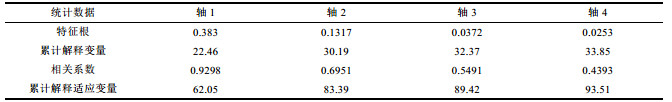
运用Canoco 5软件进行典型对应分析(CCA), 用以了解檀头山岛周围海域大型底栖动物优势种与环境因子的关系(表 7)。环境因子主要有水深(Depth)、温度(WT)、盐度(SAL)、中值粒径(MGS)、黏土(Clay)、粉砂(Silt)、砂(Sand)、溶解氧(DO)、pH等。从典型对应分析(CCA)图中(图 12)可以看出, 8个环境因子对大型底栖动物优势种均有不同程度的影响, 根据箭头长短可以看出各个环境因子对大型底栖动物影响显著程度的大小, 箭头越长影响越大, 反之则越小(张均龙, 2012)。温度(WT)、盐度(SAL)、水深(Depth)、溶解氧(DO)的箭头较长, 表明这个4个环境因子与檀头山岛周围海域大型底栖动物优势种相关程度较大, 剩余的4个环境因子对其影响程度则相对较小。
|
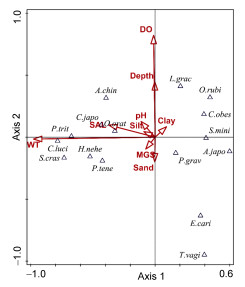 |
图 12 檀头山岛周围海域大型底栖动物优势种与环境因子之间的典型相关分析
Fig. 12 Canonical correspondence analysis (CCA) between dominant macrobenthos and environmental factors in sea area adjacent to Tantoushan Island
注: L. grac (细螯虾),
A. chin (中国毛虾), C. japo (日本蟳), O. orat (东方口虾蛄), P. trit (三疣梭子蟹), P. tene (细巧仿对虾), S. cras (中华管鞭虾), E. crai (脊尾白虾), P. grav (葛氏长臂虾), A. japo (日本鼓虾), S. mini (小荚蛏), C. obese (强壮仙人掌), C. luci (棘头梅童鱼), H. nehe (龙头鱼), T. vagi (孔 虎鱼), O. rubi (红狼牙 虎鱼), O. rubi (红狼牙 虎鱼) 虎鱼)
|
从环境因子与CCA第一排序轴夹角分析, 温度(WT)、盐度(SAL)、中值粒径(MGS)、粉砂(Silt)、pH、中值粒径(MGS)、砂(Sand)与第一排序轴成负相关, 黏土(Clay)与第一排序轴成正相关, 第一排序轴反映了大型底栖动物优势种对上述环境因子的需求趋势, 即从第一排序轴左往右, 大型底栖动物优势种对上述, 温度(WT)、盐度(SAL)、中值粒径(MGS)、粉砂(Silt)、pH、中值粒径(MGS)、砂(Sand)的适应性逐渐降低, 与砂(Sand)的适应逐渐升高。从环境因子与CCA第二排序轴夹角分析, 水深(Depth)、溶解氧(DO)与第二排序轴呈正相关, 即从第二排序轴从下到上, 大型底栖动物优势种随着水深和溶解氧的增大适应性逐渐增强。从大型底栖动物优势种个体来看, 例如日本蟳Charybdis japonica、东方口虾蛄Oratosquilla oratoria与盐度(SAL)有较大的正相关性, 三疣梭子蟹Portunus trituberculatus、棘头梅童鱼Collichthys lucidus、中华管鞭虾Solenocera crassicornis、龙头鱼Harpadon nehereus等与温度(WT)存在较大的正相关性。
3 讨论 3.1 檀头山岛周围海域大型底栖动物生物多样性特点2013年夏季和秋季节, 通过对檀头山岛周围海域大型底栖动物调查结果分析表明, 甲壳动物、软体动物、底栖鱼类在夏、秋两季合计占比均超过90%, 占有绝对优势地位, 这与2011—2013年在南韭山(孙立辉等, 2014)、2012—2013在南田岛(刘迅等, 2015)、2013年长江口潮下带(陈强等, 2015)阿氏拖网调查结果基本一致, 2002年在东海春秋季调查结果表明甲壳类和软体动物也是优势类群(刘录三等, 2002)。由于檀头山岛周围海域大型底栖动物相关研究未见报道, 没有历史数据可以直接对比, 与邻近海域相比, 本次调查获得的种类数少于象山港2006—2008年调查的123种(顾晓英等, 2010), 杭州湾2006—2007年的113种(寿鹿等, 2012), 三门湾2006—2007年的124种(廖一波等, 2011b), 远少于2000—2001年东海的392种(刘录三等, 2002), 主要原因有三方面, 一是随着时间的推移, 人类不合理的开发活动, 如过度捕捞、废水排放、海水酸化(Almagro-Pastor et al, 2015)、全球环境变化(Cheung et al, 2009)等等, 大型底栖动物种类数减少、群落结构简单化的现象较为普遍(杜飞雁等, 2008), 胶州湾(孙道元等, 1996)、深圳近岸海域(吴振斌等, 2002)出现过类似现象; 二是本研究中生物量、丰度、多样性指数、环境参数远近岸间差异均不存在显著差异, 檀头山岛周围海域空间异质性低, 空间异质性高的区域会有更加丰富多样的小生境, 有更多的物种在其适应的小生境生存, 从而具有更高的物种多样性(Davies et al, 2005; Hovick et al, 2015), 具体到大型底栖动物, 已有研究表明复杂、多样的生境是影响大型底栖动物多样性的关键因子(Levin et al, 2003; Kröncke et al, 2011; De Leo et al, 2014); 三是采样方式限制, 本次调查仅使用了定性/半定量的阿氏网, 且网孔孔径较大, 造成一些小个体的大型底栖动物未能网获, 且底内生物难以采集, 不同的采样工具采集效率不同, 联合使用可以提高采捕率(Montiel et al, 2011), 这也是造成本次调查活动大型底栖动物种类数较少的重要原因之一。
3.2 檀头山岛周围海域大型底栖动物群落结构特征分析对檀头山岛周围海域夏季和秋季大型底栖动物群落结构进行聚类分析和nMDS排序分析结果表明, 夏季20个调查站位划分成2个主要聚类组, 聚类组b包含6个站位, 聚类组e包含11个站位, 这两个聚类组平均相似度高, 均超过50%, 秋季也可以划分成2个主要聚类组, 聚类组e有2个站位, 聚类组f有14个站位, 这两个聚类组相似度低, 均不超过50%, 夏季和秋季对各聚类组内平均相似度较的大物种主要是广温、广盐性的甲壳类动物, 如东方口虾蛄Oratosquilla oratoria、中国毛虾Acetes chinensis、细螯虾Leptochela gracilis、葛氏长臂虾Palaemon gravieri、中华管鞭虾Solenocera crassicornis、三疣梭子蟹Portunus trituberculatus等, 檀头山岛位于两个重要的水产养殖基地—象山港和三门湾之间, 又受到长江径流、台湾暖流影响, 为该海域带来了丰富的饵料, 其中的葛氏长臂虾、三疣梭子蟹也是重要的经济种类, 葛氏长臂虾在两个季节均为优势种。甲壳类动物生命周期短, 活动能力强, 对种类更替率贡献较大。同时也注意到, 东方口虾蛄、葛氏长臂虾、三疣梭子蟹、细螯虾、葛氏长臂虾在檀头山岛周围海域以北的长江口及毗邻海域(刘录三等, 2008; 陈强等, 2015)、南韭山(孙立辉等, 2014)、南田岛(刘迅等, 2015)均为优势种。
大型底栖动物群落结构稳定程度是外部因素、种间关系的集中反映, 国内外关于大型底栖动物群落稳定影响机制研究较多(Linares et al, 2005; Pranovi et al, 2008), ABC曲线、香农多样性指数(Shannon-Weiner index) (H')、Pielou均匀度指数(J')与Margalef物种丰富度指数(d)常被用来判断大型底栖动物群落稳定性及受扰动情况(Chainho et al, 2007; Specchiulli et al, 2010), 根据被广泛应用的欧盟水框架指令(Water Framework Directive)(Vincent et al, 2003)中利用香农-威纳多样性指数(H')评价群落受扰动情况, 群落稳定状况被划分成5个等级, 未受到扰动(H′ > 4)、轻微扰动(H′: 3—4)、中度扰动(H′: 2—3)、重度扰动(H′: 1—2)、强烈扰动(H′ < 1), 秋季檀头山岛周围海域大型底栖动物群落受到扰动等级为重度扰动, 夏季为轻微扰动, 这与ABC曲线结果基本一致。
3.3 檀头山岛周围海域大型底栖动物与环境因子关系王宗兴等2011年研究认为影响大型底栖动物次级生产力的主要环境因素是水温(王宗兴等, 2011), 陆强等2010年研究也表明水温是影响杭州西溪湿地春季和夏季大型底栖动物群落结构的主要环境因子(陆强等, 2013), 本研究夏季丰度与水温呈显著正相关, 表明随着温度升高丰度也随着升高, 除此之外, CCA分析也表明温度、盐度、水深、溶解氧对大型底栖动物优势种影响较大。通过对生物因子和环境因子进行相关性分析, 表明各航次沉积物粒径与生物相关因子均不相关, 这可能是由于檀头山岛周围海域底质分布差异小, 该海域的粒径分布较均匀。时空尺度上, 水文状况与底质类型影响着大型底栖动物的种类组成及分布(van der Meer, 1991; Barnes et al, 2014), 陈斌林等2007年研究发现大型底栖动物分布与沉积物中值粒径成负相关(陈斌林等, 2007), 而在本研究中, 中值粒径(MGS)、黏土(Clay)、粉砂(Silt)及砂(Sand)等对大型底栖动物优势种影响程度很小, 这是因为檀头山岛周围海域底质异质性低, 通常生境异质性较高的区域沉积物粒径组成差异大, 形成不同的小生境, 这样的区域底栖动物物种较丰富, 生物多样性较高, 相反地, 在生境异质性较低的区域, 沉积物粒径小, 沉积物颗粒细, 这些区域多是一些食底泥的底栖生物, 而像一些双壳类动物由于受到较高浓度悬浮物颗粒的影响而较难以生存, 另外较细沉积物环境下, 一些在沉积物间隙活动的底栖动物分布也受到限制, 总之在细颗粒的沉积物环境下, 大型底栖的物种多样性较低, 这也间接影响到大型底栖动物的分布差异。
4 结论浙江檀头山岛周围海域夏季和秋季共采集鉴定大型底栖动物55种, 其中甲壳动物最多, 有18种(占32.73%), 其次是底栖鱼类(17种, 占30.91%)、软体动物(16种, 占29.09%), 腔肠动物3种(5.45%), 环节动物最少, 只有1种(1.82%)。节肢动物门甲壳纲的东方口虾蛄、葛氏长臂虾、细巧仿对虾、中华管鞭虾、三疣梭子蟹、日本鼓虾和软体动物门的小荚蛏等出现频率较高, 是本调查海域主要的优势种, 其中的葛氏长臂虾、细巧仿对虾夏秋两个航次的共有优势种。温度、盐度、水深、溶解氧是对大型底栖动物优势种影响较大的环境因子。大型底栖动物在檀头山岛周围海域的空间分布差异不显著。由于采样方式和调查时间的限制, 对檀头山岛周围海域大型底栖动物群落结构的变化规律、分布现状和未来变化趋势研究有待进一步深入探讨。
致谢 海上调查采样得到了宁波市海洋与渔业研究院孙元以及宁波大学李祥付、何京、陈启鹏、孙立辉、陈晨、刘懂等同学的帮助, 谨致谢忱。| 王金辉, 杨春旺, 孙亚伟, 等, 2006. 象山港大型底栖动物的生物多样性和次级生产力研究. 天津农学院学报, 13(2): 24–28 |
| 王宗兴, 孙丕喜, 刘彩霞, 等, 2011. 桑沟湾大型底栖动物的次级生产力. 应用与环境生物学报, 17(4): 495–498 |
| 尤仲杰, 陶磊, 焦海峰, 等, 2011. 象山港大型底栖动物功能群研究. 海洋与湖沼, 42(3): 431–435 DOI:10.11693/hyhz201103015015 |
| 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. GB/T 12763.6-2007海洋调查规范第6部分:海洋生物调查. 北京: 中国标准出版社, 41-44 |
| 龙华, 余骏, 周燕, 2008. 大型底栖动物污染指数在乐清湾潮间带环境质量评价中的应用. 海洋学研究, 26(4): 97–104 |
| 任彬彬, 2015. 应用底栖生物评价威海双岛湾人工鱼礁修复效果. 上海: 上海海洋大学硕士学位论文 |
| 刘迅, 林振华, 焦海峰, 等, 2015. 南田岛周围海域大型底栖动物的种类组成与分布. 生态科学, 34(2): 123–128 |
| 刘录三, 李新正, 2002. 东海春秋季大型底栖动物分布现状. 生物多样性, 10(4): 351–358 |
| 刘录三, 孟伟, 田自强, 等, 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027–3034 |
| 江锦祥, 吴启泉, 黄立强, 等, 1985. 东海陆架及邻近海区底栖生物数量分布初步研究. 海洋学报, 7(2): 246–255 |
| 孙立辉, 李祥付, 王一农, 等, 2014. 南韭山周围海域大型底栖动物种类与分布. 生态科学, 33(1): 32–37 |
| 孙道元, 张宝琳, 吴耀泉, 1996. 胶州湾底栖生物动态的研究. 海洋科学集刊, 37: 103–114 |
| 寿鹿, 曾江宁, 廖一波, 等, 2012. 杭州湾大型底栖动物季节分布及环境相关性分析. 海洋学报, 34(6): 151–159 |
| 杜飞雁, 王雪辉, 贾晓平, 等, 2013. 大亚湾海域浮游动物种类组成和优势种的季节变化. 水产学报, 37(8): 1213–1219 |
| 杜飞雁, 张汉华, 李纯厚, 等, 2008. 大亚湾大型底栖动物种类组成及物种多样性. 中国水产科学, 15(2): 252–259 |
| 杞桑, 林美心, 黎康汉, 1982. 用大型底栖动物对珠江广州河段进行污染评价. 环境科学学报, 2(3): 181–189 |
| 吴振斌, 贺锋, 付贵萍, 等, 2002. 深圳湾浮游生物和底栖动物现状调查研究. 海洋科学, 26(8): 58–64 |
| 张均龙, 2012. 黄海大型底栖生物多样性与群落结构的研究. 青岛: 中国科学院研究生院(海洋研究所)博士学位论文 |
| 张鹏弛, 徐勇, 李新正, 等, 2016. 南黄海夏季软体动物群落结构特征. 海洋与湖沼, 47(4): 774–786 DOI:10.11693/hyhz20160300043 |
| 陆强, 陈慧丽, 邵晓阳, 等, 2013. 杭州西溪湿地大型底栖动物群落特征及与环境因子的关系. 生态学报, 33(9): 2803–2815 |
| 陈强, 郭行磐, 周轩, 等, 2015. 长江口潮下带大型底栖动物群落特征. 水产学报, 39(8): 1122–1133 |
| 陈亚瞿, 徐兆礼, 王云龙, 等, 1995. 长江口河口锋区浮游动物生态研究Ⅰ生物量及优势种的平面分布. 中国水产科学, 2(1): 49–58 |
| 陈斌林, 方涛, 李道季, 2007. 连云港近岸海域底栖动物群落组成及多样性特征. 华东师范大学学报(自然科学版),(2): 1–10 |
| 周红, 张志南, 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58–64 |
| 郑新庆, 黄凌风, 林荣澄, 2014. 环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响——来自稳定同位素的证据. 海洋学报, 36(12): 32–40 DOI:10.3969/j.issn.0253-4193.2014.12.003 |
| 胡银茂, 2006. 东海海区大黄鱼种质资源的历史演变和现状分析. 绍兴文理学院学报, 26(7): 49–53 |
| 顾晓英, 陶磊, 施慧雄, 等, 2010. 象山港大型底栖动物生物多样性现状. 应用生态学报, 21(6): 1551–1557 |
| 徐开达, 朱文斌, 李鹏飞, 等, 2008. 东海北部浅海渔场头足类的数量分布. 浙江海洋学院学报(自然科学版), 27(1): 27–31 |
| 廖一波, 寿鹿, 曾江宁, 等, 2011a. 象山港不同养殖类型海域大型底栖动物群落比较研究. 生态学报, 31(3): 646–653 |
| 廖一波, 寿鹿, 曾江宁, 等, 2011b. 三门湾大型底栖动物时空分布及其与环境因子的关系. 应用生态学报, 22(9): 2424–2430 |
| Almagro-Pastor V, Conradi M, Del Valls T A, et al, 2015. Alterations in the macrobenthic fauna from Guadarranque River (Southern Spain) associated with sediment-seawater acidification deriving from CO2 leakage. Marine Pollution Bulletin, 96(1-2): 65–75 DOI:10.1016/j.marpolbul.2015.05.044 |
| Barnes R S K, Barnes M K S, 2014. Biodiversity differentials between the numerically-dominant macrobenthos of seagrass and adjacent unvegetated sediment in the absence of sandflat bioturbation. Marine Environmental Research, 99: 34–43 DOI:10.1016/j.marenvres.2014.05.013 |
| Chainho P, Costa J L, Chaves M L, et al, 2007. Influence of seasonal variability in benthic invertebrate community structure on the use of biotic indices to assess the ecological status of a Portuguese estuary. Marine Pollution Bulletin, 54(10): 1586–1597 DOI:10.1016/j.marpolbul.2007.06.009 |
| Cheung W W L, Lam V W Y, Sarmiento J L, et al, 2009. Projecting global marine biodiversity impacts under climate change scenarios. Fish and Fisheries, 10(3): 235–251 DOI:10.1111/faf.2009.10.issue-3 |
| Davies K F, Chesson P, Harrison S, et al, 2005. Spatial heterogeneity explains the scale dependence of the native-exotic diversity relationship. Ecology, 86(6): 1602–1610 DOI:10.1890/04-1196 |
| De Leo F C, Vetter E W, Smith C R, et al, 2014. Spatial scale-dependent habitat heterogeneity influences submarine canyon macrofaunal abundance and diversity off the Main and Northwest Hawaiian Islands. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 104: 267–290 DOI:10.1016/j.dsr2.2013.06.015 |
| Flemming B W, 2000. A revised textural classification of gravel-free muddy sediments on the basis of ternary diagrams. Continental Shelf Research, 20(10-11): 1125–1137 DOI:10.1016/S0278-4343(00)00015-7 |
| Hovick T J, Elmore R D, Fuhlendorf S D, et al, 2015. Spatial heterogeneity increases diversity and stability in grassland bird communities. Ecological Applications, 25(3): 662–672 DOI:10.1890/14-1067.1 |
| Jaleel K U A, Kumar P R A, Khan K N, et al, 2014. Polychaete community structure in the South Eastern Arabian Sea continental margin (200-1000m). Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 93: 60–71 DOI:10.1016/j.dsr.2014.07.006 |
| Kröncke I, Reiss H, Eggleton J D, et al, 2011. Changes in North Sea macrofauna communities and species distribution between 1986 and 2000. Estuarine, Coastal and Shelf Science, 94(1): 1–15 DOI:10.1016/j.ecss.2011.04.008 |
| Levin L A, Ziebis W, Mendoza G F, et al, 2003. Spatial heterogeneity of macrofauna at northern California methane seeps:influence of sulfide concentration and fluid flow. Marine Ecology Progress Series, 265: 123–139 DOI:10.3354/meps265123 |
| Linares C, Coma R, Diaz D, et al, 2005. Immediate and delayed effects of a mass mortality event on gorgonian population dynamics and benthic community structure in the NW Mediterranean Sea. Marine Ecology Progress Series, 305: 127–137 DOI:10.3354/meps305127 |
| Montiel A, Quiroga E, Gerdes D, 2011. Diversity and spatial distribution patterns of polychaete assemblages in the Paso Ancho, Straits of Magellan Chile. Continental Shelf Research, 31(3-4): 304–314 DOI:10.1016/j.csr.2010.11.010 |
| Pranovi F, Da Ponte F, Torricelli P, 2008. Historical changes in the structure and functioning of the benthic community in the lagoon of Venice. Estuarine, Coastal and Shelf Science, 76(4): 753–764 DOI:10.1016/j.ecss.2007.08.006 |
| Schiel D R, Steinbeck J R, Foster M S, 2004. Ten years of induced ocean warming causes comprehensive changes in marine benthic communities. Ecology, 85(7): 1833–1839 DOI:10.1890/03-3107 |
| Specchiulli A, Renzi M, Scirocco T, et al, 2010. Comparative study based on sediment characteristics and macrobenthic communities in two Italian lagoons. Environmental Monitoring and Assessment, 160(1-4): 237–256 DOI:10.1007/s10661-008-0691-x |
| van der Meer J, 1991. Exploring macrobenthos-environment relationship by canonical correlation analysis. Journal of Experimental Marine Biology and Ecology, 148(1): 105–120 DOI:10.1016/0022-0981(91)90150-U |
| Vincent C, Heinrich H, Edwards A, et al, 2003. Guidance on typology, classification and reference conditions for transitional and coastal waters. European Commission, Report of CIS WG2.4(COAST),: 119 |
| Zhang J L, Zhang S P, Zhang S Q, et al, 2016. What has happened to the benthic mollusks of the Yellow Sea in the near half century? Comparison on molluscan biodiversity between 1959 and 2007. Continental Shelf Research, 113: 21–29 DOI:10.1016/j.csr.2015.12.004 |
 2017, Vol. 48
2017, Vol. 48