中国海洋湖沼学会主办。
文章信息
- 陈兴强, 李荣华, 王春琳, 胡益鸣, 程继生, 王成, 詹萍萍, 母昌考, 宋微微, 龚小敏. 2017.
- CHEN Xing-Qiang, LI Rong-Hua, WANG Chun-Lin, HU Yi-Ming, CHENG Ji-Sheng, WANG Cheng, ZHAN Ping-Ping, MU Chang-Kao, SONG Wei-Wei, GONG Xiao-Min. 2017.
- 紫贻贝(Mytilus edulis)与厚壳贻贝(M. coruscus)杂交的细胞学观察及子一代的早期生长比较
- CYTOLOGICAL OBSERVATION ON NUCLEAR BEHAVIOR OF HYBRIDS BETWEEN MYTILUS EDULIS AND M. CORUSCUS AND COMPARISON IN EARLY-STAGE GROWTH
- 海洋与湖沼, 48(3): 600-608
- Oceanologia et Limnologia Sinica, 48(3): 600-608.
- http://dx.doi.org/10.11693/hyhz20161200279
-
文章历史
- 收稿日期:2016-12-16
- 收修改稿日期:2017-01-04
2. 浙江海洋高效健康养殖协同创新中心 宁波 315211;
3. 象山鹤浦镇人民政府海洋与渔业办公室 象山 315733
2. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo University, Ningbo 315211, China;
3. Ocean and Fishery Office of People's Government of Hepu, Xiangshan 315733, China
紫贻贝(Mytilus edulis)是一种营足丝固着生活的贝类, 在大西洋、北美洲沿岸等地均有分布。在我国原主要分布于北方, 1973年后南移到浙江嵊泗海域, 现主要为人工养殖种类, 当地人又叫“养殖淡菜”(张义浩, 2009)。紫贻贝成体壳长一般在6—8cm, 个体较小, 壳薄。
与紫贻贝同为贻贝属的厚壳贻贝(Mytilus coruscus Gould), 是浙江沿海本地优势种类, 俗称“野生淡菜”(张义浩, 2009), 成体一般壳长在10—12cm, 由于其个头大, 肉质厚实, 肉味鲜美, 被越来越多的养殖户所青睐。但长期近亲繁育、累代养殖, 导致贝类出现近交衰退, 种质逐年下降, 表现为生长缓慢、经济性状下降、抗逆性降低等等(张玉勇等, 2005), 严重影响了当地贝类养殖业的可持续发展。杂交育种是改良遗传性状、培育优良品种的可靠途径之一(Argue et al, 2014; 官俊良等, 2016; Marulanda et al, 2016)。近年来, 我国学者进行了较多有关海洋贝类种间杂交的实验: 孙长森等(2007)研究了华贵栉孔扇贝和栉孔扇贝种间的杂交, 蔡明夷等(2007)报道了杂色鲍与盘鲍的种间杂交试验, 张跃环等(2012a, b)开展了太平洋牡蛎与近江牡蛎的种间杂交试验以及香港巨牡蛎与长牡蛎的种间杂交试验, 张守都(2013)开展了海湾扇贝和秘鲁紫扇贝的种间杂交试验, 证实了海洋贝类杂交育种的可行性且后代具有一定的杂交优势。
不同种类贻贝在自然分布重叠的环境中存在杂交现象, 表现出基因漂移与渐渗(Secor et al, 2001; Hilbish et al, 2002; Toro et al, 2002; Braby et al, 2006)。常抗美等(2008)于2006年进行了厚壳贻贝与紫贻贝的人工杂交育苗生产性实验, 发现正交F1代:紫贻贝♀×厚壳贻贝♂在存活率和生长速度上相比自交组均表现出生长优势。本研究以紫贻贝和厚壳贻贝为材料进行杂交试验, 采用荧光显微观察方法, 对其受精和早期卵裂过程中核行为的细胞学变化进行观察, 并对杂交后代早期的生长状况进行比较, 以期为贻贝新品种选育提供理论和实践基础。
1 材料与方法 1.1 实验材料实验于2015年12月—2016年4月在宁波兢业水产养殖有限公司进行。紫贻贝(Mytilus edulis)与厚壳贻贝(M. coruscus)于2015年12月采自浙江省象山县渔山列岛。将亲贝悬挂在16℃水温的海水中进行暂养促熟, 每天定时定量投喂球等鞭金藻(Isochrysis galbana)和牟氏角毛藻(Chaetoceros muelleri), 流水培养。
1.2 实验设计建立紫贻贝和厚壳贻贝2个杂交组和2个自交组。杂交组包括紫贻贝♀×厚壳贻贝♂(EC, 正交)和厚壳贻贝♀×紫贻贝♂(CE, 反交); 自交组包括厚壳贻贝♀×厚壳贻贝♂ (CC)和紫贻贝♀×紫贻贝♂(EE)。
1.3 实验方法 1.3.1 催产与人工受精挑选健壮、个大、无损伤的亲贝, 剪断足丝, 清洗掉壳表面的黏附物, 放在1×10-6浓度的高锰酸钾溶液里浸泡2—3min, 期间不断搅拌贝体, 防止贻贝开壳吸入高锰酸钾溶液。消毒后用干净海水冲洗贝体, 采用阴干升温流水刺激法催产。观察到开始排放精卵的雌雄紫亲贝时, 将其单个挑拣出, 仔细清洗壳面和外套膜部位, 单独放在盛有海水的干净消毒的2L塑料盒里继续排放, 精卵待排放完毕后, 挑选4—6个紫贻贝的精子进行混合, 4—6个紫贻贝的卵子进行混合, 厚壳贻贝也相同操作, 得到分别盛有紫、厚贻贝的精液和卵液共四份, 镜检确定无污染后, 按设计的实验组进行精卵混合受精, 控制精子的浓度, 以一个卵子周围5—8个为宜。受精卵分别在4个90L聚乙烯桶中孵化, 孵化过程微量充气, 水温保持在16℃。
1.3.2 胚胎发育过程取样受精25min后, 用400目的捞网取卵子样品, 此后2h内每隔10min取样一次, 用2%海水稀释的甲醛溶液固定于2mL离心管中, 放于阴凉干燥处或4℃冰箱里储存备用。
1.3.3 幼虫培育40h后, 受精卵均孵化成D形幼虫, 用虹吸法进行100%换水, 统计幼虫数量, 计算各组孵化率, 控制在15—20ind/mL的幼虫数量。此后每周100%换水两次, 每天定时投喂金藻和角毛藻的混合藻液, 藻液浓度以100×104ind/mL为宜。培育过程中每组均设单独换水器具, 避免交叉污染。
1.4 数据测量与分析 1.4.1 受精细胞学观察取各组甲醛溶液固定的胚胎样品, 用0.1mol/L磷酸缓冲液PBS (pH=7.4) 清洗一次, 离心数秒吸出上清液, 滴加Hoechst 33258 (上海碧云天生物技术有限公司)荧光染料, 放在黑暗环境里染色5—8min后, 用PBS清洗一次, 在Olympus DP-73荧光显微镜(UV365nm)下观察、统计和拍照。
1.4.2 生长数据测量从D形幼虫开始, 每隔四天随机抽取各组20—30个幼虫进行壳长和壳高的测量。每次换水时, 统计幼虫数量, 计算成活率。
1.4.3 数据处理采用SPSS13.0统计各组生长及存活数据的平均值和标准差, 并进行单因素方差分析及Duncan多重比较分析。
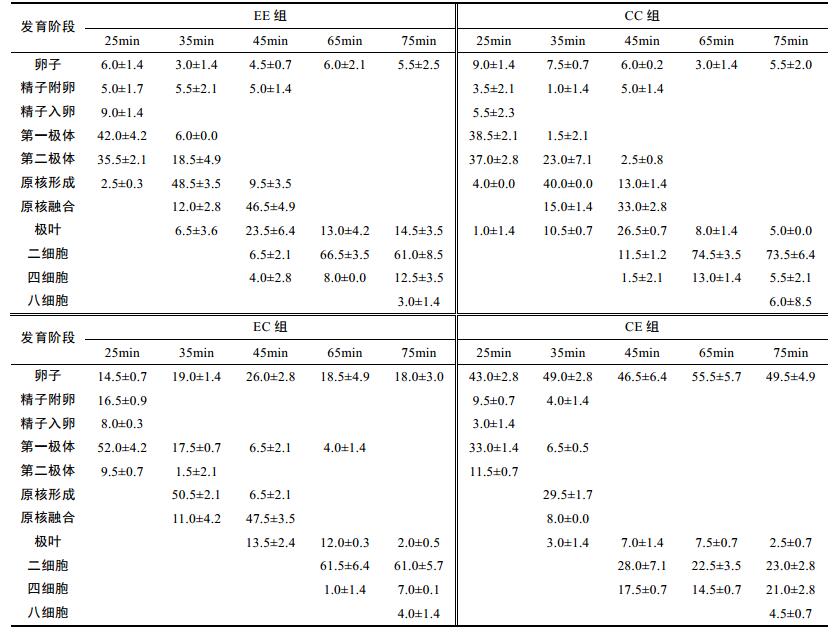
2 结果 2.1 细胞学观察细胞经荧光染料染色后, 在365nm激发光下, 胞内核物质发出亮蓝色荧光, 可以清晰的看到各组减数分裂和卵裂过程的核相变化(图 1—图 4)。在16℃水温的条件下, 自交组EE和CC受精及早期卵裂过程中的核相变化见图 3、图 4, 杂交组EC和CE受精率及受精卵发育速度与自交组差异较大, 存在较多多精入卵导致发育停止的现象, 但正常发育的受精卵核相变化过程与自交组无明显差别(图 1, 图 2)。在此以反交组CE(厚壳贻贝♀×紫贻贝♂)为例, 详述卵子受精和早期卵裂的核相变化过程(表 1, 图 1)。
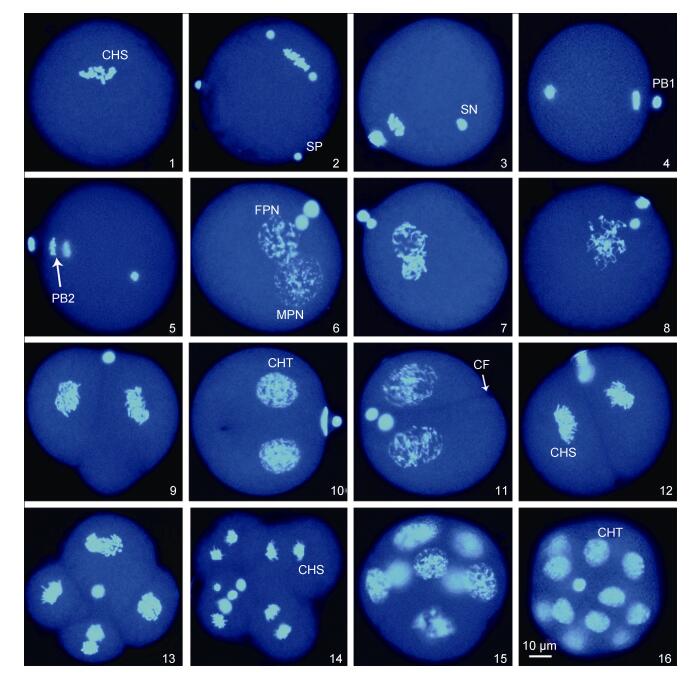 |
| 图 1 厚壳贻贝♀×紫贻贝♂杂交受精卵的减数分裂和卵裂过程(×400) Fig. 1 The process of meiosis and cleavage in eggs of the cross M. coruscus♀×M. edulis♂ (×400) 1.卵子; 2.精子附卵; 3.第一次减数分裂后期; 4.第一极体排出; 5.第二次减数分裂后期; 6.雌、雄原核的形成; 7—8.雌雄原核靠近和融合; 9.极叶; 10—12.二细胞期; 13—14.第三次卵裂后期; 15.八细胞; 16.十六细胞。CHS.染色体; CHT.染色质; SP.精子; SN.精核; PB1.第一极体; PB2.第二极体; FPN.雌性原核; MPN.雄性原核; CF.卵裂沟 |
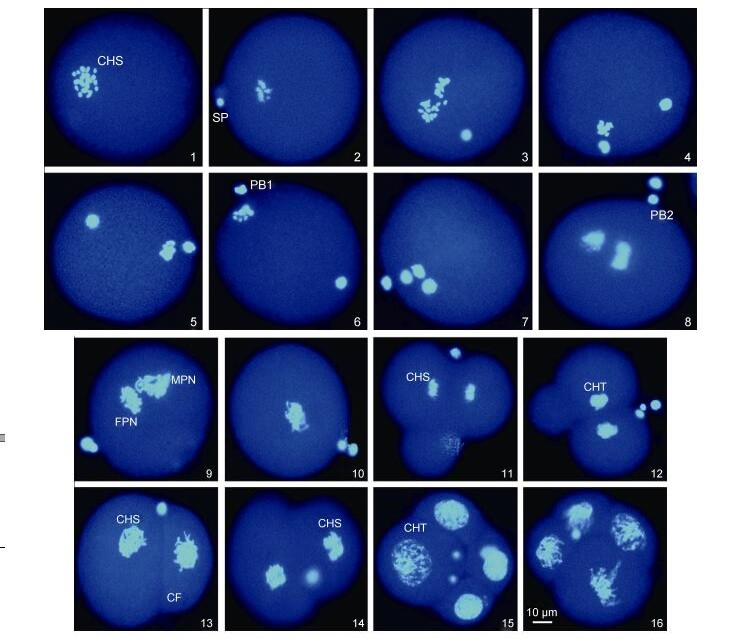 |
| 图 2 紫贻贝♀×厚壳贻贝♂杂交卵子的减数分裂和卵裂过程(×400) Fig. 2 The process of meiosis and cleavage in eggs of the cross M. edulis♀×M. coruscus♂ (×400) 1.卵子; 2.精子附卵; 3.精子入卵; 4.第一次减数分裂后期; 5—6.第一极体形成和排出; 7.第二次减数分裂后期; 8.第二极体排出; 9.雌、雄原核形成; 10.雌、雄原核融合; 11—13.二细胞期; 14.第二次卵裂后期; 15—16.四细胞期。CHS.染色体; CHT.染色质; SP.精子; SN.精核; PB1.第一极体; PB2.第二极体; FPN.雌性原核; MPN.雄性原核; CF.卵裂沟 |
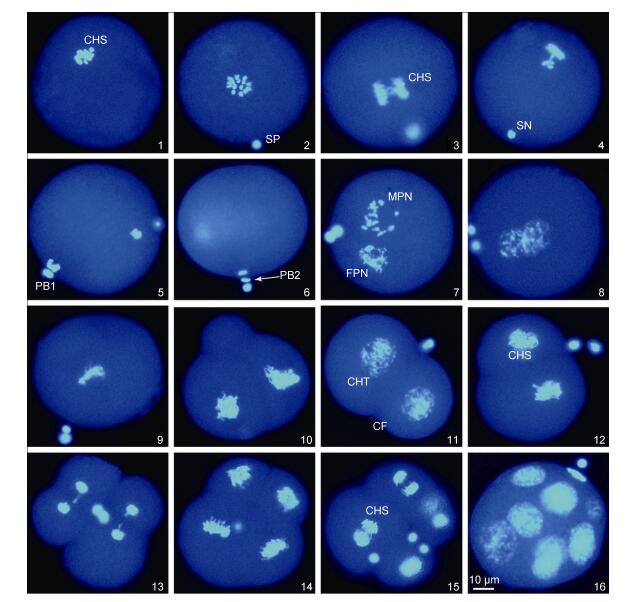 |
| 图 3 紫贻贝♀×紫贻贝♂自交卵子的减数分裂和卵裂过程(×400) Fig. 3 The process of meiosis and cleavage in eggs of the cross M. edulis♀×M. edulis♂ (×400) 1.卵子; 2.精子附卵; 3.第一次减数分裂后期; 4.精子入卵; 5.第一极体排出; 6.第二极体排出; 7.雌、雄原核的形成; 8—9.雌雄原核靠近和融合; 10.极叶; 11—12.二细胞期; 13.第二次卵裂; 14.四细胞期; 15.第三次卵裂; 16.八细胞期。CHS.染色体; CHT.染色质; SP.精子; SN.精核; PB1.第一极体; PB2.第二极体; FPN.雌性原核; MPN.雄性原核; CF.卵裂沟 |
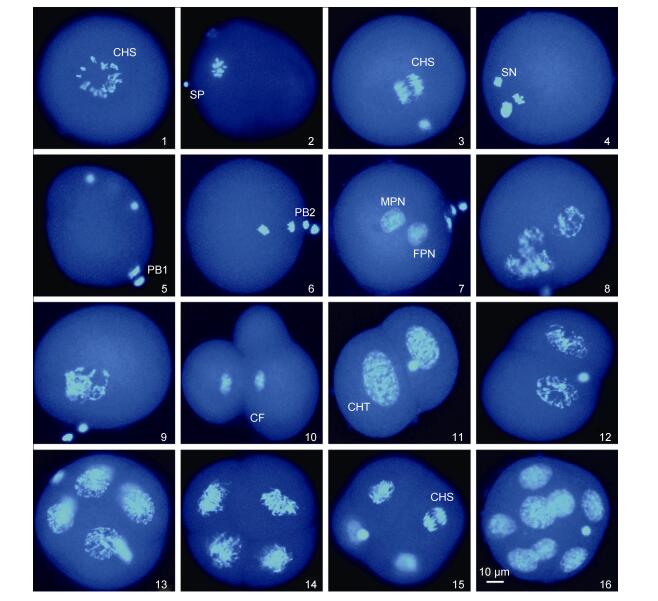 |
| 图 4 厚壳贻贝♀×厚壳贻贝♂自交卵子的减数分裂和卵裂过程(×400) Fig. 4 The process of meiosis and cleavage in eggs of the cross M. coruscus♀×M. coruscus♂ (×400) 1.卵子; 2.精子附卵; 3.第一次减数分裂后期; 4.精子入卵; 5.第一极体排出; 6.第二极体排出; 7.雌、雄原核的形成; 8—9.雌雄原核靠近和融合; 10.极叶; 11—12.二细胞期; 13—14.四细胞期; 15.第三次卵裂; 16.八细胞期。CHS.染色体; CHT.染色质; SP.精子; SN.精核; PB1.第一极体; PB2.第二极体; FPN.雌性原核; MPN.雄性原核; CF.卵裂沟 |

|
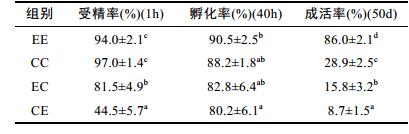
荧光显微观察发现, 各实验组均存在发育不同步、多个发育阶段并存的现象(表 2)。受精后第25min, 所有实验组均能观察到未受精卵至第二极体的胚胎发育阶段。其中反交组CE未受精卵较多; 自交组EE和CC较多受精卵发育到第二极体, 约占受精卵数目的35%和37%;杂交组EC和CE第一极体较多, 发育到第二极体的受精卵仅占9.5%和11.5%。受精后第45min, 各实验组发育不同步现象明显, EC组大部分处于原核融合期, 占47.5%, 而EE、CC和CE组均有部分受精卵已发育到二细胞。受精后第65min, 各实验组大部分均处于二细胞阶段。受精后第75min, 各实验组四细胞比例增多, 且均存在少数八细胞, 受精率CC > EE > EC > CE。
|
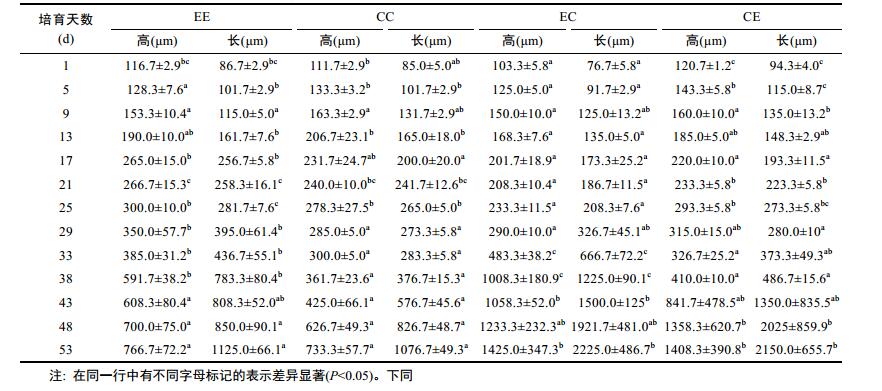
各实验组幼虫的生长情况见表 3。刚孵化的D形幼虫, 各组壳高在100—120μm之间。第1—5天, 幼虫生长较慢, 平均日生长量5μm左右。第5—9天, 各组生长变化较为接近。第9—13天, 自交组生长速率超过杂交组。第13—17天, 各组幼虫生长较快, 生长率为EE > CE > EC > CC, EE、CC与CE组均在17—21天内出现眼点, EC组在21—25天出现眼点。第29天, EE与CE组壳长均超过壳高, 但生长差异较大, 此时壳长EE > EC > CE > CC, EE、EC、CE组均完成附着变态。CC组在第29—33天壳长与壳高变化相对其他各组较小, 变态时间长达7—8天, 这可能是导致厚壳贻贝育苗成活率低的原因。幼虫完成变态以后, 生长速率加快, 最明显的是EC, 在29—33天, 生长率达到104%, 平均日生长长度达到85μm。在43—53天, EE和CC生长较慢, EC的杂交优势表现明显, 壳长均超过了2mm。第50天时, 对4个实验组的稚贝数量进行了统计, 获得平均壳长0.98mm的EE组附着稚贝51.58×104个, 平均壳长0.95mm的CC组附着稚贝17.12×104个, 平均壳长2.07mm的EC组附着稚贝9.24×104个, 平均壳长1.82mm的CE组附着稚贝5.08×104个。养殖成活率EE > CC > EC > CE(表 4)。
|
|
本研究采用荧光显微观察的方法对紫贻贝与厚壳贻贝受精和早期卵裂过程中核行为的细胞学变化进行观察(图 1—图 4), 结果表明紫贻贝与厚壳贻贝正反交的受精细胞学过程和自交无明显区别, 精子进入一个异源卵子, 激活卵子完成两次减数分裂和卵裂。但杂交组胚胎发育速度明显慢于自交组, 受精后25min, 杂交组第二极体释放所占比例远低于第一极体释放, 而自交组这两个阶段则的胚胎比率接近于1:1。说明异源精子对卵子的识别是一个缓慢适应和协调的过程。之后的取样观察发现, 杂交组发育并未出现明显的发育延后, 发育阶段较为统一。表明异源精子识别的过程可能是延缓其胚胎发育的原因之一, 其具体机制还有待进一步研究。
关于贝类种间杂交的研究中, 有较多的物种杂交能实现双向受精, 但正、反交组受精率却不尽相同, 如紫贻贝Mytilus edulis×翡翠贻贝Perna viridis (陈新祥等, 1976)、太平洋牡蛎Crassostrea gigas×近江牡蛎Crassostrea rivularis (Allen Jr et al, 1993)、紫贻贝Mytilus edulis ×地中海贻贝Mytilus galloprovincialis (Beaumont et al, 2004)、长牡蛎Crassostrea gigas×熊本牡蛎Crassostrea sikamea (滕爽爽等, 2010)等。本研究中紫贻贝和厚壳贻贝的正反交组均能受精, 但正交组EC受精率高达82.0%, 而反交组CE仅有50.5%, 两组也存在较大的受精率差异。许飞(2009)提出卵子表面的受精相关物质是在其遗传背景的指导下形成的, 部分基因型形成的卵子可以与外源精子结合发生受精作用, 而那些不相容的配子不能发生受精作用。本研究的正反交组均能受精, 说明母本表达结合素(bindin)、细胞溶素(lysin)等合成的基因能与异源配子兼容。而不对称受精现象的发生, 则可能跟母本的精子结合素蛋白的表达强弱有关。
常抗美等(2007)通过厚壳贻贝与紫贻贝的人工杂交育苗生产性实验发现, 正交F1代紫贻贝♀×厚壳贻贝♂在经过近37天的培养后, 生长率和成活率均显著超过自交组与反交组, 在第37天的壳长生长速度是厚壳贻贝的162%。在本实验中, 杂交组幼虫在浮游阶段并未表现出明显的生长优势, 而正交组EC在经过附着变态以后生长迅速, 在29—38天壳长生长率达到275.0%, 在第38天时壳长比自交组EE高56.39%, 比CC高出226%, 与常抗美报道较一致。本研究中反交组CE在附着后个体间生长差异明显增大, 推测可能存在多方面原因, 例如较优的附着位置、异源精子刺激下导致雌核发育等, 具体情况有待进一步研究。陈新祥等(1976)对紫贻贝♀×翡翠贻贝♂的杂交实验中, 也观察到杂种优势出现于附着后的情况。但贝类杂交后代的生长情况呈现出比较大的差异性, 如海湾扇贝秘鲁紫扇贝正反交组在1—10天均表现出了杂种优势, 在第10天杂交组壳长远大于纯种组, 杂种优势达21.43%(张守都, 2013); 长牡蛎和近江牡蛎正反交组在浮游期的12天内都为正向杂种优势, 而在12天后杂种优势下降, 经历了一个正向到负向的过程。推测可能是配子兼容性发挥作用, 不利于浮游期幼苗的生长(姚托, 2014)。说明同为双壳贝类, 杂交后代可能表现出杂种优势, 也会存在杂种劣势, 说明在双亲遗传差异、遗传背景、所携带等位基因还有环境等因素的不同下, 会得到不一样的杂交结果, 显示出了亲本选择的重要性。
4 结论本研究采用荧光显微观察的方法, 对紫贻贝与厚壳贻贝杂交及自交组受精卵的核行为进行了细胞学观察, 并对早期子代生长情况进行了比较, 研究发现杂交组正常发育的受精卵核相变化过程与自交组无明显差别, 但受精率、孵化率、成活率均低于自交组; 正交组在附着变态后表现出明显的生长优势。本研究结果为进一步解析贻贝的杂交机理提供了理论参考, 并为贻贝杂交育种提供了一定的实践依据。
| 许飞, 2009. 小庙洪牡蛎礁巨蛎属牡蛎间生殖隔离研究. 青岛: 中国科学院海洋研究所博士学位论文, 11-109 |
| 孙长森, 包振民, 王师, 等, 2007. 栉孔扇贝(Chlamys farreri)与华贵栉孔扇贝(C.nobilis)远缘杂交子代的胚胎发生及幼虫生长发育的初步研究. 海洋与湖沼, 38(3): 227–233 |
| 张义浩, 2009. 浙江沿海贻贝种类形态比较研究. 渔业经济研究,(2): 14–20 |
| 张玉勇, 常亚青, 宋坚, 2005. 杂交育种技术在海水养殖贝类中的应用及研究进展. 水产科学, 24(4): 39–41 |
| 张守都, 2013. 海湾扇贝的选择和杂交育种. 青岛: 中国科学院海洋研究所博士学位论文, 62-66 |
| 张跃环, 王昭萍, 闫喜武, 等, 2012a. 太平洋牡蛎与近江牡蛎的种间杂交. 水产学报, 36(8): 1215–1224 |
| 张跃环, 王昭萍, 闫喜武, 等, 2012b. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状. 生态学报, 32(4): 1105–1114 |
| 陈新祥, 林向阳, 黄智芳, 等, 1976. 贻贝有性杂交初步试验. 水产与教育,(2): 36–41 |
| 官俊良, 张跃环, 苏家齐, 等, 2016. 两个地理群体香港牡蛎(Crassostrea hongkongensis)杂交子代早期生长发育的杂种优势研究. 海洋与湖沼, 47(1): 182–187 |
| 姚托, 2014. 长牡蛎、葡萄牙牡蛎与近江牡蛎的种间杂交研究. 青岛: 中国海洋大学博士学位论文, 29-31 |
| 常抗美, 刘慧慧, 李家乐, 等, 2008. 紫贻贝和厚壳贻贝杂交及F1代杂交优势初探. 水产学报, 32(4): 552–557 |
| 常抗美, 吴剑锋, 2007. 厚壳贻贝人工繁殖技术的研究. 南方水产, 3(3): 26–30 |
| 蔡明夷, 柯才焕, 游伟伟, 等, 2007. 杂色鲍♀×盘鲍♂杂交受精的细胞学研究. 厦门大学学报(自然科学版), 46(2): 239–243 |
| 滕爽爽, 李琪, 李金蓉, 2010. 长牡蛎(Crassostrea gigas)与熊本牡蛎(C.sikamea)杂交的受精细胞学观察及子一代的生长比较. 海洋与湖沼, 41(6): 914–921 DOI:10.11693/hyhz201006018018 |
| Allen Jr S K, Gaffney P M, 1993. Genetic confirmation of hybridization between Crassostrea gigas (Thunberg) and Crassostrea rivularis (Gould). Aquaculture, 113(4): 291–300 DOI:10.1016/0044-8486(93)90400-S |
| Argue B J, Kuhlers D L, Liu Z J, et al, 2014. Growth of channel catfish (Ictalurus punctatus), blue catfish (I.furcatus), and their F1, F2, F3, and F1 reciprocal backcross hybrids in earthen ponds. Journal of Animal Science, 92(10): 4297–4305 |
| Beaumont A R, Turner G, Wood A R, et al, 2004. Hybridisations between Mytilus edulis and Mytilus galloprovincialis and performance of pure species and hybrid veliger larvae at different temperatures. Journal of Experimental Marine Biology and Ecology, 302(2): 177–188 DOI:10.1016/j.jembe.2003.10.009 |
| Braby C E, Somero G N, 2006. Ecological gradients and relative abundance of native (Mytilus trossulus) and invasive (Mytilus galloprovincialis) blue mussels in the California hybrid zone. Marine Biology, 148(6): 1249–1262 DOI:10.1007/s00227-005-0177-0 |
| Hilbish T, Carson E, Plante J, et al, 2002. Distribution of Mytilus edulis, M.galloprovincialis, and their hybrids in open-coast populations of mussels in southwestern England. Marine Biology, 140(1): 137–142 DOI:10.1007/s002270100631 |
| Marulanda J J, Mi X F, Melchinger A E, et al, 2016. Optimum breeding strategies using genomic selection for hybrid breeding in wheat, maize, rye, barley, rice and triticale. Theoretical and Applied Genetics, 129(10): 1901–1913 DOI:10.1007/s00122-016-2748-5 |
| Secor C L, Day A J, Hilbish T J, 2001. Factors influencing differential mortality within a marine mussel (Mytilus spp) hybrid population in southwestern in southwestern England:reproductive effort and parasitism. Marine Biology, 138(4): 731–739 DOI:10.1007/s002270000418 |
| Toro J E, Thomopson R J, Innes D J, 2002. Reproductive isolation and reproductive output in two sympatric mussel species (Mytilus edulis, M.trossulus) and their hybrids from Newfoundland. Marine Biology, 141(5): 897–909 |
 2017, Vol. 48
2017, Vol. 48


