
中国海洋湖沼学会主办。
文章信息
- 何杰, 王绪杰, 余方平, 许文军, 谢建军, 王庚申, 汪玮, 施慧. 2017.
- HE Jie, WANG Xu-Jie, YU Fang-Ping, XU Wen-Jun, XIE Jian-Jun, WANG Geng-Shen, WANG Wei, SHI Hui. 2017.
- 食物资源不足条件下螯足数量对三疣梭子蟹(Portunus trituberculatus)摄食行为和种内竞食能力的影响
- THE EFFECTS OF NUMBER OF CHELIPED ON THE ABILITY OF FEEDING AND THE COMPETITION FOR FOOD OF SWIMMING CRAB PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 48(3): 609-616
- Oceanologia et Limnologia Sinica, 48(3): 609-616.
- http://dx.doi.org/10.11693/hyhz20161200291
-
文章历史
- 收稿日期:2016-12-31
- 收修改稿日期:2017-01-15
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲、十足目、梭子蟹科、梭子蟹属, 是我国重要的海产大型经济蟹类。随着市场需求的增加和野生资源的减少, 三疣梭子蟹人工养殖业得到迅猛的发展, 2014年全国养殖面积已达3.33万公顷, 产量11.9万吨(农业部渔业渔政管理局, 2015), 但是三疣梭子蟹生性好斗, 领域性强, 种内相残现象及其严重, 以致池塘养殖成活率低, 单位产量不高(亩产仅30—60kg左右)的问题一直阻碍着该产业的健康可持续发展(丁天宝等, 2009; 乔振国, 2012)。
种内相残属动物种群内的捕食和竞争行为, 是一种典型的社会行为, 普遍存在于鱼类、甲壳类等水生动物中(陈学雷等, 2008)。绝大多数动物通常在应对种内相残时会采取一定的防御措施以保证自身的生命安全(He et al, 2016a), 其中虾蟹类甲壳动物往往通过自切身体附肢(包括螯足、步足或游泳足)借以迷惑对方而趁机逃生(Quinitio et al, 2011)。研究表明大多数虾蟹类在格斗过程中会张开双螯进行正面还击(Jachowski, 1974), 它们在这种预知的进攻下可大大提高存活率, 但也正因如此, 螯足成了虾蟹类最易遭受损伤或自切的附肢(Juanes et al, 1995), 作者先前的研究也发现池塘养殖条件下三疣梭子蟹附肢残缺率高达30%左右, 而且在所有残疾蟹中, 缺失螯足的个体占50%左右(He et al, 2016b)。
螯足是虾蟹类捕食、自卫和交配的重要工具(Juanes et al, 1990), 因此, 其缺失对虾蟹类摄食、生长、交配的影响已受到了广泛的关注和研究(Daleo et al, 2009; Quinitio et al, 2011), 而有关螯足缺失对虾蟹类种内竞争力的影响研究甚少。自然条件下, 同一生境中同种动物之间对有限公共资源的竞争主要包括食物、窝巢或配偶等, 其中对食物的竞争最为常见, 尤其是在高密度、封闭的人工饲养环境下, 养殖动物在获取有限的食物资源时更易发生激烈的竞争(尚玉昌, 2005)。鉴于此, 本研究将在实验室内食物不足条件下, 探讨螯足缺失(螯足数量)对三疣梭子蟹摄食、竞食能力的影响, 为进一步研究种内相残或附肢自切对甲壳动物生理生态的影响奠定研究基础, 同时为丰富甲壳动物的行为生态学、种群生态学和养殖生态学提供理论资料。
1 材料与方法 1.1 实验材料本实验于2016年8月开展于浙江省海洋水产研究所西闪岛试验场。在池塘养殖三疣梭子蟹去雄(剔除雄蟹)期间, 从池塘内诱钓并挑选十足健全、规格相近(全甲宽为90.56±2.17mm)的梭子蟹雄蟹200余只运回实验室, 暂养至室内水泥池(长×宽×高=8m×1.8m× 1m), 水深40cm, 水温28±2℃, pH 8.8±0.1, 连续充氧, DO > 5mg/L。每天下午17:00投喂鲜活带鱼鱼块, 次日上午8:00清除残饵并换水1/3, 维持良好水质。
1.2 实验方法 1.2.1 螯足缺失处理备用的三疣梭子蟹暂养3d后, 从中挑选90只处于蜕壳间期C期(蜕壳周期的判别参照沈洁等(2011) 的方法)且十足健全的三疣梭子蟹, 并参照He等(2016) 的方法, 采用人工拉压法随机使其中的30只蟹均缺失2个螯足(C0, 保留0个螯足), 30只蟹均缺失1个螯足(C1, 保留1个螯足), 剩余30只蟹均保留健全的双螯(C2), 图 1所示3组蟹的形态。
 |
| 图 1 具有不同数量螯足三疣梭子蟹的形态 Fig. 1 The morphology of P. trituberculatus which had different numbers of cheliped |
选取1只长×宽×高=8m×1.8m× 1m的室内水泥池, 使用渔网、砖块等材料将其等分成3个单元格(长×宽×高=2.6m×1.8m×1m), 单元格间的水流相通, 水深40cm, 连续充氧。在各单元格上空中心位置安装一不锈钢支架, 固定一便携式摄像机(型号: Sony HDR-PJ410)。之后向各单元格内同时放养C0、C1、C2梭子蟹各10只, 每天下午17:00投喂鲜活的带鱼鱼块, 次日上午8:00清除残饵并换水1/2, 试验期间的水温为28±2℃, PH 8.8±0.1, DO > 5mg/L。
1.2.3 数据采集4d后, 待实验蟹基本适应实验环境后开始正式实验。正式实验期间, 每天下午17:00打开摄像机, 调准好焦距, 使其可清晰拍摄单元格内所有蟹的活动行为, 然后向单元格中间区域随机投喂10块(份)大小相近(2.0±0.1g)的带鱼鱼块, 待所有蟹啃食完毕后关闭摄像机(约10—15min), 按同样方法依次记录3个单元格内蟹的摄食和竞食行为, 整个实验持续3d, 每单元格每天记录一次摄食和竞食行为, 即整个实验重复9次。拍摄结束后, 使用笔记本电脑(型号: lenovo G425) 读取摄像机SD卡内的影像资料, 人为统计每次摄食期间蟹索食所用时间(TS)、啃完食物所用时间(TF)、鱼块被不同蟹的占有率(OR), 并从每重复中随机挑选6—8只蟹, 分别记录每只蟹在整个啃食过程中被同类抢食的次数(QG)、是否被成功抢走以及其携带食物更换空间位置(以水平位移大于20cm左右为标准)的次数(QC)等。
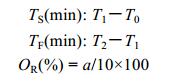
式中, T1为三疣梭子蟹发现并抱持食物时的时间, T0为实验开始时间, T2为三疣梭子
蟹啃食完食物时的时间, a为鱼块被具有不同数量螯足三疣梭子蟹占有的数量。
1.3 数据处理各实验数据均用平均值±标准差(Χ±S.D)表示, 不同试验组数据间采用单因素方差分析, 对检测达到显著的平均值用Duncan检验, 方差分析和多重比较用SPSS11.5进行, 在Sigmaplot10.0下绘制相关图表。
2 结果 2.1 螯足数量对三疣梭子蟹摄食行为的影响投喂食物后, 实验蟹均反应积极, 沿池底四处游动或爬行, 表现出明显的索食行为, 但是作者发现, 三疣梭子蟹在搜寻食物过程中有些“迷茫”, 尤其是靠近食物时, 也难以对食物的位置有准确定位, 证实其并非使用视觉发现食物, 而是依靠嗅觉索食。三疣梭子蟹一旦发现食物后, 将迅速的使用螯足或步足抱持食物, 并将食物送入口器中开始啃食。由图 2可见, 3种具有不同数量螯足的三疣梭子蟹发现并抱持食物所需的平均时间均在0.26min左右, 无显著差异(P > 0.05)。
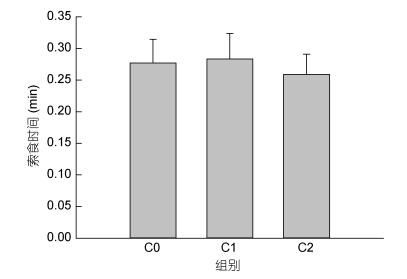 |
| 图 2 螯足数量不同的三疣梭子蟹索食所需的时间 Fig. 2 The searching time of P. trituberculatus which had different numbers of cheliped |
具有不同数量螯足三疣梭子蟹抱持、保护和啃食食物的动作却显然不同(图 3), C0组三疣梭子蟹用第一对步足抱持食物, 并将食物送入口器(图 3a), C1组三疣梭子蟹使用单个螯足夹住食物后送入口器, 并在啃食过程中使用单个螯足辅助大颚撕扯、切碎食物(图 3b); C2组梭三疣梭子蟹同时使用两螯足夹住食物后送入口器(图 3c)。实验中还发现: 3组三疣梭子蟹均有部分个体表现出同时抢占2份食物的行为。在此行为动作上, C2组三疣梭子蟹用两螯足各抱持一份食物并将其中一份食物送入口器中啃食, 啃食完毕后再啃食第二份食物; C1组三疣梭子蟹一般用大颚啃食一份食物的同时, 用单个螯足携持另一食物, 而C0组三疣梭子蟹通常用大颚啃食一份食物的同时, 用第一对步足抱持另一食物。由图 4可见, 不同螯足数量三疣梭子蟹抢占两份食物的比例也不同, C2组蟹抢占两份食物的比例最高, 达20%以上, 显著高于C0组(仅3%左右)和C1组(仅5%左右)(P < 0.05)。
 |
| 图 3 螯足数量不同的三疣梭子蟹抱持食物时的动作 Fig. 3 The action of feeding of P. trituberculatus which had different numbers of cheliped |
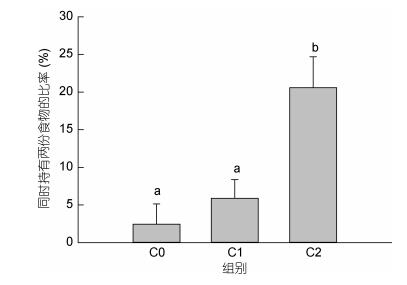 |
| 图 4 螯足数量不同的三疣梭子蟹同时持有两份食物的比率 Fig. 4 The proportion of taking two copies food at the same time of P. trituberculatus which had different numbers of cheliped 注:图中同类柱形顶部不同字母表示差异显著(P < 0.05), 下同 |
由于实验期间食物资源有限, 不同螯足数量三疣梭子蟹在持有食物期间均可能遭受同类的抢夺, 而且个体间争抢非常激烈。观察发现, 本实验中三疣梭子蟹种内抢食行为可分为4个阶段: (1) 相遇阶段:双方正面相遇, 抢食者向食物持有者靠近, 没有额外使用附肢进攻, 食物持有者也未表现出任何防御行为; (2) 示威阶段:抢食者抬高身体、展开螯足(或第一步足)以向对方示威, 而具有不同数量螯足三疣梭子蟹(食物持有者)表现出不同的防御措施, C0组蟹用小颚咬住食物并选择快速逃离, 时而用步足进行抵御, 大多数C1组蟹亦用小颚夹住食物, 用螯足防御或进攻, 少部分蟹使用螯足携持食物的同时张举螯足示威以驱赶侵袭者, C2组蟹将使用其中一个螯足携持食物, 而张举另一螯足以抵御同类攻击; (3) 抢夺阶段:抢食者直接使用螯足(或第一步足)抢夺对方所持有的食物, 双方不断使用螯足或步足推挤, 还努力翻转对方或扭曲对方的身体企图损伤或卸去对方的附肢; (4) 撤退阶段:食物完全被对方抢走后, 失败方选择撤离, 意味着抢夺结束。
图 5显示:参试蟹中的60%—80%持有食物的个体曾遭受C2组蟹的抢夺, 40%—70%的个体曾遭受C1组蟹的抢夺, 0%—30%的个体曾遭受C0组蟹的抢夺, 可见, 各组三疣梭子蟹遭C2组蟹抢食的比率最高, 遭C1组蟹抢食的比率次之, 遭C0组蟹抢食的比率最低, 而且, 经统计学分析, 各组三疣梭子蟹遭C0、C1、C2组蟹抢食的比率存在显著差异(P < 0.05);另外, C2组蟹更倾向于抢夺C0或C1组蟹所持有的食物, 而C0组蟹仅能向部分与其一样无螯或仅有一只螯的蟹发起抢食性的攻击, 整个实验期间未发现C2组蟹被C0组蟹抢食的行为。
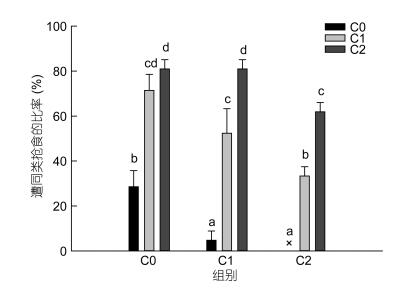 |
| 图 5 螯足数量不同的三疣梭子蟹遭同类抢食的比率 Fig. 5 The proportion of being robbed of food by their own kind of P. trituberculatus which had different numbers of cheliped |
从具有不同螯足数量三疣梭子蟹遭同类抢食的次数来看(图 6), 三疣梭子蟹在争抢食物的对象上表现出明显的选择性抢夺行为, 一方面C0、C1、C2组蟹均遭C2组蟹抢食的次数最多, 遭C0组蟹抢食的次数最少, 并且遭C2组蟹抢食的次数显著多于遭C0组蟹抢食的次数(P < 0.05), 可见C2组蟹的抢食欲望最强, 而螯足缺失(C0和C1) 后的蟹抢食欲望减弱, 尤其是C0组蟹仅对C0和C1组的蟹进行抢食, 并从未抢食C2组蟹中持有的食物; 另一方面, 各组蟹之间相比, C0组蟹分别遭C0、C1、C2组蟹抢食的次数及总次数均为最多, C1组次之, C2组最少, 但差异不显著(P > 0.05), 这也进一步说明缺失螯足后的蟹更容易遭受同类对食物的抢夺。
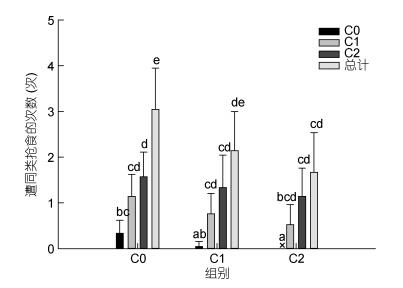 |
| 图 6 螯足数量不同的三疣梭子蟹遭同类抢食的次数 Fig. 6 The frequency of being deprived of food by their own kind of P. trituberculatus which had different numbers of cheliped |
具有不同螯足数量三疣梭子蟹所持有的食物均可能被同类抢走, 图 7显示: C0组蟹中50%的个体所持有的食物会被同类抢走, 显著高于C1组(约30%)和C2组(约20%); C0组蟹所持食物均可能被其他任何组的蟹抢走, 其中被C2组蟹抢走的比率最高, 接近30%, 被C0组蟹抢走的比率最低, 约5%, 而C1与C2组蟹所持食物被C1与C2组蟹抢走的比率接近, 未发现所持食物被C0组蟹抢走。整体上, C2组三疣梭子蟹的抢食能力较强, C1组蟹次之, 而C0组蟹最弱, 其难以从同类其他个体中成功抢夺食物, 而且, C2组三疣梭子蟹对食物的保护能力也最强, 螯足数量越少的蟹对食物的保护能力越弱。
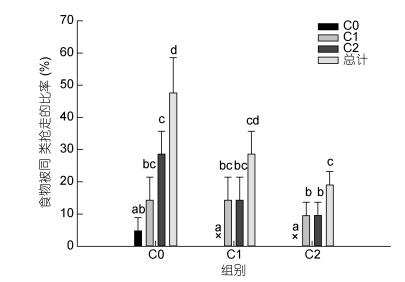 |
| 图 7 螯足数量不同的三疣梭子蟹所持食物被同类抢走的比率 Fig. 7 The proportion of being deprived of food by their own kind of P. trituberculatus which had different numbers of cheliped |
实验观察还发现:三疣梭子蟹在啃食期间, 为躲避或逃离同类抢夺食物, 其会不停的跑动, 更换空间位置, 远离同类, 以降低所持食物被同类发现和抢夺的概率, 其中, C0组蟹最为明显, 其在整个肯食过程中更换了约10次空间位置(图 8), C1组更换了约6次位置, C2组更换了约5次位置, 总体上C0组更换位置的次数显著高于C1组和C2组(P < 0.05), 而C1组和C2组之间差异不显著(P > 0.05)。
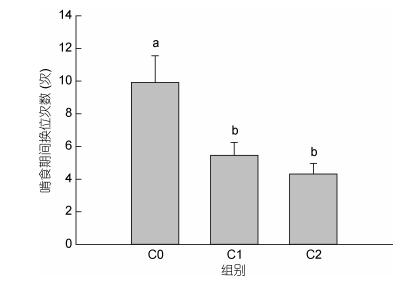 |
| 图 8 螯足数量不同的三疣梭子蟹啃食期间身体移动次数 Fig. 8 The number of moving of P. trituberculatus which had different numbers of cheliped during feeding period |
由于不同螯足数量三疣梭子蟹的抢食能力以及对食物的保护能力不同, 以致其最终对食物的占有率也不同, 由图 9可见, C2组三疣梭子蟹占有率最高, 占有了50%以上的食物, C1组蟹次之, 占有了30%的食物, C2组蟹最低, 仅占有了不到20%的食物, 整体上, C2组蟹对食物的占有率显著高于C1组和C0组。
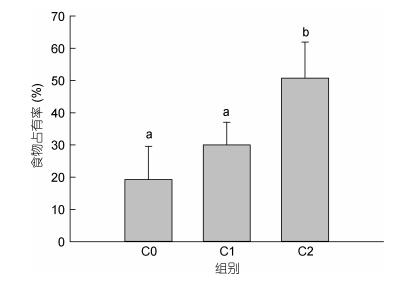 |
| 图 9 螯足数量不同的三疣梭子蟹对食物的占有率 Fig. 9 The occupation ratio of P. trituberculatus which had different numbers of cheliped |
具有不同数量螯足三疣梭子蟹不但啃食动作和速度不一, 而且其在啃食过程中因遭遇同类抢食而产生的防卫耗时也不同, 因此, 其在抱持食物后啃食完毕所持续的时间不尽相同(图 10), 整体上C1与C2组梭子蟹啃食时间相当, 啃食时间约为4min, 两组间无显著差异(P > 0.05), 而C0组梭子蟹的进食明显较慢, 啃食时间(约7min)显著长于C1与C2组(P < 0.05)。
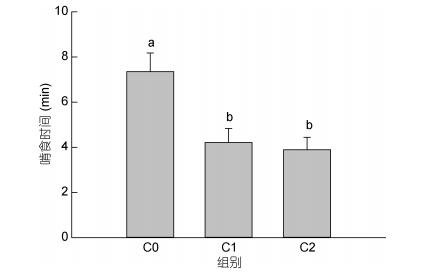 |
| 图 10 螯足数量不同的三疣梭子蟹啃食食物所需的时间 Fig. 10 The feeding time of P. trituberculatus which had different numbers of cheliped |
螯足是甲壳动物捕捉、携持和肢解食物的重要工具(Juanes et al, 1995)。Juanes等(1990)研究发现, 与健全个体相比, 螯足损伤或缺失的黄道蟹(Metacarcinus magister)捕获相同大小猎物所耗的时间较长, 而具有不同螯足数量的三疣梭子蟹索食时间基本相同, 这可能与本研究所用食物为静止不动的饲料鱼鱼块而无需三疣梭子蟹采取追逐式抓捕的行为有关。缺失1个螯足的三疣梭子蟹可用单个螯足抱持食物并辅助啃食, 而双螯均缺失的个体依靠第一步足获取、抱持食物, 这一行为与石头蟹(Menippe mercenaria) (Savage et al, 1978)、蓝蟹(Callinectes sapidus) (Smith et al, 1991)、肉球近方蟹(Hemigrapsus sanguineus) (Davis et al, 2005)和云斑厚纹蟹(Pachygrapsus transversus) (Oliveira et al, 2015)的研究结果一致, 作者认为这是甲壳动物缺失螯足后为继续获取食物维持生存所采取的一种行为补偿策略。虽然步足可抱持食物, 但始终无法代替螯足具有的抓捕、撕扯、翻转和剪切食物的功能, 在其他多种蟹类中已证实:双螯缺失的个体难以捕食外壳坚硬和活动快速的猎物(如硬壳贝类、鱼类等), 只能摄食部分无脊椎动物、藻类和水草, 甚至由典型的肉食动物转变为草食动物(Juanes et al, 1995; Flynn et al, 2015), 可见, 步足的助食能力仍有其局限性, 这也正是本研究中双螯均缺失的三疣梭子蟹啃完食物所用时间较长的主要原因之一。甲壳动物缺失的螯足会在后续的生长过程中得以再生(He et al, 2016a), 至于再生的螯足是否具有原生螯足同等的撕扯和剪切功能以及螯足再生个体是否能完全恢复其捕食和摄食能力有待今后更深入的研究。
动物往往会在食物资源丰富时, 储存一些食物等饥饿时再食用的行为称为储食行为, 在鸟类、兽类最为常见(尚玉昌, 2005), 而有关水生低等动物的储食行为报道极为罕见。我们发现无论是螯足健全还是螯足缺失的三疣梭子蟹均有部分个体同时抱持两块食物, 并在啃食一份食物的同时暂时保存(或保护)另一份食物, 这是否能说明甲壳动物也具有短期的计划性贮食行为仍有待进一步证实。
3.2 螯足数量对三疣梭子蟹种内竞食能力的影响自然界中, 由于环境变迁、季节更替以及食物分布在时空上的不均匀性, 动物经常在其生命周期中面临食物资源的短缺, 即使是在人工养殖条件下, 饵料投喂不足也时有发生, 因此, 大多数水生动物难免会因为食物短缺而加剧种内竞争(吴立新等, 2004; 李玉全等, 2013)。研究食物不足条件下水生动物的行为、生理生态响应机制, 对动物的保护和实际生产具有重要意义(范帆等, 2011; Sun et al, 2016)。本研究发现在食物不足条件下, 缺失螯足将严重影响三疣梭子蟹对食物的占有率, 作者认为一方面是螯足缺失个体为能尽快再生出新的螯足而减少索食活动造成的能量消耗, 致使其摄食机会降低; 另一方面是缺失螯足的三疣梭子蟹抢食能力不如螯足健全个体, 这一点已经从不同螯足数量三疣梭子蟹在持有食物期间被同类抢夺的比率、抢夺的次数以及被抢夺成功的比率等结果得到证实。螯足数量越多的三疣梭子蟹, 抢食欲望、抢食能力越强, 而且更趋向向双螯均缺失个体发起抢夺性攻击, 具有明显的“强欺弱”现象。而双螯缺失个体的防御能力很弱, 只能通过不停的更换空间位置来躲避同类对食物的争夺, 即使如此仍有近一半个体的食物被同类抢走, 可见, 螯足缺失将直接影响三疣梭子蟹的竞食能力, 从生态学角度论, 这是它们基于生境选择压力而就自身条件对抢食和避敌对策进行权衡和优化的结果。
3.3 种内竞食能力减弱对三疣梭子蟹的次生影响三疣梭子蟹的正常摄食, 既满足日常活动的需要, 又能储存足够的物质与能量促进自身蜕壳和生长。螯足缺失对竞食能力的影响难免会导致缺失螯足的梭子蟹受到不同程度的饥饿胁迫, 而众多研究表明饥饿胁迫对甲壳动物成活和蜕壳成功率有直接抑制外, 对其蜕壳后的增重率和蜕壳周期也有不同程度的影响, 进而加剧养殖群体的规格分化(吴立新等, 2004; 何杰等, 2013), 在其他甲壳动物中已证实:群体规格发生分化, 将继续加剧种内食物竞争, 出现强食弱、大欺小的种内自残现象, 恶性循环, 最终成活率和养殖产量低下(Polis, 1981; Gebauer et al, 2003)。但又有研究发现:螯足不仅用于捕食和摄食, 还是格斗、防御的重要工具, 如果同一群体内的甲壳动物均缺失螯足将有效降低种内自相残杀的发生率和种内社群控制力, 从而消减种群内“强欺弱”、“大欺小”现象, 可有效提高蜕壳的同步率和成活率(Aiken et al, 1979, 1981; Kendall et al, 1982)。
4 结论整体上, 缺失单个螯足对三疣梭子蟹摄食和竞食行为的影响不大, 而缺失双螯将严重影响了三疣梭子蟹的摄食和竞食能力, 因此, 建议在三疣梭子蟹养殖生产过程中要合理配置放养密度, 在池塘内尽量多投放一些瓦罐、树枝以及人工开发的蟹礁供蟹栖息和隐蔽, 同时在投喂饵料方面应通过均匀、足量的投喂管理手段, 以最大程度减少种内相残现象的发生和降低附肢损伤或丢失后引起的次生影响。
| 丁天宝, 刘振华, 2009. 影响梭子蟹池塘养殖成活率的因素及应对措施. 河北渔业,(8): 21–22 |
| 乔振国, 2012. 海水蟹类安全生产技术指南. 北京: 中国农业出版社, |
| 农业部渔业渔政管理局编, 2015. 2015中国渔业统计年鉴. 北京: 中国农业出版社, |
| 李玉全, 孙霞, 2013. 水生动物的争胜行为. 动物学研究, 34(3): 214–220 |
| 吴立新, 董双林, 姜志强, 2004. 饥饿对甲壳动物生理生态学影响的研究进展. 应用生态学报, 15(4): 723–727 |
| 何杰, 王春, 邵路畅, 等, 2013. 饥饿胁迫对中华绒螯蟹(Eriocheir sinensis)仔蟹的影响. 生态学杂志, 32(8): 2077–2084 |
| 陈学雷, 李少菁, 王桂忠, 等, 2008. 拟穴青蟹大眼幼体相残与资源可获得性和饥饿关系的研究. 厦门大学学报(自然科学版), 47(1): 99–103 |
| 范帆, 尹飞, 彭士明, 等, 2011. 饥饿胁迫对曼氏无针乌贼幼体的影响. 生态学杂志, 30(10): 2262–2268 |
| 尚玉昌, 2005. 动物行为学. 北京: 北京大学出版社, |
| Aiken D E, Young-Lai W W, 1979. Cheliped ablation and immobilization:methods for improving survival and growth of juvenile American lobsters in communal culture tanks. Journal of the World Aquaculture Society, 10(1-4): 159–161 |
| Aiken D E, Young-Lai W W, 1981. Dactylotomy, chelotomy and dactylostasis:methods for enhancing survival and growth of small lobsters (Homarus americanus) in communal conditions. Aquaculture, 22: 45–52 DOI:10.1016/0044-8486(81)90132-0 |
| Daleo P, Luppi T, Casariego A M, et al, 2009. The effect of size and cheliped autotomy on sexual competition between males of the mud crab Cyrtograpsus angulatus Dana. Marine Biology, 156(3): 269–275 DOI:10.1007/s00227-008-1081-1 |
| Davis J L D, Dobroski N A, Carlton J T, et al, 2005. Autotomy in the Asian shore crab (Hemigrapsus sanguineus) in a non-native area of its range. Journal of Crustacean Biology, 25(4): 655–660 DOI:10.1651/C-2586.1 |
| Flynn P S T, Mellish C L, Pickering T R, et al, 2015. Effects of claw autotomy on green crab (Carcinus maenas) feeding rates. Journal of Sea Research, 103: 113–119 DOI:10.1016/j.seares.2015.07.002 |
| Gebauer P, Paschke K, Anger K, 2003. Delayed metamorphosis in decapod crustaceans:evidence and consequences. Revista Chilena de Historia Natural, 76(2): 169–175 |
| He J, Wu X G, Cheng Y X, 2016a. Effects of limb autotomy on growth, feeding and regeneration in the juvenile Eriocheir sinensis. Aquaculture, 457: 79–84 DOI:10.1016/j.aquaculture.2016.02.004 |
| He J, Gao Y, Wang W, et al, 2016b. Limb autotomy patterns in the juvenile swimming crab (Portunus trituberculatus) in earth ponds. Aquaculture, 463: 189–192 DOI:10.1016/j.aquaculture.2016.05.043 |
| Jachowski R L, 1974. Agonistic behavior of the blue crab, Callinectus sapidus Rathbun. Behaviour, 50(3): 232–253 DOI:10.1163/156853974X00471 |
| Juanes F, Hartwick E B, 1990. Prey size selection in Dungeness crabs:the effect of claw damage. Ecology, 71(2): 744–758 DOI:10.2307/1940327 |
| Juanes F, Smith L D, 1995. The ecological consequences of limb damage and loss in decapod crustaceans:a review and prospectus. Journal of Experiment of Marine Biology and Ecology, 193(1-2): 197–223 DOI:10.1016/0022-0981(95)00118-2 |
| Kendall R A, Van Olst J C, Carlberg J M, 1982. Effects of chelae immobilization on growth and survivorship for in dividually and communally raised lobsters, Homarus americanus. Aquaculture, 29(3-4): 359–372 DOI:10.1016/0044-8486(82)90148-X |
| Oliveira D N D, Christofoletti R A, Barreto R E, 2015. Feeding behavior of a crab according to cheliped number. PLoS One, 10(12): e0145121 DOI:10.1371/journal.pone.0145121 |
| Polis G A, 1981. The evolution and dynamics of intraspecific predation. Annual Review of Ecology and Systematics, 12(1): 225–251 DOI:10.1146/annurev.es.12.110181.001301 |
| Quinitio E T, Estepa F D P, 2011. Survival and growth of mud crab, Scylla serrata, juveniles subjected to removal or trimming of chelipeds. Aquaculture, 318(1-2): 229–234 DOI:10.1016/j.aquaculture.2011.05.034 |
| Savage T, Sullivan J R, 1978. Growth and claw regeneration of the stone crab, Menippe mercenaria. In:St. Petersburg F L ed. Florida Department of Natural Resources. Florida:Florida Marine Research Laboratory, 1-23 |
| Smith L D, Hines A H, 1991. The effect of cheliped loss on blue crab Callinectes sapidus Rathbun foraging rate on soft-shell clams Mya arenaria L. Journal of Experiment of Marine Biology and Ecology, 151(2): 245–256 DOI:10.1016/0022-0981(91)90127-I |
| Sun Y F, Wang F, Liu D P, et al, 2016. Behavioral mechanisms underlying the functional response of the swimming crab Portunus trituberculatus preying on the Manila clam Ruditapes philippinarum. Marine Biology, 163: 124 DOI:10.1007/s00227-016-2900-4 |
 2017, Vol. 48
2017, Vol. 48


