
中国海洋湖沼学会主办。
文章信息
- 赵玉超, 秦浩, 李娜, 沈敏, 王仁杰, 李玉全. 2017.
- ZHAO Yu-Chao, QIN Hao, LI Na, SHEN Min, WANG Ren-Jie, LI Yu-Quan. 2017.
- 神经递质多巴胺(DA)和5-羟色胺(5-HT)对三种主要养殖对虾争胜行为的影响
- EFFECTS OF NEUROTRANSMITTER DOPAMINE AND 5-HYDROXYTRY PTAMINE ON AGONISTIC BEHAVIOR OF THREE FARMED SHRIMP
- 海洋与湖沼, 48(3): 628-633
- Oceanologia et Limnologia Sinica, 48(3): 628-633.
- http://dx.doi.org/10.11693/hyhz20161200293
-
文章历史
- 收稿日期:2016-12-31
- 收修改稿日期:2017-01-18
争胜行为是同种动物个体相遇争斗的行为, 是一种典型的社会行为, 普遍存在于鱼类、甲壳类等水生动物中(李玉全等, 2013b)。对虾争胜行为的研究对丰富甲壳类行为学研究、合理调控对虾工厂化养殖密度具有十分重要的作用。目前, 有关对虾争胜行为的研究甚少, 仅限于生存因子、饵料、养殖密度等方面(张沛东等, 2008; 秦浩等, 2014; 李玉全, 2014; 赵玉超等, 2016), 但探究其调控机理的研究尚未见报道。生物胺(BA)广泛分布于甲壳动物的中枢神经系统和外周器官内, 可作为神经递质或激素传递各种信息, 主要参与甲壳动物体色变化, 运动、渗透调节、行为、神经内分泌调节, 是调节动物行为的一种重要物质, 目前有关于生物胺对对虾争胜行为影响的研究甚少。
多巴胺(DA)是生物胺的一种, 具有促性腺激素释放抑制因子的作用(孙迪等, 2011), 也能影响个体的运动、行为。有研究发现, 通过注射一定剂量的多巴胺, 可以改变对虾的一些生理特性(Cheng et al, 2005, 2006)。Chen等(2005)推测DA可能参与病理性的攻击行为及其他异常行为; DA的合成、降解、受体以及转运等有关过程都可能影响个体的行为(Comings et al, 2000)。5-羟色胺(5-HT)又名血清素, 属生物胺中的抑制性神经递质, 常作为神经递质或神经调质或激素物质调控许多重要的生理功能, 广泛分布在甲壳动物中枢和外周神经组织中(Sloley et al, 1995), 参与多种行为, 如睡眠、饮食、记忆和攻击性等。在无脊椎动物中, 5-HT在认知、摄食、定位、生理节律和防御行为的反应方面起重要作用(Fingerman, 1997a, b)。Fingerman等(1977)研究发现, 5-HT和多巴胺在多种机制中证明具有相反的效应。5-HT是影响攻击行为的最主要的神经递质(Lesch et al, 2000; Miczek et al, 2005; Bortolato et al, 2013), 其他的神经递质可能是先通过影响5-HT进而影响攻击行为(孔雀等, 2006)。本研究以日本囊对虾(Penaeus japonicus)、凡纳滨对虾(Litopenaeus vannamei)和中国明对虾(Fenneropenaeus chinensis)为实验对象, 采用活体注射的方式, 分别注射不同浓度多巴胺和5-羟色胺, 分析争斗的总次数、优胜方的平均优势指数、对虾体内DA、5-HT含量等, 探讨注射不同浓度外源物质对对虾争胜行为的影响, 旨在初步阐明多巴胺和5-羟对对虾争胜行为的响应机制, 为对虾行为学研究提供科学依据。
1 材料与方法 1.1 实验材料实验所用中国明对虾、凡纳滨对虾购自昌邑海丰水产养殖有限责任公司, 生物学体长分别为9.0±0.5cm、8.0±0.3cm。日本囊对虾购自即墨市对虾养殖场, 生物学体长为8.5±0.3cm。挑选健康活泼、体格健壮、体色正常, 规格一致的个体放置于50cm×40cm×35cm的塑料水槽中暂养7d, 水位30cm。所用海水为经沉淀、消毒、沙滤后的自然海水, 盐度33, 中国明对虾、日本囊对虾的养殖水温为23.0±1.0℃, 凡纳滨对虾的养殖水温为24±1.0℃, pH 8.0±0.3;自然光照, 连续充气, 日换水1/3。饵料为人工配合饲料, 饲料成分:粗蛋白43%, 粗灰分15%, 粗纤维5%, 总磷0.9%, 粗脂肪5%, 赖氨酸2.2%, 水分12%。日投喂3次(6:00, 12:00, 18:00), 投喂后2h后清理残饵及粪便。
1.2 实验方法 1.2.1 实验设计本研究以日本囊对虾、凡纳滨对虾、中国明对虾为观察研究对象, 每种对虾均分为2个处理组: DA组、5-HT组和对照的生理盐水(0.85%)组。实验采用人工注射的方法进行, 注射量60µL, DA组与5-HT组注射液均配制有高、低两种浓度:高浓度多巴胺(HAD, 2×10–3 mol/L)、低浓度多巴胺(LDA, 2×10–4 mol/L)、高浓度5-羟色胺(H5-HT, 2×10–5 mol/L)、低浓度5-羟色胺(L5-HT, 2×10–6 mol/L)注射液用生理盐水配制, 并作灭菌处理。每处理组设3个平行组。实验在塑料水箱中进行, 实验期间与暂养期间的养殖管理相同。容器底部铺上具有5cm×5cm方格线的塑料板, 以便量化对虾的游动速度和范围等。对虾养殖密度为80尾/m2, 每天上午9:00实验开始前需从暂养箱中选取1尾对虾, 用黑色标记笔在头胸甲部标记, 注射外源物后放置到各养殖箱中观察, 连续观察20min, 实验进行10d。观察时停止充气, 减轻对对虾行为观察的影响, 记录争斗次数、争斗强度等争胜行为指标, 并计算平均优势指数。观察结束后抽取对虾血液进行血清样品的制备。实验借助行为观察法和视频图像解析技术进行行为的统计分析, 记录被观察对虾争斗中的争斗发起者、获胜方、失败方、争斗次数、争斗持续时间、游动速度及距离等。统计分析争斗发起者获胜的概率、攻击次数与攻击强度的关系。攻击强度参考李玉全(2014)关于日本囊对虾争胜行为的划分, 用摄像机记录争斗过程并加以归类。
1.2.2 对虾血淋巴的采集从每个水箱中随机选取标记对虾1尾, 用1mL一次性无菌注射器于对虾心脏处抽取对虾的血淋巴, 注射器中预先吸入预冷抗凝剂(0.51mol/L氯化钠, 0.01mol/LEDTA-2Na, 0.2mol/L柠檬酸, 0.04mol/L柠檬酸二钠, 0.1mol/L葡萄糖, pH=7.3), 使血淋巴与抗凝剂的最终比例为1 : 1, 在离心管中混匀后, 置于4℃下中保存。
1.2.3 血清的制备取上述抗凝血淋巴的样品, 在4℃下3000r/min在高速冷冻离心机中离心10min, 取上清液, 即为血清样品, 并保存于-80℃冰箱中备用。
1.2.4 指标检测多巴胺含量测定分析参考王怀友等(2003)方法; 参照ELISA试剂盒的方法, 检测对虾体内5-羟色胺含量。
1.3 数据处理与统计分析平均优势指数(MD):实验过程中总获胜次数与争斗总次数(获胜次数+失败次数)的比值。
采用SPSS17.0作数据统计分析, 利用单因子方差分析(One-way ANOVA)比较分析不同处理间的差异, P < 0.05为显著水平, P < 0.01为极显著水平, 使用Excel 2010软件作图。
2 结果与分析 2.1 多巴胺浓度对平均争斗次数的影响由图 1可知, 注射多巴胺对三种对虾争斗次数有显著性影响(P < 0.05)。在注射多巴胺后三种对虾间的争斗显著增加, 相较于对照组, 南美白对虾、日本囊对虾、中国明对虾在注射低浓度多巴胺(2×10–4 mol/L)后, 对虾平均争斗次数分别增加了13.8%、11.1%、21.8%, 高浓度多巴胺(2×10–3 mol/L)组分别增加了91.0%、64.0%、68.5%。同种对虾在注射不同浓度多巴胺后与对照组差异均显著(P < 0.05), 且高浓度多巴胺(2×10–3 mol/L)组比低浓度多巴胺(2×10–4 mol/L)组更易激发对虾间的争斗欲, 随着多巴胺浓度的升高三种对虾的争斗性呈现上升的趋势。由对照组发现, 日本囊对虾较凡纳滨对虾的平均争斗次数高38.4%, 比中国明对虾高12.6%, 表现出较强的好斗性, 且在多巴胺的作用下争斗性的增强更为明显。低浓度多巴胺组(2×10–4 mol/L)中日本囊对虾与中国明对虾争胜行为相比较差异不显著(P > 0.05), 与凡纳滨对虾相比较差异显著(P < 0.05);对照组的各种对虾间均差异显著(P < 0.05)。
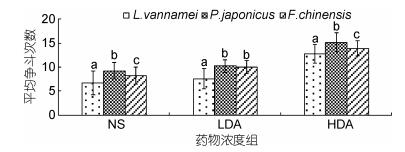 |
| 图 1 DA浓度对三种主要养殖对虾平均争斗次数的影响 Fig. 1 The effect of DA concentration on the average fight times in three main farmed shrimp |
从图 2可知, 对照组中多巴胺含量以日本囊对虾最高, 显著高于凡纳滨对虾和中国明对虾(P < 0.05), 这与图 1中日本囊对虾对虾表现出较强好斗性相符, 凡纳滨对虾最低, 对虾间的争斗较少, 与凡纳滨对虾适合高密度养殖相符合。在注射低浓度多巴胺(2×10–4 mol/L)后, 三种对虾体内的多巴胺含量均有提升, 凡纳滨对虾体内多巴胺含量变化最为明显, 升高了近3倍, 争斗结果如图 1所示, 争斗次数随之增多, 高于对照组; 日本囊对虾与中国明对虾体内多巴胺含量较高, 争斗次数也相对较多。在注射高浓度多巴胺(2×10–3 mol/L)后, 对虾体内的多巴胺含量略微上升, 但三种对虾在高浓度的多巴胺作用下均表现出较强的争斗性。由此可见, 对虾可通过调节体内多巴胺含量来调节对虾的争胜行为, 低浓度多巴胺(2× 10–4 mol/L)对对虾的争斗性影响较小, 而在高浓度多巴胺(2×10–3 mol/L)的作用下对虾用于行为调控的多巴胺含量随之增多, 对虾间的争斗增多, 多巴胺含量增加幅度显著降低。
 |
| 图 2 注射不同浓度DA后对虾体内DA的含量变化 Fig. 2 The change of determinate DA content in shrimp after injecting different concentration DA |
从图 3可以看出, 三种对虾在注射多巴胺和生理盐水后, 平均优势指数变化趋势基本一致, 随多巴胺注射浓度的升高, 对虾的平均优势指数呈现逐渐降低的趋势; 仅凡纳滨对虾在低浓度多巴胺(2× 10–4 mol/L)作用下平均优势指数表现出较为明显的抑制作用(P < 0.05), 较对照组降低了10.9%, 在三种对虾中变化最大; 在注射高浓度多巴胺(2×10–3 mol/L)后, 日本囊对虾和中国明对虾的平均优势指数比对照组分别降低了0.09和0.1, 降幅分别为12.5%和19.1%, 多巴胺浓度对平均优势指数影响差异显著(P < 0.05)。在对照组和实验组中日本囊对虾平均优势指数均在0.55以上, 最高值达到0.65, 均高于中国明对虾和凡纳滨对虾。
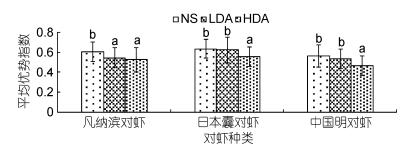 |
| 图 3 DA浓度对三种主要养殖对虾平均优势指数的影响 Fig. 3 The effect of DA concentration on the average advantage index in three main farmed shrimp |
由图 4可知, 注射5-羟色胺对凡纳滨对虾、日本囊对虾、中国明对虾的争斗行为影响显著(P < 0.05), 5-羟色胺有效地降低了同种对虾间的争斗, 各处理组间争斗次数均差异显著(P < 0.05);随着5-羟色胺注射浓度的升高, 平均争斗次数减少, 相较于对照组, 低浓度5-羟色胺(2×10–6 mol/L)组比对照组降幅超过50%, 高浓度5-羟色胺组降幅超过270%以上。对照组的平均争斗次数更是高浓度5-羟色胺(2×10–5 mol/L)组的2倍以上。对照组中日本囊对虾表现出较强的好斗性, 在注射5-羟色胺后, 对对虾争斗性的抑制作用最为显著。从图 5可以得知, 注射不同浓度5-羟色胺后日本囊对虾、中国明对虾的5-羟色胺的含量均差异显著(P < 0.05)。随着初始5-羟色胺注射浓度的升高, 对虾体内最终的5-羟色胺浓度呈现小幅上升, 与图 4中日本囊对虾、中国明对虾争斗次数减少相符合。此外, 日本囊对虾在注射不同浓度5-羟色胺和生理盐水后, 体内5-羟色胺含量变化最为显著(P < 0.05), 这也与日本囊对虾在高浓度5-羟色胺作用下争斗性降低相符合。
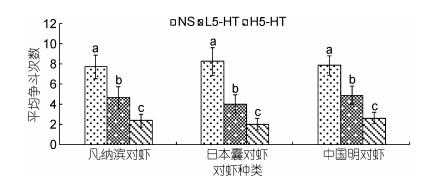 |
| 图 4 5-HT浓度对三种主要养殖对虾平均争斗次数的影响 Fig. 4 The effect of 5-HT concentration on the average fight times in three main farmed shrimp |
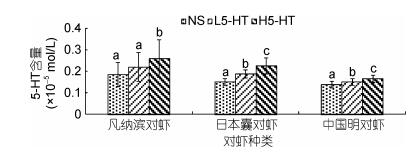 |
| 图 5 注射不同浓度5-HT后对虾体内5-HT的含量变化 Fig. 5 The change of determinate 5-HT content in shrimp after injecting different concentration 5-HT |
从图 6可以得知, 低浓度5-羟色胺(2×10–6 mol/L)对对虾争斗中确立优势地位的促进作用不明显, 其平均优势指数与对照组基本相同, 均在0.5—0.7。注射5-羟色胺溶液对凡纳滨对虾争斗的平均优势指数无显著影响(P > 0.05), 日本囊对虾和中国明对虾仅在注射高浓度5-羟色胺(2×10–5 mol/L)时表现出明显的促进作用, 平均优势指数变化显著(P < 0.05), 三种对虾最终的平均优势指数差别较小, 均保在0.65—0.75。由此可知, 高浓度5-羟色胺会提升对虾的争斗性, 对虾易在争斗中获得最终的优势地位。
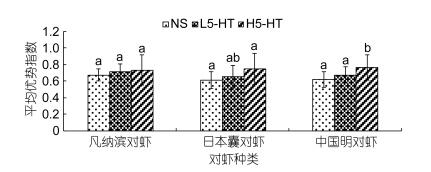 |
| 图 6 不同5-HT浓度对三种主要养殖对虾平均优势指数的影响 Fig. 6 The effect of 5-HT concentration on the average advantage index in three main farmed shrimp |
水生动物争斗行为是一种发生在种群间和种群内的普遍行为, 其行为会受到受到神经递质及相关基因等因素的影响。Fletcher等(2009)研究发现, 水生动物的个体行为往往依赖多种复杂的化学信号。许多学者研究发现, 生物胺可作为神经递质或激素传递各种信息, 参与甲壳动物渗透调节(Mo et al, 1998; 张林娟等, 2007)、行为调控(Kravitz, 1988)、免疫应激(胡发文等, 2007)、神经内分泌(叶海辉等, 2003)等生理过程。从本实验结果来看, 多巴胺作为一种神经递质参与了对虾间的争斗行为, 对对虾争斗性的提升起到了促进作用。注射多巴胺能激发对虾的争斗性, 对虾间的争斗次数显著增加。相较于对照组, 南美白对虾、日本囊对虾、中国明对虾在注射低浓度多巴胺后, 对虾平均争斗次数分别增加了13.8%、11.1%、21.8%, 高浓度多巴胺组分别增加了91.0%、64.0%、68.5%, 随着多巴胺浓度的提高, 对虾间的争斗数量呈上升趋势。实验结果与Cheng等(2005, 2006)关于多巴胺对对虾行为的影响相同, 明确了多巴胺在争胜行为方面的影响。注射高浓度多巴胺后, 对虾体内多巴胺含量相较于注射低浓度含量呈小幅升高趋势, 作者认为高浓度多巴胺在注入对虾体内后, 会作为一种神经内分泌信号或激素, 在对虾体内完成转化或代谢, 含量随之减少, 而低浓度多巴胺的注入量相较于未注射对虾体内的多巴胺含量较小, 所能引起对虾争斗性有限。目前关于最适多巴胺注入量和多巴胺在对虾体内的转化、代谢机理等方面有待进一步研究。李玉全等(2013a)认为日本囊对虾具有较强的好斗性, 较凡纳滨对虾和中国明对虾不适合高密度养殖。本研究结果显示, 日本囊对虾在注射生理盐水组中表现出较强的争斗性, 日本囊对虾较凡纳滨对虾的平均争斗次数高38.4%, 比中国明对虾高12.6%, 这与上述的研究结果相近。此外随多巴胺注射浓度的升高, 对虾的平均优势指数呈现逐渐降低的趋势。
3.2 注射5-HT对对虾争胜行为的影响魏鸿擎等(2015)和Kravitz(1988)关于水生生物的神经生物学机制研究认为, 5-羟色胺为重要的单胺类神经递质, 与水生动物争斗性行为关系紧密。本实验结果表明, 5-羟色胺有效地降低了同种对虾间的争斗, 降低对虾的争斗性; 随着5-羟色胺注射浓度的升高, 平均争斗次数减少; 低浓度5-羟色胺组比对照组降幅超过50%, 对照组的平均争斗次数更是高浓度5-羟色胺组的2倍以上, 变化较为显著。研究结果与Ferrari等(2005)和Summers等(2006)给脊椎动物补充5-羟色胺可以降低其攻击性相似, 可见5-羟色胺不仅对脊椎动物争斗行为有抑制作用, 也可对对虾的争斗起到明显的减弱作用, 与多巴胺作用正相反。此外, 研究发现, 低浓度5-羟色胺(2×10–6 mol/L)对对虾争斗中确立优势地位的促进作用不明显, 其平均优势指数与对照组基本相同, 均高于0.5, 这可能与肌肉注射对对虾的刺激有关。本研究结果可为对虾高密度养殖提供理论参考, 在饵料中适当添加5-羟色胺以减弱对虾间的争胜行为、增加养殖密度的可行性有待进一步研究。
4 结论本文研究了注射多巴胺和5-羟色胺对凡纳滨对虾、日本囊对虾和中国明对虾争胜行为的影响, 包括注射浓度与平均争斗次数、平均优势指数相关性分析、平均争斗次数与多巴胺和5-羟色胺含量变化的分析。结果显示, 多巴胺和5-羟色胺两种生物胺均能作为神经递质参与对虾争胜行为调控。注射多巴胺能显著地提高对虾间的争斗性, 随着多巴胺浓度的升高三种对虾的争斗性呈现上升的趋势, 同种对虾在注射不同浓度多巴胺后与对照组差异均显著, 高浓度多巴胺组比低浓度多巴胺组更易激发对虾间的争斗欲。此外, 随多巴胺注射浓度的升高, 对虾的平均优势指数呈现逐渐降低的趋势。5-羟色胺可以有效地降低对虾间的争斗, 随着5-羟色胺注射浓度的升高, 平均争斗次数减少, 相较于对照组, 低浓度5-羟色胺组降幅超过50%, 高浓度5-羟色胺组降幅超过270%以上。随着初始5-羟色胺注射浓度的升高, 对虾体内最终的5-羟色胺浓度呈现小幅上升。低浓度5-羟色胺对对虾争斗中确立优势地位的促进作用不明显, 其平均优势指数与对照组基本相同, 均在0.5—0.7, 高浓度5-羟色胺可提升对虾的争斗性, 利于对虾在争斗中获得优势地位。
| 王怀友, 孙悦, 唐波, 2003. 分光光度法测定多巴胺. 分析实验室, 22(1): 45–47 |
| 孔雀, 邰发道, 2006. 攻击行为神经机制的研究进展. 现代生物医学进展, 6(8): 55–58 |
| 叶海辉, 李少菁, 李祺福, 等, 2003. 生物胺对雌性锯缘青蟹生殖神经内分泌的调控作用. 海洋与湖沼, 34(3): 329–333 DOI:10.11693/hyhz200303012012 |
| 孙迪, 王慧, 黄丽波, 等, 2011. 多巴胺和半胱胺对泰山螭霖鱼生长的影响. 山东农业大学学报(自然科学版), 42(2): 223–226 |
| 李玉全, 2014. 日本囊对虾的争胜行为及其与温度的关系. 江苏农业科学, 42(8): 231–232 |
| 李玉全, 王仁杰, 姜令绪, 2013a. 密度胁迫对日本囊对虾生长和水环境的影响. 海洋科学, 37(10): 53–57 |
| 李玉全, 孙霞, 2013b. 水生动物的争胜行为. 动物学研究, 34(3): 214–220 |
| 张沛东, 张秀梅, 李健, 等, 2008. 中国明对虾、凡纳滨对虾仔虾的行为观察. 水产学报, 32(2): 223–228 |
| 张林娟, 潘鲁青, 2007. 注射生物胺对凡纳滨对虾鳃丝离子转运酶活力和血淋巴渗透压的影响. 海洋湖沼通报,(2): 114–120 |
| 赵玉超, 秦浩, 李玉全, 等, 2016. 密度和饲料种类对凡纳滨对虾Litopenaeus vannamei争胜行为和生长的影响. 水产学杂志, 29(3): 44–48 |
| 胡发文, 潘鲁青, 杨慧赞, 2007. 注射生物胺对凡纳滨对虾免疫指标的影响. 热带海洋学报, 26(5): 64–68 |
| 秦浩, 李玉全, 2014. 生存密度和饵料对中国明对虾(Fenneropenaeus chinensis)争胜行为和生长性能的影响. 海洋与湖沼, 45(4): 834–838 DOI:10.11693/hyhz20140400095 |
| 魏鸿擎, 蒋科技, 张凤英, 等, 2015. 水生动物的争斗与应激行为. 渔业信息与战略, 30(4): 280–287 |
| Bortolato M, Pivac N, Muck Seler D, et al, 2013. The role of the serotonergic system at the interface of aggression and suicide. Neuroscience, 236: 160–185 DOI:10.1016/j.neuroscience.2013.01.015 |
| Chen T J H, Blum K, Mathews D, et al, 2005. Are dopaminergic genes involved in a predisposition to pathological aggression?:hypothesizing the importance of "super normal controls" in psychiatricgenetic research of complex behavioral disorders. Medical Hypotheses, 65(4): 703–707 DOI:10.1016/j.mehy.2005.04.037 |
| Cheng W, Chieu H T, Ho M C, et al, 2006. Noradrenaline modulates the immunity of white shrimp Litopenaeus vannamei. Fish & Shellfish Immunology, 21(1): 11–19 |
| Cheng W, Chieu H T, Tsai C H, et al, 2005. Effects of dopamine on the immunity of white shrimp Litopenaeus vannamei. Fish & Shellfish Immunology, 19(4): 375–385 |
| Comings D E, Blum K, 2000. Reward deficiency syndrome:genetic aspects of behavioral disorders. Progress in Brain Research, 126: 325–341 DOI:10.1016/S0079-6123(00)26022-6 |
| Ferrari P F, Palanza P, Parmigiani S, et al, 2005. Serotonin and aggressive behavior in rodents and nonhuman primates:predispositions and plasticity. European Journal of Pharmacology, 526(1-3): 259–273 DOI:10.1016/j.ejphar.2005.10.002 |
| Fingerman M, 1997a. Crustacean endocrinology:a retrospective, prospective, and introspective analysis. Physiological Zoology, 70(3): 257–269 DOI:10.1086/639593 |
| Fingerman M, 1997b. Roles of neurotransmitters in regulating reproductive hormone release and gonadal maturation in decapod crustaceans. Invertebrate Reproduction & Development, 31(1-3): 47–54 |
| Fingerman M, Fingerman S W, 1977. Antagonistic actions of dopamine and 5-hydroxytryptamine on color changes in the fiddler crab, Uca pugilator. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 58(2): 121–127 DOI:10.1016/0306-4492(77)90091-0 |
| Fletcher N, Hardege J D, 2009. The cost of conflict:agonistic encounters influence responses to chemical signals in the European shore crab. Animal Behaviour, 77(2): 357–361 DOI:10.1016/j.anbehav.2008.10.007 |
| Kravitz E A, 1988. Hormonal control of behavior:amines and the biasing of behavioral output in lobsters. Science, 241(4874): 1775–1781 DOI:10.1126/science.2902685 |
| Lesch K P, Merschdorf U, 2000. Impulsivity, aggression, and serotonin:a molecular psychobiological perspective. Behavioral Sciences & the Law, 18(5): 581–604 |
| Miczek K A, Fish E W, 2005. Monoamines, GABA, glutamate, and aggression. In:Nelson R J ed. Biology of Aggression. Oxford:Oxford University Press, 114-150 |
| Mo J L, Devos P, Trausch G, 1998. Dopamine as a modulator of ionic transport and Na+/K+-ATPase activity in the gills of the Chinese crab Eriocheir sinensis. Journal of Crustacean Biology, 18(3): 442–448 |
| Sloley B D, Juorio A V, 1995. Monoamine neurotransmitters in invertebrates and vertebrates:an examination of the diverse enzymatic pathways utilized to synthesize and inactivate blogenic amines. International Review of Neurobiology, 38: 253–303 DOI:10.1016/S0074-7742(08)60528-0 |
| Summers C H, Winberg S, 2006. Interactions between the neural regulation of stress and aggression. Journal of Experimental Biology, 209(23): 4581–4589 DOI:10.1242/jeb.02565 |
 2017, Vol. 48
2017, Vol. 48


