
中国海洋湖沼学会主办。
文章信息
- 何成, 于文超, 蔡忠强, 魏磊, 陈军, 李佳荣, 盖超伟, 李壮, 张子豪, 郭文, 王晓通. 2017.
- HE Cheng, YU Wen-Chao, CAI Zhong-Qiang, WEI Lei, CHEN Jun, LI Jia-Rong, GAI Chao-Wei, LI Zhuang, ZHANG Zi-Hao, GUO Wen, WANG Xiao-Tong. 2017.
- 酸碱粗提配合超声破碎法制取可溶性长牡蛎(Crassostrea gigas)黑色素的研究
- THE PREPARATION OF SOLUBLE PACIFIC OYSTER MELANIN USING THE PH-SHIFT PROCESSING AND ULTRASONIC-ASSISTED PROCEDURE
- 海洋与湖沼, 48(3): 634-639
- Oceanologia et Limnologia Sinica, 48(3): 634-639.
- http://dx.doi.org/10.11693/hyhz20170100006
-
文章历史
- 收稿日期:2017-01-06
- 收修改稿日期:2017-01-27
2. 中国水产科学研究院长岛增殖实验站 长岛 265800;
3. 山东省海洋生物研究院 青岛 266104
2. Changdao Enhancement and Experiment Station, Chinese Academy of Fishery Sciences, Changdao 265800, China;
3. Marine Biology Institute of Shandong Province, Qingdao 266104, China
黑色素(melanin)是分布范围最为广泛的生物色素之一, 呈黑色或者棕褐色, 是一类在动植物体内普遍存在的生物大分子(Kollias et al, 1991; El Bassam et al, 2002), 难溶于酸、水以及有机溶剂等。黑色素具有清除自由基、抗氧化的功效, 在疾病的预防和治疗, 以及化工、食品等领域有着较好的应用前景。黑色素所具备的调节免疫、延缓衰老、保护心血管功能以及保护光照损伤等生物活性, 已使目前对其天然资源的开发研究成为一项热点。牡蛎(Osteroida)是世界第一大养殖贝类, 属于软体动物门(Mollusca)、双壳纲(Bivalvia)。牡蛎不仅肉鲜味美、营养丰富, 而且具有独特的保健功能和药用价值(申淑琦等, 2009)。牡蛎作为贝类研究的模式生物, 研究其所含的色素具有广泛的生物学意义。目前本课题组已经确认牡蛎软体部、贝壳外表面和闭壳肌痕处的黑色物质的确为黑色素(于文超等, 2015; Hao et al, 2015), 其本身在某些生物体内具有防紫外、抗氧化, 抵御病毒、提高免疫力等生物活性(Sarna et al, 1984; Menter et al, 1998; Pugh et al, 2005)。黑色素属于难溶性物质, 微溶于强碱溶液, 不溶于水、酸溶液、盐溶液和大部分有机溶剂(El Bassam et al, 2002; Goncalves et al, 2005; Selvakumar et al, 2008), 由于黑色素的大部分功效验证实验需要用到黑色素溶液, 黑色素的难溶性导致长牡蛎黑色素的功效验证工作难以开展。目前, 生物
大分子的降解最常用手段是酶解法, 但由于其成本高, 特异性强, 而且至今也未发现能够酶解长牡蛎(Crassostrea gigas)黑色素的对应酶, 因此酶解法在本实验中行不通。然而, 作者发现超声破碎法可以有效地将大颗粒的难溶黑色素降解为可溶的小颗粒, 并实验了一系列流程, 确定了可溶性黑色素的官能团结构并没有发生变化, 最终确定该套可溶性长牡蛎黑色素的制取鉴定方法。本文的研究结果对推动牡蛎黑色素的功能研究具有重要意义。
1 材料与方法 1.1 实验牡蛎样品黑色长牡蛎(Crassostrea gigas):本实验所用牡蛎样品为本课题组培育的长牡蛎。外壳均为黑色, 平均壳高10cm, 均重150g。
1.2 实验仪器与试剂 1.2.1 实验试剂盐酸、氢氧化钠、溴化钾、乙醚、蒸馏水等。
1.2.2 实验仪器超声细胞破碎仪、高速冷冻离心机、电热恒温水浴锅、循环水真空泵、真空冷冻法干燥机、激光粒度仪、傅里叶红外光谱仪、紫外分光光度计、电热鼓风干燥箱、电子天平、索氏提取器、研钵、滤纸、烧杯、三角烧瓶、玻璃棒等。
1.3 超声降解法制备可溶性长牡蛎黑色素将牡蛎外表壳用清洁刷清洗, 去除表面的泥土、藻类等附着物;
利用酸碱法提取天然长牡蛎黑色素(于文超等, 2015)。将黑色的贝壳及外套膜进行粉碎、盐酸水解、水浴加热、乙醚抽脂、干燥等流程制取2g以上天然长牡蛎黑色素;
称取2g天然长牡蛎黑色素溶于100mL体积的0.5mol/L NaoH溶液中, 均匀搅拌使其最大化溶解;
将盛有该混合液的玻璃烧杯置于盛有30℃水的大烧杯中水浴保温, 同时将大烧杯置于超声细胞破碎仪中震荡, 设定振幅50%, 超声2s, 间歇2s, 总处理时间为1h;
冷却至室温后, 滴加1mol/L的HCl溶液调节pH值至7.0后, 将混合液8000×g离心30min;
弃沉淀取上清, 置于广口器皿中, 置于–80℃冰箱冷冻凝固处理;
将样品放入真空冷冻干燥机干燥, 24h后取出所得固体密封保存。
1.4 可溶性长牡蛎黑色素验证 1.4.1 粒度分析分别取少量天然长牡蛎黑色素和超声降解后的样品溶于去离子水中, 使用激光粒度仪测试样品粒度。
1.4.2 红外光谱鉴定分别取超声降解干燥的样品和天然长牡蛎黑色素样品约0.5mg与KBr压制成片, 使用傅里叶红外光谱仪, 扫描400—4000nm波长范围的透光率。
1.4.3 紫外光谱鉴定取天然长牡蛎黑色素0.1g, 溶解在0.01mol/L氢氧化钠水溶液中, 并用同样的氢氧化钠溶液做基线, 扫描190—500nm波长范围的光谱吸光值; 取超声降解后的样品0.1g溶于去离子水中, 并同样用去离子水做基线, 扫描190—500nm波长范围的光谱吸光值。
2 结果 2.1 天然长牡蛎黑色素粒度分析结果对天然长牡蛎黑色素和超声降解处理后的物质组分进行粒度分析, 所得数据用Origin8.0软件处理。
超声处理前, 天然长牡蛎黑色素的颗粒粒度广泛分布于0.3—1100μm(图 1a), 颗粒大小不一, 极差能达到1300μm, 而且每个颗粒范围所占比例都不大, 约2%左右; 超声破碎处理后的组分则集中分布于0.3—0.9μm, 1.2—2.9μm, 颗粒粒度明显下降(图 1b), 且分布集中, 所占比例也明显提高, 表示原先的黑色素大分子都已降解成为小颗粒黑色素, 且颗粒大小均匀。
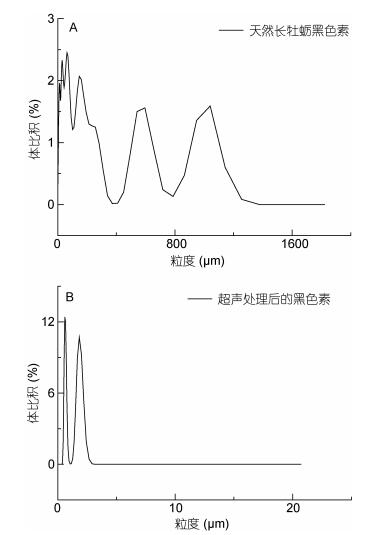 |
| 图 1 天然长牡蛎黑色素和超声处理后黑色素组分粒度分布图 Fig. 1 The particle size distribution of the Pacific oyster natural melanin and the ultrasonic degradated product melanin |
天然长牡蛎黑色素的红外光谱图如图 2a所示; 超声降解处理后物质的红外光谱图如图 2b所示。由图 2a可以看出, 天然长牡蛎黑色素的红外光谱在1630 cm–1和3400 cm–1附近有明显吸收峰; 由图 2b可以看出, 超声降解处理后的长牡蛎黑色素在1630 cm–1和3400 cm–1附近同样具有明显的吸收峰, 且峰值所对应的波长相当接近。表明该两种样品官能团结构基本相同, 也就是说超声破碎前后, 黑色素的结构没有发生变化, 引起偏振峰的决定黑色素作用的官能团在破碎后依旧存在, 确认为可溶性长牡蛎黑色素。
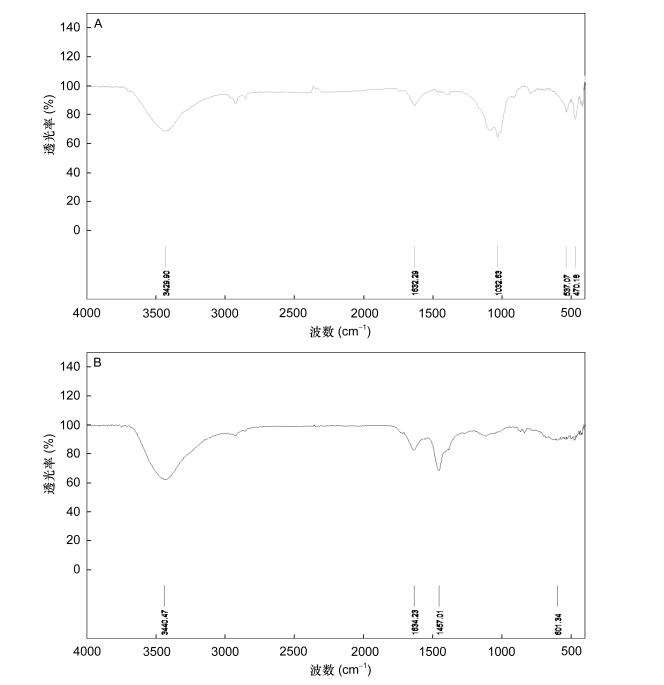 |
| 图 2 天然长牡蛎黑色素和超声降解后长牡蛎黑色素的红外光谱图 Fig. 2 IR scanning spectra of the Pacific oyster natural melanin and the ultrasonic degradation melanin |
天然长牡蛎黑色素和超声降解后黑色素的紫外光谱比较如图 3所示。通过对比可以看出, 超声降解后的物质与天然长牡蛎黑色素的紫外吸收曲线趋势相似, 并且两者共同在210nm左右有最大吸收峰, 210nm后吸光趋势一直下降, 但超声处理后的黑色素吸光值明显高于天然长牡蛎黑色素, 表明处理后的黑色素水溶液溶质含量高于天然长牡蛎黑色素碱溶液, 从图中显示, 该对比较为明显, 表明两物质的溶解性差异较大。
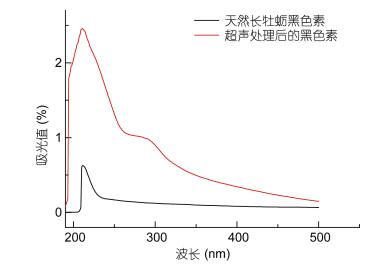 |
| 图 3 天然长牡蛎黑色素和超声降解处理后物质的紫外光谱图 Fig. 3 UV absorption spectra of the Pacific oyster natural melanin and ultrasonic degradation product |
通过对天然长牡蛎黑色素和超声降解处理后物质的粒度分析可知, 超声处理之后黑色素颗粒的平均粒度大幅度下降(图 1), 直观地说明超声破碎作用将天然长牡蛎黑色素大分子从高度聚合状态降解为小颗粒物质, 从而大大提高其本身的溶解性(Hegedusic et al, 1984; 李素霞等, 2010)。由此可以推断, 导致长牡蛎黑色素难溶的主要原因为其本身的颗粒过大, 通过借助外界能量来打破其大分子结构, 释放小颗粒, 是改变其溶解性的可行方法。因此我们选用了超声波破碎的方式, 并确定了一些该破碎成功所需要的特殊条件, 如30℃恒温水浴等。达到了预期的溶解效果, 处理后的黑色素成功溶解于水, 验证了该方法的可行性。
3.2 天然长牡蛎黑色素结构分析黑色素可分为真黑素和褐黑素, 而真黑素又可分为黑真黑素和棕真黑素(李华等, 2002; 李文等, 2007)。与天然长牡蛎黑色素相比, 可溶性降解产物在波长1630cm–1和3400cm–1附近仍然有明显的吸收峰, 研究表明, 真黑色素吲哚环偏振引起1630cm–1处的特征吸收(Stainsack et al, 2003; Liu et al, 2005; 郝世鑫等, 2015), 说明降解后主要化学结构并没有发生太大变化, 破碎处理后的物质仍然为黑色素且为真黑色素(郭欣等, 2013), 推断超声主要破坏黑色素颗粒的高度聚合状态并有效的提高天然长牡蛎黑色素的溶解性, 而黑色素的主要化学结构和官能团并没有被破坏, 保留了黑色素本身具备的理化性质和自身特性, 故红外光谱扫描这些常规指标都与处理前基本保持一致。化学性质在处理前后的稳定性, 保证了其生物活性与长牡蛎体内黑色素的一致性, 使得可溶性黑色素制得后, 可以用于后续黑色素生物功能验证工作。
3.3 天然长牡蛎黑色素溶解度分析从图 3的紫外光谱比较可以进一步看出, 超声波降解后的黑色素最大吸收峰出现在210nm左右(付湘晋, 2005; 李琦等, 2010; Mustapha et al, 2015), 与未经超声波降解的长牡蛎黑色素相同, 进一步说明了超声波没有影响化学结构的变化; 有意思的是, 超声处理后的黑色素溶液吸光值明显高于天然长牡蛎黑色素, 说明处理后黑色素水溶液的溶质含量高于天然长牡蛎黑色素碱溶液, 从而具有更高的吸光率, 这可能是由于超声降解后的黑色素颗粒直径更小、数目更多, 暴露出了更多的吲哚环基团, 从而具有更高的吸光率(Craft et al, 1992; Dubey et al, 2014)。该结果成功解决了今后可能面临的黑色素浓度低的问题, 更少的黑色素可发挥更大生理作用, 避免了因黑色素浓度过低而导致实验所需溶液体积过大的问题。由此流程制得的可溶性长牡蛎黑色素适用于绝大部分黑色素功效验证相关实验。
3.4 天然长牡蛎黑色素的去除杂质功能由步骤1.3.5可知, 破碎处理后, 留有部分不溶于水和碱溶液的沉淀, 推断该沉淀为酸碱粗提制得的其它未知杂质。由于步骤1.3.5中进行了去除沉淀操作, 相当于去除了酸碱粗提中难以去除的杂质, 提升了所得可溶性长牡蛎黑色素的纯度。
4 结论本研究采用酸碱法结合超声破碎处理法, 成功制取了可溶性长牡蛎黑色素, 实验结果表明, 该方法制取的长牡蛎黑色素能够溶于水而化学性质没有发生改变, 可以作为其他实验研究的材料。该流程是牡蛎黑色素提取方法的延伸和拓展, 可溶性黑色素的成功制取可为长牡蛎黑色素的功能研究奠定基础。
| 于文超, 何成, 武长路, 等, 2015. 长牡蛎(Crassostrea gigas)贝壳与外套膜中黑色素的提取和鉴定. 海洋与湖沼, 46(4): 909–914 |
| 申淑琦, 徐青霞, 佟瑞山, 2009. 牡蛎的营养保健功能及其开发利用. 河北农业科学, 13(10): 79–81 DOI:10.3969/j.issn.1088-1631.2009.10.032 |
| 付湘晋, 2005. 我国天然黑色素资源研究概况. 粮食与油脂,(12): 42–45 DOI:10.3969/j.issn.1008-9578.2005.12.014 |
| 李文, 邓卫东, 毛华明, 2007. 乌骨绵羊和黑色素的研究进展. 家畜生态学报, 28(3): 1–5 |
| 李华, 邱祥聘, 龙继蓉, 2002. 乌骨鸡黑色素的研究进展. 畜牧与兽医, 34(8): 33–35 |
| 李琦, 侯丽华, 刘鑫, 等, 2010. 黑木耳黑色素鉴定及提取工艺优化. 食品科学, 31(16): 87–92 |
| 李素霞, 陈山, 邹青松, 等, 2010. 大分子超声降解研究进展. 现代农业科技,(10): 14–15, 17 DOI:10.3969/j.issn.1007-5739.2010.10.002 |
| 郝世鑫, 侯鑫, 孙东方, 等, 2015. 紫贻贝贝壳和脉红螺厣中色素的提取与鉴定. 海洋科学, 39(11): 49–53 |
| 郭欣, 陈士国, 薛长湖, 等, 2013. 超声降解法制备可溶性鱿鱼墨黑色素及其抗氧化性. 水产学报, 37(7): 1113–1120 |
| Craft N E, Soares J H, 1992. Relative solubility, stability, and absorptivity of lutein and β-carotene in organic solvents. Journal of Agricultural and Food Chemistry, 40(3): 431–434 DOI:10.1021/jf00015a013 |
| Dubey S, Roulin A, 2014. Evolutionary and biomedical consequences of internal melanins. Pigment Cell & Melanoma Research, 27(3): 327–338 |
| El Bassam S, Benhamou N, Carisse O, 2002. The role of melanin in the antagonistic interaction between the apple scab pathogen Venturia inaequalis and Microsphaeropsis ochracea. Canadian Journal of Microbiology, 48(4): 349–358 DOI:10.1139/w02-030 |
| Goncalves R D C, Pombeero-Sponchiado S R, 2005. Antioxidant activity of the melanin pigment extracted from Aspergillus nidulans. Biological and Pharmaceutical Bulletin, 28(6): 1129–1131 DOI:10.1248/bpb.28.1129 |
| Hao S X, Hou X, Wei L, et al, 2015. Extraction and identification of the pigment in the adductor muscle scar of pacific oyster Crassostrea gigas. PLoS One, 10(11): e0142439 DOI:10.1371/journal.pone.0142439 |
| Hegedusic V, Lovric T, Bilic J, et al, 1984. Influence of particle size on the solubility and the dispersibility of dried milk and cocoa powder. Hrana I Ishrana, 25(1-2): 25–28 |
| Kollias N, Sayre R M, Zeise L, et al, 1991. New trends in photobiology:photoprotection by melanin. Journal of Photochemistry and Photobiology B:Biology, 9(2): 135–160 DOI:10.1016/1011-1344(91)80147-A |
| Liu Y, Hong L, Wakamatsu K, et al, 2005. Comparison of structural and chemical properties of black and red human hair melanosomes. Photochemistry and Photobiology, 81(1): 135–144 DOI:10.1562/2004-08-03-RA-259.1 |
| Menter J M, Patta A M, Hollins T D, et al, 1998. Photoprotection of mammalian acid-soluble collagen by cuttlefish sepia melanin in vitro. Photochemistry and Photobiology, 68(4): 532–537 DOI:10.1111/php.1998.68.issue-4 |
| Mustapha N, Bzéouich I M, Ghedira K, et al, 2015. Compounds isolated from the aerial part of Crataegus azarolus inhibit growth of B16F10 melanoma cells and exert a potent inhibition of the melanin synthesis. Biomedicine & Pharmacotherapy, 69: 139–144 |
| Pugh N D, Balachandran P, Lata H, et al, 2005. Melanin:dietary mucosal immune modulator from Echinacea and other botanical supplements. International Immunopharmacology, 5(4): 637–647 DOI:10.1016/j.intimp.2004.12.011 |
| Sarna T, Sealy R C, 1984. Photoinduced oxygen consumption in melanin systems.Action spectra and quantum yields for eumelanin and synthetic melanin. Photochemistry and Photobiology, 39(1): 69–74 |
| Selvakumar P, Rajasekar S, Periasamy K, et al, 2008. Isolation and characterization of melanin pigment from Pleurotus cystidiosus (telomorph of Antromycopsis macrocarpa). World Journal of Microbiology and Biotechnology, 24(10): 2125–2131 DOI:10.1007/s11274-008-9718-2 |
| Stainsack J, Mangrich A S, Maia C M B F, et al, 2003. Spectroscopic investigation of hard and soft metal binding sites in synthetic melanin. Inorganica Chimica Acta, 356: 243–248 DOI:10.1016/S0020-1693(03)00474-2 |
 2017, Vol. 48
2017, Vol. 48


