
中国海洋湖沼学会主办。
文章信息
- 黄春秀, 董焕嫦, 李扬. 2017.
- HUANG Chun-Xiu, DONG Huan-Chang, LI Yang. 2017.
- 我国东南海域2个新记录拟菱形藻物种及其产毒特征
- TWO NEW RECORDS OF DIATOM GENUS PSEUDO-NITZSCHIA AND THEIR DOMOIC ACID PRODUCTION IN SOUTHEASTERN CHINA COASTAL WATERS
- 海洋与湖沼, 48(4): 767-776
- Oceanologia et Limnologia Sinica, 48(4): 767-776.
- http://dx.doi.org/10.11693/hyhz20161200288
-
文章历史
- 收稿日期:2016-12-24
- 收修改稿日期:2017-04-11
拟菱形藻(Pseudo-nitzschia Peragallo)是广泛分布于全球近岸水体的浮游硅藻类群, 也是记忆缺失性贝毒(amnesic shellfish poisoning, ASP)——多莫酸(domoic acid, DA)的重要生物来源(Lelong et al, 2012; Trainer et al, 2012)。1987年加拿大发生了一起由于拟菱形藻引起的人类中毒事件(Bates et al, 1989), 引起了各国政府以及学者对其高度的关注。随后, 欧洲、大洋洲等地方也陆续有产毒拟菱形藻的报道(Hallegraeff, 1994; Lundholm et al, 1994)。因此拟菱形藻受到广泛关注, 并成为藻类学和环境毒理学研究热点之一(Lundholm et al, 2002, 2006; Lelong et al, 2012; Trainer et al, 2012)。
目前全球已报道48种拟菱形藻(Percopo et al, 2016; Teng et al, 2016), 我国报道了23个物种(Lü et al, 2012;徐国双等, 2015), 但绝大部分物种的研究仅停留在单纯形态学水平, 甚至有些种类仅报道于名录中, 未见任何种源信息。此外, 全球记录的24种产毒拟菱形藻中(Lelong et al, 2012; Trainer et al, 2012; Teng et al, 2016; Lundholm et al, 2017), 有15个物种在我国也有分布(李扬等, 2010; Lü et al, 2012;徐国双等, 2015), 但尚未有产毒的报道(徐国双等, 2015)。然而近年我国海域海产品中陆续有DA的检出报道(宋琍琍等, 2008;吉薇等2011;王恒等2011), 表明DA产毒物种在我国海域的真实存在。
本文从我国东南海域建立拟菱形藻单克隆培养株系, 结合形态学和分子分类学技术, 开展物种识别的工作。报道了我国的2个新记录种:镰刀拟菱形藻(P. sabit)和中鼓拟菱形藻(P. inflatula)。同时利用高效液相色谱-质谱联用法(liquid chromatography tandem mass spectrometry, LC-MS/MS)开展DA的检测工作。以期能够丰富我国拟菱形藻属的物种多样性, 并为其毒理研究提供基础数据。
1 材料和方法 1.1 单克隆藻株的建立水平拖曳浮游生物网(筛绢孔径10µm)进行采样, 尽快将样品带回实验室。利用毛细管复洗法在倒置显微镜(Mshot MI-12) 下分离目标藻细胞, 经过多洗水洗和转移, 以确保目标藻的纯化。最后转移至预先滴有L培养基的48孔细胞培养板中(Lundholm et al, 2006), 放置在光照强度约50—80µmol photons/(m2·s)、光周期12h︰12h, 温度(20±2)℃的条件下培养。待其存活并繁殖达到约100个藻细胞之后, 转移到盛有L培养基的100mL锥形瓶中培养, 以MC(Marine collection)序列进行编号, 具体藻株信息详见表 1。
| 株系 | 采样地点 | 采样时间 |
| MC990 | 台湾海峡(22°79′N, 116°78′E) | 2016.04 |
| MC3013 | 台湾海峡(22°79′N, 116°78′E) | 2016.04 |
| MC3014 | 台湾海峡(22°79′N, 116°78′E) | 2016.04 |
| MC3039 | 台湾海峡(22°79′N, 116°78′E) | 2016.04 |
| MC3111 | 南海北部(19°13′N, 112°28′E) | 2016.06 |
| MC3086 | 南海北部(17°90′N, 111°23′E) | 2016.06 |
| MC3087 | 南海北部(17°90′N, 111°23′E) | 2016.06 |
光学显微镜(light microscopy, LM)观察:取处于对数生长期的藻液0.1mL, 滴在载玻片上, 盖上玻片后, 利用Olympus BX53进行微分干涉(differential interference contrast, DIC)的观察, 并使用Olympus DP27数码相机拍照, 在Olympus CellSens软件上获取图像信息。主要观察群体特征、细胞色素体形态等。
透射电子显微镜(transmission electron microscopy, TEM)观察:取对数生长期的藻液2mL, 加入等量浓硫酸(> 95%)以去除有机质, 然后用蒸馏水多次水洗至中性(徐国双等, 2015)。用微量进样器吸取5—10µL酸化后的水样, 滴加在喷镀碳膜的铜网(100目)上, 自然晾干后, 即可在JEM-1010 TEM下观察和拍照。主要观察壳面超微结构, 如点条纹、肋突、孔纹等。
1.3 分子系统学分析离心法收集处于对数生长期的藻细胞, 进行总DNA的提取(Lundholm et al, 2002)。利用引物ITS1和ITS4进行核糖体转录间隔区(internal transcribed spacer, ITS)的扩增(Lim et al, 2013), PCR产物送至上海立菲生物科技有限公司进行纯化和测序。从NCBI下载拟菱形藻种类的ITS nrDNA序列, 使用BioEdit软件进行序列的比对和矩阵(Lim et al, 2013)。基于MrModeltest 2.3的计算, 选择最适模型和参数为GTR+I+G([AC=1.0449], [AG=3.4071], [AT=1.7247], [CG]=0.4855, [CT]=5.9824, [GT]=1.0000, gamma shape=0.5318, nucleotide frequencies: A=0.2099, C =0.2194, G=0.3136, T=0.2574)。用MrBayes 3.2 (Ronquist et al, 2012) 构建贝叶斯推理树(Bayesian inference, BI), 用RAxML-HPC2 (Miller et al, 2010) 构建最大似然树(Maximum Likelihood, ML)。以奇异棍形藻Bacillaria paxillifer、新月细柱藻Cylindrotheca closterium和船斑菱形藻Nitzschia navis-varingica为群外对照(Teng et al. 2014)。
1.4 ITS2二级结构的预测及CBCs(Compensatory base changes)分析从GenBank下载镰刀拟菱形藻的ITSrDNA序列, 参考序列标注, 将其ITS2片段截下。使用Mfold (Percopo et al, 2016) 在线预测镰刀拟菱形藻ITS2的二级结构, 所得二级结构含4个环和一个拟菱形藻属环。以镰刀拟菱形藻二级结构为同源模板, 使用ITS2 Database (Percopo et al, 2016) 在线预测本文的5个镰刀拟菱形藻单克隆株系, 与其亲缘关系最接近的并基拟菱形藻(P. decipiens)的RNA二级结构。中鼓拟菱形藻藻株的ITS2二级结构构建方法同上。最后使用VARNA(Lim et al, 2013) 观察并下载二级结构。同时使用4SALE v.1.7 (Lim et al, 2013) 软件中自带的补偿碱基变化(CBCs)功能观察CBC差异, 分析生殖隔离情况。
1.5 LC-MS/MS法检测藻毒素取处于生长稳定期中后期的藻液300—600mL, 藻细胞浓度约5×105ind./mL, 经0.2μm醋酸纤维滤膜过滤, 收集藻细胞立刻置于-20℃冰箱中保存; 另外取5mL混匀的藻细胞加2mL鲁格-4℃保存, 用于单细胞产毒量的计算。将已收集的藻细胞加4mL甲醇水(甲醇︰水=1︰1) 充分混匀, 用超声波细胞粉碎机冰浴破碎5min, 经0.22µm滤膜过滤, 滤液于-20℃下保存备用。本实验样品皆寄往中国水产科学研究院黄海水产研究所上机检测。
采用Prominence UFLC超快速液相色谱(Shimadzu公司)和5500 QTRAP四极杆-线性离子阱复合质谱检测系统(SCIEX公司)对预处理的样品进行DA检测, 参见Wu等(2014) 方法进行分析。DA标准品购自德国Sigma公司。
2 结果结合形态学、分子系统学和ITS2二级结构特征, 鉴定到我国沿海拟菱形藻两个新记录种:镰刀拟菱形藻P. sabit Teng, Lim, Lim & Leaw (MC990、MC3013、MC3014、MC3039)和中鼓拟菱形藻P. inflatula (Hasle) Hasle (MC3086、MC3087)。
2.1 形态学描述镰刀拟菱形藻Pseudo-nitzschia sabit Teng, Lim, Lim & Leaw (图 1A—G)
 |
| 图 1 镰刀拟菱形藻 Fig. 1 Pseudo-nitzschia sabit 注: A:光镜照片, 示3个细胞的链状群体; B—G:透射电镜照片; B—C:壳面外形; D:壳端; E:壳面中部放大; F:壳面局部放大; G:环带(第二条环带, Ⅱ; 第三条环带, Ⅲ)。标尺: 20µm (A), 5µm (B—C), 1µm (D—F), 0.5µm (G) |
细胞具有两个黄褐色的色素体, 对称分布在横轴两侧, 相邻两细胞间非对称分布, 可形成非直线链状群体(图 1A), 重叠部为壳面全长的1/10—1/12。细胞壳面纵轴呈现镰刀状(图 1B, C), 壳端钝圆(图 1C), 两壳端形状相似。壳面长28—47µm, 宽1.8—2.2µm。管壳缝强烈偏心, 值得注意的是管壳缝位置有所不同, 有的处于凸面(图 1B), 有的处于凹面(图 1C)。具有中央较大船骨点(图 1E)。肋突分布在壳缘, 排列不规则(图 1F), 密度为20—27个/10µm。点条纹主要由两排孔纹组成, 偶尔会出现单排孔纹(图 1E), 密度为41—48条/10µm。孔纹为不规则的多边形, 密度为1µm内11—14个。本文只观察到第二和第三条环带(图 1G), 第二条环带宽1—2个孔纹, 高1—2个孔纹, 点条纹密度50—54个/10µm, 孔纹内部由多边形的筛孔构成(图 1G); 第三条环带具有一排纵向排列的孔纹(图 1G)。
生态:海水浮游生活。
分布:标本采自台湾海峡(4月)和南海北部(6月)。本种曾报道于马来西亚和墨西哥(Teng et al, 2015)。
中鼓拟菱形藻Pseudo-nitzschia inflatula (Hasle) Hasle(图 2A—F)
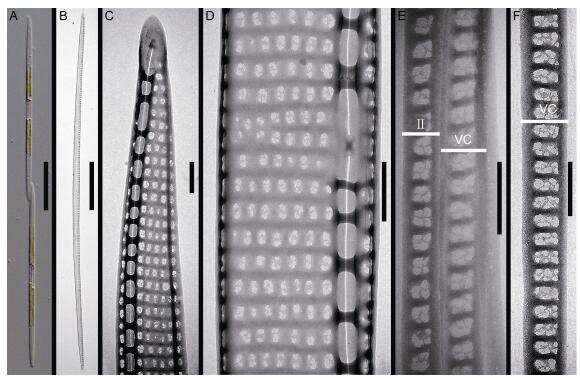 |
| 图 2 中鼓拟菱形藻 Fig. 2 Pseudo-nitzschia inflatula 注: A:光镜照片, 示2个细胞的链状群体; B—F:透射电镜照片; B:壳面外形; C:壳端; D:壳面中部放大; E:环带(壳环带, VC; 第二条环带, Ⅱ); F:壳环带。标尺: 20µm (A), 10µm (B), 0.5µm (C—F) |
细胞具有两个黄褐色的色素体, 对称分布在横轴两侧, 可形成链状群体(图 2A), 重叠部为壳面全长的1/10—1/11。细胞壳面纵轴呈线形(图 2B), 两壳端形状相似。壳面长67—74µm, 宽1.0—1.3µm。管壳缝强烈偏心(图 2D)。有中央较大船骨点(图 2D)。肋突分布在壳缘, 排列不规则(图 2C, D), 密度为23—28个/10µm。点条纹由单排孔纹组成, 密度为46—50条/10µm。孔纹内部的筛板膜分成1—3个分区, 以上下2个分区为主, 每个分区为不规则的多边形, 孔纹密度1µm内6—9个。可观察到2条环带(图 2E, F), 壳环带宽2个孔纹, 高3个孔纹, 点条纹密度59—63个/10µm, 孔纹内部有裂缝, 分成不规则的多边形(图 2E, F); 第二条环带宽2个孔纹, 高2个孔纹。
生态:海水浮游生活。
分布:标本采自南海北部(6月)。本种曾报道于丹麦海峡和亚南极的太平洋(Hasle 1997)、泰国(Priisholm et al, 2002; Lundholm et al, 2006; Quijano-Scheggia et al, 2009)、墨西哥(Hernández-Becerril et al, 2006)、马来西亚(Teng et al, 2013)。
2.2 基于ITS序列分析的分子系统学分析本文利用RAxML对ITS1-5.8S-ITS2序列的939个碱基进行了比对分析, 建立了分子系统发育树(图 3)。MC990与MC3111、MC3013与MC3014的基因完全相同, 后两个株系与前两个株系有1个碱基的差异, MC3039与前四个株系的遗传差异最大, 有5个碱基的差异。MC990、MC3111与马来西亚株系(PnPd96) 基因完全相同, 与墨西哥株系(Ps147、Ps149、Ps283) 有1—2个碱基的差异。本文建立的5个株系与已报道的5株镰刀拟菱形藻聚在同一个分支上, 且具有较高的置信值(BPP=0.84, ML=85), 这表明分子分类的结果也支持形态鉴定的结论。
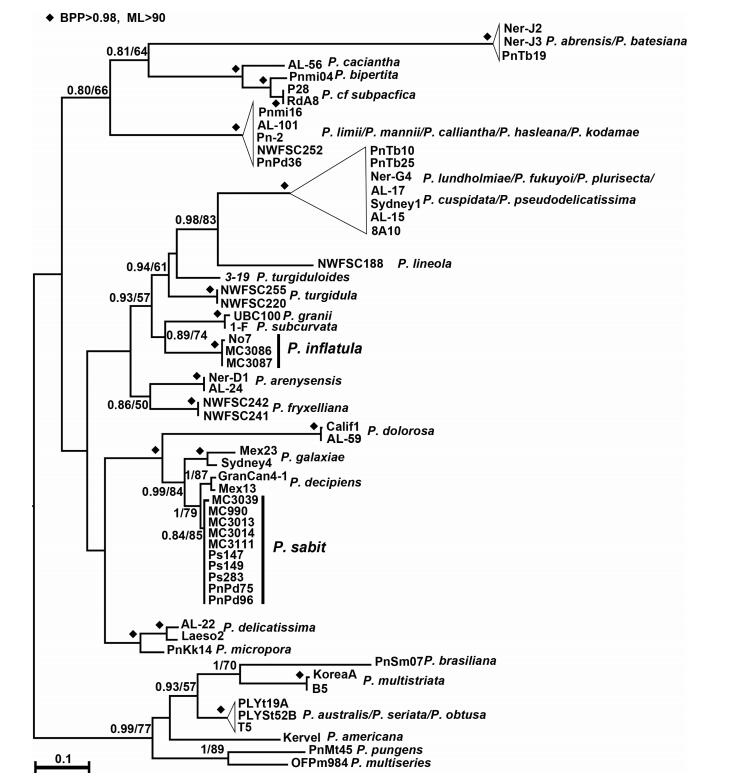 |
| 图 3 基于核糖体转录间隔区ITS1-5.8S-ITS2的分子系统树 Fig. 3 Molecular phylogenetic tree inferred from ITS1-5.8S-ITS2 rDNA |
以往对中鼓拟菱形藻的认知主要是形态特征, 分子数据较少, NCBI上只有一个株系(no7) 提供了分子序列信息。本文建立的2个单克隆株系(MC3086、MC3087) 在形态学上与以往报道的中鼓拟菱形藻完全相符。MC3086与MC3087基因完全相同, 与泰国株系(no7) 有6个碱基的差异, 应该是不同地理株系之间的差异。这三个株系聚为一枝, 并且具有较高的置信值(BPP=1, ML=100), 也表明分子系统发育树的鉴定结果与形态学鉴定的结果相一致。
2.3 ITS2二级结构分析镰刀拟菱形藻和中鼓拟菱形藻的ITS2二级结构模型具有四个单环和一个拟环IIa(图 4, 5), 与其他拟菱形藻种类的ITS2二级结构基本一致(Teng et al, 2014; Percopo et al, 2016)。镰刀拟菱形藻ITS2–RNA的标志性区间位于helix Ⅲ, 31-bp信号区域: 5'-UUG UUA CUA GCU GUU CGA ACG AUU ACU AAA A-3′。本文4个镰刀拟菱形藻株系(MC990、MC3013、MC3014、MC3111) 与之前报道的马来西亚株系(PnPd96)和墨西哥株系(Ps147、Ps149、Ps283) 具有完全一致的ITS2二级结构, 只有MC3039与前四个实验株系有3个SNPs(单核苷酸多态性)的差异, 没有CBC和hemi-CBC(HCBC)的差异, 这表明ITS2二级结构的结论亦支持形态学与分子分类的鉴定结果。将本文的镰刀拟菱形藻与系统发育树上亲缘关系最近的并基拟菱形藻相比较, 发现与并基拟菱形藻株系(GranCan4-1) 在helix Ⅲ上有2个CBCs和3个HCBCs的差异。
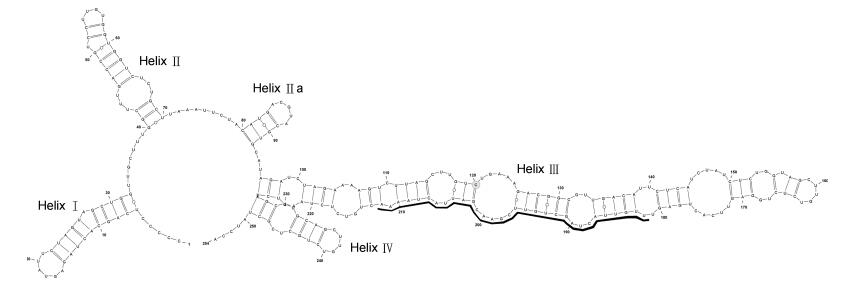 |
| 图 4 镰刀拟菱形藻ITS2二级结构图 Fig. 4 The secondary structure of ITS2-RNA in Pseudo-nitzschia sabit strain MC990 |
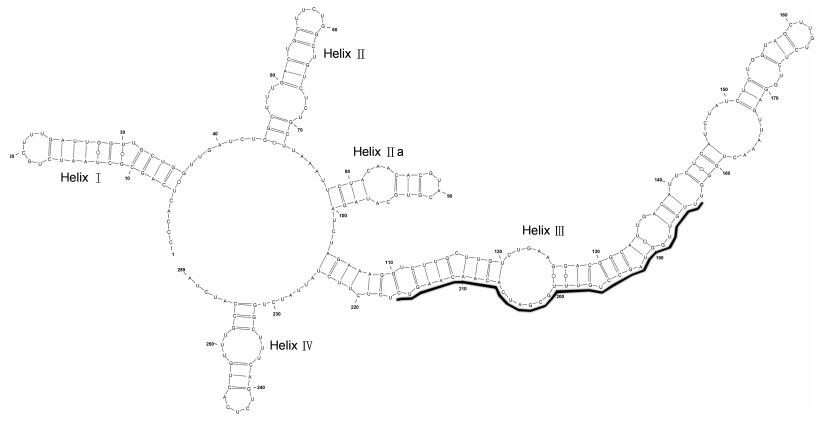 |
| 图 5 中鼓拟菱形藻ITS2二级结构图 Fig. 5 The secondary structure of ITS2-RNA in Pseudo-nitzschia inflatula strain MC3087 |
本文的2个中鼓拟菱形藻株系(MC3086、MC3087) 具有完全相同的二级结构, 与泰国株系(no7) 在helix Ⅲ上有一个SNP差异, 没有CBC和HCBC的差异, 这表明ITS2二级结构的结论也支持形态学与分子分类学的鉴定结果。中鼓拟菱形藻ITS2–RNA的标志性区间位于helixⅢ, 33-bp信号区域: 5′-UUG UUG GUA GCC UGU UUG CGA UCA CAA CAA GUC-3′。在4SALE软件中将本研究的中鼓拟菱形藻株系与分子系统树中亲缘关系较接近的格氏拟菱形藻(P. granii)株系(UBC100)和亚弧线拟菱形藻(P. subcurvata)株系(1-F)相比较, 发现与后两者均存在4个CBCs的差异, 存在生殖隔离, 应该分别隶属于不同物种。
2.4 DA产毒特征的LC-MS检测以DA标准品浓度(μg/mL)为横坐标, 峰面积为纵坐标, 建立DA的LC-MS检测标准曲线, DA浓度为50—500μg/L时, 其峰面积与质量浓度有良好的线性关系(R2=0.99934), 回归方程为: y=164.64875x-3947.22457。本方法的检测下限为50ng/mL。DA的出峰保留时间为0.77min。对常规培养的镰刀拟菱形藻和中鼓拟菱形藻进行LC-MS检测, 结果在预定的保留时间内都未出现样品峰。表明藻株在本检测限内未检到DA的存在。
3 讨论 3.1 相似种的比较研究 3.1.1 镰刀拟菱形藻与相似种的比较研究镰刀拟菱形藻最典型的形态特征是壳面呈现独特的镰刀状, 该种类的壳面宽度小于3µm, 点条纹由两排孔纹组成, 而且点条纹密度大于40条/10µm, 属于CladeⅡ:柔弱拟菱形藻类群(Teng et al, 2015)。分子系统学的研究已经证实, 拟菱形藻属内的多个复合群, 都是基于相似形态学特征而建立的种类集群, 并不能反映各个种类之间的系统学关系(Lundholm et al, 2006; Quijano-Scheggia et al, 2009; Teng et al, 2015, 2016)。本研究的镰刀拟菱形藻点条纹密度(41—48条/10µm)略高于以往报道(38—45条/10µm)(Teng et al, 2015), 明显高于柔弱拟菱形藻类群中的阿雷拟菱形藻(34—43条/10µm)(Quijano-Scheggia et al, 2009)、柔弱拟菱形藻(34—40条/10µm)(Lundholm et al, 2006)、疑难拟菱形藻(30—36条/10µm)(Lundholm et al, 2006)和P. lineola (Cleve) Hasle(22—31条/10µm)(Lundholm et al, 2012)。镰刀拟菱形藻与微孔拟菱形藻和多纹拟菱形藻都具有两排孔纹, 孔纹形状也相似, 但前者具有中央船骨点, 而后两种没有(Teng et al, 2015)。镰刀拟菱形藻与亚弧线拟菱形藻具有相似的壳面(镰刀状VS一壳面边缘有凸起)及宽度(1.8—2.2µm VS 1.3—2.5µm)(Hasle et al, 1997; Almandoz et al, 2008), 两者在光镜下易混淆, 但是前者为长链状群体生活, 而后者以单个细胞生活为主(Hasle et al, 1997; Almandoz et al, 2008), 此外在电镜下还是比较容易区分的, 如肋突密度前者(20—27个/10µm)明显高于后者(12—22个/10µm) (Almandoz et al, 2008)。
在拟菱形藻分类学中, 环带特征(环带数目、点条纹密度、环带上孔纹形状)可以作为区分不同种类或变种的重要指标(Lundholm et al, 2003, 2006, 2012; Amato et al, 2008; Lim et al, 2013), 例如依据环带上孔纹形状而划分的尖刺拟菱形藻的三个变种:尖刺拟菱形藻原变种、尖刺拟菱形藻阿维罗变种和尖刺拟菱形藻环带变种(Casteleyn et al, 2008)。镰刀拟菱形藻的环带特征也有其独特之处, 绝大多数拟菱形藻具有3条环带, 而镰刀拟菱形藻有4条环带(Teng et al, 2015)。镰刀拟菱形藻壳环带上点条纹的数目(49—58条/10µm)(Teng et al, 2015) 明显高于柔弱拟菱形藻复合群中的阿雷拟菱形藻(40—50条/10µm)(Quijano-Scheggia et al, 2009)、柔弱拟菱形藻(43—48条/10µm) (Lundholm et al, 2006)和疑难拟菱形藻(40—44条/10µm)(Lundholm et al, 2006), 略高于其形态与遗传最接近的并基拟菱形藻(48—55条/10µm)(Lundholm et al, 2006)。
镰刀拟菱形藻的遗传相似种类主要有两个:并基拟菱形藻和银河拟菱形藻。镰刀拟菱形藻与并基拟菱形藻的亲缘关系最为接近, 但两者形态上存在明显差异, 最大的区别在于前者的壳面呈独特的镰刀状(Teng et al, 2015)。镰刀拟菱形藻与银河拟菱形藻在形态学上最明显的区别是:前者的点条纹由两排孔纹构成, 而后者点条纹中未见明显的孔纹(徐国双等, 2015)。
3.1.2 中鼓拟菱形藻与相似种的比较研究有报道认为中鼓拟菱形藻的主要形态特征是点条纹由单排孔纹组成, 壳面中部略鼓起, 接近壳端也出现局部膨胀(Priisholm et al, 2002; Hernández-Becerril et al, 2006)。但是本文的中鼓拟菱形藻接近线形, 壳面中央略有膨胀, 或有时不明显; 而且壳端未见局部膨胀。因此本文认为这两个特征对于中鼓拟菱形藻是不稳定的。该种类在透射电镜下比较容易区分, 因此以往对中鼓拟菱形藻的鉴定主要是进行形态学的观察(Hasle, 1997; Priisholm et al, 2002; Hernández-Becerril et al, 2006; Teng et al, 2013), 现有的分子数据较少。本文鉴定的中鼓拟菱形藻与以往报道的泰国株系(Priisholm et al, 2002) 在形态学上更为接近, 但也存在一些差异。如泰国株系(1.3—1.8µm)宽度明显大于本文株系(1.0—1.3µm)。在点条纹密度上, 本文株系(46—50条/10µm)稍高于泰国株系(38—46条/10µm), 而在壳环带点条纹密度上, 本文株系(59—63µm)也明显高于泰国株系(46—52条/10µm)。在ITS序列系统树中, 本文株系与泰国株系聚在同一个分枝, 而且具有较高置信值。同时鉴于ITS2-RNA二级结构的分析结论, 我们认为上述形态差异应该是地理分布差异引起的。中鼓拟菱形藻属于伪柔弱拟菱形藻复合群中的一员, 其中与其形态最为相似的是伪柔弱拟菱形藻(P. pseudodelicatissima)和尖细拟菱形藻 (P. cuspidate)。本文中鼓拟菱形藻的点条纹密度和壳环带上点条纹密度明显高于伪柔弱拟菱形藻(36—43条/10µm; 48—55条/10µm)和尖细拟菱形藻(35—44条/10µm; 47—53条/10µm)(Lundholm et al, 2003)。在孔纹内部筛板膜的分区上, 中鼓拟菱形藻具有1—3个, 以上下不规则的2个分区为主, 而后两者孔纹则分成较均匀的2个分区。
在分子系统学中, 由于中鼓拟菱形藻与拟菱形藻属中其他物种的亲缘关系较远, 在以往研究中多被作为外类群(Lundholm et al, 2006)。但中鼓拟菱形藻与格氏拟菱形藻、亚弧线拟菱形藻的亲缘关系相对较近, 然而前者与后两者在形态学上却存在明显区别。虽然三者细胞壳面都是中部膨大, 但是中鼓拟菱形藻壳面中部膨胀的特征不是很明显, 而后两者较明显。在孔纹形状上前者孔纹主要分成2部分, 而后两者孔纹分成4—6部分(Almandoz et al, 2008)。此外在肋突密度和点条纹密度上也存在些许差别。值得注意的是, 本研究对格氏拟菱形藻(UBC100)和亚弧线拟菱形藻 (图 1F)的ITS序列进行比对, 发现两者只有7个碱基差异, 构建的系统发育树中它们也聚在一起, 而且具有较高置信值(图 3)。甚至它们的ITS2-RNA二级结构不存在CBC或HCBC的差异。Hasle et al在1997年对这两个种类进行了描述, 主要依据两者壳面特征进行区分, 认为亚弧线拟菱形藻的一边壳缘凸起, 另一边壳缘是直线或稍微出现凹面, 而格氏拟菱形藻细胞壳面中部膨大, 两边壳缘都凸起。此外, 它们在宽度、肋突密度、点条纹密度上也完全一样。格氏拟菱形藻和亚弧线拟菱形藻之间更为清晰的种类界限, 需要后续研究加以澄清。
3.2 拟菱形藻属DA产毒特征分析Teng等(2015) 首次报道了镰刀拟菱形藻, 样品采自马来西亚和墨西哥, 但未检测到DA的存在。而中鼓拟菱形藻最早报道于丹麦海峡和亚南极的太平洋, 至今未有产生DA的直接报道。本文从我国东南海域分离并建立了4株镰刀拟菱形藻和2株中鼓拟菱形藻培养株系, 利用LC-MS技术对其产毒特征进行检测, 也没有检测到DA的存在。截至目前, 全球已报道能够产生DA的拟菱形藻种类达到24种(Lelong et al, 2012; Lundholm, 2017; Teng et al, 2016), 其中15种在我国也有分布(徐国双等, 2015), 但是目前尚未有我国拟菱形藻产毒的直接报道。近年来我国沿海的部分水产品中却已有DA的检出报道(宋琍琍等, 2008;吉薇等, 2011;王恒等, 2011), 并且采集的浮游植物网样品中亦有检出(深圳大鹏澳, 2016年8月, 浓缩网样中DA的含量9.56—13.28mg/L, 黄春秀等, 未发表数据), 但本数据由于拖网滤过的实际海水体积无法计算, 因此只能用于定性, 而不能定量分析。因此上述DA的生物来源是什么?有待后续研究的持续深入。
拟菱形藻的产毒能力是一个比较复杂的情况, 国内外学者对影响拟菱形藻产毒的因素进行了分析(Lelong et al, 2012), 如硅和磷限制可以促进DA的产生, 低浓度的铁和高浓度的铜也能激发DA的产生; 有机氮源、pH、二氧化碳、盐度、细菌浓度等的变化都能影响拟菱形藻属产DA(Lelong et al, 2012)。
4 结论(1) 结合形态学与分子生物学数据, 发现并鉴定了我国拟菱形藻属的两个新记录种, 分别是镰刀拟菱形藻P. sabit和中鼓拟菱形藻P. inflatula, 丰富了我国拟菱形藻属的物种多样性。
(2) 对所建立的7个拟菱形藻株系进行了DA检测, 未检测到DA的存在。
| 王恒, 2011. 舟山海域贝类海产品中软骨藻酸含量调查. 中国卫生检验杂志, 21(12): 2986–2988, 2992 |
| 吉薇, 郑洁莹, 曾雪萍, 等, 2011. 南海海域软骨藻酸(DA)贝类毒素的HPLC方法检测. 现代食品科技, 27(1): 120–122, 116 |
| 李扬, 何利娜, 马艳艳, 等, 2010. 伪柔弱拟菱形藻复合群的形态分类学研究. 水生生物学报, 34(2): 302–311 |
| 宋琍琍, 张海琪, 侯镜德, 等, 2008. 液相色谱-串联质谱法测定贝类毒素软骨藻酸的残留. 水产学报, 32(6): 950–956 |
| 徐国双, 李扬, 2015. 我国沿海拟菱形藻属的2新记录种及其产毒特征分析. 热带亚热带植物学报, 23(6): 614–624 DOI:10.11926/j.issn.1005-3395.2015.06.002 |
| Almandoz G O, Ferreyra G A, Schloss I R, et al, 2008. Distribution and ecology of Pseudo-nitzschia species (Bacillariophyceae) in surface waters of the Weddell Sea (Antarctica). Polar Biology, 31(4): 429–442 DOI:10.1007/s00300-007-0369-9 |
| Amato A, Montresor M, 2008. Morphology, phylogeny, and sexual cycle of Pseudo-nitzschia mannii sp.nov. (Bacillariophyceae):a pseudo-cryptic species within the P.pseudodelicatissima complex.. Phycologia, 47(5): 487–497 DOI:10.2216/07-92.1 |
| Bates S S, Bird C J, de Freitas A S W, et al, 1989. Pennate diatom Nitzschia pungens as the primary source of domoic acid, a toxin in shellfish from eastern Prince Edward Island, Canada. Canadian Journal of Fisheries and Aquatic Sciences, 46(7): 1203–1215 DOI:10.1139/f89-156 |
| Casteleyn G, Chepurnov V A, Leliaert F, et al, 2008. Pseudo-nitzschia pungens (Bacillariophyceae):A cosmopolitan diatom species?. Harmful Algae,: 241–257 |
| Hallegraeff G M, 1994. Species of the diatom genus Pseudo-nitzschia in Australian waters. Botanica Marina, 37(5): 397–411 |
| Hasle G R, Syvertsen E E, 1997. Marine diatoms. In:Tomas C R ed. Identifying Marine Phytoplankton. San Diego:Academic Press, 5-385 |
| Hernández-Becerril D U, Díaz-Almeyda E M, 2006. The Nitzschia bicapitata group, new records of the genus Nitzschia, and further studies on species of Pseudo-nitzschia (Bacillariophyceae) from Mexican Pacific coasts. Nova Hedwigia, Beiheft, 130: 293–306 |
| Lelong A, Hégaret H, Soudant P, et al, 2012. Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning:revisiting previous paradigms. Phycologia, 51(2): 158–216 |
| Lim H C, Teng S T, Leaw C P, et al, 2013. Three novel species in the Pseudo-nitzschia pseudodelicatissima complex:P. batesiana sp. nov., P.lundholmiae sp. nov., and P.fukuyoi sp. nov. (Bacillariophyceae) from the Strait of Malacca, Malaysia. Journal of Phycology, 49(5): 902–916 |
| Lü S H, Li Y, Lundholm N, et al, 2012. Diversity, taxonomy and biogeographical distribution of the genus Pseudo-nitzschia (Bacillariophyceae) in Guangdong coastal waters, South China Sea. Nova Hedwigia, 95(1-2): 123–152 |
| Lundholm N, 2017. IOC-UNESCO taxonomic reference list of harmful micro algae.http://www.marinespecies.org/hab |
| Lundholm N, Bates S S, Baugh K A, et al, 2012. Cryptic and pseudo-cryptic diversity in diatoms-with descriptions of pseudo-nitzschia hasleana sp. nov. and p.fryxelliana sp. nov.. Journal of Phycology, 48(2): 436–454 DOI:10.1111/jpy.2012.48.issue-2 |
| Lundholm N, Daugbjerg N, Moestrup , 2002. Phylogeny of the Bacillariaceae with emphasis on the genus Pseudo-nitzschia (Bacillariophyceae) based on partial LSU rDNA. European Journal of Phycology, 37(1): 115–134 DOI:10.1017/S096702620100347X |
| Lundholm N, Moestrup , Hasle G R, et al, 2003. A study of the Pseudo-nitzschia pseudodelicatissima ⁄ cuspidata complex (Bacillariophyceae):what is P. pseudodelicatissima? Journal of Phycology, 39(4): 797–813 DOI:10.1046/j.1529-8817.2003.02031.x |
| Lundholm N, Moestrup , Kotaki Y, et al, 2006. Inter-and intraspecific variation of the Pseudo-nitzschia delicatissima complex (Bacillariophyceae) illustrated by rRNA probes, morphological data and phylogenetic analyses. Journal of Phycology, 42(2): 464–481 DOI:10.1111/jpy.2006.42.issue-2 |
| Lundholm N, Skov J, Pocklington R, et al, 1994. Domoic acid, the toxic amino acid responsible for amnesic shellfish poisoning, now in Pseudonitzschia seriata (Bacillariophyceae) in Europe. Phycologia, 33(6): 475–478 DOI:10.2216/i0031-8884-33-6-475.1 |
| Miller M A, Pfeiffer W, Schwart T, 2010. Creating the CIPRES science gateway for inference of large phylogenetic trees. In:Proceedings of 2010 Gateway Computing Environments Workshop (GCE). New Orleans, LA, USA:IEEE, 1-8, doi:10.1109/gce.2010.5676129 |
| Percopo I, Ruggiero M V, Balzano S, et al, 2016. Pseudo-nitzschia arctica sp. nov., a new cold-water cryptic Pseudo-nitzschia species within the P.pseudodelicatissima complex. Journal of Phycology, 52(2): 184–199 |
| Priisholm K, Moestrup , Lundholm N, 2002. Taxonomic notes on the marine diatom genus Pseudo-nitzschia in the Andaman Sea near the island of Phuket, Thailand, with a description of Pseudo-nitzschia micropora sp. nov. Diatom Research, 17(1):153-175 |
| Quijano-Scheggia S I, Garcés E, Lundholm N, et al, 2009. Morphology, physiology, molecular phylogeny and sexual compatibility of the cryptic Pseudo-nitzschia delicatissima complex (Bacillariophyta), including the description of P.arenysensis sp. nov. Phycologia, 48(6): 492–509 DOI:10.2216/08-21.1 |
| Ronquist F, Teslenko M, van der Mark P, et al, 2012. MrBayes 3.2:efficient Bayesian phylogenetic inference and model choice across a large model space.. Systematic Biology, 61(3): 539–542 DOI:10.1093/sysbio/sys029 |
| Teng S T, Leaw C P, Lim H C, et al, 2013. The genus Pseudo-nitzschia (Bacillariophyceae) in Malaysia, including new records and a key to species inferred from morphology-based phylogeny. Botanica Marina, 56(4): 375–398 |
| Teng S T, Lim H C, Lim P T, et al, 2014. Pseudo-nitzschia kodamae sp. nov. (Bacillariophyceae), a toxigenic species from the Strait of Malacca, Malaysia. Harmful Algae, 34: 17–28 |
| Teng S T, Lim P T, Lim H C, et al, 2015. A non-toxigenic but morphologically and phylogenetically distinct new species of Pseudo-nitzschia, P. sabit sp. nov. (Bacillariophyceae). Journal of Phycology, 51(4): 706–725 |
| Teng S T, Tan S N, Lim H C, et al, 2016. High diversity of Pseudo-nitzschia along the northern coast of Sarawak (Malaysian Borneo), with descriptions of P. bipertita sp. nov. and P.limii sp. nov. (Bacillariophyceae). Journal of Phycology, 52(6): 973–989 DOI:10.1111/jpy.12448 |
| Trainer V L, Bates S S, Lundholm N, et al, 2012. Pseudo-nitzschia physiological ecology, phylogeny, toxicity, monitoring and impacts on ecosystem health. Harmful Algae, 14: 271–300 DOI:10.1016/j.hal.2011.10.025 |
| Wu H Y, Guo M M, Tan Z J, et al, 2014. Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks. Journal of Chromatography A, 1358: 172–180 DOI:10.1016/j.chroma.2014.06.105 |
 2017, Vol. 48
2017, Vol. 48


