中国海洋湖沼学会主办。
文章信息
- 胡顺鑫, 杨丁, 唐学玺, 臧宇, 周斌. 2017.
- HU Shun-Xin, YANG Ding, TANG Xue-Xi, ZANG Yu, ZHOU Bin. 2017.
- 海水酸化对米氏凯伦藻和盐生杜氏藻种群增长和种间竞争的影响
- OCEAN ACIDIFICATION ON POPULATION GROWTH AND INTER-SPECIES COMPETITION BETWEEN KARENIA MIKIMOTOI AND DUNALIELLA SALINA
- 海洋与湖沼, 48(4): 777-785
- Oceanologia et Limnologia Sinica, 48(4): 777-785.
- http://dx.doi.org/10.11693/hyhz20161100261
-
文章历史
- 收稿日期:2016-11-29
- 收修改稿日期:2017-03-07
由于化石燃料的使用和植被破坏的加剧, 大气中二氧化碳浓度(pCO2)不断升高, 导致广泛的环境、生态和气候问题发生(Hughes, 2000; Solomon et al, 2009)。海洋是地球表面最大的碳源之一, 吸收了人类排放二氧化碳总量的四分之一; 大气二氧化碳浓度升高也导致海水吸收更多的二氧化碳, 引起表层海水碱度下降, 导致海水酸化(ocean acidification)。自工业革命以来, 大气中二氧化碳浓度由280ppmv上升到现在的399.6ppmv, 海水pH值相应下降了0.1个单位(Doney et al, 2009)。在不改变现有能源使用结构的情况下, 到22世纪初期, 大气二氧化碳浓度将升高至800—1000ppmv, 与工业革命前相比, 海水pH将会下降0.3—0.4个单位, pCO2将增加近200%, 这种酸化速度在过去的几亿年间都未曾发生过(Gattuso et al, 1999; Caldeira et al, 2003)。
海水酸化正改变海洋生物赖以生存的化学环境, 进而影响海洋中大部分生物的生长、繁殖、生理和代谢, 最终对海洋生态系统产生深远的影响。目前已经有大量研究表明, 海水酸化会降低珊瑚、珊瑚藻类和贝类的钙化量(Gao et al, 1993), 从而降低颗石藻的钙化速率, 导致细胞表面的钙片脱落(Riebesell et al, 2000), 对钙化无脊椎动物幼虫的不利影响尤为显著(Kurihara, 2008)。海水酸化对非钙化生物也同样会产生影响, Hein等(1997) 指出, 走航调查时的二氧化碳加富实验表明, 二氧化碳浓度升高促进了浮游植物群落的光合固碳; Wu等(2010) 发现, 二氧化碳浓度升高促进了海洋硅藻三角褐指藻(Phaeodactylum tricornutum)的生长和光合作用并且下调了其无机碳浓缩机制。浮游植物对二氧化碳浓度变化的响应, 因种类不同存在较大差异。例如, 生长在1000ppmv CO2的假微型海链藻(Thalassiosira pseudonana)的光合作用显著高于在390ppmv条件下, 但是由于酸化条件下呼吸作用的增加, 生长速率并没有增加(Yang et al, 2012)。在浮游植物种间竞争对二氧化碳的响应方面, 李春雷(2009) 发现, 二氧化碳加富改变了金藻、中肋骨条藻和亚心形扁藻的种间竞争关系, 种群竞争向着有利于亚心形扁藻种群增长的方向发展, 使得亚心形扁藻由正常条件下的亚优势种变为二氧化碳加富条件下的优势种。另外, 海水酸化将会影响动物的受精(Havenhand et al, 2008) 及鱼类嗅觉作用(Munday et al, 2009)。然而, 海水酸化对有毒有害赤潮主要原因种——甲藻的影响鲜有报道。近年来, 有害赤潮的暴发频率逐年增加, 已经成为主要的海洋灾难之一。赤潮的生消过程与海水酸化有着密切的关系, 而有害赤潮藻种群生长以及与其他微藻的竞争关系对海水酸化的响应仍未见报道。
米氏凯伦藻(Karenia mikimotoi)属于裸甲藻目, 凯伦藻属, 为世界广布种, 常见于热带和温带浅海水域。米氏凯伦藻能够分泌具有一定细胞毒性的化感物质(如溶血性毒素和鱼毒素), 这些化感物质的分泌能够对其他海洋生物产生毒性效应(周成旭等, 2007)。中国海洋灾害公报数据显示, 近年来, 由米氏凯伦藻引发的赤潮屡见报道, 2003年至2009年我国近岸海域有87次米氏凯伦藻赤潮, 累计发生面积超过36300km2; 2012年, 东海附近的大型有害赤潮优势种均为米氏凯伦藻。米氏凯伦藻已经成为我国近岸海域主要的赤潮原因种之一。因此, 近期有关环境因子对米氏凯伦藻种群增长以及与其他微藻种间竞争关系的影响的报道颇多。例如, He等(2016) 发现, 在米氏凯伦藻和盐生杜氏藻的混合培养体系中, 米氏凯伦藻为竞争优势种, 并且随着温度的升高或光照强度的降低, 米氏凯伦藻的竞争优势逐渐增大; 董文隆等(2011) 发现, 长时间的UV-B辐射对米氏凯伦藻的种群生长有持续抑制效应; 斯丹等(2016) 指出, 在米氏凯伦藻与中肋骨条藻的竞争过程中, 氮磷比浓度越高, 中肋骨条藻的竞争优势越明显, 米氏凯伦藻所受抑制程度更大。本文选用米氏凯伦藻和盐生杜氏藻为研究对象, 探究海水酸化对米氏凯伦藻和盐生杜氏藻种群动态变化以及种间竞争关系的影响, 以期为预测未来海水酸化对米氏凯伦藻赤潮的危害和生消的影响提供理论基础和依据。
1 材料与方法 1.1 藻种及培养条件实验中所用的2种海洋微藻——米氏凯伦藻(K.mikimotoi)和盐生杜氏藻(D. salina)均取自中国海洋大学微藻种质资源库, 培养于装有f/2培养基的500mL三角瓶中, 海水取自青岛市鲁迅公园附近的自然海水, 光照强度为80μmol/(m2·s), 光暗周期为12h:12h, 培养温度为(20±0.1)℃, 每天定时摇动三角瓶两次, 防止微藻沉降。实验所用的两种微藻均是处于指数生长期的藻种。
1.2 实验体系 1.2.1 海水酸化体系海水酸化实验体系如图 1所示, 实验过程中选取了三个浓度的二氧化碳气体, 二氧化碳浓度分别为390ppmv、1000ppmv (2100年的预测值)和2000ppmv (2300年的预测值)。390ppmv为正常空气(气体取自人为干扰较小的室外), 1000ppmv和2000ppmv浓度的CO2气体是由高纯二氧化碳气体(99.99%)和空气在二氧化碳光照培养箱(HP400G, 瑞华, 武汉)内混合而成, 二氧化碳光照培养箱可以控制培养箱内二氧化碳气体的浓度。借助空气压缩泵将达到预设浓度的二氧化碳气体通过0.22μm的针式过滤器泵入培养瓶内(Yang et al, 2012)。微藻接种前, 预先向培养液中通各浓度的CO2气体24h, 使培养液中的碳酸盐系统达到稳定, 测得稳定后的pH值分别为: 390ppmv: pHNBS 8.10; 1000ppmv: pHNBS 7.78; 2000ppmv: pHNBS 7.48。实验时先将目标微藻培养至指数生长期, 然后分别接种到三种培养体系下进行充气培养, 充气速率为300mL/min。实验过程中每天用pH计测定培养液中的pH值, pH计(SevenCompactTM S210k, Mettler Toledo, 瑞士)使用前用NBS(National Bureau of Standards, Hanna)标准缓冲液(pH 4.01、7.01和10.01) 进行三点校正。
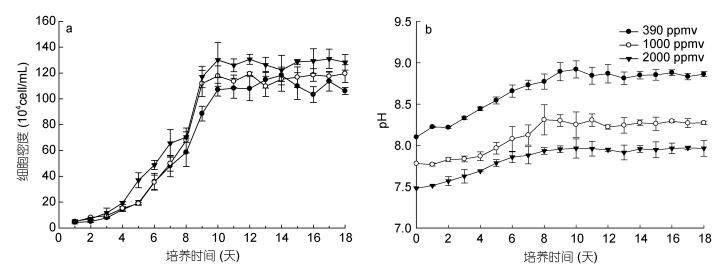 |
| 图 1 不同二氧化碳浓度下米氏凯伦藻的生长曲线(a)及pH变化趋势(b) Fig. 1 The growth curves of Karenia mikimotoi (a) and the pH trend (b) at different pCO2 |
将处于指数生长期的两种海洋微藻分别接种于300mL培养液中, 起始密度均为5.0×104cell/mL, 置于光照培养箱中连续培养18d。每隔5天用f/4培养基对培养液进行加富; 每隔24h取1mL藻液, 用Lugol碘液固定, 通过血球计数板计数。每个培养瓶取3次计数, 取平均值。每个二氧化碳浓度下, 设置三个平行样品。
1.2.3 双藻共培养体系实验中将处于指数生长期的米氏凯伦藻和盐生杜氏藻共同接种到300 mL培养基中, 起始藻细胞密度均为5.0×104cell/mL, 密度之比为1︰1, 连续培养18d, 设置三个平行组。每隔5天用f/4培养基对培养液进行加富, 每隔24h取样, 血球计数板技数, 观察双藻共培养体系中微藻细胞密度的变化。
1.2.4 米氏凯伦藻去藻过滤液培养盐生杜氏藻在米氏凯伦藻去藻过滤液实验中, 在不同二氧化碳浓度下将米氏凯伦藻培养至指数生长期, 然后将米氏凯伦藻培养液经0.45μm醋酸纤维素膜过滤, 保留去藻过滤液。用f/2培养基对去藻过滤液进行加富, 然后接种盐生杜氏藻, 起始藻密度为5.0×104cell/mL, 以正常灭菌海水中单独培养米氏凯伦藻为对照组, 设置三个平行组, 连续培养18d, 每隔24h取样观察藻密度。
1.3 数据分析 1.3.1 环境负载能力、内禀增长率和进入平台期时间的计算利用Logistic方程的积分形式(公式(1))拟合两种微藻种群增长曲线:
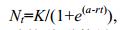 (1)
(1)式中, Nt为时间为t时的种群数量(×104cell/mL); K为环境负载能力(×104cell/mL); r为种群内禀增长率(/d); a为曲线对原点的相对位置; t为时间(d)
1.3.2 竞争抑制参数的计算通过Lotka-Volterra双藻竞争模型的差分形式(Volterra, 1926):
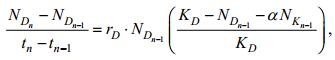 (2)
(2)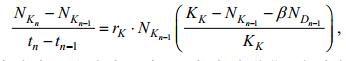 (3)
(3)在公式(2)和公式(3) 中, tn代表种群进入拐点的时间(d), NDn、NKn分别代表共培养体系中盐生杜氏藻和米氏凯伦藻在时间tn时的细胞密度(×104cell/mL); NDn-1、NKn-1分别代表共培养体系中杜氏盐藻和米氏凯伦藻在时间tn-1时的藻细胞密度(×104cell/mL); rD和rK分别代表杜氏盐藻和米氏凯伦藻的内禀增长率(/d)(单培养体系中计算所得); KD和KK分别代表杜氏盐藻和米氏凯伦藻的环境负载能力(×104cell/mL)(单培养体系中计算所得); α和β分别代表共培养体系中米氏凯伦藻对盐生杜氏藻, 盐生杜氏藻对米氏凯伦藻的竞争抑制参数。理论上讲, 两种微藻竞争的可能结果有:
(1) 当KD > KK / β, KK < KD / α时, 米氏凯伦藻在竞争中占有优势;
(2) 当KK > KD/ α, KD < KK/ β时, 盐生杜氏藻藻在竞争中占有优势;
(3) 当KD < KK/ β, KK < KD/ α时, 米氏凯伦藻和盐生杜氏藻在竞争中共存;
(4) 当KD > KK/β, KK > KD/α时, 可能出现平衡, 但是这种平衡是不稳定的。
1.3.3 统计分析用SPSS 19.0软件的one-way ANOVA在α=0.05水平上进行组间差异性分析, 并用Sigmaplot 12.5作图。数据以平均值±标准差(Mean± SD)方式给出(n=3)
2 结果与分析 2.1 不同二氧化碳浓度下米氏凯伦藻的生长曲线及pH变化趋势不同二氧化碳浓度下, 米氏凯伦藻的生长曲线如图 1所示。不同二氧化碳浓度下的米氏凯伦藻生长曲线均呈现典型的“S”型增长模式。根据逻辑斯蒂种群增长模型对生长曲线进行拟合的结果发现(表 1), 二氧化碳浓度升高显著提高了米氏凯伦藻种群的最大环境负载能力(P < 0.05), 且二氧化碳浓度越高, 对K值影响越显著; 而二氧化碳浓度升高对米氏凯伦藻进入拐点的时间(P > 0.05)、内禀增长率(P > 0.05)、进入指数生长期(P > 0.05)和静止期的时间(P > 0.05) 均无显著性影响。培养过程中, 米氏凯伦藻培养体系的pH变化如图 1b所示, 结果表明, 培养体系中的pH随着培养天数和藻细胞密度的增加而增加。
| 种群生长参数 | 二氧化碳浓度(ppmv) | ||
| 390 | 1000 | 2000 | |
| 生长回归方程 | N=112.9/(1+e5.223-0.715t) | N=118.7/(1+e6.07-0.850t) | N=131.1/(1+e4.49-0.657t) |
| 环境负载能力K (×104cell/mL) | 112.9±2.9 | 118.7±3.4 | 131.1±6.0 |
| 内禀增长率(r) | 0.715±0.042 | 0.850±0.075 | 0.657±0.039 |
| 到达拐点时间Tp (d) | 7.32±0.46 | 7.15±0.27 | 6.83±0.23 |
| 进入指数生长期的时间(d) | 5 | 5 | 5 |
| 进入静止期的时间(d) | 10 | 10 | 10 |
不同二氧化碳浓度下, 盐生杜氏藻的生长曲线如图 2所示。不同二氧化碳浓度下的盐生杜氏藻生长曲线均呈现典型的“S”型增长模式。根据逻辑斯蒂种群增长模型对生长曲线进行拟合的结果发现(表 2), 二氧化碳浓度升高显著降低了盐生杜氏藻进入拐点的时间(P < 0.05)和内禀增长率(P < 0.05), 而对种群的最大环境负载能力(P > 0.05)、进入指数生长期(P > 0.05)和静止期的时间(P > 0.05) 无显著性影响。培养过程中, 盐生杜氏藻培养体系中的pH变化如图 2b所示, 结果表明, 培养体系中的pH值随着培养天数和藻细胞密度的增加而增加。
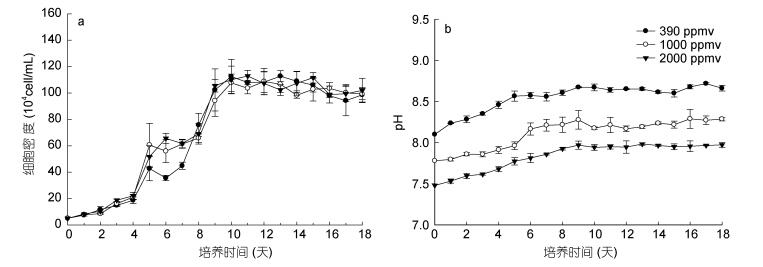 |
| 图 2 不同二氧化碳浓度下盐生杜氏藻的生长曲线(a)及pH变化趋势(b) Fig. 2 The growth curves of Dunaliella salina (a) and the pH trend (b) at different pCO2 |
| 种群生长参数 | 二氧化碳浓度(ppmv) | ||
| 390 | 1000 | 2000 | |
| 生长回归方程 | N=107.4/(1+e4.450–0.682t) | N=104.5/(1+e3.289–0.570t) | N=106.9/(1+e3.42–0.601t) |
| 环境负载能力K (×104cell/mL) | 107.4±0.85 | 104.5±1.95 | 106.9±1.98 |
| 内禀增长率(r) | 0.682±0.040 | 0.570±0.013 | 0.601±0.022 |
| 到达拐点时间Tp(d) | 6.5±0.31 | 5.7±0.34 | 5.6±0.16 |
| 进入指数生长期的时间(d) | 4 | 4 | 4 |
| 进入静止期的时间(d) | 10 | 10 | 10 |
在390ppmv CO2条件下, 共培养体系中的盐生杜氏藻和米氏凯伦藻的生长与单培养体系中相比均发生了明显的变化(图 3, 表 3)。与单培养体系相比, 共培养体系中盐生杜氏藻的K、Tp以及进入指数生长期和静止期的时间均显著下降(P < 0.05), 但是r显著增加(P < 0.05);米氏凯伦藻只有K值和进入指数生长期的时间显著降低(P < 0.05), 而r、Tp进入静止期的时间均未发生显著性变化(P > 0.05)。
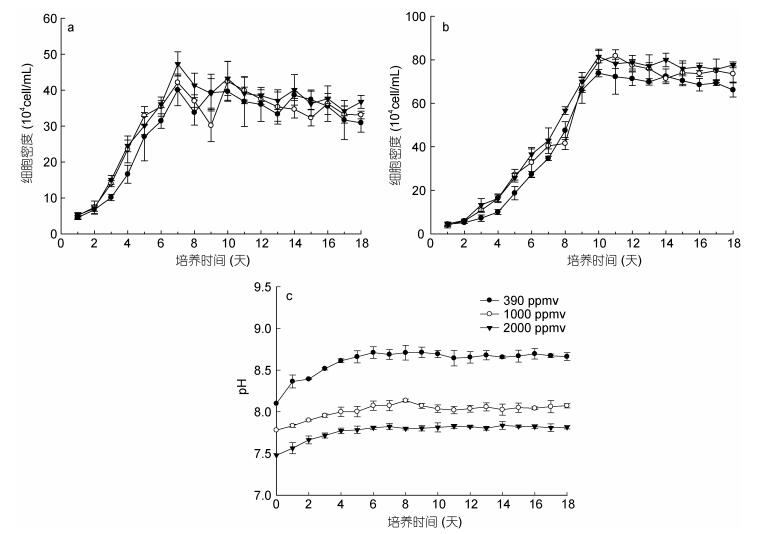 |
| 图 3 共培养体系中, 不同二氧化碳浓度下盐生杜氏藻(a)和米氏凯伦藻(b)的生长曲线及pH变化趋势(c) Fig. 3 The growth curves of Dunaliella salina (a) and Karenia mikimotoi (b) in co-culture and the pH trend(c) at different pCO2 |
| 种群参数 | 盐生杜氏藻 | 米氏凯伦藻 | |||||
| 390 ppmv | 1000 ppmv | 2000 ppmv | 390 ppmv | 1000 ppmv | 2000 ppmv | ||
| 环境负载能力K (×104cell/mL) | 35.7±1.5 | 36.0±0.86 | 38.7±1.37 | 71.6±1.0 | 77.1±0.9 | 79.34±1.9 | |
| 内禀增长率(r) | 0.84±0.098 | 1.12±0.053 | 0.97±0.035 | 0.74±0.076 | 0.59±0.055 | 0.63±0.011 | |
| 到达拐点时间Tp (d) | 3.9±0.12 | 3.2±0.10 | 3.4±0.05 | 6.6±0.07 | 6.4±0.094 | 6.2±0.145 | |
| 进入指数生长期的时间(d) | 3.0 | 3.0 | 3.0 | 3.0 | 3.0 | 3.0 | |
| 进入静止期的时间(d) | 7.0 | 7.0 | 7.0 | 10.0 | 10.0 | 10.0 | |
在1000ppmv CO2条件下, 共培养体系中的盐生杜氏藻和米氏凯伦藻的生长与单培养体系中的相比也发生了明显的变化(图 3, 表 3)。通过比较发现, 与单培养体系相比, 共培养体系中盐生杜氏藻在1000ppmv CO2条件下各种群参数的变化趋势与390ppmv CO2条件下的变化趋势相似。但是米氏凯伦藻表现出不同的变化, 1000ppmv CO2条件下, 相比于单培养体系, 除了共培养体系中的K值和进入指数生长期的时间显著降低(P < 0.05) 外, r和Tp值也显著性降低(P < 0.05)。
在2000ppmv CO2条件下, 共培养体系中的盐生杜氏藻和米氏凯伦藻的生长与单培养体系中的相比也发生了明显的变化(图 3, 表 3)。通过比较发现, 与单培养体系相比, 共培养体系中盐生杜氏藻在2000ppmv CO2条件下各种群参数的变化趋势与390ppmv CO2条件下的变化趋势相似。与单培养体系相比, 共培养体系中米氏凯伦藻K值、Tp值和进入指数生长期的时间显著降低(P < 0.05), 而r和进入静止期的时间均未发生显著性变化(P > 0.05)。
培养过程中, 混合培养体系的pH变化如图 3c所示, 结果表明, 培养体系中的pH随着培养天数和藻细胞密度的增加而增加。
为了进一步确定二氧化碳增加导致的海水酸化对两种海洋微藻种间竞争关系的影响, 根据Lotka-Volterra双藻竞争模型计算出抑制参数(表 4), 结果表明, 在390ppmv CO2条件下, Kk > KD/β, KD > KK/α, 米氏凯伦藻和盐生杜氏藻在竞争中可能出现平衡, 但这种平衡是不稳定的; 然而在1000ppmv和2000ppmv CO2条件下得到不同的结果, Kk > KD/β, KD < KK/α, 米氏凯伦藻在竞争中占据优势。
| pCO2(ppmv) | α | β | 优势种 |
| 390 | 1.37 | 1.13 | 可能出现平衡, 但是这种平衡是不稳定的 |
| 1000 | 0.80 | 1.43 | 米氏凯伦藻在竞争中占有优势 |
| 2000 | 0.74 | 1.36 | 米氏凯伦藻在竞争中占有优势 |
不同二氧化碳浓度下, 盐生杜氏藻在米氏凯伦藻细胞过滤液中的生长曲线如图 4a所示。结果表明, 米氏凯伦藻的细胞过滤液能使盐生杜氏藻的生长受到抑制, 差异极其显著(P < 0.05), 说明米氏凯伦藻滤液中存在着抑制另一种微藻生长的化感物质。另外, 通过比较不同二氧化碳浓度下盐生杜氏藻在米氏凯伦藻细胞过滤液中的生长情况, 发现1000ppmv和2000ppmv CO2条件下, 盐生杜氏藻的藻细胞密度显著低于390ppmv CO2条件下的藻细胞密度, 说明高浓度二氧化碳条件下, 米氏凯伦藻细胞过滤液对盐生杜氏藻的抑制作用更强。米氏凯伦藻细胞过滤液培养盐生杜氏藻体系的pH变化如图 4b所示, 结果表明, 培养体系中的pH随着培养天数和藻细胞密度的增加而增加。
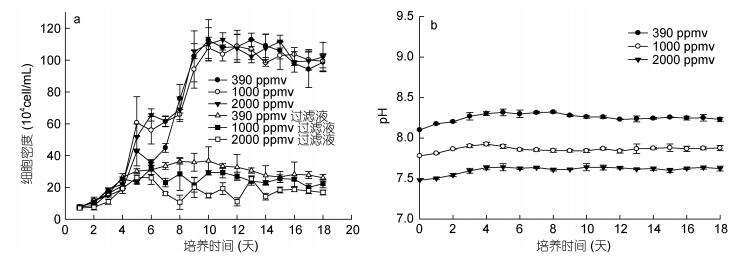 |
| 图 4 不同二氧化碳浓度下盐生杜氏藻在米氏凯伦藻细胞过滤液中的生长曲线(a)及pH变化趋势(b) Fig. 4 The growth curves of Dunaliella salina in filtrates medium of Karenia mikimotoi (a) and the pH trend (b) at different pCO2 |
随着大气中二氧化碳浓度的不断升高, 表层海水的pH将不断下降, 海水中的碳酸盐系统将发生巨大的变化(Gattuso et al, 1999; Caldeira et al, 2003)。未来的海水酸化必将对生存其中的海洋生物造成影响, 尤其是生存在表层海水的浮游植物(高坤山, 2011)。实验过程中培养体系中的pH均随着培养天数和藻细胞密度的增加而升高, 这与Zou(2005) 的结果相同。藻细胞的大量繁殖必定会吸收海水中更多的无机碳(CO2和HCO3-), 海水中CO2减少, 必定会导致pH的升高; 另外, 大部分藻类可以通过胞外碳酸酐酶水解HCO来满足光合作用对无机碳的需求, 而HCO3-水解生成CO2的同时也增加了海水中的OH-, 因此藻细胞吸收利用HCO3-也会导致海水中的pH升高。藻类的其他生理过程(例如NO3-的吸收)也会使海水中的pH值升高(Axelsson, 1988)。另外, 藻类在生长的过程中会向外分泌某些溶解性有机物, 而这些有机物也将会改变海水中的pH。
目前已经有大量研究表明, 二氧化碳升高导致的海水酸化将会使得颗石藻和珊瑚等钙化生物表面的钙质溶解, 降低钙化生物的钙化作用, 而针对非钙化生物的研究相对较少。已有研究表明, 二氧化碳浓度升高将下调浮游植物的无机碳浓缩机制, 但对其光合作用和生长的效应不尽相同, 存在种间差异性, 或促进(Wu et al, 2010; Low-D Carie et al, 2011), 或无影响(Chen et al, 2003; Fu et al, 2007), 或负面效应(Montechiaro et al, 2010; Gao et al, 2012)。本研究结果发现, 单独培养体系中, 二氧化碳浓度升高对两种微藻的种群增长的影响既有相似性, 同时又存在一定的差异性。二氧化碳升高对米氏凯伦藻和盐生杜氏藻进入指数生长期和静止期的时间均无显著性影响。然而, 米氏凯伦藻最大环境负载能力显著增加, 而对进入拐点的时间(Tp)、内禀增长率(r)无显著性影响。对盐生杜氏藻而言, 二氧化碳浓度升高降低了盐生杜氏藻的Tp和r, 对最大环境负载能力无显著影响。高浓度CO2明显促进了米氏凯伦藻的生长, 最终导致了最大环境负载能力显著提高, 这可能是由于高浓度CO2条件下更多的得无机碳通过被动扩散进入细胞, 进而减少了在无机碳获取方面消耗的能量所导致的(Wu et al, 2010)。然而, CO2对生长的促进作用并没有在盐生杜氏藻中得以体现, 其最大环境负载能力未发生显著变化并且内禀增长率显著降低, 其原因可能是CO2升高在增加了光合固碳底物得同时会引起海水中的pH值降低, 细胞需要消耗更多的能量来维持酸碱平衡, 进而抵消了CO2增加对盐生杜氏藻的促进作用, 甚至产生了负面效应。浮游植物种群增长对CO2升高响应不同已被广泛报道, 周立明等(2008) 探究了三种赤潮微藻种群增长对二氧化碳浓度升高的响应, 结果表明, 三种微藻对二氧化碳浓度升高表现出不同的敏感性, 赤潮异弯藻最敏感, 塔玛亚历山大藻次之, 中肋骨条藻最不敏感; 于娟(2004) 发现, 高二氧化碳浓度促进了6种海洋微藻的生长, 随着时间的延长, 促进效果更为明显, 对二氧化碳的敏感性顺序为:塔胞藻 > 亚心形扁藻 > 小新月菱形藻 > 金藻8701 > 盐藻 > 小球藻。浮游植物的种群生长对CO2升高的响应具有显著的种间差异, 这种差异一方面归结于物种自身生理、形态和遗传等方面的特异性; 另一方面, CO2升高对浮游植物类群将会产生正、负效应, 而正负效应的净值将决定浮游植物对其的最终响应。
浮游植物对二氧化碳升高响应具有明显的种间差异性, 因此会改变目前浮游植物种群之间的竞争关系, 最终甚至会影响整个浮游植物的群落结构。本研究结果表明, 与单培养体系相比, 共培养体系中米氏凯伦藻和盐生杜氏藻的藻细胞密度均显著降低。对共培养体系中米氏凯伦藻和盐生杜氏藻生长曲线以逻辑斯蒂方程进行拟合, 结果表明, 各二氧化碳浓度下, 共培养体系中盐生杜氏藻和米氏凯伦藻的最大环境负载能力均显著小于单培养体系的值。说明共培养体系中, 两种微藻彼此间均存在抑制作用。表 4结果显示, 在390ppmv CO2条件下, Kk > KD/β, KD > KK/α, 米氏凯伦藻和盐生杜氏藻在竞争中可能出现平衡, 但这种平衡是不稳定的; 然而在1000和2000ppmv CO2条件下得到不同的结果, Kk > KD/β, KD < KK/α, 米氏凯伦藻在竞争中占据优势。综上可得, 二氧化碳浓度升高改变了米氏凯伦藻和盐生杜氏藻的种间竞争关系, 从两者间的不稳定的平衡状态到米氏凯伦藻在竞争中占据优势。
通常而言, 海洋浮游植物之间的竞争方式主要有两种, 一是通过对营养盐的消耗速率来引起种间竞争的改变的资源利用型竞争, 另一种是直接的细胞接触抑制或分泌化感物质的相互干扰性竞争(Lampert et al, 2007)。本实验是在设定的实验条件下进行的, 具有充足的营养物质、光强以及适宜的温度温度, 因此我们推断米氏凯伦藻与盐生杜氏藻并非资源利用型竞争。而且已有研究表明, 米氏凯伦藻能够分泌具有一定细胞毒性的化感物质, 这种化感物质的分泌能够对其他海洋生物造产生一定的毒性效应(周成旭等, 2007)。本研究中, 在营养物质充足的情况下, 米氏凯伦藻细胞过滤液对盐生杜氏藻的生长产生了明显的抑制, 说明米氏凯伦藻是通过向滤液中分泌化感物质从而抑制了盐生杜氏藻的种群生长, 另外, 藻细胞间的直接接触以及细胞内所含的活性物质也会帮助其在竞争中占据更大的优势。另外, 通过比较不同二氧化碳浓度下的米氏凯伦藻去藻过滤液对盐生杜氏藻的抑制作用, 结果发现, 高浓度二氧化碳条件下米氏凯伦藻的无细胞过滤液对盐生杜氏藻的抑制程度显著大于低浓度二氧化碳条件下的抑制程度。已有研究表明, 化感作用效果与藻细胞密度成正相关关系(Granéli et al, 2003), 藻细胞密度越大时, 分泌的化感物质较多, 其毒性作用总体效果就越强。而单培养体系中, 高浓度条件下培养的米氏凯伦藻藻细胞密度显著升高, 因此我们可以推测, 高浓度二氧化碳条件下米氏凯伦藻的竞争优势是由于藻细胞密度升高引起的单位体积培养液中化感物质含量升高而导致的。另外, 高浓度二氧化碳条件下, 单位细胞分泌化感物质增多可也能是导致米氏凯伦藻对盐生杜氏藻抑制程度增加的原因。徐金涛等(2016) 研究表明, 二氧化碳浓度升高显著提高了塔玛亚历山大藻分泌的氨基甲酸酯类毒素(GTX1、GTX4), 从而改变了藻细胞的整体毒性作用。
虽然本实验的结果表明海洋酸化条件下米氏凯伦藻去藻过滤液对杜氏盐藻的抑制作用更明显, 但是并没有分析米氏凯伦藻所分泌的化感物质的具体种类和数量以及对海洋酸化的响应。因此, 进一步的实验需探究海洋酸化条件下对米氏凯伦藻分泌化感物质种类和数量上的变化情况, 以期为全面评估未来海洋酸化条件下米氏凯伦藻赤潮的危害提供理论根据。另外, 藻类的生存环境非常复杂, 藻类的关键生理过程的一些微小的变化都可能是几个环境因子(如光强, 营养盐等)共同作用的结果, 并非单因子效应。因此, 在研究海洋酸化的效应的同时, 应将海洋酸化与温度升高、营养盐限制、光强增加以及UV-B辐射相结合, 进一步探讨海洋酸化和其他环境因子对海洋浮游植物的复合效应。
4 结论(1) 二氧化碳升高导致的海洋酸化改变了米氏凯伦藻和盐生杜氏藻的种群生长, 两种微藻种群生长对二氧化碳升高的响应, 既有相似性, 同时又存在一定的差异性。二氧化碳升高对米氏凯伦藻和盐生杜氏藻进入指数生长期和静止期的时间均无显著性影响。然而, 米氏凯伦藻最大环境负载能力显著增加, 而对进入拐点的时间(Tp)、内禀增长率(r)无显著性影响。对盐生杜氏藻而言, 二氧化碳浓度升高降低了盐生杜氏藻的Tp和r, 对最大环境负载能力无显著影响。
(2) 二氧化碳升高改变了米氏凯伦藻和盐生杜氏藻的种间竞争关系, 竞争表现出向有利于米氏凯伦藻的方向发展。
(3) 米氏凯伦藻分泌的化感物质对盐生杜氏藻产生了抑制作用, 并且二氧化碳浓度升高加剧了这种抑制效应。
| 于娟, 2004. 海洋微藻对UV-B辐射增强与CO2加富共同作用的复合响应. 青岛: 中国海洋大学博士学位论文 |
| 李春雷, 2009. 海洋微藻对CO2加富响应的实验生态学研究. 中国海洋大学博士学位论文 |
| 周立明, 肖慧, 唐学玺, 2008. CO2加富对3种赤潮微藻种群增长的影响. 海洋环境科学, 27(4): 317–319 |
| 周成旭, 傅永静, 严小军, 2007. 4种典型有害赤潮原因种的溶血特性研究. 生态毒理学报, 2(1): 78–82 |
| 徐金涛, 庞敏, 马新, 等, 2016. CO2加富对塔玛亚历山大藻叶绿素荧光参数及产毒的影响. 海洋与湖沼, 47(3): 557–563 |
| 高坤山, 2011. 海洋酸化正负效应:藻类的生理学响应. 厦门大学学报(自然科学版), 50(2): 411–417 |
| 斯丹, 张拿慧, 刘桂群, 等, 2016. 不同氮磷比对米氏凯伦藻和中肋骨条藻种群竞争的影响. 海洋湖沼通报,(5): 118–124 |
| 董文隆, 王仁君, 陈田田, 等, 2011. UV-B辐射对米氏凯伦藻生长及其某些生理特性的影响. 曲阜师范大学学报(自然科学版), 37(4): 93–98 |
| Axelsson L, 1988. Changes in pH as a measure of photosynthesis by marine macroalgae. Marine Biology, 97(2): 287–294 DOI:10.1007/BF00391314 |
| Caldeira K, Wickett M E, 2003. Oceanography:anthropogenic carbon and ocean pH. Nature, 425(6956): 365–365 DOI:10.1038/425365a |
| Chen X W, Gao K S, 2003. Effect of CO2 concentrations on the activity of photosynthetic CO2 fixation and extracelluar carbonic anhydrase in the marine diatom Skeletonema costatum. Chinese Science Bulletin, 48(23): 2616–2620 DOI:10.1360/03wc0084 |
| Doney S C, Fabry V J, Feely R A, et al, 2009. Ocean acidification:the other CO2 problem. Annual Review of Marine Science, 1(1): 169–192 DOI:10.1146/annurev.marine.010908.163834 |
| Fu F X, Warner M E, Zhang Y H, et al, 2007. Effects of increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (Cyanobacteria). Journal of Phycology, 43(3): 485–496 DOI:10.1111/jpy.2007.43.issue-3 |
| Gao K, Aruga Y, Asada K, et al, 1993. Calcification in the articulated coralline alga Corallina pilulifera, with special reference to the effect of elevated CO2 concentration. Marine Biology, 117(1): 129–132 DOI:10.1007/BF00346434 |
| Gao K S, Helbling E W, H der D P, et al, 2012. Responses of marine primary producers to interactions between ocean acidification, solar radiation, and warming. Marine Ecology Progress Series, 470: 167–189 DOI:10.3354/meps10043 |
| Gattuso J P, Allemand D, Frankignoulle M, 1999. Photosynthesis and calcification at cellular, organismal and community levels in coral reefs:a review on interactions and control by carbonate chemistry. American Zoologist, 39(1): 160–183 DOI:10.1093/icb/39.1.160 |
| Granéli E, Johansson N, 2003. Increase in the production of allelopathic substances by Prymnesium parvum cells grown under N-or P-deficient conditions. Harmful Algae, 2(2): 135–145 DOI:10.1016/S1568-9883(03)00006-4 |
| Havenhand J N, Buttler F R, Thorndyke M C, et al, 2008. Near-future levels of ocean acidification reduce fertilization success in a sea urchin. Current Biology, 18(15): R651–R652 DOI:10.1016/j.cub.2008.06.015 |
| He D, Liu J, Hao Q, et al, 2016. Interspecific competition and allelopathic interaction between Karenia mikimotoi and Dunaliella salina in laboratory culture. Chinese Journal of Oceanology and Limnology, 34(2): 301–313 DOI:10.1007/s00343-016-4320-1 |
| Hein M, Sand-Jensen K, 1997. CO2 increases oceanic primary production. Nature, 388(6642): 526–527 |
| Hughes L, 2000. Biological consequences of global warming:is the signal already apparent. Trends in Ecology & Evolution, 15(2): 56–61 |
| Kurihara H, 2008. Effects of CO2-driven ocean acidification on the early developmental stages of invertebrates. Marine Ecology Progress Series, 373(1): 275–284 |
| Lampert W, Sommer U, 2007. Limnoecology. New York: Oxford University Press, 89-147 |
| Low-Décarie E, Fussmann G F, Bell G, 2011. The effect of elevated CO2 on growth and competition in experimental phytoplankton communities. Global Change Biology, 17(8): 2525–2535 DOI:10.1111/j.1365-2486.2011.02402.x |
| Montechiaro F, Giordano M, 2010. Compositional homeostasis of the dinoflagellate Protoceratium reticulatum grown at three different p CO2. Journal of Plant Physiology, 167(2): 110–113 DOI:10.1016/j.jplph.2009.07.013 |
| Munday P L, Dixson D L, Donelson J M, et al, 2009. Ocean acidification impairs olfactory discrimination and homing ability of a marine fish. Proceedings of the National Academy of Sciences of the United States of America, 106(6): 1848–1852 DOI:10.1073/pnas.0809996106 |
| Riebesell U, Zondervan I, Rost B, et al, 2000. Reduced calcification of marine plankton in response to increased atmospheric CO2. Nature, 407(6802): 364–367 DOI:10.1038/35030078 |
| Solomon S, Plattner G K, Knutti R, et al, 2009. Irreversible climate change due to carbon dioxide emissions. Proceedings of the National Academy of Sciences of the United States of America, 106(6): 1704–1709 DOI:10.1073/pnas.0812721106 |
| Volterra V, 1926. Fluctuations in the abundance of a species considered mathematically. Nature, 118(2972): 558–560 DOI:10.1038/118558a0 |
| Wu Y, Gao K, Riebesell U, 2010. CO2-induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum. Biogeosciences, 7(9): 2915–2923 DOI:10.5194/bg-7-2915-2010 |
| Yang G Y, Gao K S, 2012. Physiological responses of the marine diatom Thalassiosira pseudonana to increased pCO2 and seawater acidity. Marine Environmental Research, 79: 142–151 DOI:10.1016/j.marenvres.2012.06.002 |
| Zou D H, 2005. Effects of elevated atmospheric CO2 on growth, photosynthesis and nitrogen metabolism in the economic brown seaweed, Hizikia fusiforme (Sargassaceae, Phaeophyta). Aquaculture, 250(3-4): 726–735 DOI:10.1016/j.aquaculture.2005.05.014 |
 2017, Vol. 48
2017, Vol. 48


