
中国海洋湖沼学会主办。
文章信息
- 王赛君, 吴湘, 王奕棉, 楼雯靓, 卢雨芳. 2017.
- WANG Sai-Jun, WU Xiang, WANG Yi-Mian, LOU Wen-Jing, LU Yu-Fang. 2017.
- 水生入侵植物对常见水华的抑藻效应及其影响机理
- INHIBITORY EFFECT OF INVASIVE AQUATIC PLANTS ON COMMON ALGAE BLOOM SPECIES AND THE UNDERLYING PHYSIOLOGICAL MECHANISMS
- 海洋与湖沼, 48(4): 798-805
- Oceanologia et Limnologia Sinica, 48(4): 798-805.
- http://dx.doi.org/10.11693/hyhz20161200294
-
文章历史
- 收稿日期:2016-12-31
- 收修改稿日期:2017-05-11
随着水体富营养化程度的加剧, 频繁暴发的水华严重威胁水环境安全并成为全球关注的水环境问题(Heisler et al, 2008; O′Neil et al, 2012)。因此, 寻找高效、安全、简便的抑藻方法已成为水环境保护领域一个前沿和热点的研究课题。利用水生植物产生的化感物质控制有害藻类的生长是一种较有前景的生态抑藻方法(Xiao et al, 2010), 具有效果好、费用低、材料天然易得、不易造成二次污染等优点。目前已发现多种水生植物的化感物质对藻类生长具有一定抑制作用(Gross, 2003; Wang et al, 2011; Bhrs et al, 2012), 其中水生入侵植物由于具备生物量大、生长迅速、次生代谢物质更加丰富等特点, 使得利用其化感物质进行藻类控制研究具有更好的应用前景, 且利于入侵植物的资源化利用, 减少其对生态环境的危害。因此, 将水生入侵植物及其产生的化感物质应用于水华控制研究具有重要的环境和生态意义。
研究发现, 天然富营养化水体中频繁发生的水华往往由多种藻类共同引发, 且不同水域的优势藻种也各不相同, 而化感物质具有一定的选择性和专一性(Li et al, 2005), 往往只对一种或少数藻种有较强的化感抑制作用, 对其他藻种抑制效果一般或者无抑制(郭长城等, 2009)。因此, 根据不同水域的水华组成特征, 选择具有代表性的水华优势藻种作为研究对象, 研究不同类型水生入侵植物化感物质的选择性抑藻作用及其影响机理, 对推进水生入侵植物化感作用的高效实际应用具有重要意义。此外, 水生入侵植物化感物质的选择性抑藻作用差异不仅与藻种自身特性以及植物种类有关, 还与化感作用的方式有关, 针对不同藻种筛选高效抑藻的化感作用方式也是利用水生入侵植物化感物质控制水华的重要前提和基础。同时还应注意在进行实际水体水华控制时, 化感物质对除藻类以外的其他水生生物的生态安全性的影响。
基于上述研究基础, 本文选取3种我国常见的水生入侵植物, 即水浮莲(Pistia stratiotes)、凤眼莲(Eichhornia crassipes)、空心莲子草(Alternanthera philoxeroides)作为研究对象, 研究不同的植物化感作用方式(植物种植水抑藻、植物粗提物抑藻)对绿藻门的蛋白核小球藻(Chlorella pyrenoidosa)、硅藻门的梅尼小环藻(Cyclotella meneghiniana)、蓝藻门的铜绿微囊藻(Microcystis aeruginosa)等3种常见水华微藻的生长抑制作用差异, 阐明水生入侵植物化感作用的选择性抑藻规律, 并确定其最佳化感作用方式。在此基础上, 进一步深入研究水生入侵植物化感作用对选择性受抑最强的藻种生理生化指标的影响, 以此推测选择性化感抑藻的作用靶点。最后考察水生植物化感作用的生态安全性, 为其在水华频发水体实行高效、安全的实际应用提供理论与实验依据。
1 材料与方法 1.1 实验材料 1.1.1 水生入侵植物水浮莲、凤眼莲、空心莲子草均采自湖州当地农村野外河道, 并用以下方法对这3种水生入侵植物进行处理以获取实验材料:
① 种植水的制备:将3种水生入侵植物的全株洗净, 吸干表面水分, 各称取40g置于4000mL的Hoaglangd’s营养液中进行培养(鲜啟鸣等, 2005), 3天后过滤培养液作为各种植物的种植水(10g/L), 4℃低温储存备用。
② 植物粗提物的提取:采用乙酸乙酯溶剂、索氏提取法提取各植物的粗提物(Wu et al, 2013;吴湘等, 2014)。称取20g干植物体(粉碎至50目), 置于500mL锥形瓶中, 加入400mL乙酸乙酯, 超声波(KQ-100DB型数控超声波清洗机, 昆山市超声仪器有限公司)常温提取1h。提取结束后, 用滤纸滤去提取液中的残渣, 并通过0.22μm有机系滤膜(购自上海亚兴净化材料厂)除去颗粒物的干扰, 之后利用旋转蒸发仪(RE-52系列, 购自上海亚荣生化仪器厂)以100r/min转速在65℃下除去溶剂, 获得浸膏并称重, 最后用二甲基亚砜(dimethyl sulfoxide, DMSO; 浓度低于1%时对微藻生长无影响)进行定容溶解(Ball et al, 2001), 以10g/L的浓度定容至DMSO溶液中备用。
1.1.2 藻种蛋白核小球藻(FACHB-415)、梅尼小环藻(FACHB-1654)、铜绿微囊藻(FACHB-315) 由中国科学院水生生物研究所淡水藻种库提供, 实验前铜绿微囊藻和蛋白核小球藻采用BG-11培养基预培养9-10天, 梅尼小环藻采用CSI培养基预培养7-8天, 使之处于对数增长期。
1.2 实验设计与方法 1.2.1 实验设计① 不同水生入侵植物种植水对不同藻类增殖的影响:将水浮莲、凤眼莲、空心莲子草的种植水分别以体积比为20︰1的量(鲜啟鸣等, 2005)等量加入蛋白核小球藻(初始光密度OD750为0.126)、梅尼小环藻(初始OD750为0.630)、铜绿微囊藻(初始OD750为0.083) 的培养液中, 共培养7天, 每天通过测定藻细胞的OD750和叶绿素a(chl a)含量的变化, 研究不同水生入侵植物种植水对不同藻类生长的影响及其选择性抑藻作用。
② 不同水生入侵植物粗提物对不同藻类生长的影响研究:将水浮莲、凤眼莲、空心莲子草的粗提物分别等量加入蛋白核小球藻(初始OD750为0.583)、梅尼小环藻(初始OD750为0.457)、铜绿微囊藻(初始OD750为0.172) 的培养液中, 使其最终浓度均为0.1g/L, 在培养温度为25℃、光照条件为2000lx、昼夜比设置为12h︰12h的条件下共培养7天, 每天通过测定各平行组藻细胞的OD750和chl a含量变化, 研究不同水生入侵植物粗提物对不同藻类生长的影响及其选择性抑藻作用。
③ 水生入侵植物对选择性抑制藻类的生长影响机理研究:在实验①和② 的实验结果基础上, 进一步研究水生入侵植物的最佳抑藻方式对其选择性抑制作用最强的藻种的生理生化指标的影响, 以此阐明水生入侵植物对选择性抑制藻种的生长影响机理。
1.2.2 实验方法① 藻细胞光密度值(OD750)的测定:取定量的藻细胞培养液, 采用分光光度计(752PC型, 购自上海光谱仪器有限公司)测定其OD750值。
② 藻细胞chl a含量的测定:用真空抽滤泵抽滤收集藻细胞后, 加入20mL 90%丙酮, 在4℃避光抽提24h, 之后4000r/min离心10min, 取上清液, 以90%的丙酮为空白, 测定其吸光度(A664), chl a的含量依据以下公式进行计算:
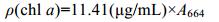
③ 生理生化指标的测定:主要包括藻细胞的光合色素(以叶绿体色素含量为代表)、呼吸速率、丙二醛含量(malondialdehyde, MDA)、蛋白质含量和超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)等抗氧化酶的活性。各指标测定方法参考《植物生理生化实验原理与技术(第3版)》(王学奎等, 2015), 胞外藻毒素含量测定方法参照吴颖川等(2016)。采用的具体方法为:叶绿体色素含量测定采用分光光度法; 蛋白质含量测定采用紫外吸收法(Varian紫外分光光度计, Cary50); MDA含量测定采用硫代巴比妥酸(2-Thiobarbituric acid, TBA)法; 呼吸速率测定采用小篮子法(广口瓶法); CAT活性测定采用高锰酸钾滴定采用法; POD活性测定采用愈创木酚法; SOD活性测定用氮蓝四唑法; 藻毒素含量测定采用ELISA试剂盒(购于中国科学院水生生物研究所)。
1.3 数据统计与分析实验所有样品均平行测定3次, 结果取其均值。实验数据利用Microsoft Excel 2016进行单因子方差统计分析和制图。
2 结果与讨论 2.1 不同水生入侵植物的两种化感作用方式对常见水华藻种生长的影响差异 2.1.1 对蛋白核小球藻生长的影响差异由图 1可知, 水浮莲种植水对蛋白核小球藻的生长有一定促进作用, 而水浮莲粗提物对蛋白核小球藻的生长表现出较强抑制作用。这可能是因为水生入侵植物抑藻作用的强弱与其分泌化感物质的浓度密切相关(Nakai et al, 1999), 由此推测水浮莲化感物质的水溶性较差, 导致其种植水中所含化感物质浓度较低, 对蛋白核小球藻的生长反而起促进作用, 而水浮莲化感物质易被乙酸乙酯溶解提取, 因此其植物粗提物表现出较强的抑藻作用。根据图 1还可看出, 凤眼莲、空心莲子草种植水对蛋白核小球藻的抑藻效果都要显著优于其植物粗提物:共培养第7天空心莲子草种植水处理组的OD750值下降64.12%, chl a含量下降68.76%, 而凤眼莲种植水处理组的OD750下降值则高达77.32%, chl a含量下降86.84%, 后者的抑藻效果相对更好。由此可见这两种植物分泌的化感物质水溶性都较好, 因种植水中所含化感物质浓度较高, 使得其对蛋白核小球藻的生长抑制作用较强。
 |
| 图 1 不同水生入侵植物的两种化感作用方式对蛋白核小球藻的生长抑制作用差异 Fig. 1 The growth inhibition effects for two allelopathic methods of different invasive aquatic plants on Chlorella pyrenoidosa 注: a、b为水生入侵植物种植水处理组, c、d为水生入侵植物粗提液处理组。 |
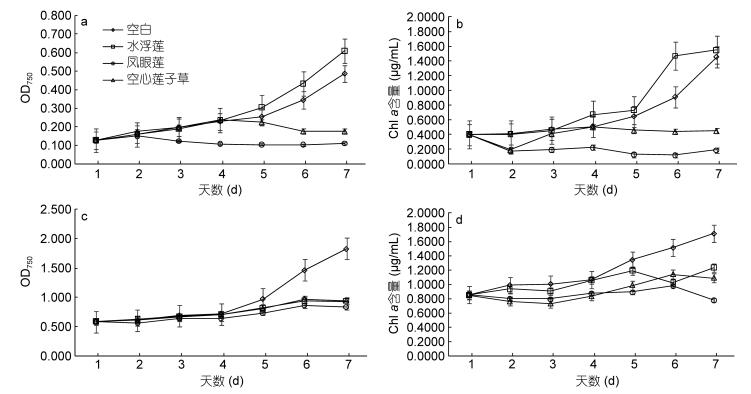
水浮莲粗提物中有效的化感组分不稳定, 易被分解转化而浓度降低, 或者其中一部分被梅尼小环藻吸收并转化为其同化产物(门玉洁等, 2006;李庆华等, 2010)。凤眼莲根部含有抑藻活性物质, 且乙酸乙酯对其萃取作用最佳(张振业等, 2013)。chl a含量的减少可能与活性氧的伤害有关(唐学玺等, 1998), 在化感物质的胁迫下, 梅尼小环藻叶绿体产生的有害活性氧无法及时清除, 使叶绿体膜受到氧化, 基质外露, 叶绿体代谢功能紊乱, 从而导致chl a含量降低(李睿等, 2006)。根据图 2可以看出, 水浮莲种植水的抑藻效果强于凤眼莲和空心莲子草的种植水, 凤眼莲粗提物的抑藻效果强于水浮莲和空心莲子草的粗提物。相比较而言, 共培养第7天水浮莲种植水处理组的OD750值下降65.37%, chl a含量下降64.64%, 而凤眼莲粗提物处理组的OD750值仅下降43.16%, chl a含量下降57.50%, 由此说明水浮莲种植水中植物分泌的化感物质对梅尼小环藻的选择性抑藻作用最强, 这与可促进蛋白核小球藻生长的结果(图 1) 不同, 可能是因为不同藻种对水生入侵植物分泌的化感物质的敏感程度不同。
 |
| 图 2 不同水生入侵植物的两种化感作用方式对梅尼小环藻的生长抑制作用差异 Fig. 2 The growth inhibition effects for two allelopathic methods of different invasive aquatic plants on Cyclotella meneghiniana 注: a、b为水生入侵植物种植水处理组, c、d为水生入侵植物粗提液处理组。 |
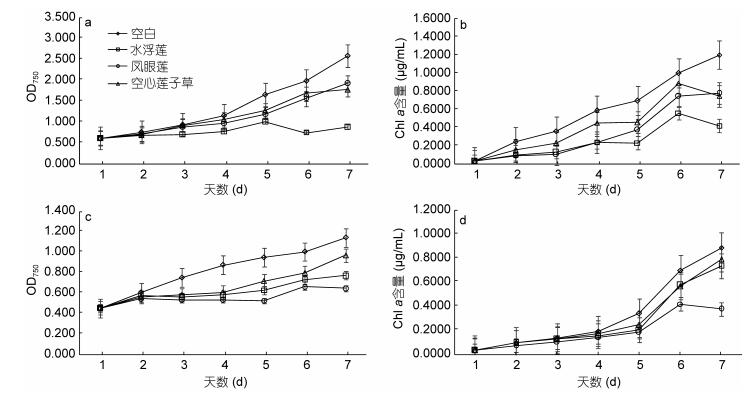
不同植物所分泌的物质对铜绿微囊藻的生长抑制作用影响差异很大(李磊等, 2007)。实验后期实验组OD750明显下降, 藻体开始黄化失绿, chl a含量呈明显下降趋势, 这可能是因为随着化感物质在藻细胞内逐渐积累, 藻细胞开始破壁, 大量死亡。由图 3可见, 凤眼莲粗提物的抑藻效果比水浮莲和空心莲子草好, 最高OD750下降值可达79.08%, chl a含量下降90.20%。投加水浮莲种植水实验组共培养第7天OD750值下降58.18%, chl a含量下降84.44%;投加凤眼莲种植水实验组共培养第7天OD750值下降69.09%, chl a含量下降90.91%;投加空心莲子草种植水实验组共培养第7天OD750值下降78.19%, chl a含量下降96.61%, 由此可知, 空心莲子草种植水对铜绿微囊藻的生长抑制效果最佳。
 |
| 图 3 不同水生入侵植物的两种化感作用方式对铜绿微囊藻的生长抑制作用差异 Fig. 3 The growth inhibition effects for two allelopathic methods of different invasive aquatic plants on Microcystis aeruginosa 注: a、b为水生入侵植物种植水处理组, c、d为水生入侵植物粗提液处理组。 |
综上所述, 3种水生入侵植物的种植水对3种水华藻种的生长抑制作用总体好于粗提物, 而种植水的化感作用表现出选择性抑藻效果:水浮莲、凤眼莲、空心莲子草的种植水分别对梅尼小环藻、蛋白核小球藻、铜绿微囊藻的生长抑制效果最佳, 其中以空心莲子草种植水对铜绿微囊藻的选择性抑制作用最为显著。因此, 下文将着重陈述空心莲子草种植水对铜绿微囊藻生理生化指标的影响的研究。
2.2 空心莲子草种植水对铜绿微囊藻生理生化指标的影响 2.2.1 对光合色素的影响藻细胞中的叶绿体色素含量往往与藻细胞的生长状况及其光合作用密切相关(何池全等, 1999)。由图 4可见, 对照组(空白组)的叶绿体色素含量在实验过程中存在波动现象, 而实验组的趋势与对照组基本一致, 但相比对照组出现了明显的下降, 到第7天下降88.12%, 这与实验过程中观察到藻液逐渐变澄清的现象一致。数据处理的结果表明, 在实验过程中空心莲子草种植水对铜绿微囊藻叶绿体色素含量的影响非常明显, 此结果与实验组铜绿微囊藻光合作用受到明显抑制的现象吻合。
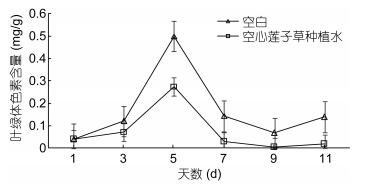 |
| 图 4 空心莲子草种植水对铜绿微囊藻叶绿体色素含量的影响 Fig. 4 Influences of planting water of Alternanthera philoxeroides on the chloroplast pigment content of M. aeruginosa |
由图 5可见, 培养11天后对照组铜绿微囊藻的呼吸速率由0.040mgCO2/ (mL·h)提高到0.137mgCO2/(mL·h), 而实验组则下降到0.017mgCO2/(mL·h), 且实验组在加入空心莲子草种植水第5天呼吸速率明显提高, 几乎为对照组的2倍。呼吸速率的急剧增加是铜绿微囊藻细胞受到胁迫的一种表现(王立新等, 2004;李锋民等, 2007), 可见种植水中的化感物质对藻细胞形成了伤害。第7天实验组呼吸速率明显下降, 此时藻细胞已经开始解体, 而对照组藻细胞呼吸速率处于稳定增长期, 到第11天实验组藻细胞呼吸速率下降87.59%。
 |
| 图 5 空心莲子草种植水对铜绿微囊藻呼吸速率的影响 Fig. 5 Influences of planting water of A. philoxeroides on the respiration rate of M. aeruginosa |
当藻细胞受到外界胁迫时, 细胞内产生大量活性氧, 破坏膜结构, 使膜透性消失, 导致藻细胞抗氧化酶活性上升, 但当细胞内氧自由基浓度超过一定范围, 抗氧化酶不能及时清除过量的氧自由基时, 导致藻细胞大量死亡, 抗氧化酶活性降低(Lu et al, 2014)。由图 6a-c可知, 对照组藻细胞的抗氧化酶活性在实验过程中存在一定波动, 但总体上处于平稳状态, 而实验组藻细胞POD活性第5天相比对照组提高2倍以上, 随后开始下降, 到第9天急剧下降54.93%; CAT活性在实验前期一直高于对照组, 到第7天急剧下降, 第9天接近为0; SOD活性则呈现出先升后降的趋势, 到第11天下降了68.50%。POD、CAT、SOD活性在处理前期增大是因为铜绿微囊藻在种植水中受到化感物质的胁迫而做出的应激反应, 而在后期下降说明藻细胞已经受到实质性的损害, 大量藻细胞死亡。MDA是脂质过氧化的产物, 其形成和积累量可作为细胞膜结构损伤、藻细胞受胁迫程度的一种标志(唐萍等, 2000)。SOD活性对于防止膜脂过氧化连锁反应具有重要作用, 由图 6c-d可知, 当SOD活性最大时MDA含量急剧下降, 实验组MDA含量在第3天较第1天升高了8.26%, 而第3天后其显著降低可能与此时藻细胞膜结构受到严重损伤相关, 实验过程中对照组MDA含量未见大幅度波动。
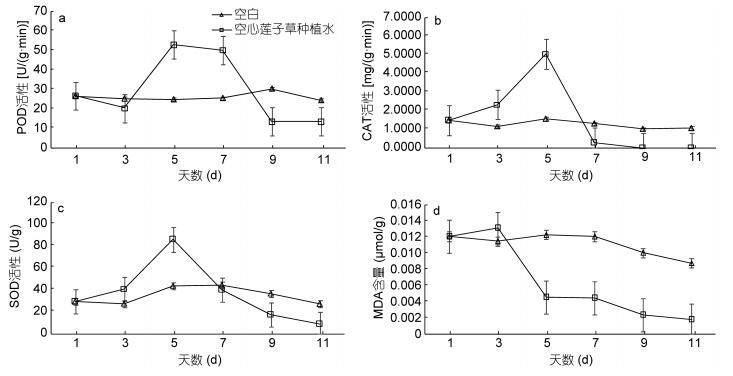 |
| 图 6 空心莲子草种植水对铜绿微囊藻POD活性(a)、CAT活性(b)、SOD活性(c)、MAD含量(d)的影响 Fig. 6 Influences of planting water of A. philoxeroides on the activities of POD (a), CAT (b), SOD (c) and MAD (d) of M. aeruginosa |
藻细胞中含有多种蛋白质, 包括参与代谢的各种酶、光合系统蛋白以及藻胆蛋白等。在受到环境胁迫时, 细胞可能会合成逆境蛋白用以对抗环境, 细胞结构受到不可逆破坏, 蛋白质积累减少甚至停止, 同时参与各种生理活动的酶合成受到抑制或被大量分解, 导致细胞代谢功能紊乱, 直至细胞死亡(周晓见等, 2011)。由图 7可见, 对照组藻细胞的蛋白质含量在整个实验过程中呈上升趋势, 而实验组藻细胞中蛋白质含量在培养前5天略有上升, 而后下降, 到第11天下降99.31%, 藻细胞结构严重受损, 表明铜绿微囊藻细胞内的蛋白质合成及水解系统对空心莲子草种植水中的化感物质相当敏感。
 |
| 图 7 空心莲子草种植水对铜绿微囊藻蛋白质含量的影响 Fig. 7 Influences of planting water of A. philoxeroides on the protein content of M. aeruginosa |
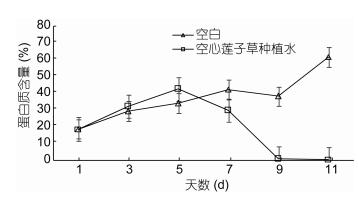
到第11天测得对照组胞外藻毒素, 即微囊藻毒素(Microcystins, MCs)的含量为0.7308μg/L, 实验组胞外MCs含量为0.7944μg/L, 实验组仅比对照组增加8.69%, 此结果表明投加空心莲子草种植水后铜绿微囊藻培养液中藻毒素含量并无明显增加, 这可能是因为在空心莲子草种植水所含化感物质的影响下, 铜绿微囊藻藻细胞的破壁率并不高, 处理后仅有少部分细胞破裂导致胞外藻毒素含量略微增加, 说明空心莲子草种植水并不是通过裂解藻细胞实现抑藻, 因此具有较好的生态安全性, 不会对环境造成二次污染。
3 结论(1) 3种水生入侵植物种植水对3种常见水华藻种表现出选择性抑藻作用, 水浮莲、凤眼莲、空心莲子草的种植水分别对梅尼小环藻、蛋白核小球藻、铜绿微囊藻增殖产生较强的抑制效果, 其中空心莲子草种植水对铜绿微囊藻的抑制作用最强;
(2) 3种水生入侵植物粗提物对3种常见水华藻种也表现出较好的抑制作用, 其中以凤眼莲粗提物的效果最好。但是总体而言, 水生入侵植物粗提物的抑藻效果不及种植水;
(3) 铜绿微囊藻与空心莲子草种植水共培养过程中, 藻细胞的叶绿体色素含量、呼吸速率、POD活性、CAT活性、SOD活性、MDA积累量、蛋白质含量均受到显著影响, 共培养11天后铜绿微囊藻培养液即出现藻体黄化、细胞结构进行性损伤等明显的胁迫和伤害现象。
| 门玉洁, 胡洪营, 李锋民, 2006. 芦苇化感组分对斜生栅藻Scenedesmus obliquus生长特性的影响. 生态环境, 15(5): 925–929 |
| 王立新, 吴国荣, 王建安, 等, 2004. 黑藻(Hydrilla verticillata)对铜绿微囊藻(Microcystis aeruginosa)抑制作用. 湖泊科学, 16(4): 337–342 |
| 王学奎, 黄见良, 2015. 植物生理生化实验原理与技术. 3版. 北京: 高等教育出版社, 131-286 |
| 李睿, 刘玉, 谭凤仪, 等, 2006. 双酚A对微小小环藻的毒性效应. 中山大学学报(自然科学版), 45(3): 110–113 |
| 李磊, 侯文华, 2007. 荷花和睡莲种植水对铜绿微囊藻生长的抑制作用研究. 环境科学, 28(10): 2180–2186 DOI:10.3321/j.issn:0250-3301.2007.10.005 |
| 李庆华, 郭沛涌, 田美燕, 等, 2010. 两种陆生植物浸提液对蛋白核小球藻(Chlorella pyrenoidosa)的化感作用. 浙江大学学报(理学版), 37(1): 80–86 |
| 李锋民, 胡洪营, 种云霄, 等, 2007. 芦苇化感物质EMA对铜绿微囊藻生理特性的影响. 中国环境科学, 27(3): 377–381 |
| 吴湘, 吴昊, 叶金云, 2014. 黄花水龙化感物质对铜绿微囊藻生长及藻毒素产生和释放的影响. 海洋与湖沼, 45(4): 783–788 DOI:10.11693/hyhz20130700101 |
| 吴颖川, 邹琳, 汪瑾, 等, 2016. EGCG对铜绿微囊藻的抑制效应及机制研究. 南京农业大学学报, 39(1): 78–83 DOI:10.7685/jnau.201506007 |
| 何池全, 叶居新, 1999. 石菖蒲(Acorus tatarinowii)克藻效应的研究. 生态学报, 19(5): 754–758 |
| 张振业, 2013. 凤眼莲根系提取物对铜绿微囊藻的化感抑制作用研究. 扬州: 扬州大学硕士学位论文, 1-65 |
| 周晓见, 夏洁, 靳翠丽, 等, 2011. 龙爪槐正己烷提取物对铜绿微囊藻抑制机理的研究. 安徽农业科学, 39(29): 18135–18137 DOI:10.3969/j.issn.0517-6611.2011.29.138 |
| 郭长城, 李欣, 胡洪营, 2009. 芦苇生物活性组分对小球藻生长的促进效应. 中国环境科学, 29(11): 1186–1189 DOI:10.3321/j.issn:1000-6923.2009.11.012 |
| 唐萍, 吴国荣, 陆长梅, 等, 2000. 凤眼莲根系分泌物对栅藻结构及代谢的影响. 环境科学学报, 20(3): 355–359 |
| 唐学玺, 颜挺进, 李永祺, 等, 1998. 久效磷对扁藻的损伤作用Ⅱ.叶绿素a降解与活性氧损伤的相关性. 应用生态学报, 9(6): 631–634 |
| 鲜啟鸣, 陈海东, 邹惠仙, 等, 2005. 四种沉水植物的克藻效应. 湖泊科学, 17(1): 75–80 |
| Bhrs H, Steinberg C E W, 2012. Impact of two different humic substances on selected coccal green algae and cyanobacteria-changes in growth and photosynthetic performance. Environmental Science and Pollution Research, 19(2): 335–346 DOI:10.1007/s11356-011-0564-7 |
| Ball A S, Williams M, Vincent D, et al, 2001. Algal growth control by a barley straw extract. Bioresource Technology, 77(2): 177–181 DOI:10.1016/S0960-8524(00)00148-6 |
| Gross E M, 2003. Allelopathy of aquatic autotrophs. Critical Reviews in Plant Sciences, 22(3-4): 313–339 DOI:10.1080/713610859 |
| Heisler J, Glibert P M, Burkholder J M, et al, 2008. Eutrophication and harmful algal blooms:a scientific consensus. Harmful Algae, 8(1): 3–13 DOI:10.1016/j.hal.2008.08.006 |
| Li F M, Hu H Y, 2005. Isolation and characterization of a novel antialgal allelochemical from Phragmites communis. Applied and Environmental Microbiology, 71(11): 6545–6553 DOI:10.1128/AEM.71.11.6545-6553.2005 |
| Lu Y P, Wang J, Yu Y, et al, 2014. Changes in the physiology and gene expression of Microcystis aeruginosa under EGCG stress. Chemosphere, 117: 164–169 DOI:10.1016/j.chemosphere.2014.06.040 |
| Nakai S, Inoue Y, Hosomi M, et al, 1999. Growth inhibition of blue-green algae by allelopathic effects of macrophytes. Water Science and Technology, 39(8): 47–53 |
| O'Neil J M, Davis T W, Burford M A, et al, 2012. The rise of harmful cyanobacteria blooms:the potential roles of eutrophication and climate change. Harmful Algae, 14: 313–334 DOI:10.1016/j.hal.2011.10.027 |
| Wang J, Zhu J Y, Liu S P, et al, 2011. Generation of reactive oxygen species in cyanobacteria and green algae induced by allelochemicals of submerged macrophytes. Chemosphere, 85(6): 977–982 DOI:10.1016/j.chemosphere.2011.06.076 |
| Wu X, Wu H, Chen J R, et al, 2013. Effects of allelochemical extracted from water lettuce (Pistia stratiotes Linn) on the growth, microcystin production and release of Microcystis aeruginosa. Environmental Science and Pollution Research, 20(11): 8192–8201 DOI:10.1007/s11356-013-1783-x |
| Xiao X, Chen Y X, Liang X Q, et al, 2010. Effects of Tibetan hulless barley on bloom-forming cyanobacterium (Microcystis aeruginosa) measured by different physiological and morphologic parameters. Chemosphere, 81(9): 1118–1123 DOI:10.1016/j.chemosphere.2010.09.001 |
 2017, Vol. 48
2017, Vol. 48


