
中国海洋湖沼学会主办。
文章信息
- 黄银爽, 欧林坚, 杨宇峰. 2017.
- HUANG Yin-Shuang, OU Lin-Jian, YANG Yu-Feng. 2017.
- 广东南澳岛大型海藻龙须菜与浮游植物对营养盐的竞争利用
- NUTRIENT COMPETITION BETWEEN MACROALGAE GRACILARIA LEMANEIFORMIS AND PHYTOPLANKTON IN COASTAL WATERS OF NAN'AO ISLAND, GUANGDONG
- 海洋与湖沼, 48(4): 806-813
- Oceanologia et Limnologia Sinica, 48(4): 806-813.
- http://dx.doi.org/10.11693/hyhz20170200031
-
文章历史
- 收稿日期:2017-02-16
- 收修改稿日期:2017-04-17
2. 暨南大学水生生物研究所 广州 510632;
3. 水体富营养化与赤潮防治广东普通高校重点实验室 广州 510632
2. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China;
3. Key Laboratory of Aquatic Eutrophication and Control of Harmful Algal Blooms of Guangdong Higher Education Institutes, Guangzhou 510632, China
无机态的氮(nitrogen, N)、磷(phosphorus, P)是浮游植物利用营养盐的主要形式(Burkholder et al, 2008)。一般情况下,当无机态N、P浓度较低时,浮游植物会转为利用有机形态的营养盐(Glibert et al, 2011)。浮游植物通过诱导合成胞外酶将有机物分解成其能直接利用的无机态营养盐,亮氨酸氨肽酶(leucine amino peptide, LAP)和碱性磷酸酶(alkaline phsophatase, AP)分别是水解有机态N、P的最重要的酶类(Berges et al, 2008; Duhamel et al, 2010)。海水中胞外酶活性的大小可指示浮游植物是否受到N、P胁迫及浮游植物对有机营养盐的利用情况(Dyhrman et al, 2006)。
龙须菜(Gracilaria lemaneiformis)是江蓠属(Gracilaria)的一种大型海藻。近年来,我国近海诸如广东、福建、浙江、山东和辽宁大规模发展龙须菜养殖(Yang et al, 2015a)。龙须菜养殖对周边海区环境造成的影响已成为生态学家关注的问题之一。有研究认为,龙须菜会大量吸收海水中的无机态N、P,从而降低海水中的营养盐含量(Yang et al, 2006; Mao et al, 2009)。龙须菜和浮游植物间存在竞争关系,可能通过营养竞争和他感效应抑制浮游植物的生长(雷光英等, 2010;孙颖颖等, 2011)。Lü rling等(2006) 认为营养竞争是大型海藻对浮游植物发挥抑制作用的主导因子。然而,目前关于自然海域龙须菜与浮游植物对营养盐(尤其是有机态营养盐)的竞争利用的研究鲜有报道,相关工作有待开展。
南澳岛位于广东省汕头市,其北部是我国龙须菜养殖的重要基地,龙须菜的养殖面积由2000年刚引进时的0.13hm2已经扩大到2011年的1500hm2(Yang et al, 2015a)。为了探究现场海区龙须菜对浮游植物生长的影响,本文通过分析南澳岛北部海域龙须菜养殖前后海水中营养盐含量和结构的变化,结合浮游植物对有机营养盐利用的胞外酶活性变化分析,研究龙须菜和浮游植物对海水中营养盐的竞争利用,探讨龙须菜养殖是否对浮游植物生物量存在一定的抑制作用。
1 材料与方法 1.1 采样位置与时间研究海域位于南澳岛北部,该海域面积为13.3km2,水深1.1—6.3m,无较大的地表径流(王亮根等, 2010)。针对该海域的养殖功能区划,共设置14个采样点(图 1)。其中G1—G3站位于龙须菜养殖区(G区),GA1—GA3站位于龙须菜与鲍鱼混养区(GA区),A1—A3站位于鲍鱼养殖区(A区),N1—N5站位于非龙须菜鲍鱼养殖区(N区, 简写为非养殖区)。分别于2016年3月23日(此时龙须菜刚完成播种, 为龙须菜生长初期)、5月25日(龙须菜生长高峰期, 养殖户计划收割龙须菜)和6月22日(此时龙须菜已收割完)进行现场采样。需要指出的是,在5月份调查时,G3站的龙须菜刚收割完。
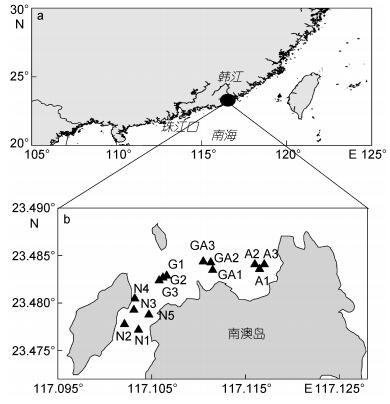 |
| 图 1 南澳岛北部近海采样站位图 Fig. 1 Sampling stations in coastal water of the northern Nan'ao Island 注: a.采样区域位置示意图, b.采样站位图; G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
使用有机玻璃采水器在水深0.5m处采集表层海水,水温(temperature, T)、盐度(salinity, S)、溶解氧(dissolved oxygen, DO)、酸碱度(potential of hydrogen, pH)用多参数水质分析仪(YSI pro plus, 维赛, 美国)现场测定。其余水样避光冷藏带回实验室进行分析。水样经GF/F滤膜(450℃, 煅烧2h)过滤,硝氮(NO3-N)、亚硝氮(NO2-N)、铵氮(NH4-N)和溶解无机磷(dissolved inorganic phosphorus, DIP)和活性硅酸盐(SiO3-Si)根据Valderrama(1995) 的方法检测。溶解无机氮(dissolved inorganic nitrogen, DIN)值为NO3-N、NO2-N和NH4-N三者之和。总溶解态磷(total dissolved phosphorus, TDP)和总溶解态氮(total dissolved nitrogen, TDN)依据Jeffries等(1979) 的方法采用酸性过硫酸钾(K2S2O8)氧化法进行测定。溶解态有机磷(dissolved organic phosphorus, DOP)的浓度为TDP和DIP之差,溶解态有机氮(dissolved organic nitrogen, DON)的浓度为TDN和DIN之差。每个样品设三个平行样。
取200mL经120µm筛绢过滤的海水,用GF/F膜过滤,采用丙酮萃取法测定叶绿素a(chl a) (Jespersen et al, 1987)。每个样品设三个平行样。
1.3 胞外酶活性的测定LAP和AP活性分别采用荧光底物L-leucine-7-amido-4-MCA hydrochloride(Sigma L2145, Sigma, 美国)和4-MUF-phosphate(Sigma M8883, Sigma, 美国)在荧光分光光度计(HITACHI F-4600, 日本日立有限公司, 日本)下进行检测(Hoppe et al, 1983)。
用经0.22µm孔径的水系微孔滤膜(混合纤维滤膜, 直径25mm, 上海兴亚净化材料厂, 中国上海)过滤的灭菌海水作为空白对照。采用0.22µm或3µm孔径的水系微孔滤膜(混合纤维滤膜, 直径25mm, 上海兴亚净化材料厂)过滤或不过滤水样的方式,进一步将胞外酶划分为溶解态(< 0.22μm),pico级(0.22—3µm),nano级(> 3µm)及总态(不过滤)粒径。每个样品设三个平行样。分别用相对应的标准物质7-amino-4-methyoxyethanol (Sigma A9891)和4-methylumbelliferone (Sigma M1381) 制作LAP和AP的标准曲线,胞外酶活性的表示单位是nmol/(L·h)。
1.4 数据分析所有的数据分析都是在SPSS 22.0软件中完成。Kolmogorov-Smirnov检验变量是否正态分布,对非正态分布变量进行对数(以10为底数)或三角函数(cos)转换。采用单因素方差分析(One way ANOVA)分析同一因子随时空变化的差异,P < 0.05表明存在显著差异。使用双变量相关性分析叶绿素、LAP、AP与各环境因子的相关性,实行双尾检验。通过F检验,进一步使用逐步线性回归方法分析其相关性。
2 结果 2.1 理化环境因子的变化如表 1所示,从3月到6月,南澳岛近海表层海水的温度显著上升(P < 0.05),盐度显著下降(P < 0.05),海水的pH逐渐升高(P < 0.05)。三次采样期间溶解氧先显著下降,后显著上升(P < 0.05)。不同月份间DIN浓度平均值变化不大(P > 0.05),整体平均值为12.34±2.37μmol/L。DIP浓度呈现逐渐下降的趋势(P < 0.05),至6月份时,DIP浓度已低于检出限(0.12μmol/L)。SiO3-Si的浓度在5月份比较高,测站浓度最高可达27.05μmol/L,显著高于3月和6月(P < 0.05)。海水中的无机态N/P比值随着DIP浓度降低逐渐上升,从3月的27.7±5.7上升到5月的34.1±9.6,海区逐渐演化为P限制海域。
| 理化因子 | 3月 | 5月 | 6月 | |||||
| 范围 | 平均值±S.D. | 范围 | 平均值±S.D. | 范围 | 平均值±S.D. | |||
| T(℃) | 14.10—14.90 | 14.41±0.23 | 25.00—25.80 | 25.45±0.24 | 28.30—30.80 | 29.34±0.89 | ||
| S(PSU) | 31.00—31.20 | 31.15±0.05 | 29.80—31.90 | 30.72±0.78 | 24.50—28.90 | 26.46±1.26 | ||
| DO(mgO2/L) | 6.44—8.40 | 7.39±0.58 | 6.45—7.73 | 6.81±0.36 | 8.64—10.44 | 9.47±0.58 | ||
| pH | 7.09—7.38 | 7.26±0.09 | 8.05—8.12 | 8.07±0.02 | 7.89—8.30 | 8.22±0.11 | ||
| DIN(μmol/L) | 10.47—16.79 | 12.78±1.98 | 9.57—20.20 | 12.55±2.55 | 7.19—18.16 | 11.65±2.59 | ||
| DIP(μmol/L) | 0.38—0.73 | 0.49±0.10 | 0.27—0.49 | 0.38±0.06 | - | - | ||
| SiO3-Si(μmol/L) | 7.42—16.08 | 11.11±2.44 | 16.92—27.05 | 21.06±3.02 | 3.03—21.96 | 14.08±4.81 | ||
| DON(μmol/L) | 3.88—22.59 | 13.96±1.45 | 0—16.60 | 3.80±5.86 | 0—11.34 | 3.99±3.32 | ||
| DOP(μmol/L) | 0.18—0.71 | 0.35±0.14 | 0.11—0.46 | 0.25±0.09 | 0.28—0.45 | 0.38±0.06 | ||
| DIN/DIP | 16.7—38.2 | 26.9±6.0 | 22.9—53.2 | 34.1±9.2 | - | - | ||
| 注: “-”表示低于检出限; T.温度, S.盐度, DO.溶解氧, pH.酸碱度, DIN.溶解无机氮, DIP.溶解无机磷, SiO3-Si.硅酸盐, DON.溶解有机氮, DOP.溶解有机磷, DIN/DIP.溶解无机氮磷比 | ||||||||
DON从3月至5月明显减少(P < 0.05),6月龙须菜收割之后又略有回升(P < 0.05)。DIN占TDN的比值由3月份的50%上升到80%左右,DIN一直是浮游植物生长的主要N源。DOP浓度变化则是先显著下降,再显著上升,恢复到与3月差不多的浓度。3月和5月,DOP占TDP的比例为40%左右,至6月份,DOP成为浮游植物生长的主要P源。
比较同一月份不同区域间理化环境因子变化(表 2),发现在3月和6月,各区域之间的理化因子不存在显著差异(P > 0.05)。在5月份,龙须菜养殖区DO显著高于其他区(P < 0.05),DIP浓度显著低于鲍鱼养殖区(P < 0.05)(表 2)。混养区的DIP与龙须菜养殖区无显著差异(P > 0.05),但与非养殖区和鲍鱼区有极显著差异(P < 0.01)。
| 理化因子 | 平均值±S.D. | |||
| 龙须菜养殖区(G区) | 混养区(GA区) | 鲍鱼区(A区) | 非养殖区(N区) | |
| T(℃) | 25.15±0.21 | 25.40±0.00 | 25.63±0.15 | 25.48±0.28 |
| S(PSU) | 31.90±0.008 | 30.00±0.00 | 30.73±0.81 | 30.66±0.65 |
| DO(mgO2/L) | 7.57±0.23a | 6.70±0.04b | 6.56±0.10b | 6.73±0.17b |
| pH | 8.07±0.01 | 8.05±0.01 | 8.06±0.01 | 8.11±0.01 |
| DIN(μmol/L) | 12.06±0.32 | 12.05±1.38 | 11.08±1.45 | 13.03±3.63 |
| DIP(μmol/L) | 0.34±0.048a | 0.31±0.04a | 0.44±0.05b | 0.40±0.03b |
| SiO3-Si(μmol/L) | 17.77±1.20 | 21.90±5.07 | 23.04±2.95 | 20.68±0.83 |
| DON(μmol/L) | 2.08±2.95 | - | 7.76±8.35 | 4.38±4.97 |
| DOP(μmol/L) | 0.16±0.07 | 0.25±0.07 | 0.27±0.06 | 0.27±0.11 |
| 注:上角标a、b表示同一因子在不同区域间存在显著差异,非养殖区DIP的显著差异不包括与龙须菜养殖区,字母相同或无标记的表示无显著差异者; “-”表示低于检出限; T.温度, S.盐度, DO.溶解氧, pH.酸碱度, DIN.溶解无机氮, DIP.溶解无机磷, SiO3-Si.硅酸盐, DON.溶解有机氮, DOP.溶解有机磷, DIN/DIP.溶解无机氮磷比 | ||||
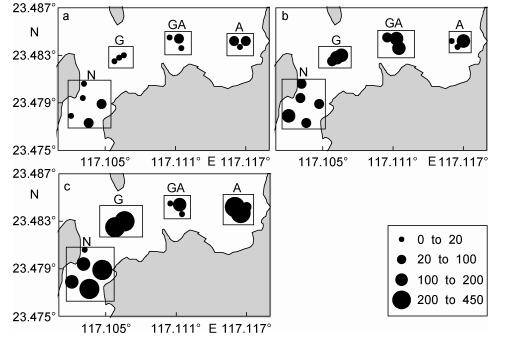
如图 2所示,3月份研究海域chl a浓度平均值为1.64±1.45µg/L,显著低于5月份的3.79±1.81µg/L和6月份的20.85±7.37µg/L(P < 0.05)。在5月份,龙须菜养殖区(G区)的chl a浓度为0.91±0.90µg/L,显著低于其他区域(P < 0.05);至6月份,龙须菜养殖区和混养区(GA区)的chl a浓度分别为25.26±6.91和26.36±7.70µg/L,显著高于其他区域(16.31±3.36µg/L)(P < 0.05)。将chl a和其他理化因子进行相关性分析,chl a与温度正相关(R2=0.82, n=40, P < 0.01),与DIP负相关(R2=-0.67,n=40,P < 0.01),用逐步回归法分析发现,DIP可以解释海区chl a 69.1%的变化(P < 0.01)。
 |
| 图 2 2016年3月(a)、5月(b)和6月(c)南澳岛近海表层海水中叶绿素a浓度(单位: µg/L)的分布 Fig. 2 Distribution of Chl a in the coastal waters of Nan'ao Island in (a) March, (b) May and (c) June, 2016 (unit: µg/L) 注: G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
3月份,海水中LAP活性变化范围为6.06—145.19nmol/(L·h),平均值为74.38±44.69nmol/(L·h),LAP活性的低值区位于龙须菜养殖区(图 3)。至5月份,海水中LAP活性显著升高(P < 0.01),平均值达到628.84±457.29nmol/(L·h),龙须菜养殖区的LAP高于其他区域(P < 0.05)。至6月份,海水中LAP平均值为666.34±412.36nmol/(L·h),与5月不存在显著差异(P > 0.05),不同区域之间的LAP活性无明显差异(P > 0.05)。
 |
| 图 3 2016年3月(a)、5月(b)和6月(c)南澳岛近海表层海水中亮氨酸氨肽酶活性的分布[单位: nmol/(L·h)] Fig. 3 Distribution of leucine amino peptide activities in the coastal waters of Nan'ao Island in (a) March, (b) May and (c) June, 2016 [unit: nmol/(L·h)] 注: G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
LAP活性的变化与chl a和硅酸盐浓度,呈正相关关系(R2=0.52, n=40, P < 0.01; R2=0.52, n=40, P < 0.01),与DIP浓度呈负相关关系(R2=-0.50, n=40, P < 0.01)。进一步采用逐步回归分析可知,DIP和硅酸盐是影响LAP的主要因子,用它们可以解释LAP活性33.7%的变化(P < 0.01)。
分析不同粒径浮游生物对LAP的贡献,结果表明,各月份中,LAP活性主要都是以细胞结合形态存在(图 4)。其中,3月份的nano-和pico-粒径的LAP分别占57.1%和31.5%。5月份,nano-和pico-粒径对LAP活性的贡献分别上升至60.6%和38.7%。至6月份,pico-粒径对LAP活性的贡献进一步增大,达到44.5%。
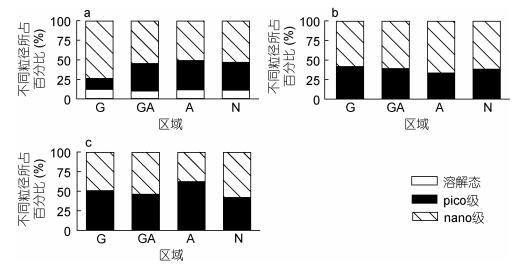 |
| 图 4 2016年3月(a)、5月(b)和6月(c)不同粒径亮氨酸氨肽酶活性所占的比例 Fig. 4 Percentages of leucine amino peptide activities in different-sized fractions 注: G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
整个海区的AP活性在3、5、6月的平均值分别为16.11±9.24、92.78±60.44和149.01±118.85nmol/ (L·h)。龙须菜养殖区和混养区的AP活性从3月至5月显著升高(P < 0.01),此后无明显变化(P > 0.05)(图 5)。而非养殖区和鲍鱼区的AP活性则是在5月至6月份时显著升高(P < 0.01)。在收获时和收获后龙须菜养殖区的AP活性显著高于其他区域(P均小于0.05)。
 |
| 图 5 2016年3月(a)、5月(b)和6月(c)南澳岛近海表层海水中碱性磷酸酶活性的分布[单位: nmol/(L·h)] Fig. 5 Distribution of alkaline phosphatase activities in the coastal waters of Nan'ao Island in March (a), May (b) and June (c), 2016 [unit: nmol/(L·h)] 注: G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
AP活性与chl a呈显著正相关关系(R2=0.44, n=40, P < 0.01),与DIP呈显著负相关关系(R2=-0.58, n=40, P < 0.01)。逐步回归分析结果表明在3个月份中,DIP是影响AP活性的主要贡献者(R2=0.320, P < 0.05)。在5月份,DIP浓度的变化可解释AP活性36.3%的变量。
3月时,游离态和细胞结合态AP活性分别占到37.5%和45.2%(图 6)。到了5月和6月,nano-粒径的AP活性显著上升,对AP活性的贡献分别达到72.2%和77.7%。
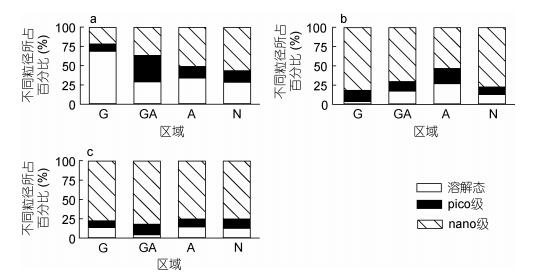 |
| 图 6 2016年3月(a)、5月(b)和6月(c)不同粒径碱性磷酸酶活性所占的比例 Fig. 6 Percentages of alkaline phosphatase activities in different-sized fractions 注: G.龙须菜养殖区, GA.龙须菜和鲍鱼混养区, A.鲍鱼区, N.非龙须菜鲍鱼养殖区 |
调查期间,除N1站之外,整个海区的DIN、DIP浓度平均值均达到《GB3097-1997》中国家一类水质标准的要求,这与近年来汕头市环境质量公报的调查结果一致。南澳岛海区总体水质良好,适合水产养殖(汕头海洋与渔业局,2005—2015)。N1站主要受鱼类养殖的影响,DIN浓度偏高,符合国家二类水质标准。从春季至夏季,调查海域的DIP含量逐渐降低,至6月份时甚至低于检出限,海水中无机N/P比值高于30,该结果表明随着浮游植物的生长,磷酸盐将成为营养限制因子(Beardall et al, 2001;孙元敏等, 2010)。至海区磷酸盐限制时,DOP成为浮游植物生长的主要P源。海区DIN含量稳定在12.34±2.37μmol/L,浓度较高,表明DIN一直是浮游植物的主要可利用N源。
3.2 龙须菜和浮游植物对营养盐P的竞争生长近年来研究显示,龙须菜通过营养竞争、化感作用和遮蔽作用能抑制浮游植物的生长。相比较浮游植物,龙须菜对无机营养盐的吸收有优势,这使龙须菜在与浮游植物竞争时更胜一筹(徐永健等, 2005)。龙须菜能分泌克生物质,抑制多种藻华生物生长,这种化感作用在营养盐充足的条件下也仍然存在(Yang et al, 2015b)。遮蔽作用虽然存在,但贡献较小(Yang et al, 2015b),龙须菜对浮游植物的抑制主要受营养竞争和化感作用的影响。研究者发现,5月份龙须菜生长量达到高峰时,龙须菜养殖区内浮游植物的chl a浓度显著低于其他区域;而当龙须菜收割后,龙须菜养殖区内浮游植物的chl a含量明显升高,且龙须菜养殖区和混养区的chl a浓度甚至高于其他区域。此外,5月份,龙须菜区和混养区DIP的浓度显著低于无龙须菜生长的海区,表明龙须菜对水体中的DIP具有显著吸收作用。在整个调查期间,浮游植物的chl a浓度与水温正相关,与DIP负相关。南澳岛近海为潜在的P限制海区,随着水温升高,浮游植物大量生长消耗水体中的DIP,至6月份,海区呈现无机P限制。张善东等(2005a, b)对龙须菜和赤潮微藻的营养盐竞争实验结果显示,龙须菜对营养盐的吸收能力远远高于微藻,这一点使龙须菜在共培养体系中占据优势,能抑制微藻的生长密度。而且大型海藻的这种抑制能力会随着生物量的增大而加强(杜锦, 2014)。因此,在南澳岛近海,当龙须菜大规模生长时,可能通过与微藻竞争利用DIP,抑制浮游植物的生长。
3.3 浮游生物的胞外酶受水体中营养盐变化的调控大型海藻和浮游植物在无机N、P匮乏时能转为对有机N、P进行水解利用,以此满足植物对生长的需要。在本研究中,采用分粒径的方式研究不同类群浮游生物的LAP和AP活性,未分析细胞表面来源的龙须菜的酶活性。在溶解态的胞外酶活性中,可能有部分来源于龙须菜。然而,溶解态LAP的比例在整个调查阶段都相对较低,溶解态胞外酶对总态胞外酶的结果影响可基本忽略,因此,可以认为,本文中检测到的胞外酶活性基本来源于浮游生物,未研究龙须菜对胞外酶的贡献。
海区的DIN浓度相对较高,对龙须菜和浮游植物的胁迫小,与LAP活性变化无相关性(Nausch et al, 2000)。相同月份间龙须菜养殖区的DIN浓度及DON浓度与其他区域间无显著差异,但5月,龙须菜养殖区LAP活性显著高于其他区域,表明在该区域DON的水解利用高于其他区域。LAP分粒径分析显示LAP活性主要是由nano-和pico-级浮游生物构成,相关性分析表明LAP活性与chl a浓度成正比,这显示LAP活性与浮游植物关系密切。此外,LAP活性与DIP浓度成反比,这个发现与Salerno等(2009) 在野外对LAP活性的研究结果一致。浮游植物吸收海水中N、P的比例是按照16﹕1的比例进行(Redfield et al, 1963)。海水中的P胁迫或限制可能也会诱导浮游植物表达更多的LAP来水解利用有机营养盐。南澳岛AP活性主要由nano-级浮游植物构成,5、6月份海水中磷酸盐浓度的下降及浮游植物AP活性的大量表达,表明5、6月份的南澳岛浮游植物受到严重的P限制。在5、6月,龙须菜养殖区的AP活性显著升高,暗示着浮游植物对DOP的水解利用能力增强,随着海水中DIP含量的下降甚至限制,DOP逐渐成为浮游植物可利用的主要P源。南澳海区的AP活性主要受到DIP和浮游植物影响,DIP浓度的下降或chl a浓度的升高皆能提高AP活性,此结果与Dyhrman等(2006)和Meseck等(2009) 的研究结果一致,DIP浓度对AP活性的影响较大。在5月份尽管龙须菜养殖区chl a浓度较低,但在低浓度DIP(相对于其他区)的影响下,AP活性显著高于其他区。
4 结论(1) 南澳岛近海从春季至夏季,随着海水中的chl a含量显著升高,P酸盐成为限制浮游植物生长的主要营养限制因子,有机P成为浮游植物生长的主要P源。
(2) nano-级浮游植物是LAP和AP的主要贡献者。浮游植物LAP和AP表达受到海水中DIP浓度的调控。浮游植物通过水解利用有机营养盐,缓解P胁迫。
(3) 龙须菜会和浮游植物竞争利用水体中的营养盐,并在一定程度上抑制浮游植物的生长。龙须菜的养殖可能对净化水质,预防有害藻华的发生起到一定程度的作用。
| 王亮根, 杜虹, 陈伟洲, 等, 2010. 深澳湾浮游植物群落特征及其多样性研究. 生态科学, 29(3): 200–206 |
| 汕头海洋与渔业局, 2005-2015. 汕头市海洋环境状况公报. 汕头: 汕头海洋与渔业局 |
| 孙元敏, 陈彬, 马志远, 等, 2010. 南亚热带海岛周边海域富营养化评价及原因分析. 海洋通报, 29(5): 572–576 |
| 孙颖颖, 张静, 刘泓君, 等, 2011. 龙须菜对3种赤潮微藻生长的影响. 海洋通报, 30(3): 328–333 |
| 杜锦, 2014. 浒苔对营养盐吸收特性及与赤潮藻竞争关系的初步研究. 青岛: 中国海洋大学硕士学位论文, 1-91 |
| 张善东, 宋秀贤, 王悠, 等, 2005a. 大型海藻龙须菜与锥状斯氏藻间的营养竞争研究. 海洋与湖沼, 36(6): 556–561 |
| 张善东, 俞志明, 宋秀贤, 等, 2005b. 大型海藻龙须菜与东海原甲藻间的营养竞争. 生态学报, 25(10): 2676–2680 |
| 徐永健, 钱鲁闽, 焦念志, 2005. 添加大型海藻龙须菜对中肋骨条藻赤潮的影响. 台湾海峡, 24(4): 533–539 |
| 雷光英, 杨宇峰, 李宵, 2010. 龙须菜对赤潮异弯藻和海洋原甲藻的生长抑制效应. 海洋环境科学, 29(1): 27–31 |
| Beardall J, Young E, Roberts S, 2001. Approaches for determining phytoplankton nutrient limitation. Aquatic Sciences, 63(1): 44–69 DOI:10.1007/PL00001344 |
| Berges J A, Mulholland M R, 2008. Enzymes and nitrogen cycling. In:Capone D G, Bronk D A, Mulholland M R, et al eds. Nitrogen in the Marine Environment. 2nd ed. Amsterdam:Elsevier, 1385-1444 |
| Burkholder J M, Glibert P M, Skelton H M, 2008. Mixotrophy, a major mode of nutrition for harmful algal species in eutrophic waters. Harmful Algae, 8(1): 77–93 DOI:10.1016/j.hal.2008.08.010 |
| Duhamel S, Dyhrman S T, Karl D M, 2010. Alkaline phosphatase activity and regulation in the North Pacific Subtropical Gyre. Limnology and Oceanography, 55(3): 1414–1425 DOI:10.4319/lo.2010.55.3.1414 |
| Dyhrman S T, Ruttenberg K C, 2006. Presence and regulation of alkaline phosphatase activity in eukaryotic phytoplankton from the coastal ocean:Implications for dissolved organic phosphorus remineralization. Limnology and Oceanography, 51(3): 1381–1390 DOI:10.4319/lo.2006.51.3.1381 |
| Glibert P M, Burkholder J M, 2011. Harmful algal blooms and eutrophication:"strategies" for nutrient uptake and growth outside the Redfield comfort zone. Chinese Journal of Oceanology and Limnology, 29(4): 724–738 DOI:10.1007/s00343-011-0502-z |
| Hoppe H G, 1983. Significance of exoenzymatic activities in the ecology of brackish water:measurements by means of methylumbelliferyl-substrates. Marine Ecology Progress Series, 11: 299–308 DOI:10.3354/meps011299 |
| Jeffries D S, Dieken F P, Jones D E, 1979. Performance of the autoclave digestion method for total phosphorus analysis. Water Research, 13(3): 275–279 DOI:10.1016/0043-1354(79)90206-9 |
| Jespersen A M, Christoffersen K, 1987. Measurements of chlorophyll-a from phytoplankton using ethanol as extraction solvent. Archiv Für Hydrobiologie, 109(3): 445–454 |
| Lürling M, van Geest G, Scheffer M., 2006. Importance of nutrient competition and allelopathic effects in suppression of the green alga Scenedesmus obliquus by the macrophytes Chara, Elodea and Myriophyllum. Hydrobiologia, 556(1): 209–220 DOI:10.1007/s10750-005-1168-3 |
| Mao Y Z, Yang H S, Zhou Y, et al, 2009. Potential of the seaweed Gracilaria lemaneiformis for integrated multi-trophic aquaculture with scallop Chlamys farreri in North China. Journal of Applied Phycology, 21(6): 649–659 DOI:10.1007/s10811-008-9398-1 |
| Meseck S L, Alix J H, Wikfors G H, et al, 2009. Differences in the soluble, residual phosphate concentrations at which coastal phytoplankton species up-regulate alkaline-phosphatase expression, as measured by flow-cytometric detection of ELF-97® fluorescence. Estuaries and Coasts, 32(6): 1195–1204 DOI:10.1007/s12237-009-9211-7 |
| Nausch M, Nausch G, 2000. Stimulation of peptidase activity in nutrient gradients in the baltic sea. Soil Biology and Biochemistry, 32(13): 1973–1983 DOI:10.1016/S0038-0717(00)00173-5 |
| Redfield A C, Keiehum B H, Richards F A, 1963. The influence of organisms on the composition of seawater. In:Hill M N ed. The Sea (2). New York:Wiley Interscience, 26-79 |
| Salerno M, Stoecker D K, 2009. Ectocellular glucosidase and peptidase activity of the mixotrophic dinoflagellate Prorocentrum minimum (Dinophyceae) 1. Journal of Phycology, 45(1): 34–45 DOI:10.1111/jpy.2009.45.issue-1 |
| Valderrama J C, 1995. Methods of nutrient analysis. In:Hallegraeff G M, Anderson D M, Cembella A D eds. Manual on Harmful Marine Microalgae, IOC Manuals and Guides No. 33. Paris:UNESCO, 251-282 |
| Yang Y F, Chai Z Y, Wang Q, et al, 2015a. Cultivation of seaweed Gracilaria in Chinese coastal waters and its contribution to environmental improvements. Algal Research, 9: 236–244 DOI:10.1016/j.algal.2015.03.017 |
| Yang Y F, Fei X G, Song J M, et al, 2006. Growth of Gracilaria lemaneiformis under different cultivation conditions and its effects on nutrient removal in Chinese coastal waters. Aquaculture, 254(1-4): 248–255 DOI:10.1016/j.aquaculture.2005.08.029 |
| Yang Y F, Liu Q, Chai Z Y, et al, 2015b. Inhibition of marine coastal bloom-forming phytoplankton by commercially cultivated Gracilaria lemaneiformis (Rhodophyta). Journal of Applied Phycology, 27(6): 2341–2352 DOI:10.1007/s10811-014-0486-0 |
 2017, Vol. 48
2017, Vol. 48


