
中国海洋湖沼学会主办。
文章信息
- 穆方申, 苗亮, 李明云, 侯红红, 李笑萌, 徐玉敏. 2017.
- MU Fang-Shen, MIAO Liang, LI Ming-Yun, HOU Hong-Hong, LI Xiao-Meng, XU Yu-Min. 2017.
- 光唇鱼(Acrossocheilus fasciatus)Leptin基因克隆及禁食-再投喂对其表达的影响
- CLONING AND EXPRESSION OF LEPTIN GENE IN ACROSSOCHEILUS FASCIATUS DURING FASTING AND REFEEDING
- 海洋与湖沼, 48(4): 822-829
- Oceanologia et Limnologia Sinica, 48(4): 822-829.
- http://dx.doi.org/10.11693/hyhz20170100023
-
文章历史
- 收稿日期:2017-01-26
- 收修改稿日期:2017-03-03
由于天然饵料的季节性丰度变化以及人工养殖中的限制性投饵, 鱼类无论在野生还是养殖条件下都可能会经历一定的食物匮乏期。饥饿状态导致的鱼体生理生化、代谢变化会影响摄食行为、能量代谢、物质组成及生长发育、生殖等生命活动(王婷等, 2015;贺诗水等, 2016)。Leptin又称瘦素, 是在动物摄食和能量平衡的调节中有重要的作用一种蛋白质激素, 并在生殖和发育、免疫、心血管功能调节等方面有重要作用(Klok, 2007)。在哺乳动物中, Leptin可通过下丘脑-垂体轴的反馈调节使动物摄食减少、能量消耗增加(Sahu, 2004)。目前已获得了斑马鱼(Danio rerio)、虹鳟(Oncorhynchus mykiss)、鲤(Cyprinus carpio)、草鱼(Ctenopharyngodon idella)、大西洋鲑(Salmo salar)等多种鱼类的Leptin基因序列, 虽然鱼类的Leptin蛋白有着相似的高级结构, 但各科、目之间氨基酸序列却有较大差异, 关于鱼类中Leptin的功能也存在争议(Copeland et al, 2011)。就摄食调节方面而言, 鲤(C. carpio)和草鱼(C. idella)均为禁食后Leptin基因表达上调、摄食表达后下调(卢荣华等, 2015), 且对金鱼(Carassius auratus)和虹鳟(O. mykiss)侧脑室注射Leptin蛋白后可以抑制摄食、导致体重降低(de Pedro et al, 2006; Aguilar et al, 2010);但在点带石斑鱼(Epinephelus coioides)、虹鳟(O. mykiss)中则发现饥饿状态下Leptin基因表达上调(Kling et al, 2009; Zhang et al, 2013)。鱼类中Leptin的功能可能比哺乳动物复杂, 要弄清Leptin在鱼类摄食管理和能量代谢调控中的功能及作用机制还需要进行更加广泛和深入的研究。
光唇鱼(Acrossocheilus fasciatus)俗称淡水石斑鱼, 属鲤形目、鲤科、鲃亚科、光唇鱼属, 不但有较高的营养价值, 还可作为小型观赏鱼(潘娜等, 2015)。近年来光唇鱼的人工繁育和养殖技术逐渐成熟, 养殖规模不断扩大, 但在摄食调控、能量代谢调节等方面鲜有研究报道。本研究克隆光唇鱼Leptin基因(AfLep), 并检测禁食期间及恢复投喂后AfLep的表达变化, 以期为研究鱼类Leptin的功能及其光唇鱼的摄食和能量代谢调节中的作用提供基础资料。
1 材料与方法 1.1 实验动物及禁食-再投喂实验光唇鱼由浙江省新昌县新渔水产养殖专业合作社提供, 为人工繁育、养殖的12月龄光唇鱼, 共450尾, 平均体重(3.13±1.14) g、平均体长(6.82±0.64) cm。将鱼随机分配到9个容积为50L的塑料桶中, 每桶50尾, 暂养4天后开始实验。暂养期间每天投喂2次通威牌颗粒饲料, 每次投喂量为鱼体重的2%。每3个桶为1组, 处理如下:第1组禁食1d后恢复投喂, 第2组禁食3d后恢复投喂, 第3组禁食7d后恢复投喂。
1.2 样品采集在禁食前(0d)和禁食后1d、3d、7d以及再投喂后3h分别采样1次, 每次每桶随机取样5尾。取样时将鱼用丁香酚麻醉后立即解剖, 其中禁食前取肌肉、鳃、心、肝脏、脾、肠、肾、脑等组织, 用于AfLep基因克隆、组织表达分析和表达量检测; 禁食及再投喂后取肝脏, 用于检测AfLep基因表达变化。样品经液氮速冻后–80℃保存, 用Trizol法提取各组织总RNA, 反转录合成第一链cDNA。
1.3 AfLep基因克隆检索GenBank数据库中鲤科鱼类Leptin蛋白序列, 经序列比对后根据保守区域设计3对兼并引物(lep1, lep2和lep3, 见表 1) 对光唇鱼AfLep基因cDNA序列进行扩增。用Ex Taq® Hot Start Version聚合酶体系(TaKaRa)进行PCR扩增, 50μL反应体系包括: 5U/μL的Ex Taq HS 0.25μL, 10×Ex Taq Buffer (Mg2+ Plus) 5μL, dNTP Mixutre 4μL, 上、下游引物各0.5μL, cDNA模板1μL, dH2O 38.75μL。反应程序为: 94℃预变性5min; 94℃变性30s、退火(引物退火温度见表 1)30s、72℃合成30s, 循环30次; 72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳检测后连接入pMD-19T载体, 转化入感受态大肠杆菌, 挑选阳性克隆菌落送测序。引物合成和测序均由生工生物工程(上海)股份有限公司进行。对测得的序列进行拼接后获得光唇鱼AfLep基因核心序列。
| 用途 | 引物名称 | 引物序列(5′→3′) | 退火温度(℃) | 预期产物大小(bp) |
| 核心序列扩增 | lep1 | F: TCTACMCMTGCWTTTTGRSCATKCT R: WGTAAYGKGGTGSGTGC |
54 | 420 |
| lep2 | F: GGCAGASACCATYATCMWCAGAA R: MTTGGGCAGYVTTTGVAG |
56 | 180 | |
| lep3 | F: AAAMHRCAGGCAGASACCA R: TAGCAGCTYTTCAMMTGGTC |
44 | 420 | |
| 3′-RACE | lep-3′-RACE | Inner: CGCGGATCCTCCACTAGTGATTTCACTATAGG Outer: TACCGTCGTTCCACTAGTGATTT |
62 | — |
| 5′-RACE | lep-5′-RACE | Inner: GACGAGGTTTGGAGATAGTTTCAGC Outer: ACCCGAGACCTTGGAGTGGTTTAT |
62 | — |
| 表达检测 | q-lep | F: AGAAGGTTCTTCAAAGGCTG R: AAAGTAATGTGGTGGGTGGC |
58 | 178 |
| 内参 | β-actin | F: CCTATTGAGCACGGTATTG R: CTGTTGGCTTTGGGATTG |
58 | 140 |
根据所获核心序列设计引物lep-3′-RACE和lep-5′-RACE(表 1), 用3′-Full RACE Core Set Ver.2.0和5′-Full RACE Kit (TaKaRa)扩增光唇鱼AfLep基因cDNA的3′端和5′端序列, 扩增体系及反应程序均按照说明书进行。扩增产物经1.5%琼脂糖凝胶电泳检测后连接入pMD-19T载体, 转化入感受态大肠杆菌, 挑选阳性克隆菌落送测序, 拼接后获得光唇鱼AfLep基因cDNA序列全长。
1.4 AfLep序列分析及系统进化树构建对获得的AfLep基因cDNA序列, 用在线ORF Finder工具(https://www.ncbi.nlm.nih.gov/orffinder/)分析开放读码框(open reading frame, ORF); 用SingalP 3.0 (http://www.cbs.dtu.dk/services/SignalP)预测信号肽; 用SWISS-MODEL (http://swissmodel.expasy.org//SWISS-MODEL.html)的ProMod II功能对AfLep蛋白进行二级和三级结构预测(以蛋白质数据库中的人Leptin结构作为参照); 从GenBank数据库中检索鱼类及其他脊椎动物的Leptin序列(表 2), 经Cluastal X1.83软件进行多重比对后用MEGA5.0软件构建基于氨基酸序列的NJ法(Neighbor-joining)系统进化树, 设置bootstraps验证次数为1000次。
| 登录号 | 序列名 | 种名 | 俗名 |
| AIE45855 | Leptin | Schizothorax prenanti | 齐口裂腹鱼 |
| CAI30828 | Leptin-Ⅰ | Cyprinus carpio | 鲤鱼 |
| CAI30828 | Leptin-Ⅱ | Cyprinus carpio | 鲤鱼 |
| ACL68083 | Leptin | Carassius auratus | 鲫鱼 |
| ACO82076 | Leptin-Ⅱ | Carassius auratus | 鲫鱼 |
| ACI32423 | Leptin | Ctenopharyngodon idella | 草鱼 |
| AHI13615 | Leptin | Culter alburnus | 翘嘴红鲌 |
| ACZ02412 | Leptin | Salmo salar | 大西洋鲑 |
| ADI77098 | Leptin-A2 | Salmo salar | 大西洋鲑 |
| AGB34181 | Leptin | Oncorhynchus mykiss | 虹鳟 |
| AGR51148 | Leptin | Larimichthys crocea | 大黄鱼 |
| AFU55260 | Leptin | Epinephelus coioides | 点带石斑鱼 |
| CEE15395 | Leptin-1 | Anguilla Anguilla | 鳗鲡 |
| CEE15396 | Leptin-2 | Anguilla Anguilla | 鳗鲡 |
| XP_002931881 | Leptin | Xenopus tropicalis | 爪蟾 |
| CDL67225 | Leptin | Columba livia | 鸽 |
| NP_032519 | Leptin | Mus musculus | 小鼠 |
| NP_000221 | Leptin | Homo sapiens | 人 |
根据获得的AfLep基因cDNA序列设计1对表达检测引物q-lep、并以β-actin作为内参(表 1), 检测AfLep基因在光唇鱼各组织中的表达情况及禁食-再投喂后的表达变化。
以提取的正常投喂健康光唇鱼各组织cDNA为模板, 通过半定量RT-PCR检测各组织中AfLep基因的表达情况。20μL反应体系包括: 2×Taq Premix-Dye酶10μL, 正反向引物各1μL, 模板cDNA 1μL, dH2O 7μL。程序为: 94℃预变性5min: 94℃变性30s、58℃退火30s、72℃延伸30s, 循环30次; 72℃延伸10min。PCR产物用1.5%琼脂糖凝胶电泳检测后凝胶成像。
对禁食期间及再投喂后光唇鱼肝脏中AfLep基因的表达变化进行实时荧光定量PCR (real-time quantitative PCR, RT-qPCR)检测。反应使用SYBR®Premix Ex TaqTM试剂盒(TaKaRa), 20μL反应体系包括: SYBR®Premix Ex Taq (Tli RNaseH Plus) 10μL, 正、反向引物各1μL, cDNA模板1μL, ddH2O 7μL。反应程序为: 94℃预变性2min; 94℃变性15s、58℃退火15s、72℃延伸30s, 循环40次并记录CT值。反应完成后, 系统在65—94℃、每次升温0.5℃生成溶解曲线。以β-actin为内参、用2–DDCt法(Livak et al, 2001) 计算AfLep基因相对表达量。用Excel2007软件对数据进行统计, 计算平均数和标准差; 用SPSS16.0软件对不同时间点的基因相对表达量进行单因素方差(One way ANOVA)分析, 以P < 0.05为具有显著性差异。
2 结果 2.1 AfLep序列特征经测序和拼接, 获得AfLep基因序列全长1315bp, 其中5′端175bp, 3′端699bp; 该序列含有1个长度为516bp的开放阅读框(ORF), 编码171个氨基酸; 经SignalP4.1预测, 编码蛋白有长度为20aa的信号肽(图 1)。
 |
| 图 1 AfLep基因cDNA核苷酸序列及预测编码的氨基酸序列 Fig. 1 The nucleotide sequences of AfLep cDNA and deduced amino acid sequence 注: *示终止密码子; 下划线示信号肽 |
基于各种动物Leptin氨基酸序列构建的系统进化树中(图 2), 鱼类Leptin独立于两栖类、鸟类、哺乳类等其他脊椎动物而聚为一个大簇; 在鱼类Leptin中鲤科、鳗鲡科、石首鱼科、鲑科鱼类均单独聚为一个小簇; AfLep位于鲤科鱼类的分支中, 优先与齐口裂腹鱼Leptin相聚。多重序列比对显示AfLep与齐口裂腹鱼Leptin相似性最高(86.7%), 与鲤科其他鱼类Leptin的相似性均在80%以上, 与非鲤科鱼类Leptin的相似性较低(30%左右), 而与两栖类、鸟类和哺乳类等其他脊椎动物Leptin相似性仅约20%。
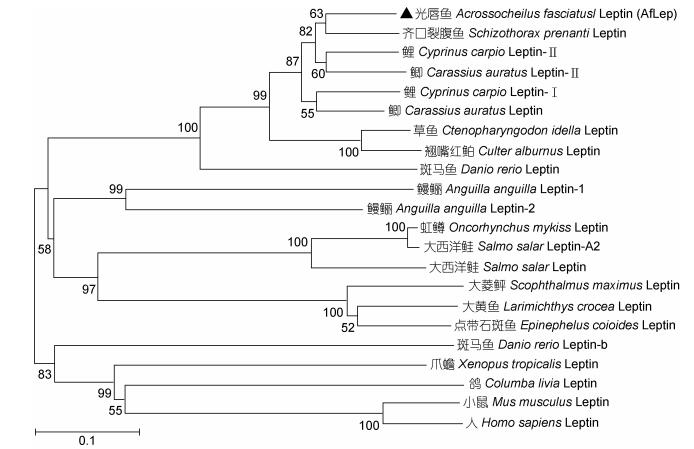 |
| 图 2 Leptin系统进化树(NJ法, bootstraps=1000) Fig. 2 The phylogenetic tree of Leptin (neighbor-joining method, bootstraps=1000) |
序列比对(图 3) 显示光唇鱼、齐口裂腹鱼、鲤等鲤科鱼类的Leptin氨基酸序列较为保守, 而与非鲤科鱼类以及其他脊椎动物的Leptin序列差异较大; 但各种动物Leptin蛋白的二级结构高度保守, 均有4个α螺旋(Helix A-D), 且具有长度约20aa的信号肽。预测的AfLep蛋白三级空间结构也与人Leptin蛋白相似(图 4)。
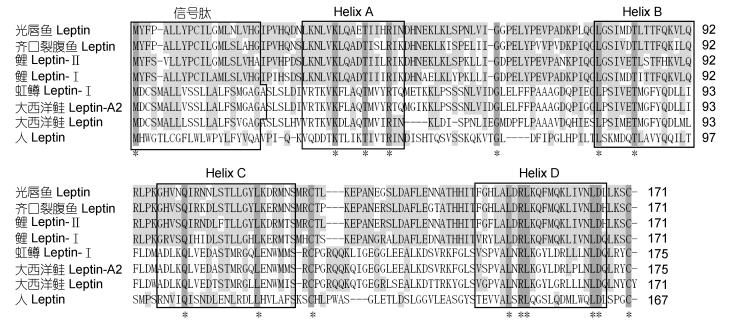 |
| 图 3 AfLep与其他生物Leptin氨基酸序列比对 Fig. 3 Amino acid sequence alignment among AfLep and Leptin of other species |
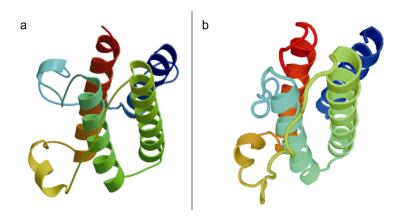 |
| 图 4 Leptin蛋白三级结构 Fig. 4 The tertiary structures of Leptin protein 注: a: AfLep; b:人Leptin |
半定量RT-PCR检测显示了AfLep基因在光唇鱼肝脏中的表达量最高, 其次是脑和肾, 在肌肉、脾、心脏、鳃和肠等组织中仅有微弱表达(图 5)。
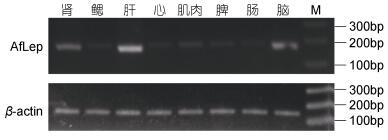 |
| 图 5 AfLep基因在光唇鱼各组织中的表达 Fig. 5 The expression of AfLep gene in various tissues of A. fasciatus |
经实时荧光定量PCR检测(图 6), 禁食后光唇鱼肝脏中AfLep基因表达显著下调(P < 0.05), 且表达水平随禁食时间延长而逐渐降低:禁食1d、3d、7d后AfLep基因表达量分别比禁食前(0d)降低了58.25%、73.82%和92.05%。禁食-再投喂后AfLep基因表达上调, 其中禁食1d组和禁食3d组分别显著升高了1.79倍和2.65倍(P < 0.05), 而禁食7d组的表达水平仅略有升高、差异不显著(P > 0.05)。
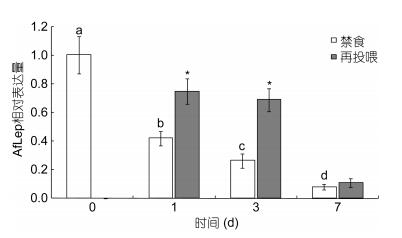 |
| 图 6 禁食及再投喂后光唇鱼肝脏中AfLep基因表达变化 Fig. 6 Changes in expression of AfLep in liver of A. fasciatus during fasting and after refeeding |
自Zhang等(1994) 率先在小鼠中得到Leptin基因以来, 已在包括鱼类在内的脊椎动物各类群中都发现有与哺乳类Leptin同源的基因存在。在哺乳动物及非洲爪蟾的基因组中Leptin基因仅有1个拷贝、编码1种蛋白, 而在某些鱼类中则发现存在多个拷贝以及不同的Leptin蛋白亚型(Kurokawa et al, 2009; Angotzi et al, 2013;卢荣华等, 2015), 这可能与鱼类在进化过程中发生过基因组复制有关(周莉等, 2006)。另外, 鱼类中Leptin基因的起源进化关系也比较复杂, 例如鲤(C. carpio)2个Leptin基因拷贝所编码的蛋白相似性较高(84%), 而斑马鱼(D. rerio)中2个Leptin蛋白亚型的相似性却仅有24%(卢荣华等, 2015)。本研究通过同源克隆从光唇鱼中获得了一个Leptin基因(AfLep), 但不能确定光唇鱼基因组中是否还存在该基因的其他拷贝。
在本研究构建的Leptin系统进化树中, 包括光唇鱼AfLep在内的各种鲤科鱼类Leptin聚为一簇, 其氨基酸序列相似性在80%以上, 而与非鲤科鱼类Leptin的相似性仅30%左右。鱼类不同科、目之间Leptin氨基酸序列有较大差异, 这可能与鱼类种系发生和系统进化关系复杂有关; 但研究显示在各种脊椎动物基因组中Leptin基因有着相似的线性排列, 表明它们可能有相同的起源; 并且各类动物Leptin蛋白二级结构高度保守, 均含2个半胱氨酸和形成4个α螺旋(卢荣华等, 2015;张沛等, 2016);本研究预测的光唇鱼AfLep蛋白的空间结构也与人类Leptin蛋白相似。结构上的保守可能对Leptin蛋白的稳定性和活性有重要影响, 而氨基酸序列的低相似性则反映了Leptin基因在物种进化中的差异, 这种差异可能导致该基因在不同生物中功能的多样化。
小鼠等哺乳动物中Leptin基因主要在脂肪组织表达(Trayhurn et al, 1995), 两栖类Leptin则是脑和心脏中表达量较高。在光唇鱼肝脏中AfLep基因高表达, 斑马鱼(D. rerio)、花鲈(Lateolabrax maculatus)、鳜鱼(Siniperca chuatsi)、点带石斑鱼(E. coioide)等鱼类中也是肝脏中Leptin基因表达量最高(Gorissen et al, 2009; Zhang et al, 2013;张沛等, 2016; Yuan et al, 2016);但也有些鱼类在其他组织中出现Leptin的高表达, 如团头鲂(Megalobrama amblycephala)肾脏、鳃、肠、性腺中Leptin的表达量远均高于肝脏(赵鸿昊等, 2016), 大西洋鲑(S. salar)Leptin则是在脑中表达量最高、肌肉中也有较高表达(Ronnestad et al, 2010); Leptin基因组织表达的这种差异性提示该基因在鱼类中可能有多种功能, 并且在不同鱼类中的功能可能有较大差异。
在人、小鼠等哺乳动物中的实验显示饥饿后Leptin基因表达量和血浆Leptin蛋白水平显著降低、进食后升高(Kolaczynski et al, 1995; Saladin et al, 1995; Trayhurn et al, 1995; Weigle et al, 1997)。本研究中AfLep在光唇鱼肝脏中的表达也表现为禁食后显著降低、恢复喂食后升高, 提示该基因有降低食欲的作用, 在草鱼(C. idella)、金鱼(C. auratus)、鲈鱼(Morone saxatilis)、虹鳟(O. mykiss)等鱼类中也得到了相似的结果(卢荣华等, 2015), 但在点带石斑鱼(E. coioides)和虹鳟(O. mykiss)中则发现禁食后Leptin基因表达上调、血浆Leptin蛋白含量升高(Kling et al, 2009; Zhang et al, 2013)。这可能与不同鱼类在摄食和糖、脂代谢管理方式上有着很大的差异有关, 例如通常情况下机体处于饥饿状态时会分解脂肪提供能量, 但真鲷(Pagrus major)幼鱼经过短期饥饿后却出现了脂肪含量的升高(Kaneko, 2016);而肉食性和植食性鱼类在糖代谢上也有很大不同(Moon, 2001)。另外, 本研究中禁食1d和3d的光唇鱼在摄食后肝脏AfLep基因表达量均显著升高, 提示此时鱼体的能量储备可能消耗不大; 而禁食7d组摄食后肝脏AfLep基因表达仍处于较低水平, 提示鱼体脂肪消耗过多、需摄取更多食物进行补充。贺诗水等(2016) 也发现鲫鱼(Carassius auratus)饥饿4d后脂肪含量仅下降了约10%, 而饥饿6d后已减少了50%以上。虽然本研究表明AfLep基因参与了光唇鱼的摄食管理, 但要弄清其作用机制以及在能量代谢中的功能仍需进一步研究。
| 王婷, 刘利平, 陈桃英, 等, 2015. 鳗鲡(Anguilla japonica)性腺发育和饥饿胁迫下生物学指标及体内蛋白质与氨基酸含量变化. 海洋与湖沼, 46(6): 1373–1379 |
| 卢荣华, 孙君君, 梁旭方, 等, 2015. 鱼类leptin的生物学特性及功能. 水生生物学报, 39(3): 583–589 DOI:10.7541/2015.76 |
| 张沛, 温海深, 迟美丽, 等, 2016. 花鲈瘦素基因的克隆及低盐度条件下调控表达分析. 大连海洋大学学报, 31(1): 13–18 |
| 周莉, 汪洋, 桂建芳, 2006. 鱼类特异的基因组复制. 动物学研究, 27(5): 525–532 |
| 赵鸿昊, 李学华, 曾聪, 等, 2016. leptin基因在团头鲂成鱼各组织和早期发育中的表达分析. 华中农业大学学报, 35(1): 92–98 |
| 贺诗水, 王洪凯, 蒋万祥, 等, 2016. 上市前短期饥饿对鲫鱼肌肉品质的影响. 食品工业科技, 37(1): 334–337 |
| 潘娜, 苗亮, 李明云, 等, 2015. 浙江新昌光唇鱼(Acrossocheilus)COⅡ和D-loop基因克隆及系统发育分析. 海洋与湖沼, 46(2): 381–388 DOI:10.11693/hyhz20140900235 |
| Aguilar A J, Conde-Sieira M, Polakof S, et al, 2010. Central leptin treatment modulates brain glucosensing function and peripheral energy metabolism of rainbow trout. Peptides, 31(6): 1044–1054 DOI:10.1016/j.peptides.2010.02.026 |
| Angotzi A R, Stefansson S O, Nilsen T O, et al, 2013. Molecular cloning and genomic characterization of novel leptin-like genes in salmonids provide new insight into the evolution of the leptin gene family. General and Comparative Endocrinology, 187: 48–59 DOI:10.1016/j.ygcen.2013.03.022 |
| Copeland D L, Duff R J, Liu Q, et al, 2011. Leptin in teleost fishes:an argument for comparative study. Frontiers in Physiology, 2: 26 |
| de Pedro N, Martínez-lvarez R, Delgado M J, 2006. Acute and chronic leptin reduces food intake and body weight in goldfish (Carassius auratus). Journal of Endocrinology, 188(3): 513–520 DOI:10.1677/joe.1.06349 |
| Gorissen M, Bernier N J, Nabuurs S B, et al, 2009. Two divergent leptin paralogues in zebrafish (Danio rerio) that originate early in teleostean evolution. Journal of Endocrinology, 201(3): 329–339 DOI:10.1677/JOE-09-0034 |
| Kaneko G, Shirakami H, Yamada T, et al, 2016. Short-term fasting increases skeletal muscle lipid content in association with enhanced mRNA levels of lipoprotein lipase 1 in lean juvenile red seabream (Pagrus major). Aquaculture, 452: 160–168 DOI:10.1016/j.aquaculture.2015.10.030 |
| Kling P, Rnnestad I, Stefansson S O, et al, 2009. A homologous salmonid leptin radioimmunoassay indicates elevated plasma leptin levels during fasting of rainbow trout. General and Comparative Endocrinology, 162(3): 307–312 DOI:10.1016/j.ygcen.2009.04.003 |
| Klok M D, Jakobsdottir S, Drent M L, 2007. The role of leptin and ghrelin in the regulation of food intake and body weight in humans:a review. Obesity Reviews, 8(1): 21–34 DOI:10.1111/obr.2007.8.issue-1 |
| Kolaczynski J W, Considine R V, Ohannesian J, et al, 1995. Responses of leptin to short-term fasting and refeeding in humans:a link with ketogenesis but not ketones themselves. Diabetes, 45(11): 1511–1515 |
| Kurokawa T, Murashita K, 2009. Genomic characterization of multiple leptin genes and a leptin receptor gene in the Japanese Medaka, Oryzias latipes. General and Comparative Endocrinology, 161(2): 229–237 DOI:10.1016/j.ygcen.2009.01.008 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Moon T W, 2001. Glucose intolerance in teleost fish:fact or fiction?. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 129(2-3): 243–249 DOI:10.1016/S1096-4959(01)00316-5 |
| Ronnestad I, Nilsen T O, Murashita K, et al, 2010. Leptin and leptin receptor genes in Atlantic salmon:cloning, phylogeny, tissue distribution and expression correlated to long-term feeding status. General and Comparative Endocrinology, 168(1): 55–70 DOI:10.1016/j.ygcen.2010.04.010 |
| Sahu A, 2004. Minireview:a hypothalamic role in energy balance with special emphasis on leptin. Endocrinology, 145(6): 2613–2620 DOI:10.1210/en.2004-0032 |
| Saladin R, De Vos P, Guerre-Millo M, et al, 1995. Transient increase in obese gene expression after food intake or insulin administration. Nature, 377(6549): 527–528 DOI:10.1038/377527a0 |
| Trayhurn P, Thomas M E A, Duncan J S, et al, 1995. Effects of fasting and refeeding on ob gene expression in white adipose tissue of lean and obese (ob/ob) mice. FEBS Letters, 368(3): 488–490 DOI:10.1016/0014-5793(95)00719-P |
| Weigle D S, Duell P B, Connor W E, et al, 1997. Effect of fasting, refeeding, and dietary fat restriction on plasma leptin levels. The Journal of Clinical Endocrinology and Metabolism, 82(2): 561–565 |
| Yuan X C, Li A X, Liang X F, et al, 2016. Leptin expression in mandarin fish Siniperca chuatsi (Basilewsky):regulation by postprandial and short-term fasting treatment. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 194: 8–18 |
| Zhang H X, Chen H P, Zhang Y, et al, 2013. Molecular cloning, characterization and expression profiles of multiple leptin genes and a leptin receptor gene in orange-spotted grouper (Epinephelus coioides). General and Comparative Endocrinology, 181: 295–305 DOI:10.1016/j.ygcen.2012.09.008 |
| Zhang Y Y, Proenca R, Maffei M, et al, 1994. Positional cloning of the mouse obese gene and its human homologue. Nature, 372(6505): 425–432 DOI:10.1038/372425a0 |
 2017, Vol. 48
2017, Vol. 48


