中国海洋湖沼学会主办。
文章信息
- 杨扬, 周惠强, 舒琥, 蓝昭军, 李强, 谷平华. 2017.
- YANG Yang, ZHOU Hui-Qiang, SHU Hu, LAN Zhao-Jun, LI Qiang, GU Ping-Hua. 2017.
- 缩骨鲫(Carassius auratus sogu var.)MC4R克隆、组织分布以及与生长相关SNPs的筛选
- CLONE, EXPRESSION, AND SCREENING OF GROWTH ASSOCIATED SNPS OF CARASSIUS AURATUS SOGU VAR.
- 海洋与湖沼, 48(4): 830-837
- Oceanologia et Limnologia Sinica, 48(4): 830-837.
- http://dx.doi.org/10.11693/hyhz20170100025
-
文章历史
- 收稿日期:2017-01-29
- 收修改稿日期:2017-03-04
2. 韶关市水产研究所 韶关 512006
2. Shaoguan Fisheries Research Institute, Shaoguan 512006, China
黑色素皮质素受体-4 (melanocortin reporter-4, MC4R)属于黑色素皮质激素受体(melanocortin reporters)家族, 是G蛋白偶联受体超家族成员, 具有7个跨膜结构, 为典型的视紫红质受体蛋白(Jangprai et al, 2011)。黑色素皮质素受体与其配体—阿黑皮素原(POMC)的衍生物所组成的黑色素皮质素系统在生物体代谢调控和能量平衡中扮演着重要的角色(Ellacott et al, 2004)。MC4R是该系统中的重要组成部分, 其功能十分广泛, 与能量代谢(Ellacott et al, 2004)、食物摄入(Bertile et al, 2006)、性行为(Van der Ploeg et al, 2002)以及疼痛感触(Vrinten et al, 2000)均有关联。MC4R可接受多种受体, 它可以受到α-MSH的激活, 促使生物体加快代谢, 抑制进食, 抑制体重增长; 也可以受到刺鼠蛋白(agouti), 刺鼠相关蛋白(AGRP)以及神经肽Y (NPY)的抑制, 抑制生物体代谢, 促进生物体觅食, 减缓体重降低(左北瑶等, 2011)。在人类中, MC4R的突变可以引起肥胖症(Vaisse et al, 1998)。有统计显示, 有4%的肥胖患者都是由于MC4R基因突变引起的(Froguel et al, 2001)。在小鼠中敲除该基因, 小鼠表现出多食、肥胖、胰岛素分泌过多等症状(Huszar et al, 1997)。由于MC4R在能量调控中发挥的重要作用, 在疾病治疗和农业方面, MC4R受到越来越多的关注。
MC4R作为一种脑神经受体主要分布于脑中, 在其他组织内也有着不同程度的分布。MC4R的组织表达在哺乳动物和家禽有着较多的研究。Mountjoy等(1994)通过原位杂交技术对大鼠脑内MC4R的表达进行检测, 结果显示MC4R在皮质、丘脑、下丘脑、脑干和脊髓内均有表达。王婕等(2011)对鸭的MC4R基因的组织表达差异进行了分析, 结果显示, 肌肉、脂肪、心脏、肾脏、脾脏和脑中均有不同程度的表达。在鱼类中, MC4R的组织表达在齐口裂腹鱼(Schizothorax prenati, Wei et al, 2013), 金鱼(C. auratus var., Cerdá-Reverter et al, 2003), 虹鳟(Oncorhynchus mykiss, Haitina et al, 2004)和蛇皮鱼(Snakeskin gourami, Jangprai et al, 2011)等鱼中有所研究, 均在脑中有着较高的表达。
单核苷酸多态(single nucleotide polymorphisms, SNPs)是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性(Lander, 1996)。SNPs分布极为广泛, 平均每1000bp的基因就含有一个SNPs (Zhao et al, 2003)。分布于基因内的SNP可能会对mRNA的表达, 翻译和剪切以及蛋白质的结构和功能造成影响, 从而导致生物体性状的改变(Carroll et al, 2005)。MC4R的SNPs与生物体的性状关联分析在家畜和家禽中有着广泛的研究, 但在鱼类中罕有报道, 只对吉富罗非鱼(Oreochromis niloticus)和红鳍东方鲀(Takifugu rubripes) MC4R的SNPs有所研究(刘福平等, 2009; 张丽等, 2012)。
缩骨鲫(C. auratus sogu var.)主要分布于湖南与广东, 因其尾部脊椎萎缩而得名, 在广东有一定规模的养殖(谢楠等, 2016)。其躯体较高, 体长约为体高的1.6倍。距背鳍前基部三分之一处的后部脊椎骨呈萎缩状, 尾柄长远小于尾柄高。背鳍后基部的两侧肌肉发达。这种体型并非病态, 而是纯粹的遗传所致(俞豪祥等, 1986)。缩骨鲫肉质鲜美, 营养丰富, 但是生长较为缓慢。故以能量代谢密切相关的MC4R作为本实验的候选基因, 对其克隆, 序列分析, 表达分布以及检测与生长潜在相关SNPs, 为缩骨鲫生长和发育的分子机制研究以及遗传育种提供基础资料。
1 材料与方法 1.1 实验用鱼实验用缩骨鲫14尾, 体质量为(106±8.7) g, 取自广东韶关水产研究所, 饲养于广州大学水产养殖室的水族箱内。
1.2 实验试剂Ezup柱式动物基因组DNA抽提试剂盒和SanPrep柱式DNA胶回收试剂盒购自生物工程(上海)股份有限公司; Taq酶和RNA keeper购自Vazyme Biotech公司。PMD19-T、大肠杆菌DH5α感受态、RNAiso、PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)和SYBR® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus), ROX plus均购自TaKaRa公司。
1.3 引物设计和序列的克隆根据鲫鱼MC4R基因设计两对CDs区域的引物(MC4R1F, MC4R1R, MC4R2F和MC4R2R)和一对3’非翻译区引物(MC4R3F和MC4R3R), 根据已扩增出缩骨鲫MC4R片段, 设计三条染色体步移引物MC4R4、MC4R5、MC4R6和一对Real-time PCR引物(表 1)。剪取25mg缩骨鲫背部肌肉, 使用生工DNA提取试剂盒抽提基因组DNA。使用上述的引物对缩骨鲫基因组DNA进行扩增, 纯化后, 转入大肠杆菌, 送至上海美吉生物医药科技有限公司测序并使用Seqman拼接。
| 引物 | 序列(5′→3′) |
| MC4R1F | ATGAACACCTCACATCATCATG |
| MC4R1R | TGGTGAAGAACATGCTGATAAG |
| MC4R2F | CTACATCACAATCTTCTACGCT |
| MC4R2R | CTATACACACAGAGAGGTCAAT |
| MC4R3F | ATGTGCAACTCGGTCATAGACC |
| MC4R3R | GGGATAAATGAGAGTTTATTGGAGG |
| MC4R4 | GGGTCATGATGTTGTGGTAGCG |
| MC4R5 | GAAGATCGTGATGTAGCGGTCC |
| MC4R6 | CAAATGGAGGCCAACAGTGAGC |
| QMC4RF | AGCTGTAGCAGACTTGTTGGTC |
| QMC4RR | TGTTCTTGATGATGCTCTCGCG |
| β-actinF | CAGCCATCCTTCCTAGGTATG |
| β-actinR | TCTGCATACGGTCAGCAATGC |
将测序获得MC4R基因片段利用DNAstar 7.1的Seqman对序列进行拼接、比对, 获得缩骨鲫MC4R基因组基因全序列, NCBI登录号为KX988002。利用ExPASy-ProtParam tool在线分析工具分析缩骨鲫MC4R基因编码蛋白的理化性质。使用TMHMM Server v. 2.0对缩骨鲫MC4R蛋白的跨膜结构预测。使用Mega 5.0软件对已公布的部分MC4R以及MCR家族的氨基酸序列(表 2)进行多重比对, 并使用NJ法构建分子系统发育树, Bootstrap检验重复1000次。
| 物种 | 登录号 | 蛋白 |
| 缩骨鲫C. auratus sogu var. | KX988002 | MC4R |
| 鲫鱼C. auratus | CAD58853.1 | MC4R |
| 鲤鱼Cyprinus carpio | CBX89936.1 | MC4R |
| 斑马鱼Danio rerio | NP_775385.1 | MC4R |
| 齐口裂腹鱼S. prenanti | AGF80338.1 | MC4R |
| 三刺鱼Gasterosteus aculeatus | ALF99996.1 | MC4R |
| 赤魟 Dasyatis akajei | BAU98233.1 | MC4R |
| 五线鳉Aphyosemion striatum | SBP15058.1 | MC4R |
| 拉氏假鳃鳉Nothobranchius rachovii | SBR74851. 1 | MC4R |
| 剑尾鱼Xiphophorus maculatus | AHC02878.1 | MC4R |
| 乌鳢Channa argus | AMM02541.1 | MC4R |
| 金钱鱼Scatophagus argus | AOQ25859.1 | MC4R |
| 牙鲆Paralichthys olivaceus | ADP09415.1 | MC4R |
| 海鲈Dicentrarchus labrax | CBN82190.1 | MC4R |
| 非洲爪蟾Xenopus tropicalis | XP_004915370.1 | MC4R |
| 原鸡Gallus gallus | NP_001026685.1 | MC4R |
| 灰雁Anser anser | ABF19809.1 | MC4R |
| 原鸽Columba livia | ACC60975.1 | MC4R |
| 家鼠Mus musculus | NP_058673.2 | MC4R |
| 人Homo sapiens | NP_005903.2 | MC4R |
| 牛Bos Taurus | NP_776535.1 | MC4R |
| 绵羊Ovis aries | AFJ95892.1 | MC4R |
| 鲫鱼C. auratus | CAE11349.1 | MC5R |
| 斑马鱼D. rerio | AAI62747.1 | MC3R |
| 斑马鱼D. rerio | AAO24742.1 | MC1R |
| 斑马鱼D. rerio | AAO24743.1 | MC2R |
取3尾缩骨鲫的9个组织:脑、眼、心脏、卵
巢、肝胰脏、肠、肾脏、鳃和肌肉迅速放入RNA keeper中, 使用trizol法提取总RNA, 使用2%琼脂糖电泳检测RNA质量。按照PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)说明书进行反转录。该实验使用的荧光定量PCR平台是ABI7000, 按照SYBR® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)试剂盒要求进行Real-time PCR对9种组织的mRNA表达量进行检测, 每一个样品设置三个重复。对PCR产物进行溶解曲线检测, 并送至上海美吉生物医药科技有限公司测序, 以确定扩增基因为目的基因。本实验使用β-actin作为内参基因(表 1), QMC4RF和QMC4RR作为缩骨鲫MC4R特异性引物。使用2–ΔΔct法对不同组织的相对表达量进行计算并作图。
1.6 与生长相关的SNPs的检测在一同时孵化, 饲养条件相同的缩骨鲫群体内, 选取5条较大个体和5条较小个体, 作为筛选与生长相关的SNPs的样本, 并剪其鳍条, 提取基因组DNA。将提取的10尾缩骨鲫基因组DNA混合成基因池, 使用MC4R1F、MC4R1R、MC4R2F和MC4R2R两对引物以该基因池为模板分别对两段CDs进行扩增, 并送至上海美吉生物医药科技有限公司测序, 得到的结果使用Chromas 2.33查看, 筛选SNPs点, 并对SNPs位点进行初步分析。
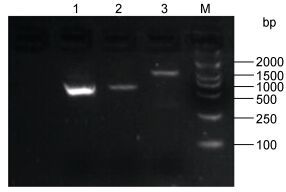
2 结果 2.1 缩骨鲫的MC4R基因组基因获得与分析缩骨鲫MC4R CDs以及3’非翻译区的扩增片段如图 1所示, 启动子区域通过染色体步移获得, MC4R基因组基因长度为2854bp, 只包含一个外显子, 长度为981bp, 共编码326个氨基酸, 缩骨鲫MC4R序列的具体分析见图 2。推测的MC4R蛋白预计分子量为36531.58, 等电点为8.45。其氨基酸组成中以亮氨酸(Leu)的含量最高(12.6%), 含量最低的是色氨酸(Trp), 为1.5%, 其他氨基酸含量在1.8%—10.7%之间。此蛋白不稳定系数为35.65, 是一种较为稳定的蛋白。此外, 蛋白质氨基酸残基亲疏水性总平均数(GRAVY)为–0.713, 此蛋白为疏水蛋白。
 |
| 图 2 缩骨鲫MC4R核苷酸序列与推测的氨基酸序列 Fig. 2 MC4R nucleotide sequence and predicted amino acid sequence of C. auratus sogu var. 注:加框表示启动子元件, 下划线表示跨膜结构, 加粗表示启动子, 阴影部分表示加尾信号, 下划线加粗表示跨膜结构, 加框加粗表示SNPs, 星号表示终止密码子 |
缩骨鲫MC4R氨基酸序列的跨膜结构使用TMHMM Server v. 2.0进行分析, 结果显示, 该蛋白共有七个跨膜结构, 与其他G蛋白偶联受体相同。跨膜蛋白N-末端位于细胞膜外, C-末端位于细胞膜内七个跨膜结构的位置分别为45—67, 79—101, 121—143, 163—185, 195—217, 243—265和280—302(图 2)。
2.3 缩骨鲫MC4R的同源性分析对比GenBank中已经公布的一些物种的MC4R和MCRs氨基酸序列, 结果显示, 缩骨鲫与鲫鱼的MC4R氨基酸序列的同源度最高达到99.3%, 与鲤鱼的同源度次之达到98.6%, 缩骨鲫与其他鲤科鱼类的同源度为97.9%—97.5%, 鲤科鱼类中的MC4R非常保守。缩骨鲫与其他硬骨鱼类的同源度为83.4%— 79.7%, 与软骨鱼类赤魟的同源度为75.3%, 与陆生动物的同源度为71.2%—68.9%。在MCRs家族中, 缩骨鲫MC4R与鲫鱼的MC5R最为同源, 达到68.4%。另外, 与斑马鱼的MC3R的同源度为60.5%, 与斑马鱼MC1R的同源度为42.5%, 与斑马鱼的MC2R同源度为25.7%。总而言之, MC4R在不同的物种内相对保守, MCRs家族间有着较大差异。
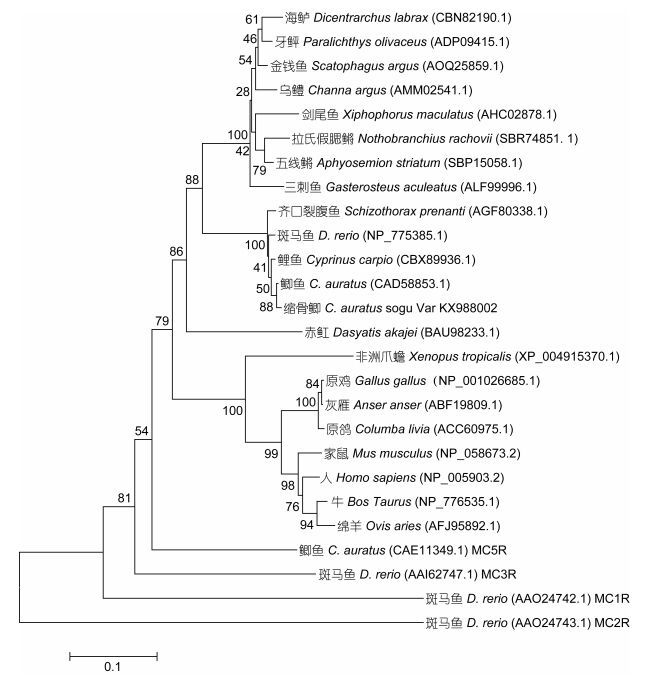 |
| 图 3 不同物种MC4R以及MCRs家族氨基酸序列的系统发育树 Fig. 3 Phylogenetic tree of MC4R of different species and MCRs family |
通过Real-time PCR对缩骨鲫MC4R在不同组织内的表达量研究。Real-time PCR的扩增产物溶解曲线为单峰, 测序结果确认扩增产物为目的片段。Real-time PCR结果表明, 在缩骨鲫脑中MC4R中含量最高, 眼中次之, 肌肉, 卵巢和肾脏中表达较少, 在鳃、肠、心脏和肝胰腺中微量表达(图 4)。
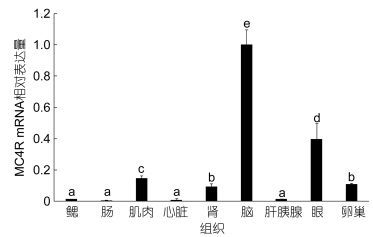 |
| 图 4 缩骨鲫MC4R mRNA在不同组织内的表达 Fig. 4 Relative expression of MC4R mRNA in tissues of in C. auratus sogu var. |
在缩骨鲫的CDs区域中, 有6个SNPs被检测到(图 2), 以编码区第1个核苷酸为1, 编码区下游为正值, 对SNPs进行命名, 分别为A123G、A199G、C231T、A444G、C480T和A881C (图 5), A123G位同义突变(CTA > CTG), 均编码亮氨酸; A199G为错义突变(ATC > GTC), 分别编码异亮氨酸和缬氨酸, 均为非极性氨基酸, 该突变位于第一个跨膜结构内; C231T为同义突变(TAC > TAT), 均编码酪氨酸; A444G为同义突变(ACG > ACA), 均编码苏氨酸; C480T为同义突变(ACT > ACC), 均编码苏氨酸, A881C位错义突变(CAC > CAA), 分别编码组氨酸和谷氨酰胺, 位于第四个细胞外结构区。这些突变均可能对缩骨鲫的生长数量性状造成影响。
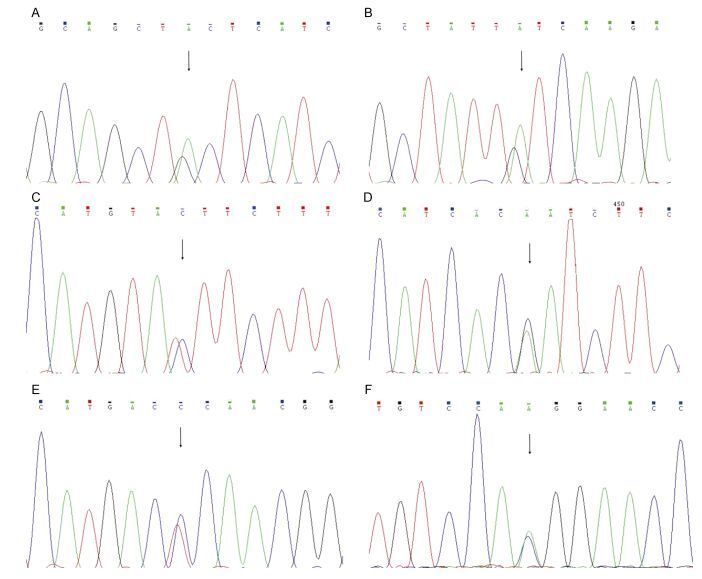 |
| 图 5 缩骨鲫MC4R编码区的SNPs位点 Fig. 5 The SNPs in CDs of C. auratus sogu var. 注: A—F分别代表A123G, A199G, C231T, A444G, C480T和A881C的测序峰图 |
缩骨鲫MC4R与部分GenBank公布MC4R的序列和MCRs家族成员比对显示, 缩骨鲫与鲫鱼的同源性最高达到99.3%, 这与刘良国等(2005)采用RAPD方法分析鲫鱼品系所得出的结果相符:缩骨鲫可能是由普通鲫鱼分化而来。鲤科鱼类中, MC4R的同源度都很高, 可达97.5%—99.3%, 这意味着MC4R在生理调控方面可能有着重要作用。MC4R与其他MCR家族成员同源度为25.7%—68.4%, 其中, MC4R与MC3R和MC5R的同源度相对其他MCRs成员较高, 分别为68.4%和60.5%, 有报道称这三个黑色素皮质素受体在功能上有所重叠(Shukla et al, 2013), 这可能是由于MC4R与MC5R和MC3R相对于其他MCR家族成员分化时间较短有关。另外, Klovins等(2004)的实验结果显示在白斑角鲨(Squalus acanthias)中, MC4R与MC3R和MC5R的同源度相对于其他MCRs成员也是最高的, 本实验结果与其相符。多重比对显示, 鱼类中的MC4R与陆生动物有着较大的差异, 鱼类MC4R氨基酸长度多为326—327aa, 但是陆生动物中MC4R氨基酸残基长度一般332aa左右。另外, 通过MC4R氨基酸序列构建的分子系统发育树与形态学的系统分类结果基本吻合。
缩骨鲫的MC4R mRNA表达主要分布于脑中, 在肌肉, 肾脏, 眼和卵巢中也有不同程度的分布, 在鳃, 肝胰腺, 肠和心脏中微量表达。缩骨鲫在脑, 肌肉, 肾脏, 眼和卵巢中的表达与蛇皮鱼较为相似(Jangprai et al, 2011); 在金鱼中, MC4R在脑, 眼和性腺中同样有着显著的分布(Cerdá-Reverter et al, 2003)。在虹鳟中, MC4R也主要集中于脑, 肾脏和性腺中表达, 但在肌肉中表达较少, 与缩骨鲫相异。MC4R作为一种中枢神经受体, 故而在脑中有着较高的表达(Ellacott et al, 2004); MC4R与性行为有着密切的关联, 这可能是MC4R在性腺中有着显著的表达的原因(Lh et al, 2002); MC4R在肾中的显著表达, 可能与肾脏是重要的调节能量平衡的器官并且肾脏中有着POMC衍生物的存在有关(Bertile et al, 2006)。有报道称MC4R存在于肌肉中, 可能与代谢调节有关(刘欣等, 2012), 但是其对肌肉及其周围组织的作用尚不清楚。
本实验共发现位于缩骨鲫MC4R编码区上的6个SNPs, 其中四个同义突变, 两个错义突变, 在很多研究中, 同义突变同样会影响生物体的生长性状, 这主要是因为同义突变可能会改变蛋白的折叠空间结构, 导致蛋白的功能发生变化(Kimchi-Sarfaty et al, 2007), 这在多种动物中均有报道(刘德武等, 2008; 付金秀等, 2016)。Komar (2007)也认为只有少数的同义突变属于中性突变, 大部分的同义突变会对个体造成影响。A199G为错义突变(ATC > GTC), 分别编码异亮氨酸和缬氨酸, 但均为非极性疏水氨基酸, 这种变化并不会对该蛋白造成致命的影响, 但是很有可能影响缩骨鲫的性状。A881C为错义突变(CAC > CAA), 分别编码组氨酸和谷氨酰胺, 位于第四个细胞外结构区, 两个氨基酸均为极性氨基酸, 同样不是致命的, 但是否对缩骨鲫的个体性状有影响, 还需要大规模的群体进行SNPs与性状的关联分析。
4 结论本文采用同源克隆及染色体步移对缩骨鲫MC4R基因进行了克隆, 得到了缩骨鲫MC4R的基因序列长度为2854bp, 只包含一个外显子, 长度为981bp, 共编码326个氨基酸, MC4R共有七个跨膜结构, 是较为稳定的疏水蛋白。该基因与其他鱼类相比具有较高的同源度, 但与陆生动物的同源度相对较低。缩骨鲫MC4R mRNA在脑中表达量最为显著, 眼中次之, 肌肉、卵巢和肾脏中表达较少, 在鳃、肠、心脏和肝胰腺中仅微量表达。另外还发现了位于编码区上的6个潜在的与生长性状相关联的SNP位点。本实验可为研究缩骨鲫的生长和发育的调控机制以及分子辅助育种提供基础资料和理论依据。
| 王婕, 刘小林, 侯水生, 等, 2011. 北京鸭MC4R基因的克隆及其组织表达的差异. 西北农业学报, 20(1): 29–34 |
| 左北瑶, 钱宏光, 2011. MC4R基因研究进展. 中国草食动物, 31(5): 45–50 |
| 付金秀, 郭红威, 李超, 等, 2016. 鸡DGAT2基因第7外显子多态性与生产性能的关联. 农业生物技术学报, 24(5): 689–696 |
| 刘欣, 金勇君, 杨美子, 等, 2012. MC5R在促黑素对骨骼肌细胞脂肪酸氧化影响中的作用. 中国现代医学杂志, 22(17): 12–16 DOI:10.3969/j.issn.1005-8982.2012.17.003 |
| 刘良国, 赵俊, 陈湘粦, 2005. 彭泽鲫两个雌核发育克隆与三个鲫鱼品系的RAPD分析. 淡水渔业, 35(2): 13–16 |
| 刘福平, 白俊杰, 叶星, 等, 2009. 罗非鱼MC4R基因克隆及与其生长相关的SNPs位点. 中国水产科学, 16(6): 816–823 |
| 刘德武, 杜颖军, 张豪, 等, 2008. 猪Leptin基因的SNP筛查及其与生长性状的关联分析. 华中农业大学学报, 27(2): 251–257 |
| 张丽, 仇雪梅, 王娟, 等, 2012. 红鳍东方鲀(Takifugu rubripes)MC4R基因的多态性分析. 生物技术通报,(7): 97–102 |
| 俞豪祥, 张海明, 1986. "缩骨鲫"的生物学及养殖试验初报. 水产科技情报,(3): 21 |
| 谢楠, 刘凯, 冯晓宇, 2016. 鲫鱼常见品种概述. 杭州农业与科技,(4): 13–17 |
| Bertile F, Raclot T, 2006. The melanocortin system during fasting. Peptides, 27(2): 291–300 DOI:10.1016/j.peptides.2005.03.063 |
| Carroll L, Voisey J, van Daal A, 2005. Gene polymorphisms and their effects in the melanocortin system. Peptides, 26(10): 1871–1885 DOI:10.1016/j.peptides.2004.12.031 |
| Cerdá-Reverter J M, Ringholm A, Schith H B, et al, 2003. Molecular cloning, pharmacological characterization, and brain mapping of the melanocortin 4 receptor in the goldfish:involvement in the control of food intake. Endocrinology, 144(6): 2336–2349 DOI:10.1210/en.2002-0213 |
| Ellacott K L, Cone R D, 2004. The central melanocortin system and the integration of short-and long-term regulators of energy homeostasis. Recent Progress in Hormone Research, 59: 395–408 DOI:10.1210/rp.59.1.395 |
| Froguel P, Boutin P, 2001. Genetics of pathways regulating body weight in the development of obesity in humans. Experimental Biology and Medicine, 226(11): 991–996 DOI:10.1177/153537020122601105 |
| Haitina T, Klovins J, Andersson J, et al, 2004. Cloning, tissue distribution, pharmacology and three-dimensional modelling of melanocortin receptors 4 and 5 in rainbow trout suggest close evolutionary relationship of these subtypes. Biochemical Journal, 380(2): 475–486 DOI:10.1042/bj20031934 |
| Huszar D, Lynch C A, Fairchild-Huntress V, et al, 1997. Targeted disruption of the melanocortin-4 receptor results in obesity in mice. Cell, 88(1): 131–141 DOI:10.1016/S0092-8674(00)81865-6 |
| Jangprai A, Boonanuntanasarn S, Yoshizaki G, 2011. Characterization of melanocortin 4 receptor in Snakeskin gourami and its expression in relation to daily feed intake and short-term fasting. General and Comparative Endocrinology, 173(1): 27–37 DOI:10.1016/j.ygcen.2011.04.021 |
| Kimchi-Sarfaty C, Oh J M, Kim I W, et al, 2007. A "silent" polymorphism in the MDR1 gene changes substrate specificity. Science, 315(5811): 525–528 DOI:10.1126/science.1135308 |
| Klovins J, Haitina T, Ringholm A, et al, 2004. Cloning of two melanocortin (MC) receptors in spiny dogfish:MC3 receptor in cartilaginous fish shows high affinity to ACTH-derived peptides while it has lower preference to γ-MSH. European Journal of Biochemistry, 271(21): 4320–4331 DOI:10.1111/ejb.2004.271.issue-21 |
| Komar A A, 2007. Silent SNPs:impact on gene function and phenotype. Pharmacogenomics, 8(8): 1075–1080 DOI:10.2217/14622416.8.8.1075 |
| Lander E S, 1996. The new genomics:global views of biology. Science, 274(5287): 536–539 DOI:10.1126/science.274.5287.536 |
| Lh V D P, Martin W J, Howard A D, et al, 2002. A role for the melanocortin 4 receptor in sexual function. Proceedings of the National Academy of Sciences of the United States of America, 99(17): 11381–11386 DOI:10.1073/pnas.172378699 |
| Mountjoy K G, Mortrud M T, Low M J, et al, 1994. Localization of the melanocortin-4 receptor (MC4-R) in neuroendocrine and autonomic control circuits in the brain. Molecular Endocrinology, 8(10): 1298–1308 |
| Shukla C, Koch L G, Britton S L, et al, 2013. Differential contribution of brain-region-specific melanocortin 5 receptor to physical activity levels in lean vs. obesity-prone rats. The FASEB Journal, 27: 935.1 |
| Vaisse C, Clement K, Guy-Grand B, et al, 1998. A frameshift mutation in human MC4R is associated with a dominant form of obesity. Nature Genetics, 20(2): 113–114 DOI:10.1038/2407 |
| Van der Ploeg L H T, Martin W J, Howard A D, et al, 2002. A role for the melanocortin 4 receptor in sexual function. Proceedings of the National Academy of Sciences of the United States of America, 99(17): 11381–11386 DOI:10.1073/pnas.172378699 |
| Vrinten D H, Gispen W H, Groen G J, et al, 2000. Antagonism of the melanocortin system reduces cold and mechanical allodynia in mononeuropathic rats. The Journal of Neuroscience, 20(21): 8131–8137 |
| Wei R B, Yuan D Y, Zhou C W, et al, 2013. Cloning, distribution and effects of fasting status of melanocortin 4 receptor (MC4R) in Schizothorax prenanti. Gene, 532(1): 100–107 DOI:10.1016/j.gene.2013.09.068 |
| Zhao Z M, Fu Y X, Hewett-Emmett D, et al, 2003. Investigating single nucleotide polymorphism (SNP) density in the human genome and its implications for molecular evolution. Gene, 312: 207–213 DOI:10.1016/S0378-1119(03)00670-X |
 2017, Vol. 48
2017, Vol. 48