中国海洋湖沼学会主办。
文章信息
- 王昊盛, 宋鑫金, 董文强, 吴斌, 陈永霞, 卢玮筱, 祁鹏志, 郭宝英. 2017.
- WANG Hao-Sheng, SONG Xin-Jin, DONG Wen-Qiang, WU Bin, CHEN Yong-Xia, LU Wei-Xiao, QI Peng-Zhi, GUO Bao-Ying. 2017.
- 厚壳贻贝(Mytilus coruscus)金属硫蛋白MT-10:cDNA克隆、结构分析及铜离子胁迫下的表达
- THE CDNA CLONING AND CHARACTERIZATION OF MYTILUS CORUSCUS METALLOTHIONEIN 10 AS WELL AS ITS MRNA EXPRESSION UNDER THE CU2+ STRESS
- 海洋与湖沼, 48(4): 864-869
- Oceanologia et Limnologia Sinica, 48(4): 864-869.
- http://dx.doi.org/10.11693/hyhz20170300056
-
文章历史
- 收稿日期:2017-03-15
- 收修改稿日期:2017-04-03
厚壳贻贝(Mytilus coruscus), 属贻贝目(Mytiloida)、贻贝科(Mytilidae)、贻贝属(Mytilus), 是海洋双壳贝类中生长速度最快的种类之一。主要分布于我国黄渤海、东海、台湾等地, 在日本北海道、韩国济州岛等地也有分布。随着工业进程的不断深入, 给沿海海域环境带来巨大压力, 工业废水、船舶油污、生活污水等造成的海水污染不断加剧, 许多重金属严重超标(郭远明等, 2012)。重金属不易降解, 在食物链中不断富集, 人类食用富含重金属的鱼虾贝等海产品会产生中毒现象, 对健康危害极大(Shuai et al, 2001)。双壳贝类对重金属具有较强的生物富集能力, 且活动性低, 是天然的重金属污染指示物。其在重金属胁迫下的变化可间接反映在高浓度金属离子胁迫下生物机体内的氧化反应程度, 是指示环境污染的重要标志(Moore et al, 2004)。贻贝作为重金属污染指示物在很多国家已经得到应用(Miller, 1999), 相关基础研究也逐渐得到重视。但现阶段国内外对贻贝的研究主要集中于翡翠贻贝与紫贻贝, 对厚壳贻贝的研究主要集中在人工育苗养殖(常抗美等, 2007), 遗传特异性(Ye et al, 2012)以及营养成分比对分析(Kim et al, 2012)等方面。本研究旨在填补贻贝属中厚壳贻贝的作为重金属污染指示物研究, 为今后对厚壳贻贝进行更加全面深入的科研提供基础。
金属硫蛋白(metallothioneins, MT)是一种富含半胱氨酸(Cys)及金属离子的小分子蛋白。通常含有CC、CXC等结构, 因为半胱氨酸(Cys)能与重金属离子结合因而取名金属硫蛋白, 在一定程度上起到重金属解毒和自由基清除等修复作用(刘维青等, 2006)。MT蛋白在生物体内的的表达水平通常也反映了该生物对重金属的应激及自我修复能力, 同时也能作为环境中重金属浓度的指示物。近年来国内外已经出现了许多关于生物体内MT的报道(Wang et al, 2011), 主要集中于各种鱼类(Olsson et al, 1998; Roeva et al, 1999)和水生无脊椎动物(Roesijadi et al, 1991), 以及大量的软体动物(Isani et al, 1997; Langston et al, 1998)和甲壳动物(Roesijadi et al, 1997; Engel et al, 1993; Barka, 2000)。但厚壳贻贝MT基因的研究尚未见报道。本研究通过RACE技术克隆了厚壳贻贝MT-10全长cDNA序列, 通过铜离子胁迫, 模拟当前海洋环境重金属污染现状, 通过对厚壳贻贝细胞内MT-10 mRNA相对表达量的测定及分析, 论证厚壳贻贝遭遇重金属污染之后的应激行为及对重金属的自我修复能力, 为厚壳贻贝今后作为海洋环境中重金属浓度指示物提供理论基础。同时也为解决当前厚壳贻贝养殖业面对海洋重金属污染的困境提供一定建议。
1 材料与方法 1.1 实验材料本次实验所用的厚壳贻贝(Mytilus coruscus)于2016年10月采集于舟山东极青浜岛附近海域, 外壳平均长度为(9.25±0.43) cm, 壳宽(4.51±0.3) cm, 壳高(3.05±0.20) cm, 湿重(60.18±6.45) g。清污后置于蓝色养殖桶内暂养, 每天换取经过过滤的海水, 10d之后选择生命特征明显的个体进行对照实验。
1.2 方法 1.2.1 铜离子胁迫将选择后的厚壳贻贝随机分为两组, 每组40只。实验组海水中加入硫酸铜作为铜离子源, 使Cu2+终浓度为20μg/L。每天换水一次, 更新一半并在实验组中添加硫酸铜维持Cu2+浓度。
1.2.2 RNA提取及逆转录处理后2d、5d、10d、15d、21d、28d进行取样。对照组和实验组随机取出4个的厚壳贻贝, 解剖得到外套膜及消化腺存放于–80℃冰箱内暂存。采集厚壳贻贝腮、性腺、消化腺、血细胞、肾脏、肌肉及外套膜组织, 存放于–80℃冰箱内暂存。待样品全部采集完成之后带回实验室提取总RNA。RNA提取采用常规TRIzol RNA提取方法进行, RNA提取完成后立即进行逆转录, 逆转录步骤参考RevertAidTM First StrandcDNA Synthesis Kit说明书。
1.2.3 引物设计及Mc-MT-10全长cDNA克隆通过NCBI查找并下载已知的双壳贝类MT蛋白氨基酸序列并进行序列比对, 在保守区设计一对特异引物MT-F: ATGSCTGCACCTTGTAACTGYATY, MT-R: TCAYTTGCAGGARCANCCAGRTKC, 克隆Mc-MT-10基因部分cDNA片段, 并送武汉转导生物科技有限公司进行Race测序。
1.2.4 Mc-MT-10荧光定量分析逆转录后的cDNA为模板稀释后作为Q-PCR的模板, 以厚壳贻贝β-actin为内参, MT-F、MT-R为引物进行Q-PCR实验, 分析Mc-MT-10组织表达谱及铜离子胁迫下的表达变化。
1.2.5 数据处理及分析运用最小二乘法2–ΔΔCt法(Livak et al, 2001)处理Q-PCR数据, 以溶解曲线判定扩增产物的特异性, 利用SPSS 13.0软件对数据进行分析, 采用单因子方差分析显著性差异。通过Oligin软件对数据进行处理并导出柱状图。
2 结果与分析 2.1 Mc-MT-10基因分析经Race测序获得Mc-MT-10基因cDNA全长序列(图 1), 注册序列号为KX987251。该序列全长为431bp, 包含101bp的5′-UTR区, 108bp的3′-UTR区, ORF区全长为222bp, 推导其编码73个氨基酸。预测其分子量为72.81kDa, 等电点为7.24。其分子式为C274H460N86O101S22, 含943个原子。预测分子量大小和等电点分别为76.11kDa和9.027, 原子总数10747, 分子式C3365H5400N950O1005S27, 不稳定系数44.34。用Clustal W软件将Mc-MT-10氨基酸序列与其他物种MT-10序列进行比对(图 2), 发现19个保守的Cys, 其中9对Cys与其相邻的氨基酸构成9个CXC结构。另外, CKCXXXCXCX结构也是软体动物金属硫蛋白常见的保守结构, 在Mc-MT-10蛋白序列中也发现存在一个类似结构域。
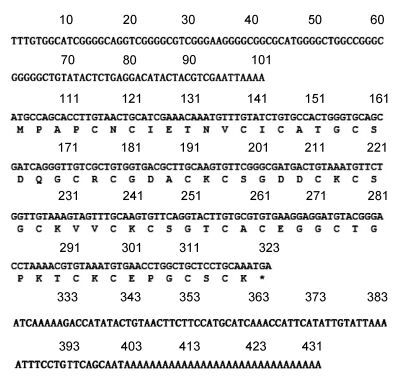 |
| 图 1 厚壳贻贝MT-10基因cDNA及氨基酸序列 Fig. 1 The whole sequence of cDNA and deduced amino acid sequence of Mc-MT-10 |
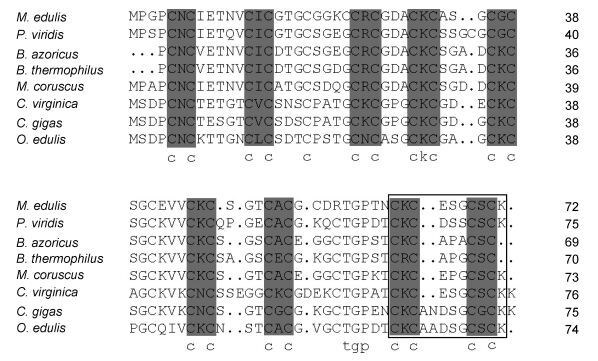 |
| 图 2 MT-10蛋白氨基酸多序列比对 Fig. 2 The multiple alignments of amino acid sequences of MT-10s 注:黑色阴影部分为保守的CXC结构, 黑色方框为CKCXXXCXCX结构 |
构建了基于Neighbor-joining的系统进化树, boot值为5000(图 3)。在进化树中, Mc-MT-10首先与同属物种M. galloprovincialis的MT-10聚合在一起, 通过单序列比对, Mc-MT-10与Mg-MT-10核苷酸相似度为93.15%。而后与同属或科中的同源物聚合成一个大的分支, 与脊椎动物的相距较远。厚壳贻贝MT-10的进化地位与厚壳贻贝的生物学分类地位基本一致, 显示了较强的保守性。
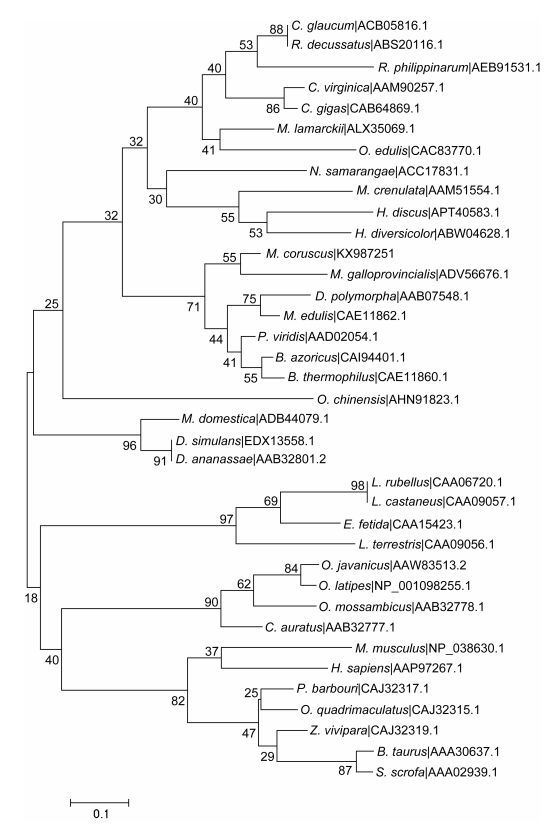 |
| 图 3 基于Neighbor Joining的系统进化树 Fig. 3 The phylogenetic tree constructed based on Neighbor Joining method |
用qRT-PCR技术检测了Mc-MT-10基因在厚壳贻贝腮、肌肉、消化腺、外套膜、血细胞、性腺和肾脏等组织中的表达情况, 结果表明Mc-MT-10基因在各组织中均有表达, 在消化腺中的表达量最高, 其次为腮、血细胞和肾脏, 在肌肉、外套膜和性腺中的表达量最低(图 4)。
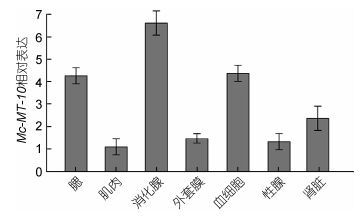 |
| 图 4 厚壳贻贝MT-10 mRNA组织表达谱 Fig. 4 The tissues distributions of MT-10 mRNA in M. coruscus |
用qRT-PCR技术检测了厚壳贻贝外套膜和消化腺Mc-MT-10基因在Cu2+胁迫下的表达情况(图 5, 图 6)。实验结果表明:铜离子胁迫下, 外套膜和消化腺Mc-MT-10基因呈现类似的表达模式。处理2d时, Mc-MT-10基因表达量显著升高, 5d时, 表达量达到峰值, 而后逐渐下降, 处理15d时, 消化腺Mc-MT-10基因表达量已回落至正常水平, 实验结束时(28d), 外套膜Mc-MT-10基因表达量回落至接近正常水平。但两种组织Mc-MT-10基因表达量变化并不完全相同, 外套膜中Mc-MT-10基因表达量变化显著高于消化腺。
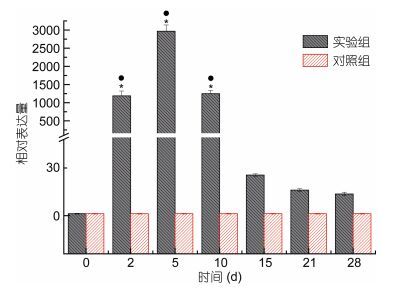 |
| 图 5 铜离子胁迫下厚壳贻贝外套膜组织MT-10 mRNA表达变化 Fig. 5 The expression analysis of MT-10 mRNA in mantle of M. coruscus under Cu2+ stress |
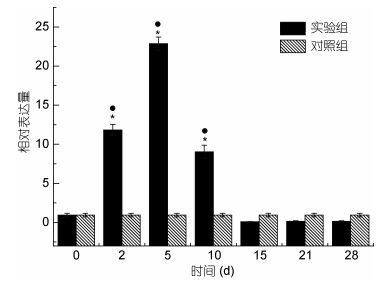 |
| 图 6 铜离子胁迫下厚壳贻贝消化腺组织MT-10 mRNA表达变化 Fig. 6 The expression analysis of MT-10 mRNA in digestive glands of M. coruscus under Cu2+ stress |
金属硫蛋白一类广泛存在于生物界的低分子量蛋白, 富含半胱氨酸, 由于Cys巯基能共价结合金属离子, 是金属结合位点, 因此其对多种重金属, 如铜、镉及锌具有高度亲和性, 可参与生物体中对金属元素的解毒过程(Coyle et al, 2002)。本研究中, 厚壳贻贝MT-10蛋白含有19个Cys残基, 含量达26.0%, 显示其发达的金属结合能力, 这与在其他软体动物的报道相一致(Engelken et al, 1999; 吕达等, 2012)。CXC结构是软体动物MT蛋白的显著特征, 结果发现厚壳贻贝MT-10蛋白含有9个CXC结构, 经序列比对, 发现此类CXC结构在软体动物MT蛋白中的高度保守。有研究认为, 软体动物MT蛋白还存在保守的CKCXXXCXCX结构(Imagawa et al, 1990), 本研究发现厚壳贻贝MT-10蛋白也存在一个这样的结构域, 同大部分软体动物的发现相一致, 但在海湾扇贝(Argopecten irradians) MT蛋白中却存在两个类似结构, 而且其包含145个氨基酸, Cys含量高达27.6, 显示了更强的重金属结合能力, 可能是两物种进化过程所处环境差异造成的, A. irradians在进化过程中所面对的重金属环境压力更大(刘维青等, 2006)。基于Neighbor-joining的系统进化树表明厚壳贻贝MT-10的进化地位与厚壳贻贝的生物学分类地位基本一致, 显示了较强的保守性。
厚壳贻贝MT-10的组织表达谱表明, MT-10在各组织中是广泛存在的, 显示其广泛参与各类生命活动。而在消化腺以及腮、血细胞和肾脏中的表达量较高, 在软体动物中此类组织均为重要的免疫组织, 参与对外界刺激的应急、防御及免疫调控等, 进一步表明MT-10蛋白在厚壳贻贝中发挥重要的防御作用。
一些学者认为, 生物体内MT蛋白响应重金属胁迫呈现倒“U”型模式(Hermesz et al, 2001; Chan et al, 2004; Wu et al, 2006), MT蛋白适应重金属胁迫有一个剂量阈值, 即当重金属达到某一浓度时, 金属硫蛋白会随重金属剂量增加而上升, 一旦超出该浓度阈值, 重金属就会对生物体产生不可逆的毒性, 金属硫蛋白水平就会随重金属水平增加而降低。本研究发现, 随着处理时间的不断延长, MT-10蛋白的表达量逐渐升高, 到达峰值后逐步回落。在组织细胞吸收的铜离子剂量不断增加的情况下, 确实出现了典型的倒“U”型模式。研究结果表明, 在20μg/L铜离子胁迫下, 厚壳贻贝细胞内铜离子浓度阈值出现的时间在5d, 5d后MT-10蛋白的表达量就逐渐下降, 15d后其表达量回落至正常水平。
4 结论厚壳贻贝作为一种具有重要经济价值的海洋双壳贝类, 其作为环境指示生物的作用近年来也逐渐引起人们重视。本研究首次克隆了厚壳贻贝MT-10蛋白全长cDNA序列, 分析其结构特征, 并对其响应重金属胁迫的mRNA表达变化进行了初步研究。研究结果可为深入研究厚壳贻贝MT蛋白的功能奠定基础, 为厚壳贻贝抗重金属污染新品种选育提供数据支持, 为降低贻贝养殖业风险提供了重要依据。
| 刘维青, 倪多娇, 宋林生, 等, 2006. 海湾扇贝(Argopecten irradians)金属硫蛋白基因的克隆与分析. 海洋与湖沼, 37(5): 444–449 |
| 吕达, 罗凯娅, 潘宝平, 等, 2012. 青蛤(Cyclina sinensis)金属硫蛋白及硫氧还蛋白基因的克隆与表达分析. 海洋与湖沼, 43(1): 47–51 DOI:10.11693/hyhz201201007007 |
| 郭远明, 刘琴, 顾捷, 等, 2012. 4种海洋贝类对海水中铜(Cu)的富集能力. 水产学报, 36(5): 708–713 |
| 常抗美, 吴剑锋, 2007. 厚壳贻贝人工繁殖技术的研究. 南方水产, 3(3): 26–30 |
| Barka S, 2000. Processus de détoxication et localisation tissulaire des métaux traces (cuivre, zinc, nickel, cadmium, argent et mercure) chez un crustacé marin Tigriopus brevicornis (Müller). Etude du biomarqueur "protéines type métallothionéines", de la bioaccumulation des métaux et des conséquences sur le transfert trophique. Paris:Université de Paris |
| Chan P C, Shiu C K M, Wong F W Y, et al, 2004. Common carp metallothionein-1 gene:cDNA cloning, gene structure and expression studies. Biochimica et Biophysica Acta-Gene Structure and Expression, 1676(2): 162–171 DOI:10.1016/j.bbaexp.2003.11.009 |
| Coyle P, Philcox J C, Carey L C, et al, 2002. Metallothionein:The multipurpose protein. Cellular and Molecular Life Sciences, 59(4): 627–647 DOI:10.1007/s00018-002-8454-2 |
| Engel D W, Brouwer M, 1993. Crustaceans as models for metal metabolism:I. Effects of the molt cycle on blue crab metal metabolism and metallothionein. Marine Environmental Research, 35(1-2): 1–5 |
| Engelken J, Hildebrandt A, 1999. cDNA cloning and cadmium-induced expression of metallothionein mRNA in the zebra mussel Dreissena polymorpha. Biochemistry and Cell Biology, 77(3): 237–241 DOI:10.1139/o99-026 |
| Hermesz E, ábrahám M, Nemcsók J, 2001. Tissue-specific expression of two metallothionein genes in common carp during cadmium exposure and temperature shock. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 128(3): 457–465 |
| Imagawa M, Onozawa T, Okumura K, et al, 1990. Characterization of metallothionein cDNAs induced by cadmium in the nematode Caenorhabditis elegans. Biochemical Journal, 268(1): 237–240 DOI:10.1042/bj2680237 |
| Isani G, Serra R, Cattani O, et al, 1997. Adenylate energy charge and metallothionein as stress indices in Mytilus galloprovincialis exposed to cadmium and anoxia. Journal of the Marine Biological Association of the United Kingdom, 77(4): 1187–1197 DOI:10.1017/S0025315400038704 |
| Kim E K, Joung H J, Kim Y S, et al, 2012. Purification of a novel anticancer peptide from enzymatic hydrolysate of Mytilus coruscus. Journal of Microbiology and Biotechnology, 22(10): 1381–1387 DOI:10.4014/jmb |
| Langston W J, Bebianno M J, Burt G R, 1998. Metal handling strategies in molluscs. In:Langston W J, Bebianno M J eds. Metal Metabolism in Aquatic Environments. Dordrecht:Springer, 219-283 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-DD Ct method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Miller B S, 1999. Mussels as biomonitors of point and diffuse sources of trace metals in the clyde sea area, Scotland. Water Science and Technology, 39(12): 233–240 |
| Moore M N, Depledge M H, Readman J W, et al, 2004. An integrated biomarker-based strategy for ecotoxicological evaluation of risk in environmental management. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 552(1-2): 247–268 DOI:10.1016/j.mrfmmm.2004.06.028 |
| Olsson P E, Kling P, Hogstrand C, 1998. Mechanisms of heavy metal accumulation and toxicity in fish. In:Langston W J, Bebianno M J eds. Metal Metabolism in Aquatic Environments. Dordrecht:Springer, 321-350 |
| Roesijadi G, Fowler B A, 1991. Purification of invertebrate metallothioneins. Methods in Enzymology, 205: 263–273 DOI:10.1016/0076-6879(91)05106-6 |
| Roesijadi G, Brubacher L L, Unger M E, et al, 1997. Metallothionein mRNA induction and generation of reactive oxygen species in molluscan hemocytes exposed to cadmium in vitro. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 118(2): 171–176 DOI:10.1016/S0742-8413(97)00085-6 |
| Roeva N N, Sidorov A V, Yurovitskii Y G, 1999. Metallothioneins, proteins binding heavy metals in fish. Biology Bulletin, 26(6): 617–622 |
| Shuai J S, Wang L, 2001. Discussion about the health impact of heavy metal and the countermeasure. Environment and Exploitation, 16(4): 62 |
| Wang Q, Ning X X, Chen L L, et al, 2011. Responses of thioredoxin1 and thioredoxin-related protein 14 mRNAs to cadmium and copper stresses in Venerupis philippinarum. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 154(3): 154–160 |
| Wu S M, Jong K J, Lee Y J, 2006. Relationships among metallothionein, cadmium accumulation, and cadmium tolerance in three species of fish. Bulletin of Environmental Contamination and Toxicology, 76(4): 595–600 DOI:10.1007/s00128-006-0961-7 |
| Ye Y Y, Li J, Wu C W, et al, 2012. Genetic analysis of mussel (Mytilus coruscus) populations on the coast of East China Sea revealed by ISSR-PCR markers. Biochemical Systematics and Ecology, 45: 1–6 DOI:10.1016/j.bse.2012.07.022 |
 2017, Vol. 48
2017, Vol. 48


