
中国海洋湖沼学会主办。
文章信息
- 张涛, 苏倡, 刘艳, 张迪骏, 周君, 芦晨阳, 明庭红, 司开学, 苏秀榕. 2017.
- ZHANG Tao, SU Chang, LIU Yan, ZHANG Di-Jun, ZHOU Jun, LU Chen-Yang, MING Ting-Hong, SI Kai-Xue, SU Xiu-Rong. 2017.
- 泥蚶(Tegillarca granosa)重组铁蛋白富集重金属离子的特性及化学传感器的研究
- RESEARCH OF CHARACTERISTICS OF ENRICHMENT OF HEAVY METALS BY RECOMBINANT FERRITIN FROM TEGILLARCA GRANOSA
- 海洋与湖沼, 48(4): 870-876
- Oceanologia et Limnologia Sinica, 48(4): 870-876.
- http://dx.doi.org/10.11693/hyhz20170300067
-
文章历史
- 收稿日期:2017-03-23
- 收修改稿日期:2017-04-20
2. 宁波职业技术学院 宁波 315800
2. Ningbo Polytechnic, Ningbo 315800, China
泥蚶(Tegillarca granosa Linnaeus)俗称血蚶、花蚶、粒蚶、血螺等, 隶属于软体动物门(Mollusca), 瓣鳃纲(Lamellibranchia), 蚶目(Arcoida), 蚶科(Arcidae), 泥蚶属(Tegillarca), 主要分布于印度洋及西太平洋的热带、亚热带近岸海域, 在中国主要分布在黄、渤海以南的沿海地区, 是我国四大传统养殖贝类之一(李太武等, 2003; 苏秀榕等, 2005; 张春丹等, 2012)。
近年来, 随着沿海重金属污水排放的加重, 环境中的重金属通过食物链进入人体危害健康的事件, 使得泥蚶对于重金属的富集作用成为近年来研究的热点(Wang et al, 1999; 李学鹏等, 2008)。通过研究发现, 生物体通过铁结合蛋白和对铁的外界吸收来维持铁的稳态(孙雪松等, 2007)。泥蚶对重金属污染的抗逆性与其体内编码铁蛋白基因的表达密切相关控(Jin et al, 2011)。典型的铁蛋白结构是由蛋白9外壳和铁内核两部分构成, 其中蛋白外壳是由24个亚基自组装形成的笼状结构(Hamburger et al, 2005)。铁蛋白主要存在于大多数生物体内, 在铁的储存和维持体内铁代谢平衡方面具有重要的作用(Wang et al, 2009)。铁蛋白可以存储生物体内多余的铁, 同时铁诱导铁蛋白基因表达, 让机体内部产生铁蛋白对多余铁进行富集, 避免发生铁中毒(Stillman et al, 2001)。Zhang等(2007)发现在白斑综合症病毒或重金属刺激下, 铁蛋白基因明显上调。
由于近年来我国沿海城市经济发展, 水环境中重金属浓度的增加成为水体污染的主要因素之一。相比过去水中的重金属的直接检测, 海洋贝类生物对重金属的富集效应被认为更适宜检测水环境中的重金属污染程度。本研究利用原核表达工程菌表达重组铁蛋白, 通过圆二色光谱对纯化后的重组铁蛋白二级结构进行分析, 研究了对Fe2+、Mn2+、Cd2+、Cr3+、Hg2+、Pb2+和As3+等7种重金属离子的富集能力, 制备了可以检测Cd2+和Pb2+浓度的电化学生物传感器。
1 材料与方法 1.1 材料泥蚶重组铁蛋白由实验室制备。氯化亚铁(FeCl2), 氯化镉(CdCl2), 氯化锰(MnCl2), 氯化汞(HgCl2), 氯化铬(CrCl3), 氯化铅(PbCl2), 氯化砷(AsCl3), 铁氰化钾(K3[Fe (CN)6]), 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC), N-羟基丁二酰亚胺(NHS), 乙酸(CH3COOH), 乙酸钠(CH3COONa)等购于国药集团上海化学试剂有限公司。BCA总蛋白浓度测定试剂盒购至南京建成有限公司, CLMS-2AN多元素混合标准溶液购于美国SamplePrep公司, 锡元素溶液标准物质购于北京世纪奥科生物技术有限公司, 羧基修饰丝网印刷电极购于苏州长三角系统生物交叉科学研究院有限公司。标准马脾铁蛋白购于美国Sigma公司。
1.2 方法 1.2.1 重组铁蛋白的圆二色光谱(CD)分析经原核表达纯化后获得的泥蚶重组铁蛋白利用超滤管浓缩至蛋白含量1mg/mL。取1.0mL样品, 采用1mm光径的样品池, 在波长范围为190—260nm远紫外区域进行扫描, 氮气流量为5L/min, 以纯水为参比溶液。利用二级结构分析软件CDNN对实验数据进行二级结构组成的估算, 并以标准马脾铁蛋白作为对照。
1.2.2 富集重金属的研究富集单一重金属离子:将纯化后的泥蚶重组铁蛋白(0.1mg/mL)利用透析装置, 分别在0.2mmol/L的氯化亚铁(FeCl2), 氯化镉(CdCl2), 氯化锰(MnCl2), 氯化铬(CrCl3), 氯化汞(HgCl2), 氯化铅(PbCl2), 氯化砷(AsCl3)溶液中透析12h后, 然后利用PBS溶液洗去未被吸附的重金属离子。反应全过程均用磁力搅拌器, 并每隔4h更换一次溶液。富集处理完成后放置到4℃条件下, 保存备用。
富集两种重金属离子:蛋白浓度和方法同上, 将氯化亚铁(FeCl2)分别和氯化镉(CdCl2), 氯化锰(MnCl2), 氯化铬(CrCl3), 氯化汞(HgCl2), 氯化铅(PbCl2), 氯化砷(AsCl3)两两混合后的溶液中透析12h后, 然后利用PBS溶液洗去未被吸附的重金属离子。富集完成后放置到4℃条件下, 保存备用。
1.2.3 富集重金属后重组铁蛋白的形貌观察取泥蚶重组铁蛋白富集重金属的处理组溶液各10μL。分别滴在干净无菌的云母片表层, 静置, 自然干燥后用高真空溅射镀膜仪进行喷金处理, 利用扫描电镜(S-3400N, 日本HITACHI公司)对铁蛋白富集不同重金属后的聚集形貌进行观察。利用软件Image-Pro Plus计算各个蛋白聚集体的大小。
1.2.4 重组铁蛋白富集重金属的能力研究取泥蚶重组铁蛋白富集各种重金属溶液各0.1mL, 加入5%的稀硝酸, 摇动使样品分散, 装入微波消解系统中进行微波消解处理, 采用电感耦合等离子体质谱仪对所富集的重金属含量进行定量的分析测定。标准液为多元素混合液和锡单元素溶液, 用超纯水配成标准工作液。
1.2.5 电化学传感器的制备和检测将羧基修饰的丝网印刷电极表面用超纯水进行清洗并晾干后备用。其中, 0.4mol/L的EDC溶液和NHS溶液为0.1mol/L按照1︰1混合后滴到丝网印刷电极上进行30min的羧基活化, 用超纯水清洗掉干净后, 将200μL浓度为2mg/mL重组铁蛋白溶液滴在工作电极表面, 静置反应30min后用超纯水除去未反应的蛋白, 最后将修饰好的丝网印刷电极4℃保存。利用浓度为5mmol/L的K3[Fe (CN)6]溶液对修饰电极和空白电极灵敏度进行检测, 然后利用修饰电极在在pH为4.5的乙酸/乙酸钠缓冲液条件下, 室温下用溶出伏安法测定浓度为10μg/L、25μg/L、50μg/L、75μg/L、100μg/L的Pb2+和Cd2+的电化学信号, 记录数据做标准曲线。最后在相同检测条件下对50μg/L的Pb2+和Cd2+溶液重复检测5次, 记录数据。
2 结果与分析 2.1 圆二色谱检测结果将分子筛层析收集到的各蛋白峰溶液, 利用圆二色谱进行分析获得各个峰蛋白溶液的复性蛋白的二级结构完整程度。泥蚶原核表达的重组铁蛋白的α-螺旋所占比例低于标准马脾铁蛋白, 无规则卷曲所占比例则明显高于马脾铁蛋白, 但四种二级结构总体占比趋势与标准马脾铁蛋白相似, 可见经过一系列分离纯化和复性操作获得的泥蚶重组铁蛋白二级结构趋于完整, 所占比例与对照组存在微小差异(图 1)。
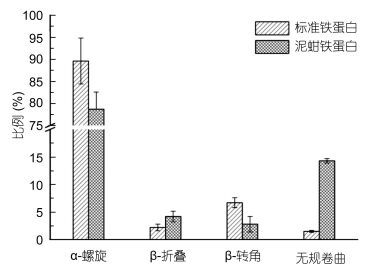 |
| 图 1 泥蚶重组铁蛋白二级结构分析 Fig. 1 Secondary structure analysis ofrecombinant proteins of T. granosa |
如图 2所示泥蚶重组铁蛋白富集Fe2+后的聚集体仍为大小相似的圆球体, 直径大约为1μm, 但球体间发生了粘连现象。推测为Fe2+的氧化作用。富集Mn2+的蛋白聚集体形貌与对照组相比变化非常明显, 由原来的小球体变为花球状结构, 且直径也增大到5μm左右。富集Cd2+的蛋白聚集体为大小均匀的小圆球状单体或聚集体, 颗粒较小, 直径大约为1μm。富集Cr3+的蛋白聚集体为粘连在一起的圆球体, 直径大小没有变化。富集Hg2+的蛋白为明显聚集成堆的圆球体, 直径变化不明显。富集As3+组的蛋白由原来的光滑小球体变为椭圆形、周围出现小刺状的球体结构。富集Pb2+的蛋白小球体直径明显增大为2—3μm, 且2—3个小球体之间发生明显的相融合现象。
 |
|
图 2 重组铁蛋白富集不同金属离子的扫描电镜图 Fig. 2 SEM of different ferritins treatment groups 注: a:空白组; b:富集Fe2+组; c:富集Mn2+组; d:富集Cd2+组; e:富集Cr3+组; f:富集Hg2+组; g:富集As3+组; h:富集Pb2+组 |
泥蚶重组铁蛋白在相同的条件下, 对Fe2+的富集量最高为615.28mg/g, 其次为Mn2+的富集量545.04mg/g。对Cd2+和Hg2+的富集量在400mg/g左右, 而对Cr3+、As3+和Pb2+的富集量均在200mg/g左右, 由此可见泥蚶重组铁蛋白更易于富集多价态金属离子Fe2+和Mn2+。而对于As3+的富集可能与其在溶液中的存在状态相关(图 3)。
观察比较泥蚶重组铁蛋白富集两种混合金属离子的情况发现, Mn2+与Fe2+、Cd2+、As3+和Hg2+的混合基本没有影响泥蚶铁蛋白对于Mn2+的富集量300mg/g左右。而Hg2+和As3+的混合组增加明显, 重组铁蛋白对两种混合离子的富集明显高于单一离子条件下的富集量; 而大部分混合组均表现为拮抗状态, 其中Cd2+和As3+混合组最为明显, 单一离子溶液条件下富集量是混合条件下富集量的2倍。
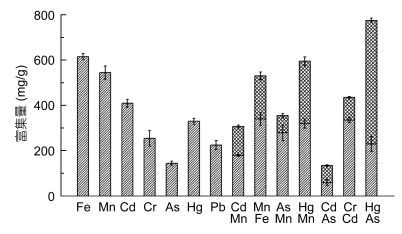 |
| 图 3 泥蚶重组铁蛋白对不同重金属离子的富集量 Fig. 3 Comparison of results for different metals treatment of recombinant proteins of T. granosa |
利用泥蚶重组铁蛋白修饰的丝网印刷电极在pH 4.5的乙酸/乙酸钠缓冲液条件下, 室温下用溶出伏安法测定不同浓度的Pb2+和Cd2+的电化学信号。重金属离子浓度分由低到高分别为10μg/L、25μg/L、50μg/L、75μg/L、100μg/L。Pb2+和Cd2+溶液的最低检测限可以达到10μg/L, 在10—100μg/L之间表现出良好的线性关系, Pb2+溶液的回归方程为y = 0.2979x + 34.336, R2值为0.9960, Cd2+溶液的回归方程为y=0.1651x+ 6.0569, R2值为0.9342 (图 4)。在相同的检测条件下对50μg/L的Pb2+和Cd2+溶液重复检测5次, 其偏差分别为3.4%和4.1%, 可见重现性较好。
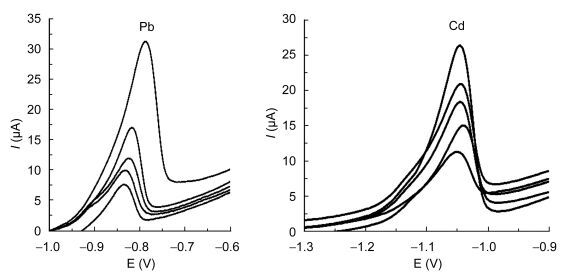 |
| 图 4 泥蚶重组铁蛋白修饰电极测定Pb2+和Cd2+浓度梯度曲线 Fig. 4 Determination of concentration gradient of Pb2 + and Cd2 +modified electrode of recombinant proteins of T. granosa |
泥蚶重组铁蛋白的二级结构中的无规卷曲大于标准铁蛋白, 此类蛋白聚集体的形成源于复性过程中高浓度的尿素溶液破坏了蛋白的类天然二级结构, 形成天然卷曲, 复性过程中更易形成天然聚集(Harrison et al, 1996; Zou et al, 2016)。
通过一系列复性和纯化操作获得的泥蚶重组铁蛋白在扫描电镜下我们观察为大小均匀的球体, 当铁蛋白富集不同种类重金属离子后, 其聚集体表面形貌发生了明显变化。首先表现为球体直径的增大, 由原来的1μm增加到2—3μm (Pb2+富集组), 直径变化最为明显的Mn2+富集组, 蛋白球体直径增加为5μm。Zou等(2016)研究发现当铁蛋白内部有铁核或其他金属核填充时, 蛋白球体直径较大。富集重金属后, 蛋白空腔的内部被金属支撑起来, 金属离子氨基酸侧链间存在着如疏水键、氢键、静电作用和范德华力等相互作用力, 对蛋白质的折叠会造成较为显著的影响, 从而增加了蛋白壳的厚度, 使重组铁蛋白聚集体直径明显增加(Truffi et al, 2016)。其次蛋白聚集体之间发生了不同程度的粘连、聚集成堆而不是均匀分散, 蛋白球体表面出现层状结构或者刺状结构。铁蛋白富集重金属后, H+和OH–一方面在构成金属核的过程中有促进作用(Levi et al, 2015), 另一方面会与蛋白壳内外表层的氨基酸发生结合, 对蛋白壳的构象发生影响, 也会改变蛋白壳的柔性调节能力。这种调节能力大小影响了蛋白聚集体的表面形貌。同时, 不同的重金属具有不同的氧化还原强度, 会影响介质中的正负离子强度, 也造成不同处理组的不同形貌变化。Yamashita等(2010)研究铁蛋白富集Fe2+、Co2+和Ni2+发现, 三重金属离子在进入铁蛋白内部成核过程中, 氧化还原能力的不同导致铁蛋白结构发生独特的变化进而在电镜下呈现出不同的形貌。另一方面, 金属离子水化可能摧毁了铁蛋白水化层, 并使铁蛋白容易折叠中间体。金属离子水合作用不同, 导致铁蛋白对重金属的富集强度不一, 促使表面形貌发生不同的变化(Zolea et al, 2015)。Yang等(2007)利用铁蛋白在不同金属离子溶液中蛋白亚基间的解聚/聚合特性装载铂金属。最后, 反应系统形成了形貌各异的Fe-铁蛋白、Cd-铁蛋白、Cr-铁蛋白、Mn-铁蛋白、Hg-铁蛋白、As-铁蛋白和Pb-铁蛋白的聚集体。
3.2 重组铁蛋白对重金属离子的富集泥蚶重组铁蛋白对Fe2+和Mn2+富集相对其他重金属离子表现出明显优势。蛋白对Fe2+的富集优势与铁蛋白本身的特性和活性位点有关。铁蛋白在生物体内的主要功能即为储存多余的Fe2+, 避免其对生物体的伤害(Yang et al, 2007)。同时有研究发现当铁核内充满Fe3+时会加速Fe2+的氧化和储存速率(Bou-Abdallah, 2010)。重组铁蛋白对Mn2+富集优势则源于锰很强的氧化还原特性, 在锰的化学氧化过程中, 二价锰先被氧化成含大量三价锰的固体氧化物或氢氧化物, 再经缓慢的歧化反应, 最终生成四价锰。有研究发现生物锰氧化物形成过程中伴随着多种形式的氧化还原反应, 初级锰氧化物物的晶体结构也会随时间发生变化(Toner et al, 2005)。
重组铁蛋白对于两种混合金属离子的富集大多表现为两种金属离子的竞争关系, 例如Cd2+和As3+混合组、Cr3+与Cd2+混合组等。这是受铁蛋白内核的空间大小和结合位点的数量限制的。Wong等(1996)就是利用铁蛋白内核空间的固定大小合成均匀大小的金属纳米颗粒。但与其他金属离子混合组不同, 重组铁蛋白对Hg2+和As3+混合组的富集表现出协同促进作用。Hg2+和As3+混合组的富集量明显高于单一金属离子组的富集量。Hg2+和As3+同时存在可能改变了重组铁蛋白所处的溶液环境条件, 研究发现溶液pH的升高可以显著增加铁蛋白所带负电荷量, 增加静电吸引作用, 富集更多的金属阳离子。
3.3 重组铁蛋白电化学生物传感器铁蛋白具有氧化外界Fe2+为Fe3+并在内部形成铁核的功能, 同时在特定的条件下铁蛋白可以将内核中的Fe3+还原为Fe2+释放到外界中, 氧化还原过程伴随着的电子转移特性使得铁蛋白在电极上表现出传递电子的能力(Inamuddin et al, 2016)。Zapien等(2000)利用铁蛋白成功实现了在金电极上的自组装, 并测得相当明确的电流-电位曲线。本实验利用重组铁蛋白富集重金属离子Cd2+和Pb2+的特性, 将铁蛋白固定在丝网印刷电极上以检测溶液中Cd2+和Pb2+的浓度。相比于以酶作为敏感元件的生物传感器更具有专一性和准确性(王明华等, 2013)。Wu等(2004)也是将铁蛋白加入到制备纳米金薄膜电极的溶液体系中, 发现能够显著增强电极的灵敏度和稳定性。另一方面, 重组铁蛋白本身氨基酸侧链带有-NH2基团, 可以直接与羧基修饰的丝网印刷电极发生反应实现铁蛋白的固定, 无需外加修饰基团。Ritzert等(2009)利用铁蛋白氨基酸侧链的-NH2基团将其直接固定在羧基修饰的金电极表面, 实现在电化学方面探究铁蛋白的Fe2+释放动力学。泥蚶重组铁蛋白电化学生物传感器在Cd2+和Pb2+溶液的最低检测限方面均能达到10μg/L, 相比于Shen等(2008)构建的Pb2+最低检测限1nmol/L的脱氧核糖核酸酶金电极生物传感器有明显的优势。泥蚶重组铁蛋白修饰电极在10—100mg/L之间也表现出良好的线性关系, R2值达到0.9960和0.9342。
4 结论泥蚶重组铁蛋白富集Fe2+的聚集体为直径约1μm圆球体, 富集Mn2+的为直径5μm左右花球, 富集Cd2+为直径约1μm小圆球, 富集Cr3+的为粘连在一起的圆球体, 富集Hg2+为成堆的圆球体, 富集As3+为椭圆形、周围出现小刺状的球体结构, 富集Pb2+的为直径2—3μm左右、且2—3个小球体相融合。泥蚶重组铁蛋白在相同的条件下, 对Fe2+的富集量最高为615.28mg/g, 其次为Mn2+的富集量545.04mg/g。对Cd2+和Hg2+的富集量在400mg/g左右, 而对Cr3+、As3+和Pb2+的富集量均在200mg/g左右, 由此可见泥蚶重组铁蛋白更易于富集多价态金属离子Fe2+和Mn2+。泥蚶重组铁蛋白富集Hg2+和As3+为协同效应, 富集Cd2+和As3+为拮抗效应。泥蚶重组铁蛋白传感器对Pb2+和Cd2+溶液的最低检测限为10μg/L。
| 王明华, 赵二劳, 李杜娟, 2013. 检测重金属离子生物传感器的研究进展. 生物技术通报, 10: 9–11 |
| 孙雪松, 何庆瑜, 2007. 含铁蛋白介导的铁转运分子机制. 化学进展, 9(12): 1986–1990 |
| 苏秀榕, 吕振明, 李太武, 等, 2005. 泥蚶(Tegillarca granosa)个体发育过程中同工酶基因表达与调控的研究. 海洋与湖沼, 36(1): 81–87 |
| 李太武, 李成华, 宋林生, 等, 2003. 5个泥蚶群体遗传多样性的RAPD分析. 遗传多样性, 11(2): 118–124 |
| 李学鹏, 励建荣, 段青源, 等, 2008. 泥蚶对重金属铜、铅、镉的生物富集动力学. 水产学报, 32(4): 592–600 |
| 张春丹, 周君, 李晔, 等, 2012. 重金属胁迫对泥蚶(Tegillarca granosa)能量代谢酶转录水平的研究. 海洋与湖沼, 43(5): 919–923 DOI:10.11693/hyhz201205007007 |
| Bou-Abdallah F, 2010. The iron redox and hydrolysis chemistry of the ferritins. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(8): 719–731 DOI:10.1016/j.bbagen.2010.03.021 |
| Hamburger A E, West A P Jr, Hamburger Z A, et al, 2005. Crystal structure of a secreted insect ferritin reveals a symmetrical arrangement of heavy and light chains. Journal of Molecular Biology, 349(3): 558–569 DOI:10.1016/j.jmb.2005.03.074 |
| Harrison P M, Arosio P, 1996. The ferritins:molecular properties, iron storage function and cellular regulation. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1275(3): 161–203 DOI:10.1016/0005-2728(96)00022-9 |
| Inamuddin, ul Haque S, Naushad M, 2016. Electrochemical studies of biocatalytic anode of sulfonated graphene/ferritin/glucose oxidase layer-by-layer biocomposite films for mediated electron transfer. Enzyme and Microbial Technology, 87-88: 29–36 DOI:10.1016/j.enzmictec.2016.02.011 |
| Jin C H, Li C H, Su X R, et al, 2011. Identification and characterization of a Tegillarca granosa ferritin regulated by iron ion exposure and thermal stress. Developmental & Comparative Immunology, 35(7): 745–751 |
| Levi S, Rovida E, 2015. Neuroferritinopathy:From ferritin structure modification to pathogenetic mechanism. Neurobiology of Disease, 81: 134–143 DOI:10.1016/j.nbd.2015.02.007 |
| Ritzert N L, Casella S S, Zapien D C, 2009. Surface-electrochemistry of ferritin adsorbed on 8-mercaptooctanoic acid-modified gold electrodes. Electrochemistry Communications, 11(4): 827–830 DOI:10.1016/j.elecom.2009.02.005 |
| Shen L, Chen Z, Li Y H, et al, 2008. Electrochemical DNAzyme sensor for lead based on amplification of DNA-Au Bio-Bar codes. Analytical Chemistry, 80(16): 6323–6328 DOI:10.1021/ac800601y |
| Stillman T J, Hempstead P D, Artymiuk P J, et al, 2001. The high-resolution X-ray crystallographic structure of the ferritin (EcFtnA) of Escherichia coli; comparison with human H ferritin (HuHF) and the structures of the Fe3+ and Zn2+ derivatives. Journal of Molecular Biology, 307(2): 587–603 DOI:10.1006/jmbi.2001.4475 |
| Toner B, Fakra S, Villalobos M, et al, 2005. Spatially resolved characterization of biogenic manganese oxide production within a bacterial biofilm. Applied and Environmental Microbiology, 71(3): 1300–1310 DOI:10.1128/AEM.71.3.1300-1310.2005 |
| Truffi M, Fiandra L, Sorrentino L, et al, 2016. Ferritin nanocages:A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research, 107: 57–65 DOI:10.1016/j.phrs.2016.03.002 |
| Wang D, Kim B Y, Lee K S, et al, 2009. Molecular characterization of iron binding proteins, transferrin and ferritin heavy chain subunit, from the bumblebee Bombus ignitus. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 152(1): 20–27 DOI:10.1016/j.cbpb.2008.09.082 |
| Wang W X, Fisher N S, 1999. Delineating metal accumulation path ways for marine invertebrates. Science of the Total Environment, 237-238: 459–472 DOI:10.1016/S0048-9697(99)00158-8 |
| Wong K K W, Mann S, 1996. Biomimetic synthesis of cadmium sulfide-ferritin nanocomposites. Advanced Materials, 8(11): 928–932 DOI:10.1002/(ISSN)1521-4095 |
| Wu Y H, Hu S S, 2004. Direct electron transfer of ferritin in dihexadecylphosphate on an Au film electrode and its catalytic oxidation toward ascorbic acid. Analytica Chimica Acta, 527(1): 37–43 DOI:10.1016/j.aca.2004.08.025 |
| Yamashita I, Iwahori K, Kumagai S, 2010. Ferritin in the field of nanodevices. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(8): 846–857 DOI:10.1016/j.bbagen.2010.03.005 |
| Yang Z, Wang X Y, Diao H J, et al, 2007. Encapsulation of platinum anticancer drugs by apoferritin. Chemical Communications,(33): 3453–3455 DOI:10.1039/b705326f |
| Zapien D C, Johnson M A, 2000. Direct electron transfer of ferritin adsorbed at bare gold electrodes. Journal of Electroanalytical Chemistry, 494(2): 114–120 DOI:10.1016/S0022-0728(00)00364-8 |
| Zhang L, Swift J, Butts C A, et al, 2007. Structure and activity of apoferritin-stabilized gold nanoparticles. Journal of Inorganic Biochemistry, 101(11): 1719–1729 |
| Zolea F, Biamonte F, Candeloro P, et al, 2015. H ferritin silencing induces protein misfolding in K562 cells:A Raman analysis. Free Radical Biology and Medicine, 89: 614–623 DOI:10.1016/j.freeradbiomed.2015.07.161 |
| Zou W Y, Liu X Y, Zhao X, et al, 2016. Expression, purification, and characterization of recombinant human L-chain ferritin. Protein Expression and Purification, 119: 63–68 DOI:10.1016/j.pep.2015.11.018 |
 2017, Vol. 48
2017, Vol. 48


