
中国海洋湖沼学会主办。
文章信息
- 时永强, 左涛, 袁伟, 王俊. 2017.
- SHI Yong-Qiang, ZUO Tao, YUAN Wei, WANG Jun. 2017.
- 夏季崂山湾浮游动物群落结构及空间分布特征
- COMMUNITY STRUCTURE AND SPATIAL DISTRIBUTION OF ZOOPLANKTON IN LAOSHAN BAY IN SUMMER
- 海洋与湖沼, 48(5): 990-997
- Oceanologia et Limnologia Sinica, 48(5): 990-997.
- http://dx.doi.org/10.11693/hyhz20170200035
-
文章历史
- 收稿日期:2017-02-20
- 收修改稿日期:2017-05-15
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266237;
3. 农业部海洋渔业可持续发展重点实验室 青岛 266071;
4. 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao 266071, China;
4. Key Laboratory for Fishery Resources and Eco-Environment, Shandong Province, Qingdao 266071, China
浮游动物在海洋食物网中起着承上启下的传递作用, 其种类组成和数量变动能够直接影响海洋生态系统能流和物流的方向和效率, 一方面浮游动物通过摄食影响浮游植物及微生物等的群落演替方向(Banse, 1995), 另一方面浮游动物是大多数渔业生物的食物来源, 被认为是影响许多经济鱼类年储量变化的最重要的环境因子, 其粒径、丰度及季节性峰值发生时间的年际波动都会影响鱼类的种群补充(Beaugrand et al, 2003)。同时, 浮游动物对环境变化十分敏感, 国际上常常将浮游动物作为反映海洋环境变化的理想研究对象(Hays et al, 2005)。因此, 研究浮游动物群落组成及分布情况, 对评价海洋环境质量及生态系统承载力都具有非常重要的作用。
崂山湾位于山东半岛南部, 在黄海的胶州湾和丁字湾之间, 包括鳌山湾(亦称北湾)和小岛湾, 海湾开阔。在20世纪80年代, 崂山湾环境质量高, 渔业资源丰富(中国海湾志编纂委员会, 1993), 但在气候变化及过度捕捞等人类活动的多重压力下, 崂山湾渔业资源衰退严重。为恢复渔业资源, 促进渔业经济增长, 我国在沿海许多区域开展了增殖放流工作, 而崂山湾就是当前渔业生物增殖放流重点海域之一。目前, 在崂山湾已开展了浮游植物群落(乔芮等, 2015; 宋秀凯等, 2016)、鱼类群落及摄食生态(张波等, 2015, 2016)、渔业生物增殖效果评价(梅春等, 2010; 袁伟等, 2015)等相关研究, 但对食物网中间环节浮游动物的研究仅见1981年的调查报道(中国海湾志编纂委员会, 1993)。在崂山湾开展浮游动物群落的调查工作, 对弄清渔业资源增殖的饵料基础具有重要意义。本文通过对夏季崂山湾浮游动物群落结构以及空间分布进行研究, 补充了崂山湾浮游动物群落研究资料的不足, 以期为进一步开展生态容量研究、实施科学的增殖放流和渔业保护提供基础数据。
1 材料与方法 1.1 样品采集及处理2014年8月21—24日, 搭乘中国水产科学研究院黄海水产研究所“黄海星”号调查船在崂山湾及其邻近海域(36.0°—36.5°N, 120.6°—121.0°E)进行水文环境、浮游生物及渔业生物的综合调查, 航次共设置19个浮游动物采样站位(图 1)。调查海域水深范围是5(C2站)—31m (A4站和B5站), 由近岸到外海方向逐渐加深。根据《海洋调查规范》(GB12763.6-2007), 利用浅水Ⅱ型浮游生物网(网口面积0.08m2, 孔径160μm)自近底层至表层垂直拖取浮游动物, 并现场用5%福尔马林海水溶液保存样品, 采样结束后在实验室内对浮游动物样品进行镜检鉴定并计数。根据各站位浮游动物拖网的滤水量体积, 计算获得各站位浮游动物的丰度(ind./m3)。
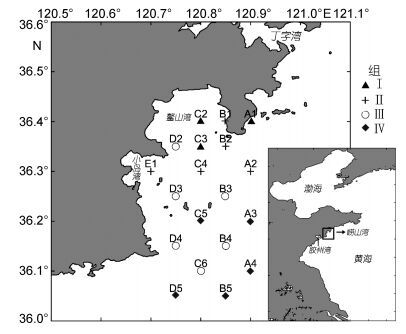 |
| 图 1 崂山湾研究区域及采样站位分布图 Fig. 1 The study area and locations of the sampling stations of Laoshan Bay |
在各站位调查中, 使用YSI ProPlus水质分析仪同步测定表层海水(水深1—2m)温度、盐度、溶解氧和pH值。现场采集500mL表层海水过滤到Whatman公司GF/F玻璃纤维滤膜(孔径0.70μm, 直径47mm)上, 滤膜收集后避光-20℃冷冻保存, 在实验室内经90%丙酮溶液萃取后, 利用Turner Designs Trilogy荧光计测定叶绿素a浓度。
1.2 数据分析根据浮游动物的优势度确定优势种, 优势度(Y)的计算公式为: Y = (ni/N)×fi, 式中ni是第i种的丰度, N为所有种的总丰度, fi为第i种在各站位的出现频率。以Y≥0.02的物种为优势种(徐兆礼等, 1989)。
将浮游动物丰度数据经过log转化后, 根据各个站位浮游动物的种类组成及其丰度信息, 基于Bray-Curtis相似性指数和组平均的方法对各调查站位进行q型聚类分析(Field et al, 1982), 再对各站位的聚类相似系数矩阵进行多维尺度分析(MDS), 通常认为压力系数(stress)小于0.2的MDS图具有较好的解释意义(Kruskal, 1964), 以此来更直观地了解站位间浮游动物群落结构的相似程度。对聚类分出的站位群组进行单因素相似性分析(One-way ANOSIM), 检验群组间浮游动物群落结构的差异显著性; 利用相似百分比分析(SIMPER)确定对群组划分起到关键作用的物种。将筛选出的关键种丰度数据经标准化处理后, 进行R型聚类分析确定种间关联(Field et al, 1982)。
指示种分析可以确定各站位群组的指示物种(Dufrêne et al, 1997)。首先计算群组特异性(Aij)和群组保真度(Bij):
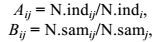
其中N.indij为第i种在第j组的平均丰度, N.indi为第i种在所有群组中的平均丰度之和; N.samij指第i种在第j组中出现的站位数, N.samj指第j组的总站位数。指示种数值(IndVal)的计算是将代表独立的种类分布信息的A与B相乘:
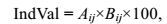
以IndVal≥25%的物种为站位群组的指示种, 代表此种在该组50%以上的站位中出现, 并且其在该组的相对丰度超过50%。浮游动物物种及浮游幼虫均计算指示种数值, 分析时仅浮游动物物种作为指示种。
将各调查站位在MDS图中的排序得分与环境因子数据进行多元回归分析, 用以确认影响浮游动物群落组成及群组划分的环境因子(Zuo et al, 2006)。
所有的多元统计分析及聚类分析图、多维尺度分析图的绘制均借助PRIMER 6.0完成, 平面分布图运用Surfer 10.0绘制。
2 结果 2.1 环境条件表层海水温度变化范围是28.3—31.1℃, 高值区主要分布在北部的湾内和西部近岸海域, 而在调查海域东部海水温度较低。表层海水盐度整体上呈现从近岸到外海逐渐增加的趋势, 另外在调查海域东南部也存在较低盐度的水舌。表层海水的叶绿素a浓度由南向北逐渐降低, 基本呈现随水深增加而逐渐降低的变化趋势(图 2)。崂山湾调查海域表层海水溶解氧浓度从西北近岸区域到东南外海区域逐渐升高, pH值则在调查海域的中部区域最高。
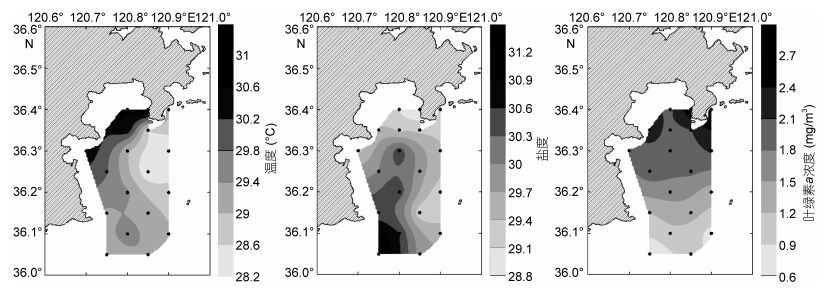 |
| 图 2 夏季崂山湾表层海水温度、盐度和叶绿素a浓度的分布 Fig. 2 Distributions of surface temperature, salinity and chlorophyll a concentration in Laoshan Bay in summer |
鉴定浮游动物40种(类), 其中浮游幼虫16类, 占种类组成的40.0%, 桡足类14种, 占35.0%, 水螅水母类4种, 占10.0%, 另外采集到枝角类、毛颚类各2种, 原生动物和被囊类各1种。
各个站位均采集到大量夜光虫(Noctiluca scintillans), 占有绝对优势, 为避免夜光虫的高丰度对其他浮游动物的遮蔽影响, 在计算浮游动物优势种时, 去除掉夜光虫丰度数据。除去夜光虫后, 浮游动物优势种为小拟哲水蚤(Paracalanus parvus)、异体住囊虫(Oikopleura dioica)、强额孔雀水蚤(Parvocalanus crassirostris)和洪氏纺锤水蚤(Acartia hongi), 其优势度分别为0.71、0.08、0.05和0.03。
2.3 群落结构与地理分布由聚类分析结果可知(图 3a), 调查站位在72.5%的相似性水平上可划分到四个聚类群组中。多维尺度分析(MDS)所得的压力系数为0.15(图 3b), 说明图 3b中各站位的空间分布距离可用来解释各站位的生物组成相似性, 并可清晰看出四个聚类群组的相似关系模式。ANOSIM分析显示, 四个聚类群组的浮游动物群落结构差异达极显著水平(P < 0.01)。
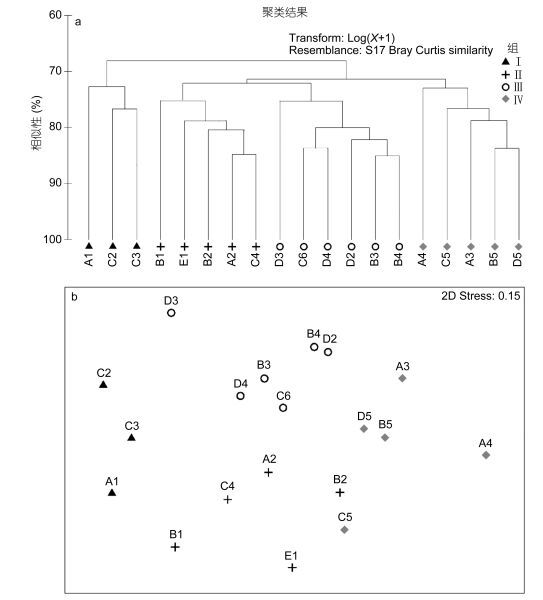 |
| 图 3 各站位浮游动物群落的相似性聚类分析图(a)和多维尺度分析图(b) Fig. 3 Dendrogram of station similarity based on cluster analysis on zooplankton abundance (a); and the ordination plot based on non-metric multidimensional scaling method (b). Symbol-code is shared. |
通过SIMPER分析, 以对群组内相似性和组间差异性的贡献率均超过2%的浮游动物为主要浮游动物, 确定了17种(类)主要浮游动物, 列于表 1中, 其中桡足类种类最多, 这17种(类)浮游动物的出现频率及丰度均相对较高。从各站位聚类群组的地理分布情况(图 1)及浮游动物指示种(表 1)可以看出, 群组Ⅰ的3个站位, 位于北部的湾内及东北部近岸海域, 该群组各站位水深较浅, 且浮游动物指示种较多, 主要包括夜光虫、半球美螅水母、小拟哲水蚤、强额孔雀水蚤、背针胸刺水蚤和洪氏纺锤水蚤, 短尾类溞状幼虫在该群组平均丰度最高, 另外火腿伪镖水蚤(Pseudodiaptomus poplesia)仅在群组Ⅰ中采集到。群组Ⅱ中5个站位的地理分布紧邻群组Ⅰ, 各站位水深相对较浅, 其浮游动物组成与群组Ⅰ接近, 如太平洋纺锤水蚤在两个群组均为指示种, 长尾类幼体在两个群组的平均丰度均较高, 群组Ⅰ中指示种夜光虫和半球美螅水母在群组Ⅱ也有较高丰度, 另外瘦尾胸刺水蚤在群组Ⅱ的指数种数值最大, 腹足类幼体在群组Ⅱ的平均丰度最高。群组Ⅲ由6个站位组成, 主要分布在崂山湾中部海域和西部近岸海域, 夜光虫在该群组丰度最低, 拟长腹剑水蚤、近缘大眼剑水蚤、强壮滨箭虫和异体住囊虫在该群组的指示种数值最大。群组Ⅳ的5个站位主要位于调查海域东南部, 与外海相连, 圆唇角水蚤在该群组的指示种数值最大, 桡足类无节幼虫在该群组的平均丰度最高。
| 中文名 | 拉丁文名 | 组 | |||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | ||
| 夜光虫 | Noctiluca scintillans | 57.15×104 | 19.80×104 | 5.23×104 | 11.21×104 |
| 半球美螅水母 | Clytia hemisphaerica | 52.43 | 22.58 | 0.98 | 0.00 |
| 小拟哲水蚤 | Paracalanus parvus | 1.20×104 | 953.37 | 5253.78 | 4105.30 |
| 强额孔雀水蚤 | Parvocalanus crassirostris | 1159.72 | 98.02 | 789.31 | 1.61 |
| 瘦尾胸刺水蚤 | Centropages tenuiremis | 13.54 | 29.56 | 0.66 | 25.14 |
| 背针胸刺水蚤 | Centropages dorsispinatus | 685.76 | 36.29 | 86.73 | 3.66 |
| 圆唇角水蚤 | Labidocera rotunda | 7.55 | 37.70 | 10.10 | 90.08 |
| 洪氏纺锤水蚤 | Acartia hongi | 478.01 | 44.64 | 409.56 | 91.15 |
| 太平洋纺锤水蚤 | Acartia pacifica | 22.80 | 42.02 | 1.74 | 8.10 |
| 拟长腹剑水蚤 | Oithona similis | 31.25 | 20.93 | 195.09 | 41.20 |
| 近缘大眼剑水蚤 | Corycaeus affinis | 56.71 | 143.45 | 203.97 | 17.79 |
| 强壮滨箭虫 | Aidanosagitta crassa | 107.99 | 71.63 | 114.03 | 56.55 |
| 异体住囊虫 | Oikopleura dioica | 186.34 | 332.14 | 894.62 | 642.62 |
| 腹足类幼体 | Gastropoda larva | 5.21 | 13.04 | 0.00 | 0.00 |
| 桡足类无节幼虫 | Copepoda nauplius larva | 171.88 | 16.77 | 143.06 | 209.98 |
| 长尾类幼体 | Macrura larva | 32.64 | 33.33 | 10.48 | 10.44 |
| 短尾类溞状幼虫 | Brachyura zoea larva | 14.00 | 3.54 | 3.25 | 3.74 |
| 注:指示种数值≥25%的种类为群组的指示种, 以粗体数字表示, 某种类的最大指示种数值加下划线表示 | |||||
为更好地研究崂山湾浮游动物的种间群聚关系, 对17种(类)主要的浮游动物进行R型聚类分析可见(图 4), 在43%的相似性水平下, 浮游动物可以划分到5个组中。对比图 4和表 1可见, 组A包含5种(类)浮游动物, 它们在站位群组Ⅰ和群组Ⅱ中均有较高的丰度及指示种数值; 组B由圆唇角水蚤和瘦尾胸刺水蚤组成, 是群组Ⅱ和群组Ⅳ的指示种; 组C由4种浮游动物组成, 它们的最大指示种数值全部出现在群组Ⅲ; 组D包括5种(类)浮游动物, 它们的最大指示种数值全部出现在群组Ⅰ; 组E仅由桡足类无节幼虫组成, 其丰度在群组Ⅳ中最高。
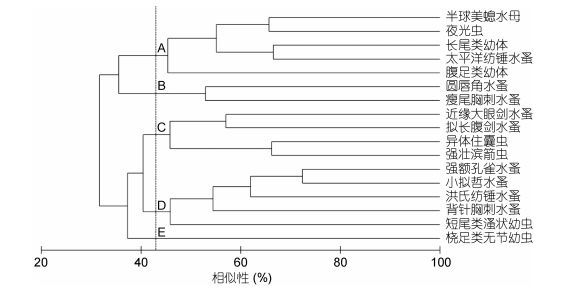 |
| 图 4 夏季崂山湾主要浮游动物的种间群聚划分图 Fig. 4 Dendrogram of species similarity based on inverse (R-type) analysis for 17 major zooplankton species in Laoshan Bay in summer |
从各浮游动物类群在B和C断面中所占比例来看(图 5), 随水深加深, 浮游动物群落结构发生变化。夜光虫和桡足类在两个断面中所有站位所占比例均较高; 水母类仅出现在群组Ⅰ(C2和C3站)和群组Ⅱ(B1、B2和C4站)中的站位; 枝角类仅出现在群组Ⅱ的B1站和群组Ⅳ的C5站; 在B断面毛颚类所占比例在群组Ⅲ的B3和B4站最高; 同样地, 在C断面毛颚类所占比例在群组Ⅲ的C6站最高; 背囊类在两个断面中均在群组Ⅲ(B3、B4和C6) 和群组Ⅳ(B5和C5) 中站位占比最高; 在B断面浮游幼虫类所占比例在群组Ⅲ(B3、B4) 和群组Ⅳ(B5) 最高, 在C断面浮游幼虫类在群组Ⅰ中的C2站占比最高。
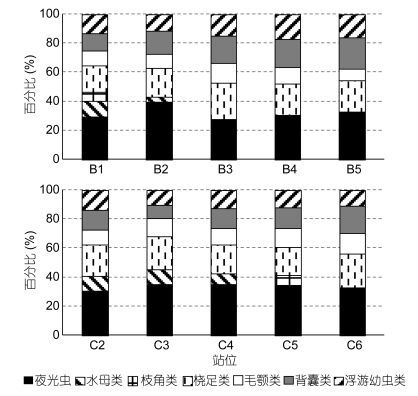 |
| 图 5 各浮游动物类群在B断面和C断面的丰度(经log转化)比例 Fig. 5 Log-transformed abundance percentage of each zooplankton taxon along transects B and C |
各站位聚类群组的环境因子情况列于表 2, 群组Ⅰ的水深最浅、表层温度最高、盐度最低、叶绿素a浓度最高; 与之相对, 群组Ⅳ的水深最深、表层温度最低、盐度最高、叶绿素a浓度最低。One-way ANOVA分析显示, 水深和表层叶绿素a浓度在不同群组间差异极显著(P < 0.01), 而不同群组间的其他环境因子差异不显著(P > 0.05)。多元回归分析结果显示, 水深和表层叶绿素a浓度对浮游动物群落的变化有较大影响(表 3)。
| 环境因子 | 组 | |||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 水深(m) | 7.33±1.70 | 10.60±2.06 | 16.83±6.36 | 24.00±7.8 |
| 表层温度(℃) | 30.10±0.66 | 29.54±1.05 | 29.40±0.62 | 29.15±0.24 |
| 表层盐度 | 29.22±0.10 | 29.48±0.54 | 29.93±0.50 | 30.10±0.73 |
| 表层叶绿素a浓度(mg/m3) | 2.30±0.38 | 2.13±0.28 | 1.64±0.44 | 1.08±0.37 |
| 表层溶解氧浓度(mg/L) | 8.04±0.11 | 7.97±0.47 | 8.19±0.39 | 8.54±0.22 |
| 表层pH值 | 8.23±0.14 | 8.09±0.33 | 8.33±0.22 | 8.25±0.13 |
| 环境因子 | 各方向系数 | 调整R2 | F | P | |
| x | y | ||||
| 水深 | 6.915 | 2.510 | 0.457 | 8.576 | ** |
| 温度 | –0.430 | –0.196 | 0.141 | 2.474 | 0.116 |
| 盐度 | 0.191 | 0.101 | –0.047 | 0.594 | 0.564 |
| 叶绿素a浓度 | –0.493 | –0.263 | 0.485 | 9.472 | ** |
| 溶解氧 | 0.147 | 0.177 | 0.037 | 1.350 | 0.287 |
| pH | –0.026 | 0.227 | 0.193 | 3.147 | 0.070 |
| 注: **表示P < 0.01 (df=2, 16) | |||||
崂山湾浮游动物以广温低盐近岸种和温带外海种为主, 浮游动物群落结构的季节变化明显, 在1981年季度月采样中, 共鉴定浮游动物36种(类), 其中浮游幼虫8类, 在8月份以强壮滨箭虫、鸟喙尖头溞(Penilia avirostris)、瘦尾胸刺水蚤、钳形歪水蚤(Tortanus forcipatus)、汤氏长足水蚤(Calanopia thompsoni)和背针胸刺水蚤占优势(中国海湾志编纂委员会, 1993)。与1981年使用的浅水Ⅰ型浮游生物网(网口面积0.20m2, 孔径505μm)不同, 本研究中利用浅水Ⅱ型浮游生物网在崂山湾共采集到浮游动物40种(类), 其中浮游幼虫16类, 优势种为夜光虫、小拟哲水蚤、异体住囊虫、强额孔雀水蚤和洪氏纺锤水蚤, 与1981年差别很大。虽然网具对不同体型浮游动物的采集效率有较大影响(王荣等, 2003), 但年际间不同网具采集样品中浮游动物优势地位的巨大变化仍能部分说明, 与1981年相比, 崂山湾浮游动物群落结构已发生较大改变。鸟喙尖头溞、钳形歪水蚤多分布于河口区等低盐水域, 二者在1981年夏季崂山湾为优势种, 而在2014年夏季, 枝角类和歪水蚤的丰度及出现频率均十分低, 这可能与水利工程修建等导致径流输入减少有关(傅日辉, 1992)。
与中国北方其他海湾对比, 2004年8月份利用浅水Ⅱ型浮游生物网在胶州湾共采集到33种浮游动物(不包括夜光虫和浮游幼虫), 优势种主要为小拟哲水蚤、洪氏纺锤水蚤、异体住囊虫、太平洋纺锤水蚤、近缘大眼剑水蚤、强壮滨箭虫等(孙松等, 2008)。2009年7月在黄河口及其邻近海域利用浅水Ⅱ型浮游生物网共采集到浮游动物69种(类), 其中浮游幼虫23类, 优势种主要为小拟哲水蚤、双壳类幼体、强额孔雀水蚤、洪氏纺锤水蚤、拟长腹剑水蚤、短角长腹剑水蚤(Oithona brevicornis)、异体住囊虫等(王文杰, 2011)。受采样位置及样品鉴定人员差异, 夏季中国北方各湾浮游动物种类数及优势种存在一定差异, 但小拟哲水蚤、洪氏纺锤水蚤和异体住囊虫在莱州湾、胶州湾和崂山湾均有较高优势地位。
夜光虫在夏季崂山湾浮游动物群落中丰度最高(表 1)。利用浅水Ⅲ型浮游生物网(网口面积0.10m2, 孔径77μm)在崂山湾进行网采浮游植物群落研究可见, 夜光虫在春季和夏季均为优势种, 但在春季具有更高的优势度(乔芮等, 2015; 宋秀凯等, 2016)。夜光虫在胶州湾网采(浅水Ⅲ型)浮游植物样品中, 优势度较低(罗璇等, 2016), 但在浅水Ⅱ型浮游生物网获取样品中, 夜光虫的丰度要明显高于其他浮游动物(孙松等, 2008; 田达玮等, 2017)。近年来, 夜光虫赤潮在渤海的暴发频次增多(Song et al, 2016), 这与人类活动导致富营养化等环境污染有很大的关系(于仁成等, 2016)。本研究中, 夜光虫在崂山湾近岸区域丰度更高, 原因是近岸区域受人类活动影响更加强烈, 并且更高的表层叶绿素a浓度可为夜光虫提供丰富饵料。夜光虫可以通过摄食浮游植物与浮游动物形成竞争关系, 并可直接摄食浮游动物卵或幼体, 从而影响浮游动物的群落结构(Yılmaz et al, 2005)。因此, 本研究中高丰度的夜光虫也会对夏季崂山湾浮游动物群落产生一定的影响。
根据夏季不同站位浮游动物群落结构的相似性, 可将崂山湾调查站位划分到四个群组中, 并且各群组间的水深具有极显著的差异, 即随着水深加深, 崂山湾浮游动物群落结构发生变化。夜光虫和半球美螅水母在水深最浅的群组Ⅰ中丰度最高, 另外饵料性浮游动物小拟哲水蚤、强额孔雀水蚤、背针胸刺水蚤、洪氏纺锤水蚤也都在该群组有最高丰度; 而群组Ⅳ与群组Ⅰ在MDS图中距离最远, 二者的浮游动物群落结构差别最大, 在水深最深的群组Ⅳ中圆唇角水蚤和桡足类无节幼虫丰度最高, 并且群组Ⅳ与群组Ⅰ没有共同的指示种(表 1); 群组Ⅱ和群组Ⅲ是过渡群落, 它们与其他两个群组的浮游动物群落结构既有相似又有不同, 如腹足类幼体的指示种数值在群组Ⅱ最高, 拟长腹剑水蚤仅在群组Ⅲ为指示种, 近缘大眼剑水蚤在群组Ⅱ和群组Ⅲ中均为指示种, 而其他的指示种则与群组Ⅰ或群组Ⅳ共享。除水深外, 叶绿素a浓度也对崂山湾浮游动物群组聚类影响较大(表 3), 叶绿素a浓度体现了浮游动物的饵料情况, 通过上行作用可对浮游动物群落结构产生影响。查明崂山湾不同区域浮游动物的群落组成情况, 可以评价次级生产力情况, 进而为增殖放流渔业生物种类、放流数量及放流地点的选择提供数据支持。
4 结论2014年8月崂山湾共采集到浮游动物40种(类), 其中浮游幼虫16类, 桡足类14种, 水螅水母类4种, 枝角类、毛颚类各2种, 原生动物和被囊类各1种。除夜光虫外, 其他优势种为小拟哲水蚤、异体住囊虫、强额孔雀水蚤和洪氏纺锤水蚤。根据浮游动物群落结构相似性, 崂山湾调查站位可划分到四个群组中, 水深和表层叶绿素a浓度对站位的群组聚类具有较大的作用, 平均水深最深与最浅的群组间浮游动物群落结构差异最大, 而其他两个群组为过渡群组。今后仍需在其他季节对崂山湾浮游动物群落开展相关研究工作, 以全面了解崂山湾浮游动物的周年演替情况。
致谢 感谢中国水产科学研究院黄海水产研究所渔业资源与生态系统研究室同事在野外采样及实验室样品处理中的大力支持, 感谢“黄海星”号调查船全体工作人员在采样过程中给予的无私帮助。| 于仁成, 刘东艳, 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167–1174 |
| 中国海湾志编纂委员会, 1993. 中国海湾志-第四分册-山东半岛南部和江苏省海湾. 北京: 海洋出版社 |
| 王荣, 王克, 2003. 两种浮游生物网捕获性能的现场测试. 水产学报, 27(增刊): 98–102 |
| 王文杰, 2011. 夏、秋季黄河口及其邻近海域中小型浮游动物群落生态学研究. 青岛: 中国海洋大学硕士学位论文, 12-39 http://cdmd.cnki.com.cn/Article/CDMD-10423-1011229811.htm |
| 田达玮, 宋书群, 陈田田, 等, 2017. 胶州湾夜光藻种群动态及其大量繁殖的生态机制. 海洋与湖沼, 48(2): 276–284 |
| 乔芮, 栾青杉, 王俊, 等, 2015. 2013年春季崂山湾浮游植物群落及其环境控制. 海洋科学, 39(7): 13–21 DOI:10.11759/hykx20140407001 |
| 孙松, 周克, 杨波, 等, 2008. 胶州湾浮游动物生态学研究Ⅰ. 种类组成.海洋与湖沼, 39(1): 1–7 |
| 宋秀凯, 汤宪春, 程玲, 等, 2016. 崂山湾网采浮游植物的时空分布特征及其与环境因子的关系. 海洋与湖沼, 47(6): 1205–1213 DOI:10.11693/hyhz20160600127 |
| 张波, 袁伟, 王俊, 2015. 崂山湾春季鱼类群落的摄食生态及其主要种类. 中国水产科学, 22(4): 820–827 |
| 张波, 袁伟, 戴芳群, 2016. 应用稳定同位素技术研究崂山湾夏季鱼类群落的摄食生态. 水产学报, 40(4): 585–594 |
| 罗璇, 孙晓霞, 郑珊, 等, 2016. 2011年胶州湾网采浮游植物群落结构及其环境影响因子. 海洋与湖沼, 47(5): 915–923 |
| 徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13–15, 19 |
| 袁伟, 林群, 王俊, 等, 2015. 崂山湾中国对虾(Fenneropenaeus chinensis)增殖放流的效果评价. 渔业科学进展, 36(4): 27–34 |
| 梅春, 任一平, 徐宾铎, 等, 2010. 崂山湾日本对虾增殖放流效果的初步研究. 中国海洋大学学报, 40(9): 45–50 |
| 傅日辉, 1992. 从青岛市入海水量谈水资源的合理开发利用. 水文,(S1): 37–39 |
| Banse K, 1995. Zooplankton: Pivotal role in the control of ocean production. ICES Journal of Marine Science, 52(3-4): 265–277 DOI:10.1016/1054-3139(95)80043-3 |
| Beaugrand G, Brander K M, Lindley J A, et al, 2003. Plankton effect on cod recruitment in the North Sea. Nature, 426(6967): 661–664 DOI:10.1038/nature02164 |
| Dufrêne M, Legendre P, 1997. Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecological Monographs, 67(3): 345–366 |
| Field J G, Clarke K R, Warwick R M, 1982. A practical strategy for analysing multispecies distribution patterns. Marine Ecology Progress Series, 8: 37–52 DOI:10.3354/meps008037 |
| Hays G C, Richardson A J, Robinson C, 2005. Climate change and marine plankton. Trends in Ecology & Evolution, 20(6): 337–344 |
| Kruskal J B, 1964. Multidimensional scaling by optimizing goodness of fit to a nonmetric hypothesis. Psychometrika, 29(1): 1–27 DOI:10.1007/BF02289565 |
| Song N Q, Wang N, Lu Y, et al, 2016. Temporal and spatial characteristics of harmful algal blooms in the Bohai Sea during 1952-2014. Continental Shelf Research, 122: 77–84 DOI:10.1016/j.csr.2016.04.006 |
| Yılmaz İ N, Okus E, Yüksek A, 2005. Evidences for influence of a heterotrophic dinoflagellate (Noctiluca scintillans) on zooplankton community structure in a highly stratified basin. Estuarine, Coastal and Shelf Science, 64(2-3): 475–485 DOI:10.1016/j.ecss.2005.03.011 |
| Zuo T, Wang R, Chen Y Q, et al, 2006. Autumn net copepod abundance and assemblages in relation to water masses on the continental shelf of the Yellow Sea and East China Sea. Journal of Marine Systems, 59(1-2): 159–172 DOI:10.1016/j.jmarsys.2005.09.008 |
 2017, Vol. 48
2017, Vol. 48


