中国海洋湖沼学会主办。
文章信息
- 臧宇, 黄致远, 赵新宇, 胡顺鑫. 2017.
- ZANG Yu, HUANG Zhi-Yuan, ZHAO Xin-Yu, HU Shun-Xin. 2017.
- CO2加富对盐生杜氏藻(Dunaliella salina)叶绿素荧光参数的影响
- EFFECTS OF ELEVATED CO2 ON CHLOROPHYLL FLUORESCENCE TO DUNALIELLA SALINA
- 海洋与湖沼, 48(5): 998-1003
- Oceanologia et Limnologia Sinica, 48(5): 998-1003.
- http://dx.doi.org/10.11693/hyhz20170300051
-
文章历史
- 收稿日期:2017-03-12
- 收修改稿日期:2017-06-14
2. 山东省海洋资源与环境研究院 烟台 264006;
3. 山东省青岛市第五十八中学 青岛 266199
2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China;
3. Qingdao No. 58 High School of Shandong Province, Qingdao 266199, China
因为煤炭、石油及天然气等燃料的使用以及森林破坏的加剧, 大气中CO2含量正急剧升高, 并在环境、生态以及气候等方面导致诸多问题(Hughes, 2000)。海洋作为地球表面最大的碳源之一, 可以吸收人类活动排放CO2总量的一半, 而CO2排放量上升, 也导致了一系列的负面效应, 而这其中最严峻的一个海洋化学事件就是海洋酸化(Ocean Acidification) (Fabry, 2008)。在以欧洲为代表的工业革命以前, 海水中的pH为8.2, 截至目前, 海水pH下降了0.1个单位, 此时大气CO2浓度为390ppmv。根据推断, 到2100年, 海表pH将下降0.4个单位, pCO2将上升200%, 届时CO2浓度将达到1000ppmv (Caldeira et al, 2003; Doney et al, 2009)。
海洋酸化改变了海洋化学环境, 截至目前, 大量研究表明海洋酸化可以降低珊瑚、珊瑚藻类以及贝类的钙化量(Gao et al, 1993); 海洋酸化对于非钙化生物也会产生影响, CO2浓度升高可以促进海洋硅藻三角褐指藻(Phaeodactylum tricornutum)的生长和光合作用, 并且下调了其无机碳浓缩机制(Wu et al, 2010)。同时, 利用叶绿素荧光技术探讨海洋酸化对藻类影响的研究也有很多: 徐金涛等(2016)研究表明, CO2加富条件能够显著促进塔玛亚历山大藻(Alexandrium tamarense) PSⅡ最大光化学量子产量(Fv/Fm), 提高最大相对电子传递效率(rETRmax)和光能转换效率。当营养条件及光照条件适宜时, 海洋酸化可促进坛紫菜(Pyropia haitanensis)与龙须菜(Gracilaria lemaneiformis)的光合作用, 并在一定程度上有利于坛紫菜对病害的抗性(陈斌斌, 2015)。
盐生杜氏藻(Dunaliella salina)是一种单细胞绿藻, 由于其结构简单、可以在高盐环境下生存, 抗逆性较强。作为一种良好的模式生物, 其已经被广泛应用于生物工程和遗传工程中。但关于盐生杜氏藻对环境胁迫的基础研究仍然不够系统全面, 尤其是盐生杜氏藻光合作用对海洋酸化的响应尚未见报道。因此, 本实验以盐生杜氏藻为实验对象, 拟利用叶绿素荧光技术, 探究CO2浓度升高对盐生杜氏藻对叶绿素荧光参数的影响, 以期为预测未来海洋酸化条件下海洋浮游植物的适应性提供理论基础。
1 材料与方法 1.1 藻种来源及培养条件实验所用微藻——盐生杜氏藻(Dunaliella salina)取自中国科学院海洋研究所微藻培养室, 培养于改良后的f/2培养基中。所用的海水取自青岛市鲁迅公园附近的自然海水, 经脱脂棉粗过滤、M-50抽滤器过滤(滤膜直径5cm, 孔径0.45μm)细过滤, 然后高压灭菌。光照强度为80μmol/(m2·s), 光暗周期比为12h︰12h, 培养温度(22±1) ℃, 盐度为32。
1.2 实验设计实验选取了两种CO2浓度的气体, 分别为390ppmv (目前大气中CO2浓度)和1000ppmv (2100年的预测值)。390ppmv浓度的CO2取自室外空气(气体采集处应注意通风); 1000ppmv浓度的CO2气体是高纯二氧化碳气体(99.99%)和空气在二氧化碳光照培养箱(HP400G, 瑞华, 武汉)内混合而成, 二氧化碳光照培养箱可以控制培养箱内CO2气体的浓度。借助空气压缩泵将达到预设浓度的CO2气体通过0.22μm的针式过滤器泵入培养瓶内, 以保证通入培养液的气体无菌。实验时先将目标微藻培养至指数生长期, 将处于指数生长期的微藻接种300mL锥形瓶, 实验初始密度为5×104cell/mL。微藻接种前, 预先向培养液中通各浓度的CO2气体24h, 使培养液中的碳酸盐系统达到稳定。在培养24、48、72和96h后进行相关指标的测定。
1.3 叶绿素荧光参数的测定采用调制叶绿素荧光仪(Water-PAM, Walz, 德国)测定390和1000ppmv CO2条件下盐生杜氏藻诱导光曲线和快速光响应曲线, 来反映CO2浓度升高对盐生杜氏藻叶绿素荧光参数的影响。
测定诱导光曲线时, 先将样品暗适应20min, 使得光PSⅡ处于完全开放状态。打开测量光, 测定初始荧光值(F0), 随后打开饱和脉冲, 持续时间为0.8s, 测得Fm和Fv/Fm值。40s之后打开光化光, 每隔20s打开饱和脉冲, 连续进行13次, 直至最大荧光值(Fm′)达到稳定。所得荧光值按照公式(1) 计算光系统Ⅱ的实际光化学效率(Yield):
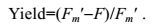 (1)
(1)快速光响应曲线测定方法:打开测量光[0.01μmol/(m2·s)]测定初始荧光值F0, 然后打开饱和脉冲[4000μmol/(m2·s), 0.8s], 测定Fm和Fv/Fm值。在预实验的基础上, 光化光强度分别设定为0、90、150、210、265、295、350、405、480μmol/(m2·s), 共8个梯度。在每个光化光梯度下, 测得饱和脉冲前的荧光值(F)和打开饱和脉冲后测得的Fm′。相对电子传递速率(rETR)通过公式(2) 计算:
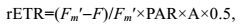 (2)
(2)其中, PAR代表光化光强度; A表示藻类的吸光系数0.84; 0.5代表有50%的吸收光能被分配到光系统Ⅱ。随后, 以光化光强度为X轴, rETR为Y轴制作相对电子传递速率随PAR变化的曲线, 即快速光响应曲线(rapid light curve, RLC)。随后, 对快速光响应曲线进行最小二乘法拟合(Platt et al, 1980), 得到初始斜率(α)、最大相对电子传递速率(rETRmax)、半饱和光强(Ek)等参数:
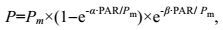 (3)
(3)其中, P代表给定光化光强度下的相对电子传递速率(rETR); α代表快速光曲线的初始斜率, 能够反映光能的利用效率; Pm代表最大相对电子传递速率(rETRmax); Ek=Pm/α, 代表半饱和光强, 反映藻类对光强的耐受能力; β代表光抑制参数。
2 结果与分析由图 1可知, 随着PAR强度的提升, 盐生杜氏藻的相对电子传递速率先线性上升到最大值后保持不变。24、48、72、96h时, 390和1000ppmv CO2条件下盐生杜氏藻快速光响应曲线拟合参数如表 1所示: 24h时, 1000ppmv处理组与390ppmv处理组相比较, α值无显著性差异(P > 0.05); 48、72、96h时, 1000ppmv处理组的α值显著增加(P < 0.05), 与390ppmv CO2条件下相比, 分别增加12.5% (P < 0.05)、21.7% (P < 0.05)、8.333% (P < 0.05)。
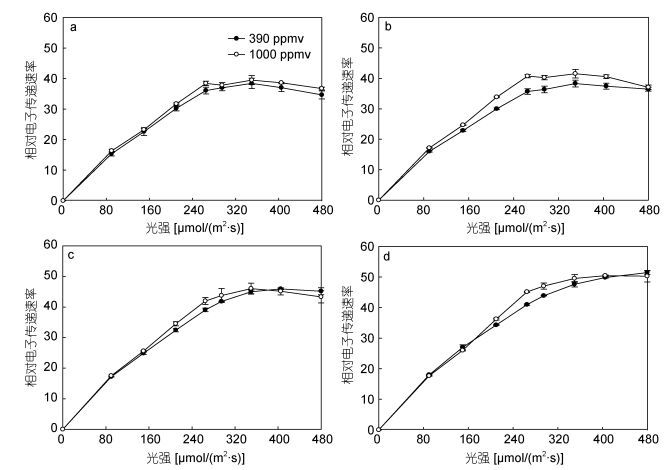 |
| 图 1 不同CO2浓度下盐生杜氏藻快速光响应曲线 Fig. 1 The curves of rapid response to light by D. salina under different pCO2 in different exposure durations 注: a:光照时间24h; b: 48h; c: 72h; d: 96h |
| 时间(h) | CO2浓度(ppmv) | α | β | rETRmax | Ek |
| 24 | 390 | 0.24±0.01 | 0.40±0.14 | 36.68±1.24 | 151.64±0.31 |
| 1000 | 0.25±0.00 | 0.56±0.03 | 39.44±0.44 | 153.17±2.16 | |
| 48 | 390 | 0.24±0.00 | 0.43±0.07 | 38.48±0.80 | 160.29±2.77 |
| 1000 | 0.27±0.01* | 0.41±0.08 | 40.22±1.00 | 144.25±2.23* | |
| 72 | 390 | 0.23±0.00 | 0.35±0.09 | 47.03±1.74 | 198.65±6.74 |
| 1000 | 0.28±0.01* | 0.38±0.06 | 48.55±0.56 | 172.41±5.36* | |
| 96 | 390 | 0.24±0.00 | 0.22±0.02 | 55.75±1.35 | 228.01±3.15 |
| 1000 | 0.26±0.00* | 0.32±0.01* | 52.96±1.35 | 198.59±6.08* | |
| 注: α代表光能利用效率; β代表光抑制参数; rETRmax代表最大相对电子传递速率; Ek代表饱和光强。“*”表示与对照组具有显著性差异(P < 0.05) | |||||
在前72小时内, 390和1000ppmv CO2条件下盐生杜氏藻光抑制参数β无显著性差异(P > 0.05);在96h时, 1000ppmv CO2条件下生长的盐生杜氏藻的β发生了显著变化, 比390ppmv CO2条件下的值增加了45.45%。
对于rETRmax值来说, 前72小时内, 1000ppmv CO2条件下的rETRmax值均高于390ppmv CO2, 但是无显著差异(P > 0.05);在96h时, 390ppmv CO2条件下的的rETRmax略高于对照组, 但两者间仍无显著性差异(P > 0.05)。
在24h时, 390和1000ppmv CO2条件下盐生杜氏藻的半饱和光强Ek无显著性差异(P > 0.05), 但是通过比较48、72、96h的Ek值发现, 其在1000ppmv CO2条件下均显著降低(P < 0.05), 分别为390ppmv CO2条件下的90%、86.79%、87.10%。
以PAR强度为横坐标, 以相应的非光化学淬灭值为纵坐标作图(图 2), 得到不同CO2浓度下, 盐生杜氏藻非光化学淬灭值随PAR的变化规律。结果表明, 随着PAR强度的上升, 所有实验组中的NPQ值均逐渐增大。通过对比24、48、72、96h时, 390和1000ppmv CO2条件下盐生杜氏藻非光化学淬灭值发现, 24、48、72h内, 当PAR大于150 μmol/(m2·s)μmol/ (m2·s)时, 1000ppmv CO2条件下的NPQ值均大于390ppmv CO2条件下; 96h时, 在PAR较低时[0— 150μmol/(m2·s)], 390ppmv CO2条件下的NPQ显著高于1000ppmv CO2(P < 0.05), 随着PAR的上升, 390ppmv CO2条件下NPQ值增长速度逐渐低于1000ppmv CO2条件下, 当PAR值大于295μmol/(m2·s)时, 1000ppmv CO2条件下NPQ显著高于390ppmv CO2条件下NPQ值。
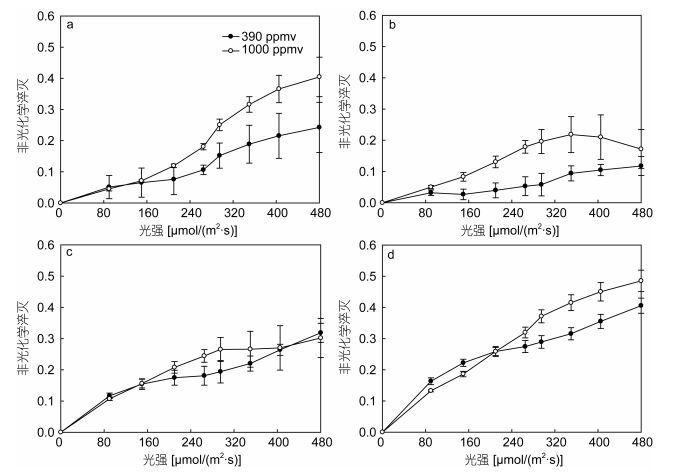 |
| 图 2 不同CO2浓度下不同光照时间盐生杜氏藻非光化学淬灭 Fig. 2 NPQ (non-photochemical quenching) of D. salina under different pCO2 in different light exposure durations 注: a:光照时间24h; b: 48h; c: 72h; d: 96h |
24、48、72、96h时, 390和1000ppmv CO2条件下盐生杜氏藻诱导光曲线中PSⅡ的潜在Fv/Fm和PSⅡ的实际光合效率如图 3和图 4所示。结果表明, 在24、48、72、96h时, 390和1000ppmv CO2条件下盐生杜氏藻PSⅡ的潜在Fv/Fm均无显著差异。然而, 在24、48、96h时, 与对照组相比, 1000ppmv CO2条件下盐生杜氏藻的PSⅡ的实际光合效率分别被促进了5.8% (P < 0.05)、6.9% (P < 0.05) 和3.8% (P < 0.05)。
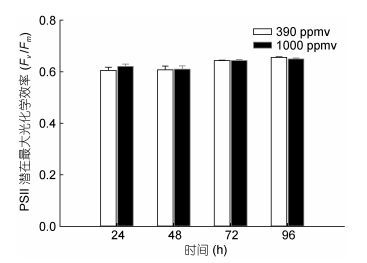 |
| 图 3 不同CO2浓度下不同光照时间对盐生杜氏藻PSⅡ的潜在最大光合作用效率(Fv/Fm)的关系 Fig. 3 Fv/Fm of D. salina under different pCO2 in different light exposure length 注: a:光照时间24h; b: 48h; c: 72h; d: 96h |
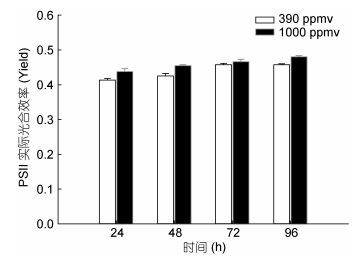 |
| 图 4 24、48、72、96h时不同CO2浓度下盐生杜氏藻PSⅡ的实际光合效率 Fig. 4 Yield of D. salina under different pCO2 at 24h, 48h, 72h, 96h. |
当外界环境发生变化时, 叶绿素荧光是反映环境变化对光合生物影响的重要指标之一(Maxwell et al, 2000), 能够客观地反映光合生物本身的光合特征及其对环境变化的适应能力(Jiang et al, 2003; 李鹏民等, 2005)。通过叶绿素荧光技术测定光合生物的快速光响应曲线和诱导曲线, 不但可以反映细胞在实验条件下对光能的分配和响应能力, 同时也可以反映细胞在不同光合环境条件下的潜在光合特征(Frank et al, 1996)。本研究结果表明, CO2浓度升高并没有改变盐生杜氏藻PSⅡ的Fv/Fm和rETRmax, 这与徐金涛等(2016)对塔玛亚历山大藻的研究结果相反, 当CO2浓度由370ppmv增加至1000ppmv时, 塔玛亚历山大藻的Fv/Fm值和rETRmax显著增加。尽管CO2升高并没有改变盐生杜氏藻的Fv/Fm和rETRmax, 但是从光能利用效率、半饱和光强以及PSⅡ的实际光化学量子产额的角度上来讲, CO2浓度升高对盐生杜氏藻的PSⅡ产生了积极的促进作用。通常来说, 光能利用效率(α)反映了光合生物对光能的吸收和利用效率(Fu et al, 2007, 2008)。对盐生杜氏藻来说, 高浓度CO2条件下盐生杜氏藻的光能利用效率明显高于对照组, 这可能是由于对照组中, 更多的能量被用来浓缩CO2以满足核酮糖-1, 5二磷酸羧化酶的需要, 因此在吸收光能不变的情况下, 高浓度CO2下更多的能量被用于光合固碳, 从而提高了光能利用效率(Olischläger et al, 2013)。类似的结果在Synechococcus sp.和Ulva prolifera中也同样被发现(Fu et al, 2007; Liu et al, 2012)。Olischläger等(2013)发现, 在10℃条件下, Neosiphonia harveyi的光能利用效率在1411ppmv CO2条件下被显著促进, 但是当温度升高至17.5℃时, CO2升高对其光能利用效率无显著影响, 这说明其他环境因子(如温度)在一定程度下会影响光能利用效率对CO2升高的响应。
半饱和光强Ek代表光合生物保持捕获光能和处理光能的最佳平衡点(Olischläger et al, 2013)。本实验中, 在高浓度CO2条件下, 光能利用效率的升高和未发生显著变化的最大相对电子传递速率引起盐生杜氏藻Ek的降低。CO2浓度升高导致的Ek降低并非普遍存在于所有浮游植物类群中, Suárez-Ávarez等(2012)的实验表明, Hypnea spinella的Ek在高浓度CO2条件下显著增加, 这可能是CO2升高使得最大相对电子传递速率被显著促进所导致的; 另外, 也有研究表明, CO2升高并不改变浮游植物的Ek (Wu et al, 2010; Yang et al, 2012)。从这个角度上讲, 未来在海洋酸化条件下, 盐生杜氏藻对光照强度的依赖程度将会减弱, 大大降低了在自然环境中遭受光强限制的可能性。与酸化情况下Ek不变或升高的浮游植物类群相比, 盐生杜氏藻在种群竞争和群落演替过程中将比现在更具竞争优势。
不断加剧的海洋酸化将会对海洋中的钙化生物产生严重的威胁, 主要表现为降低钙化生物的钙化速率、表面钙片脱落等(Gao et al, 1993; Riebesell et al, 2000)。对海洋中的非钙化生物来说, 虽然CO2升高导致的海洋酸化促进了非钙化生物的生长、光合和初级生产力, 但是酸化对非钙化生物同样也是一个潜在的胁迫因子。本研究发现, 在1000ppmv CO2条件下, 盐生杜氏藻光系统Ⅱ的光抑制率(β)显著增加, 并且伴随着较高的NPQ值。Tchernov等(2001)指出, 浮游植物可以通过无机碳浓缩机制(CCMs)的运行耗散多余的光能、分流电子以起到缓解光抑制的作用。因此, 盐生杜氏藻光抑制程度增加可能是由于高浓度CO2下调了CCMs的运行所致。在光限制条件下, 下调CCMs所节省的能量可能会促进浮游植物的生长和光合作用; 但是在光充足的情况下, 这部分能量不但不会补充藻细胞对光能的需求, 反而增加了过剩光能引起的光抑制程度, 类似的结果在三角褐指藻和浒苔幼苗中也同样被发现(Wu et al, 2010; Liu et al, 2012)。
4 结论基于本实验的结果, CO2导致的海洋酸化将会对盐生杜氏藻光系统Ⅱ产生促进作用, 主要表现为增加的光能利用效率和PSⅡ的实际光化学量子产额以及降低的半饱和光强; 但是在光能充足的条件下, CO2升高导致的海洋酸化增加了盐生杜氏藻的光抑制程度, 并且导致了更高的NPQ值。海洋酸化对盐生杜氏藻的正面效应和负面效应的净值将决定其最终对海洋酸化的响应。比较之前的研究可以发现, 浮游植物对海洋酸化的响应存在种间差异, 而这种种间差异很可能会改变浮游植物的种间竞争关系, 甚至会影响浮游植物类群的进化。
| 李鹏民, 高辉远, StrasserR J, 2005. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 31(6): 559–566 |
| 陈斌斌, 2015. 海洋酸化背景下经济海藻龙须菜与坛紫菜的生物学特性. 广州: 华南理工大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10561-1015987099.htm |
| 徐金涛, 庞敏, 马新, 等, 2016. CO2加富对塔玛亚历山大藻叶绿素荧光参数及产毒的影响. 海洋与湖沼, 47(3): 557–563 |
| Caldeira K, Wickett M E, 2003. Oceanography: anthropogenic carbon and ocean pH. Nature, 425(6956): 365 DOI:10.1038/425365a |
| Doney S C, Fabry V J, Feely R A, et al, 2009. Ocean acidification: the other CO2 problem. Annual Review of Marine Science, 1: 169–192 DOI:10.1146/annurev.marine.010908.163834 |
| Fabry V J, Seibel B A, Feely R A, et al, 2008. Impacts of ocean acidification on marine fauna and ecosystem processes. ICES Journal of Marine Science, 65(3): 414–432 DOI:10.1093/icesjms/fsn048 |
| Frank H A, Cogdell R J, 1996. Carotenoids in photosynthesis. Photochemistry and Photobiology, 63(3): 257–264 DOI:10.1111/php.1996.63.issue-3 |
| Fu F X, Warner M E, Zhang Y, et al, 2007. Effects of increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (cyanobacteria). Journal of Phycology, 43(3): 485–496 DOI:10.1111/jpy.2007.43.issue-3 |
| Fu F X, Zhang Y, Warner M E, et al, 2008. A comparison of future increased CO2 and temperature effects on sympatric Heterosigma akashiwo and Prorocentrum minimum. Harmful Algae, 7(1): 76–90 DOI:10.1016/j.hal.2007.05.006 |
| Gao K, Aruga Y, Asada K, et al, 1993. Calcification in the articulated coralline alga Corallina pilulifera, with special reference to the effect of elevated CO2 concentration. Marine Biology, 117(1): 129–132 DOI:10.1007/BF00346434 |
| Hughes L, 2000. Biological consequences of global warming: is the signal already apparent?. Trends in Ecology & Evolution, 15(2): 56–61 |
| Jiang C D, Gao H Y, Zou Q, 2003. Changes of donor and acceptor side in photosystem 2 complex induced by iron deficiency in attached soybean and maize leaves. Photosynthetica, 41(2): 267–271 DOI:10.1023/B:PHOT.0000011960.95482.91 |
| Liu Y T, Xu J T, Gao K, 2012. CO2-driven seawater acidification increases photochemical stress in a green alga. Phycologia, 51(5): 562–566 DOI:10.2216/11-65.1 |
| Maxwell K, Johnson G N, 2000. Chlorophyll fluorescence-a practical guide. Journal of Experimental Botany, 51(345): 659–668 DOI:10.1093/jexbot/51.345.659 |
| Olischl ger M, Wiencke C, 2013. Ocean acidification alleviates low-temperature effects on growth and photosynthesis of the red alga Neosiphonia harveyi (Rhodophyta). Journal of Experimental Botany, 64(18): 5587–5597 DOI:10.1093/jxb/ert329 |
| Platt T, Gallegos C L, Harrison W G, 1980. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton. J Mar Res, 38: 687–701 |
| Riebesell U, Zondervan I, Rost B , et al, 2000. Reduced calcification of marine plankton in response to increased atmospheric CO2. Nature, 407(6802): 364–367 DOI:10.1038/35030078 |
| Suárez- lvarez S, Gómez-Pinchetti J L, García-Reina G, 2012. Effects of increased CO2 levels on growth, photosynthesis, ammonium uptake and cell composition in the macroalga Hypnea spinella (Gigartinales, Rhodophyta). Journal of Applied Phycology, 24(4): 815–823 DOI:10.1007/s10811-011-9700-5 |
| Tchernov D, Helman Y, Keren N, et al, 2001. Passive entry of CO2 and its energy-dependent intracellular conversion to HCO3– in cyanobacteria are driven by a photosystem I-generated ΔμH+. Journal of Biological Chemistry, 276(26): 23450–23455 DOI:10.1074/jbc.M101973200 |
| Wu Y, Gao K, Riebesell U, 2010. CO2-induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum. Biogeosciences, 7(9): 2915–2923 DOI:10.5194/bg-7-2915-2010 |
| Yang G Y, Gao K S, 2012. Physiological responses of the marine diatom Thalassiosira pseudonana to increased pCO2 and seawater acidity. Marine Environmental Research, 79: 142–151 DOI:10.1016/j.marenvres.2012.06.002 |
 2017, Vol. 48
2017, Vol. 48


