
中国海洋湖沼学会主办。
文章信息
- 刘好真, 郑丹, 焦海峰, 王莉, 徐鹏, 史西志, 王一农, 尤仲杰. 2017.
- LIU Hao-Zhen, ZHENG Dan, JIAO Hai-Feng, WANG Li, XU Peng, SHI Xi-Zhi, WANG Yi-Nong, YOU Zhong-Jie. 2017.
- 东海渔山列岛浅海岩礁区大型消费者食源及营养级分析
- FOOD SOURCE AND TROPHIC LEVEL OF LARGE CONSUMERS IN ROCKY COASTAL WATERS OFF YUSHAN ISLANDS IN THE EAST CHINA SEA
- 海洋与湖沼, 48(5): 1036-1043
- Oceanologia et Limnologia Sinica, 48(5): 1036-1043.
- http://dx.doi.org/10.11693/hyhz20170300059
-
文章历史
- 收稿日期:2017-03-17
- 收修改稿日期:2017-04-06
2. 宁波市海洋与渔业研究院 宁波 315103
2. Ningbo Academy of Oceanology and Fisheries, Ningbo 315103, China
营养级是研究生态系统结构和功能的基础, 揭示群落内物种间的相互关系及营养结构, 阐明生态系统内的物质循环和能量流动过程(Lindeman, 1942; Cohen, 2009)。早期的研究中, 测量技术和计算方法限制了营养级在生态学中的应用; 近年来, 胃含物分析法和稳定性同位素技术的发展优化了营养级的表达和计算, 促进了营养级研究的发展(纪炜炜等, 2010; 姜亚洲等, 2015)。与胃含物分析法只能反映短期食物摄取信息相比(姜亚洲等, 2015), 稳定性同位素技术能反映较长生活周期营养状况的特点(颜云榕等, 2012), 区分消化与同化, 客观地反映动物的食物(食源)及其营养级(Thimdee et al, 2004)。目前, 稳定性同位素技术被广泛用于海洋生态研究, 揭示海洋生态系统结构和功能的变化规律(孙明等, 2013), 已成为研究海洋食物网营养级的一种有力工具(李云凯等, 2014)。
研究发现, 氮同位素在相邻营养级间存在明显的富集现象, 可以利用氮稳定同位素比值来解释动物之间的取食关系、估算其营养级和构建食物网结构(Deolalikar, 1998; Kirkbride et al, 2014; Mozaffarian et al, 2014)。此方法已经成功地估算了远古人类(Hedges et al, 2007)、潮间带底栖动物(全为民等, 2007)、淡水鱼类(Logan et al, 2008)、陆地哺乳动物(Germain et al, 2013)和土壤动物(Klarner et al, 2013)等的营养级。结合碳稳定性同位素, 运用多同位素方法可以分析食物来源及其贡献度(冯建祥等, 2013), 增加营养级分析的精度。
本研究以在东海渔山列岛浅海岩礁区进行的非定点调查所获生物资源为研究对象, 应用碳氮稳定性同位素技术分析东海渔山列岛浅海岩礁区生物的碳氮稳定性同位素比值变化, 研究东海渔山列岛浅海岩礁区生物的食性和营养级, 讨论稳定性同位素的富集以及基准生物的选取对营养级的影响, 旨在为揭示东海渔山列岛国家级海洋生态特别保护区的生态系统结构和功能变化提供参考。
1 材料与方法 1.1 研究区域样品取自2012年4月在东海渔山列岛浅海岩礁区(122°13.5xE—122°17.5xE, 28°51.4xN—28°56.4xN)进行的非定点调查。东海渔山列岛隶属于象山县石浦镇, 位于象山半岛东南、猫头洋东北, 距离浦铜瓦门山47.50km, 由13岛41礁组成, 陆地总面积2.00km2, 海岛岸线总长20.80km, 因其独特的地理位置和丰富的海洋生物资源, 被国家海洋局列为国家级海洋特别保护区和国家级海洋公园。
1.2 样品采集与前处理 1.2.1 浮游植物样品的采集浮游植物的采集用浅水Ⅲ型浮游生物网垂直拖网, 经180目筛绢网和去有机的GF/C膜过滤, 带回实验室保存于冰柜(-17℃)。同时, 取浮游植物样品用5%的中性甲醛溶液固定, 带回实验室进行生物种类鉴定。
1.2.2 底栖微藻样品的采集底栖微藻样品的采集和保存参照Riera等(2002)和全为民等(2007)的方法进行。样品经筛绢网过滤, 去除浮游动物和大型有机碎屑, 后经去有机的GF/C膜过滤, 将滤膜保存于冰柜(-17℃)。同时, 取底栖微藻样品用5%的中性甲醛溶液固定, 带回实验室进行定性分析。
1.2.3 大型底栖动物和大型藻类样品的采集大型底栖动物采集活体, 鱼类样品来自海钓渔获物, 二者均冰鲜保存带回实验室, 洗净后分别取肌肉组织制成综合样, 保存于冰柜(-17℃)。大型藻类采集活体, 进行种类鉴定后保存于冰柜(-17℃)。
1.2.4 样品前处理将所有样品于60℃鼓风干燥箱中干燥至恒重(48h), 研磨成粉状, 使用60目筛网筛分。筛分后, 样品加入盐酸(1mol/L)进行酸化处理, 去除有机碳, 经二次干燥研磨后装入样品袋放入干燥器中保存。以上操作均按照《海洋调查规范》(12763.6-2007) 执行。
1.3 氮稳定性同位素测定使用Thermo Fisher Scientific公司生产的稳定性同位素质谱仪(Delta V Advantage)进行样品碳氮稳定性同位素的测定。稳定性同位素的自然丰度表示为:
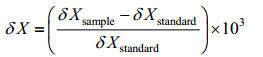
式中, δX为生物的氮或碳稳定性同位素比值; X表示15N或者13C; δXsample为15N/14N或13C/12C; δXstandard为标准物质的稳定性同位素比值, 其中, 碳的标准物为美洲拟箭石, 氮的标准物为标准气压下的洁净氮气。δ13C的分析精度STD<0.2‰; δ15N的分析精度STD<0.25‰。
1.4 营养级计算营养级(TL)计算公式如下:
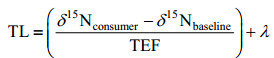
式中, δ15Nconsumer为系统消费者氮稳定性同位素比值; δ15Nfood为系统消费者食物氮稳定性同位素比值; δ15Nbaseline为该系统基准生物的氮稳定性同位素比值; TEF为营养富集因子, 其值设定为3.20‰ (Inger et al, 2006); λ为系统基准生物的营养级, 此处取值为2(全为民等, 2007)。
1.5 数据处理对所测数据进行对数转换, 运用单因素方差分析检验不同浅海岩礁区生物之间或者不同类群之间的δ15N和δ13C值差异, 数据分析前进行正态检验(K-S检验)和方差齐次性检验, 若不满足上述要求, 则进行非参数检验(K-W检验); 运用R语言siar包进行食源分析; 运用R语言mvpart包进行条件聚类分析。对上述公式的计算和数据处理均通过Microsoft Excel、SPSS 22.0和R 3.3.2软件完成。
2 结果与分析 2.1 东海渔山列岛浅海岩礁区生物资源碳、氮稳定性同位素比值共采样分析了14种初级生产者和61种消费者。将所有生物分为初级生产者14种、软体动物34种、甲壳类13种、鱼类4种和其他类别10种, 经单因素方差分析表明, 各类别间δ15N和δ13C值差异高度显著(P<0.01)。SIBER (Stable Isotope Bayes Ellipses in R)分析表明, 基于δ15N值不同类群分组间有明显的分层现象, 贝叶斯椭圆交互不明显, 初级生产者的δ15N平均值(4.20‰)最低, 鱼类的δ15N平均值(11.20‰)最高, 各类别的δ15N值极差分别为初级生产者4.21‰、软体动物6.08‰、甲壳类4.82‰、鱼类3.75‰、其他3.48‰, 东海渔山列岛浅海岩礁区大多数生物的δ15N较低, 介于初级消费者和次级消费者之间, 而肉食性的种类基本都处于食物链的顶端, 这与基本的食物营养结构相同; 基于δ13C值, 软体动物, 甲壳类和其它类别之间贝叶斯椭圆交互明显, 其它类别基本包含于甲壳类之中, 各类群δ13C值的均值鱼类(-16.67‰)>(-17.25‰)>初级生产者(-18.19‰)>甲壳类(-19.04‰)>其它类别(-19.50‰), 软体动物的极差(10.99) 最大, 鱼类的极差(2.15) 最小。初级消费者中, 短滨螺的δ15N值(4.57‰)最小, 鉴于其营养吸收较为稳定, 可作为营养级的基准生物(图 1)。
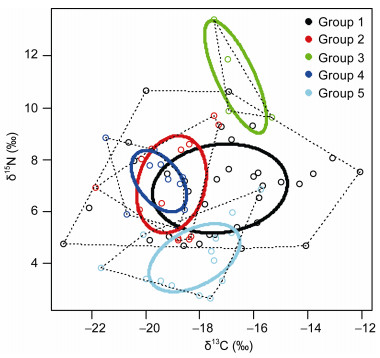 |
| 图 1 东海渔山列岛浅海岩礁区生物δ15N和δ13C值SIBER分析图 Fig. 1 SIBER analysis on δ15N and δ13C values in rocky coastal waters of Yushan Islands, the East China Sea 注: Group1表示软体动物; Group2表示甲壳类; Group3表示鱼类; Group4表示其它类别; Group5表示初级生产者; 实线表示均值的95%的置信区间; 虚线表示数据的95%的置信区间 |
将东海渔山列岛浅海岩礁区食源分为5类, 初级生产者(Primary producers)、软体动物(Mollusks)、甲壳类(Crustanceans)、鱼类(Fish)和其它类别(Other species)。经K-W检验表明其它类别生物间δ15N和δ13C值的差异不显著(P>0.05);藻类、浮游植物和底栖微藻都为自养生物, 所以将其归为初级生产者一组。单因素方差分析表明各组食源间δ15N和δ13C值差异高度显著(P<0.01)。经SIBER分析和食源选取效果分析表明甲壳类与其它类别间的重叠较高, 二者不能同时作为食源进行分析, 本文选取初级生产者、软体动物、甲壳类和鱼类作为食源进行分析(图 2)。
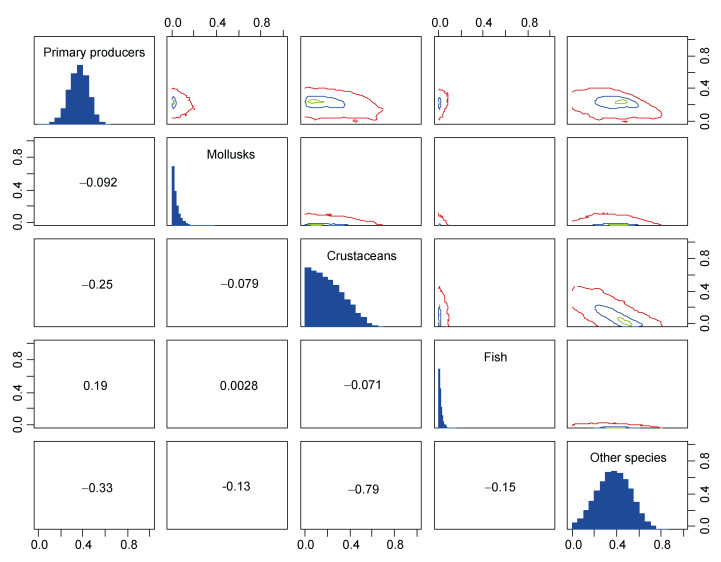 |
| 图 2 食源选取效果分析图 Fig. 2 Analysis on the effect of food source selection 注:柱状图表示此类食源的贡献率和贡献范围; 图中数值表示为食源间相似比例, 数值绝对值越大, 表示食源越相似 |
采用R语言siar包分析了各消费者与食源间的关系。得出各类群对于食物的偏向性, 软体动物多分布在初级生产者周围, 二者δ15N和δ13C值较为接近, 说明初级生产者是软体动物的主要食物来源。基于δ15N值, 食源有明显的分层现象, 初级生产者最低, 鱼类最高; 甲壳类纵向分布较为广泛, 可以说明其营养级跨度较大。软体动物的方差数值较大, 且基于δ13C值, 其分布较为广泛, 说明其食源丰富(图 3)。
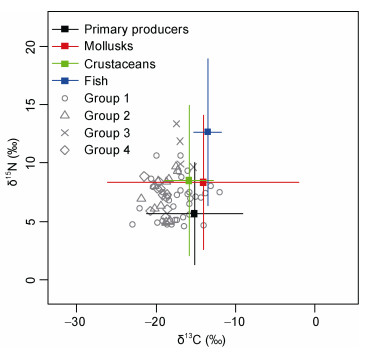 |
| 图 3 基于δ15N和δ13C值的食源分布二维散点图 Fig. 3 A two-dimensional scatter diagram of food source distribution based on δ15N and δ13C values 注: Group1表示软体动物; Group2表示甲壳类; Group3表示鱼类; Group4表示其它类别 |
单因素方差分析表明, 不同食源对各个物种的贡献率及贡献范围有显著差异(P<0.05)。初级生产者的贡献范围在27.05%—57.99%;软体动物的贡献范围在0.00%—14.83%;甲壳类的贡献范围在31.52%—66.45%;鱼类的贡献范围在0.00%—7.09%;平均贡献范围, 初级生产者(42.51%)>甲壳类(49.47%)>(5.36%)>鱼类(2.66%)。初级生产者和甲壳类的贡献范围较大, 说明二者是东海渔山列岛浅海岩礁区主要的食物源, 鱼类的贡献范围最小, 主要与鱼类是较为顶级的捕食者有关(图 4)。
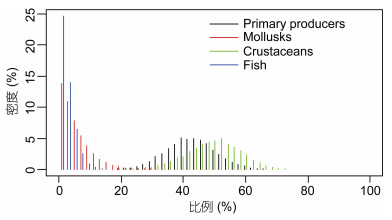 |
| 图 4 食源对各生物种的食源贡献率 Fig. 4 Rate of contribution of food source to the food source of each species |
基于消费者TL值, 使用R语言进行条件限制聚类构建多元回归树, 进行最优化营养级分析, 结果表明可将该海区消费者分为3个营养级:碎屑食性动物(初级消费者) (2.000<TL<2.984)、杂食性动物(次级消费者) (2.984≤TL<3.777), 和肉食性动物(TL≥3.777)。
东海渔山列岛浅海岩礁区消费者的营养级(TL)变化范围为2.000—4.760, 2.000<TL<2.984的有39个物种, TL平均值为2.486; 2.984≤TL<3.777的有18个物种, TL平均值为3.296; TL≥3.777的有4个物种, 平均值为4.210。消费者中营养级最高的是黑鲷(4.756), 其次是中国花鲈(4.281);营养级最低的是短滨螺(2.000), 其次是覆瓦小蛇螺(Serpulorbis imbricatus) (2.031)。丽核螺(Mitrella bella)和短蛸(Amphioctopus fangsiao)的营养级分别为3.900和3.891, 这与其它软体动物的营养级相比较明显偏高, 这种软体动物在生态系统中营养级较高的现象值得深入研究。
3 讨论 3.1 不同生物之间稳定性同位素15N的富集东海渔山列岛浅海岩礁区的初级生产者和消费者δ15N值分析结果表明, 15N在不同生物体内的富集程度差异高度显著(P<0.01), 营养级间15N富集在不同动物类群和食物之间存在较大差异(Zanden et al, 2001; 全为民等, 2007; 魏虎进等, 2013; 蒋日进等, 2014)。研究发现, 东海渔山列岛浅海岩礁区的消费者δ15N值变化范围为4.57‰—13.39‰, 平均值为7.25‰, 枸杞岛海域δ15N值变化范围为1.80‰— 12.80‰, 平均值为7.80‰ (蒋日进等, 2014), 而长江口盐沼中消费者的δ15N值变化范围为6.87‰— 13.33‰, 均值也较大(全为民等, 2007)。东海渔山列岛消费者δ15N值略低于枸杞岛的δ15N值, 原因是本研究主要针对浅海岩礁区生物进行分析, 而后者针对海域进行分析, 海域中鱼类的种类较多, 营养级较高的消费者其δ15N值也相对较高。单纯分析某个共同出现的种类, 如日本蟳(Charybdis japonica)、褐菖鲉(Sebastiscus marmoratus)和黑鲷, 东海渔山列岛的3个种类的δ15N值高于枸杞岛的δ15N值, 而东海渔山列岛中国花鲈的δ15N值高于长江口盐沼中花鲈的δ15N值(全为民等, 2007), 由此说明, 不同海域同一种生物体内富集的15N量也存在差异, 这也反映出不同海域间的生物群落结构和稳定性存在着差异。
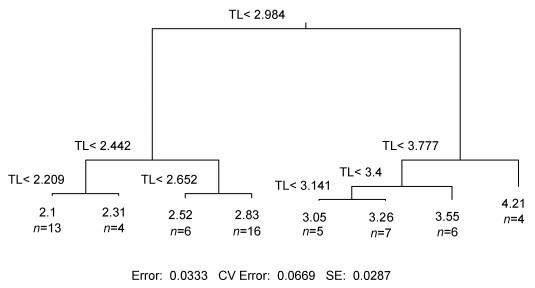 |
| 图 5 东海东海渔山列岛浅海岩礁区消费者营养级多元回归树 Fig. 5 Multiple regression of consumers' trophic level in the rocky coastal waters of Yushan Islands, the East China Sea 注: TL为营养级, n为固定TL中的个体数 |
稳定性同位素技术是生态学家研究生态系统特征与过程(包括食物网结构、食物链长度、食物网耦合等), 探讨物质和能量在生物圈的流动和循环的重要手段之一(O'Reilly et al, 2002; Layman et al, 2007; 徐军等, 2010), 目前也已逐渐成为研究生物之间的营养关系、环境营养状况与生物迁徙途径的重要手段(Gannes et al, 1997)。在生态系统研究中, 需要选择某种生物的稳定性同位素值作为“基准(Baseline)”, 用于评价生态系统中高营养级生物功能或者进行多种生态系统间的比较研究。基准生物通常是食物链或食物网中低营养级生物或有机物质, 如初级生产者、有机碎屑或初级消费者等, 而基准生物的选择以及基准同位素的准确性对推断和分析不同层次与尺度的生态学问题是至关重要的(Wolfenden et al, 2011), 因此, 选择恰当的基准生物是使用同位素技术判别生态系统结构与功能的基础(徐军等, 2010)。如前述, 不同海域中生物的稳定性同位素δ15N值存在差异, 而且不同海域中δ15N的基线值差异也较大, 因此选择合适的基准生物或基线值便成为稳定性同位素研究的关键环节(Kohn et al, 2002; Yan et al, 2004; Mendes et al, 2007), 否则会影响到对高营养级生物在生态系统中的功能的判断(Kohn et al, 2002; Goldsmith et al, 2012)。一般情况下, 同位素周转速度慢的生物对环境变化响应缓慢, 可以用作相对稳定和完整的同位素基准(魏虎进等, 2013), 一些研究者选择浮游动物作为评价鱼类营养级的基准(蒋日进等, 2014), 也有研究者选择初级消费者为营养级的基准, 如选择绯拟沼螺(Assminea latericea) (全为民等, 2007)和滤食性的贻贝(蔡德陵等, 2005)作为基准。如果直接利用初级生产者的稳定性同位素值来作为营养级计算的基线, 会引入较大的误差(蔡德陵等, 2005)。通过分析发现东海渔山列岛浅海岩礁区初级消费者短滨螺δ15N值较低, 故本文选择了短滨螺作为基准生物。
3.3 东海渔山列岛浅海岩礁区消费者营养级本研究发现, 作为基准生物的短滨螺的δ15N值为4.57‰, 仅略高于底栖微藻和浮游植物的δ15N值(前者为3.39‰, 后者为3.83‰), 同时发现覆瓦小蛇螺、厚壳贻贝(Mytilus coruscus)、偏顶蛤(Modiolus modiolus)、短石蛏(Leiosolenus curta)、日本突尾水虱(Cymodoce japonica)和扭曲猿头蛤(Chama reflexa)等种类的δ15N值也较低, 均低于5.00‰, 它们的营养级(TL)也较低(2.097)。同样的现象, 在对盐沼中两种螺类的δ15N值分析中也有发现(Kurata et al, 2001), 这2种螺类的δ15N值与食物相近, 15N在机体内并未出现富集, 经分析造成上述未富集的原因有2个:一是大型底栖动物的选择性同化(selective assimilation)行为, 在盐沼湿地中, 有机碎屑是多种有机物复合而成, 大型底栖动物在同化碎屑等有机物的过程中是由选择性的, 它们选择了跟自身同位素值相近的有机碎屑; 二是微生物降解作用, 微生物降解会导致碎屑物的δ15N值显著降低(Boschker et al, 2002; Morasch et al, 2002; Kritee et al, 2009)。全为民等(2007)也表示可以利用这2种机制来解释长江口盐沼中绯拟沼螺的15N富集较低的现象, Olive等(2003)指出在利用δ15N值来计算消费者的营养级时, TEF的选择应十分谨慎。本文参照Inger等(2006)的研究, 15N的TEF值取3.20‰, 13C的TEF值取1.45‰。
如前述, 东海渔山列岛的浅海岩礁区生物群落被划分为4个营养级:初级生产者、碎屑食性动物(初级消费者)、杂食性动物(次级消费者)和肉食性动物。其中, 初级消费者营养级小于2.984, 代表性种类有短滨螺、覆瓦小蛇螺、厚壳贻贝、短石蛏、日本突尾水虱、日本矶海绵(Reniera japonica)、紫海胆(Anthocidaris crassispina)、粗腿厚纹蟹(Pachiyarapsus crassipes)和渔舟蜒螺(Nerita albicilla)等; 次级消费者营养级小于3.777, 代表性种类有多棘海盘车(Asterias amurensis)、异须沙蚕(Nereis heterocirrata)、多齿围沙蚕等(Perinereis nuntia); 日本
然而, 生态系统中食物链的营养级并不是无限增多的, 通常只有4—5个营养级, 这也是由生态系统能流的特性所决定的, 每个能量级的转化效率只有10%左右, 所以食物链越长, 消耗于营养级上的能量越多, 因此食物链的营养级很少超过6个。经过计算表明, 东海渔山列岛浅海岩礁区消费者的营养级变化范围为2.000—4.756, 由此推断消费者主要有4个营养级, 这与枸杞岛海域的消费者营养级类似(Hedges et al, 2007)。我国东黄海和北部海域生态系统食物网中也有4个营养级(徐军等, 2010), 而长江口盐沼湿地发现仅有3个营养级(全为民等, 2007)。这种差异可能由于调查海域的范围不同引起, 具体差异机理还需要进一步研究。
4 结论东海渔山列岛浅海岩礁区生物δ15N值较低, 介于初级消费者和次级消费者之间, 而肉食性的种类基本都处于食物链的顶端, 与基本的食物营养结构相同。初级消费者中, 短滨螺的δ15N值(4.57‰)最小, 鉴于其营养吸收较为稳定, 可作为营养级的基准生物。
各食源平均贡献范围, 初级生产者(42.51%)>甲壳类(49.47%)>(5.36%)>鱼类(2.66%)。初级生产者和甲壳类的贡献范围较大, 二者是东海渔山列岛浅海岩礁区主要的食物源。
东海渔山列岛的浅海岩礁区生物群落被划分为4个营养级:初级生产者、碎屑食性动物(初级消费者)、杂食性动物(次级消费者)和肉食性动物。生物群落的营养级结构复杂, 各种食性动物之间存在相互依存的现象。
| 冯建祥, 黄敏参, 黄茜, 等, 2013. 稳定同位素在滨海湿地生态系统研究中的应用现状与前景. 生态学杂志, 32(4): 1065–1074 |
| 全为民, 张锦平, 平仙隐, 等, 2007. 巨牡蛎对长江口环境的净化功能及其生态服务价值. 应用生态学报, 18(4): 871–876 |
| 孙明, 刘修泽, 李轶平, 等, 2013. 应用氮稳定同位素技术研究辽东湾海域主要渔业生物的营养级. 中国水产科学, 20(1): 189–197 |
| 纪炜炜, 李圣法, 陈雪忠, 2010. 鱼类营养级在海洋生态系统研究中的应用. 中国水产科学, 17(4): 878–887 |
| 李云凯, 贡艺, 陈新军, 2014. 稳定同位素技术在头足类摄食生态学研究中的应用. 应用生态学报, 25(5): 1541–1546 |
| 姜亚洲, 林楠, 袁兴伟, 等, 2015. 基于碳、氮稳定同位素技术研究象山港虾虎鱼类营养生态位. 生态学杂志, 34(6): 1579–1858 |
| 徐军, 张敏, 谢平, 2010. 氮稳定同位素基准的可变性及对营养级评价的影响. 湖泊科学, 22(1): 8–20 |
| 蒋日进, 章守宇, 王凯, 等, 2014. 枸杞岛近岸海域食物网的稳定同位素分析. 生态学杂志, 33(4): 930–938 |
| 蔡德陵, 李红燕, 唐启升, 等, 2005. 黄东海生态系统食物网连续营养谱的建立:来自碳氮稳定同位素方法的结果. 中国科学C辑:生命科学, 35(2): 123–130 |
| 颜云榕, 张武科, 卢伙胜, 等, 2012. 应用碳、氮稳定同位素研究北部湾带鱼(Trichiurus lepturus)食性及营养级. 海洋与湖沼, 43(1): 192–200 DOI:10.11693/hyhz201201031031 |
| 魏虎进, 朱小明, 纪雅宁, 等, 2013. 基于稳定同位素技术的象山港海洋牧场区食物网基础与营养级的研究. 应用海洋学学报, 32(2): 250–257 |
| Boschker H T S, Middelburg J J, 2002. Stable isotopes and biomarkers in microbial ecology. FEMS Microbiology Ecology, 40(2): 85–95 DOI:10.1111/fem.2002.40.issue-2 |
| Cohen M B, 2009. Clostridium difficile infections:emerging epidemiology and new treatments. Journal of Pediatric Gastroenterology and Nutrition, 48(S2): S63–S65 |
| Deolalikar A B, 1988. Nutrition and labor productivity in agriculture:estimates for rural South India. The review of Economics and Statistics, 70(3): 406–413 DOI:10.2307/1926778 |
| Gannes L Z, O'Brien D M, del Rio C M, 1997. Stable isotopes in animal ecology:assumptions, caveats, and a call for more laboratory experiments. Ecology, 78(4): 1271–1276 DOI:10.1890/0012-9658(1997)078[1271:SIIAEA]2.0.CO;2 |
| Germain L R, Koch P L, Harvey J, et al, 2013. Nitrogen isotope fractionation in amino acids from harbor seals:implications for compound-specific trophic position calculations. Marine Ecology Progress Series, 482: 265–277 DOI:10.3354/meps10257 |
| Goldsmith G R, Muñoz-Villers L E, Holwerda F, et al, 2012. Stable isotopes reveal linkages among ecohydrological processes in a seasonally dry tropical montane cloud forest. Ecohydrology, 5(6): 779–790 DOI:10.1002/eco.v5.6 |
| Hedges R E M, Reynard L M, 2007. Nitrogen isotopes and the trophic level of humans in archaeology. Journal of Archaeological Science, 34(8): 1240–1251 DOI:10.1016/j.jas.2006.10.015 |
| Inger R, Ruxton G D, Newton J, et al, 2006. Temporal and intrapopulation variation in prey choice of wintering geese determined by stable isotope analysis. Journal of Animal Ecology, 75(5): 1190–1200 DOI:10.1111/j.1365-2656.2006.01142.x |
| Kirkbride J B, Jones P B, Ullrich S, et al, 2014. Social deprivation, inequality, and the neighborhood-level incidence of psychotic syndromes in East London. Schizophrenia Bulletin, 40(1): 169–180 DOI:10.1093/schbul/sbs151 |
| Klarner B, Maraun M, Scheu S, 2013. Trophic diversity and niche partitioning in a species rich predator guild-Natural variations in stable isotope ratios (13C/12C, 15N/14N) of mesostigmatid mites (Acari, Mesostigmata) from Central European beech forests. Soil Biology and Biochemistry, 57: 327–333 DOI:10.1016/j.soilbio.2012.08.013 |
| Kohn M J, Cerling T E, 2002. Stable isotope compositions of biological apatite. Reviews in Mineralogy and Geochemistry, 48(1): 455–488 DOI:10.2138/rmg.2002.48.12 |
| Kritee K, Barkay T, Blum J D, 2009. Mass dependent stable isotope fractionation of mercury during mer mediated microbial degradation of monomethylmercury. Geochimica et Cosmochimica Acta, 73(5): 1285–1296 DOI:10.1016/j.gca.2008.11.038 |
| Kurata K, Minami H, Kikuchi E, 2001. Stable isotope analysis of food sources for salt marsh snails. Marine Ecology Progress Series, 223: 167–177 DOI:10.3354/meps223167 |
| Layman CA, Quattrochi J P, Peyer C M, et al, 2007. Niche width collapse in a resilient top predator following ecosystem fragmentation. Ecology Letters, 10(10): 937–944 DOI:10.1111/ele.2007.10.issue-10 |
| Lindeman R L, 1942. The trophic-dynamic aspect of ecology. Ecology, 23: 339–418 |
| Logan J M, Jardine T D, Miller T J, et al, 2008. Lipid corrections in carbon and nitrogen stable isotope analyses:comparison of chemical extraction and modelling methods. Journal of Animal Ecology, 77(4): 838–846 DOI:10.1111/j.1365-2656.2008.01394.x |
| Mendes S, Newton J, Reid R J, et al, 2007. Stable carbon and nitrogen isotope ratio profiling of sperm whale teeth reveals ontogenetic movements and trophic ecology. Oecologia, 151(4): 605–615 DOI:10.1007/s00442-006-0612-z |
| Morasch B, Richnow H H, Schink B, et al, 2002. Carbon and hydrogen stable isotope fractionation during aerobic bacterial degradation of aromatic hydrocarbons. Applied and Environmental Microbiology, 68(10): 5191–5194 DOI:10.1128/AEM.68.10.5191-5194.2002 |
| Mozaffarian D, Fahimi S, Singh G M, et al, 2014. Global sodium consumption and death from cardiovascular causes. New England Journal of Medicine, 371(7): 624–634 DOI:10.1056/NEJMoa1304127 |
| Olive J F, Barret D, Gierliński M, 2003. Correlated timing and spectral behavior of 4U 1705-44. The Astrophysical Journal, 583(1): 416–423 DOI:10.1086/apj.2003.583.issue-1 |
| O'Reilly M, Alpert R, Jenkinson S, et al, 2002. Identification of a histamine H4 receptor on human eosinophils-role in eosinophil chemotaxis. Journal of Receptors and Signal Transduction Research, 22(1-4): 431–448 DOI:10.1081/RRS-120014612 |
| Riera P, Stal L J, Nieuwenhuize J, 2002. d13C vs d15N of co-occurring molluscs within a community dominated by Crassostrea gigas and Crepidula fornicata (Osterschelde, The Netherlands). Marine Ecology Progress Series, 240(1): 2914–295 |
| Thimdee W, Deein C, Sangrungruang C, 2004. Analysis of primary food sources and trophic relationships of aquatic animals in a mangrove-fringed estuary, Khung Krabaen Bay (Thailand) using dual stable isotope techniques. Wetlands Ecology and Management, 12(4): 135–144 |
| Wolfenden R, 2011. Benchmark reaction rates, the stability of biological molecules in water, and the evolution of catalytic power in enzymes. Annual Review of Biochemistry, 80: 645–667 DOI:10.1146/annurev-biochem-060409-093051 |
| Yan Z Y, Caldwell G W, 2004. Stable-isotope trapping and high-throughput screenings of reactive metabolites using the isotope MS signature. Analytical Chemistry, 76(23): 6835–6847 DOI:10.1021/ac040159k |
| Zanden M J V, Rasmussen J B, 2001. Variation in δ15N and δ13C trophic fractionation:implications for aquatic food web studies. Limnology and Oceanography, 46(8): 2061–2066 DOI:10.4319/lo.2001.46.8.2061 |
 2017, Vol. 48
2017, Vol. 48


