中国海洋湖沼学会主办。
文章信息
- 周林, 李颖, 吕振明, 史会来, 吴常文, 迟长凤. 2017.
- ZHOU Lin, LI Ying, LÜ Zhen-Ming, SHI Hui-Lai, WU Chang-Wen, CHI Chang-Feng. 2017.
- 曼氏无针乌贼(Sepiella japonica)精子表面蛋白17(Sp17) 基因克隆以及组织表达特异性分析
- MOLECULAR CLONING AND EXPRESSION ANALYSIS OF SPERM SURFACE PROTEIN 17 (SP17) GENE IN SEPIELLA JAPONICA
- 海洋与湖沼, 48(5): 1044-1051
- Oceanologia et Limnologia Sinica, 48(5): 1044-1051.
- http://dx.doi.org/10.11693/hyhz20170300060
-
文章历史
- 收稿日期:2017-03-17
- 收修改稿日期:2017-04-15
2. 浙江省海洋水产研究所 舟山 316021
2. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316021, China
精子表面蛋白17(Sp17) 是一种最初定位于哺乳动物雄性个体生殖细胞表面的特异性自身抗原性物质, 目前已经在兔(Richardson et al, 1994)、鼠(Kong et al, 1995)、人(Lea et al, 1997)等物种中有过研究, 并发现在同一个物种中编码成熟Sp17的不同长度的mRNA都有相同的编码区序列, 在功能上已被证实具有结合卵膜透明带, 参与顶体反应, 以及与葡聚糖、硫酸葡聚糖等大分子结合的作用(Richardson et al, 1994), 是在受精过程中起关键作用的蛋白。除此之外在软体动物部分种类基因组序列中也发现了具有类似Sp17结构的基因。根据其自身抗原特性, 越来越多的研究表明Sp17除了雄性生殖系统, 在呼吸系统的纤毛细胞以及某些癌细胞组织中也有不同水平的表达(Grizzi et al, 2004), 因此被作为一种候选的检测抗原而被应用于医学研究(De Jong et al, 2002)。
曼氏无针乌贼(Sepiella japonica)属软体动物门(Mollusca)、头足纲(Cephalopoda)、十腕目(Decapoda)、乌贼科(Sepiidae)、无针乌贼属(Sepiella)。作为一种具有较高药用、食用价值的经济头足类, 自20世纪80年代以来自然种群数量急剧下降(吴常文等, 2010), 众多学者对于其资源保护以及生殖发育进行了研究(李星颉等, 1986; 张建设等, 2011)。在本实验中, 我们首次克隆了编码曼氏无针乌贼Sp17(定义为Sj-Sp17) 的cDNA全长序列, 结合生物信息学分析探讨了Sj-Sp17基因以及蛋白结构与其可能存在的生物学功能的关系, 并通过real-time PCR技术分析了编码该蛋白的mRNA在不同组织中的表达特异性, 为进一步研究Sj-Sp17的细胞定位以及蛋白的生物学功能奠定了基础。
1 材料与方法 1.1 材料 1.1.1 实验动物性成熟的曼氏无针乌贼雄性个体取自浙江温州苍南头足类种苗繁育基地, 活体解剖取精巢、储精囊、输精管、前列腺、精荚、胃、肠、肝、鳃、视叶、脑、心脏、胰、肌肉共14种组织样品保存于RNAstore中, 以干冰装运至实验室, 放置于-80℃冰箱保存备用。
1.1.2 试剂RNAstore购自CWBIO公司; RNAiso Plus、PCR Master Mix、Reverse Transcriptase M-MLV (RNase H-)、SYBR Premix Ex TaqTM Ⅱ Kit、SMARTTMRACE kit均购自TaKaRa公司。
1.2 实验方法 1.2.1 总RNA提取以及cDNA第一链的合成取保存于RNAstore中的新鲜精巢组织50—100mg, 根据RNAiso Plus试剂说明书提取总RNA。cDNA的合成按照M-MLV (RNase H-)反转录试剂盒推荐的方法进行。
1.2.2 曼氏无针乌贼Sp17基因核心片段的克隆根据已有的转录组数据, 筛选并设计用于克隆Sj-Sp17基因核心片段的引物, 序列如下:
| 引物名称 | 序列(5′—3′) |
| SP17-1F | AGCAGATGTTAGCCCTTT |
| SP17-1R | CTTCAGTATCTTTGGTGCTT |
| SP17-2F | TCTTCTAGAGGGTTTCGC |
| SP17-2R | TGCAGGAGCTTTTACTTC |
| SP17-3F | ACTAAAACTGCTGAAGAG |
| SP17-3R | TGTAGCAGCAGCACTGACCT |
PCR 25μL体系根据PCR Master Mix试剂说明书进行加样, 反应条件为: 94℃预变性5min; 94℃ 30s, 58℃ 30s, 72℃ 30s, 35个循环; 72℃延伸7min, 12℃ 5min结束。PCR产物经过1.2%琼脂糖凝胶电泳检测, 含有目的片段的PCR产物送至上海华大生物公司进行测序。
1.2.3 Sp17基因全长cDNA的克隆根据上一步所得到的Sj-Sp17基因核心序列, 参考SMARTTMRACE试剂盒的要求设计5’和3’RACE引物, 见表 2。
| 引物名称 | 序列(5’—3’) |
| SP17-5’Outer | GCTCCGAACTGAATGA |
| SP17-5’Inner | TTTTGGCTGAGCCCGTAG |
| SP17-3’Outer | AGCAAGATCCAGGCAAGTTTTAGAGGTCA |
| SP17-3’Inner | ATGCTATCGACATTGACCTAACTGACCCA |
5’RACE采用引物SP17-5’Outer和试剂盒接头引物5’adapter以加尾的cDNA为模板进行第一轮PCR扩增, 然后以SP17-5’Inner引物和5’adapter进行巢式PCR第二轮扩增。3’RACE采用引物SP17-3’Outer和接头引物3’adapter进行第一轮PCR扩增, 接着以引物SP17-3’Inner和3’adapter进行巢式PCR二轮扩增。PCR条件参考试剂盒说明书。PCR产物电泳检测并纯化回收, 连接到PMD18-T载体, 后转化至DH5α感受态细胞培养, 挑取阳性克隆送至上海华大生物公司测序。
1.2.4 曼氏无针乌贼Sp17基因全长及序列分析将测序得到的片段通过DNAMAN软件进行拼接, 并用ORFfinder (https://www.ncbi.nlm.nih.gov/orffinder/)在线工具预测基因的开放阅读框(ORF)位置; 然后利用Expasy-ProtParam (http://web.expasy.org/protparam/) (Gasteiger et al, 2003)将其翻译为氨基酸序列并预测蛋白的相对分子量和等电点; 应用在线工具SignaIP (http://www.cbs.dtu.dk/services/SignalP/) (Bendtsen et al, 2004)以及TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)分别对其进行信号肽以及跨膜区的预测; NetPhos (http://www.cbs.dtu.dk/services/NetPhos/)软件分析其磷酸化位点; 保守结构域分析采用NCBI在线搜索工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi); Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo/) (Thompson et al, 1997)对Sj-Sp17及其同源氨基酸序列进行比对, 基于Sp17氨基酸序列分析不同物种之间的进化关系并利用贝叶斯法构建分子进化树。
1.2.5 曼氏无针乌贼精子表面蛋白Sp17的组织表达特异性分析根据已知的Sj-Sp17基因全长, 在ORF区内设计用于real-time PCR的引物, 选择曼氏无针乌贼β-actin基因(S. japonica JN564496.1) 作为内参基因, 合成的引物经普通PCR验证, 序列见表 3。
| 引物名称 | 序列(5′—3′) |
| SP17-YF | TCATTCAGTTCGGAGCCA |
| SP17-YR | CCTATCTTCCAAATCAGCACA |
| Actin-F | TGAGAGGGAGATTGTGCGTG |
| Actin-R | GAACATAGATTCTGGAGCACGG |
各组织的RNA提取以及合成cDNA第一链的方法, 如实验方法中1.2.1节所述。反转录后的cDNA利用核酸蛋白检测仪测定浓度, 并取足量稀释到100ng/μL备用, real-time PCR加样体系及反应条件按照SYBR Premix Ex TaqTM Ⅱ Kit产品说明书进行。
2 结果与分析 2.1 曼氏无针乌贼Sp17基因全长的获得以曼氏无针乌贼精巢cDNA为模板, 以SP17-1F/ 1R、SP17-2F/2R和SP17-3F/3R为引物扩增分别得到338bp、256bp和336bp的核心片段, 拼接后根据该基因序列设计RACE引物, 采用5′RACE和3′RACE方法分别获得了210bp和563bp的两个目的片段(图 1)。
 |
| 图 1 曼氏无针乌贼Sp17基因cDNA的扩增 Fig. 1 The amplification of Sp17 gene cDNA in S. japonica |
利用DNAMAN软件将扩增得到的长度分别为338bp、256bp和336bp的核心片段以及3’RACE和5’RACE长度分别为210bp和563bp的片段拼接得到Sj-Sp17基因全长cDNA 1463bp, 预测ORF为1149bp, 5’UTR区92bp, 3’UTR区222bp, 共编码382个氨基酸(图 2)。
 |
| 图 2 Sj-Sp17基因cDNA全长 Fig. 2 The full length of Sj-Sp17 cDNA 注:预测的开放阅读框中起始密码子(ATG)和终止密码子(TAA)用黑色线框标示出, 翻译出的氨基酸序列在核苷酸序列下方给出 |
选用来自NCBI(https://www.ncbi.nlm.nih.gov/)数据库的Sp17同源性序列与Sj-Sp17进行氨基酸比对, 发现组成该蛋白的氨基酸序列中前100个氨基酸比较保守。图 3中列出部分氨基酸序列的比对结果, Sj-Sp17氨基酸序列和太平洋牡蛎(Crassostrea gigas XP_011412976.1)、海蜗牛(Aplysia californica XP_ 012936202.1)、加州双斑蛸(Octopus bimaculoides XP_ 014778086.1)、光滑双脐螺(Biomphalaria glabrata XP_013090015.1)、紫海胆(Strongylocentrotus purpuratus XP_011680588.1) 以及囊舌虫(Saccoglossus kowalevskii XP_006818979.1) 的相似性分别为36%、36%、36%、31%、44%和38%。保守结构域的分析发现在不同物种的Sp17氨基酸序列中同一位置(12—50aa)均存在DD CABYR SP17结构域, 此外还存在至少一个IQ结构域(图 4)。采用mrBayes软件(Ronquist et al, 2003)对曼氏无针乌贼和来自于NCBI数据库的65条氨基酸序列构建系统进化树(图 5)。其中曼氏无针乌贼和加州双斑蛸位于同一进化支, 证明其亲缘关系最近, 头足类和其他软体动物例如太平洋牡蛎、海蜗牛、紫海胆等位于同一较大进化支。
 |
| 图 3 Sp17氨基酸同源比对 Fig. 3 Multiple alignments of deduced amino acid sequences of Sp17 注:相同氨基酸残基用黑色标出, 保守氨基酸残基用灰色标出 |
 |
| 图 4 Sp17结构域比对 Fig. 4 Comparison in protein domains of Sp17 |
 |
| 图 5 基于Sp17氨基酸序列构建的贝叶斯系统进化树 Fig. 5 Bayesian phylogenetic tree depicting the relationship of Sp17 amino acids sequence with other species |
分析表明, Sj-Sp17基因编码的蛋白质包括320个亲水性氨基酸和54个疏水性氨基酸, 为亲水性蛋白。理论分子量(MW)为42.0548kDa, 等电点(pI)4.66。信号肽和跨膜区预测结果显示该蛋白无跨膜区(图 6)以及信号肽结构(图 7)。磷酸化位点分析表明, 该蛋白存在45个可能发生磷酸化修饰的位点。采用Antheprot5.0软件(Geourjon et al, 1991)对SP17蛋白的二级结构分析发现, 该蛋白含有54%的螺旋(Helix), 3%的折叠(Sheet), 6%的转角(Turn)以及38%的无规则卷曲结构(Coil)(图 8)。
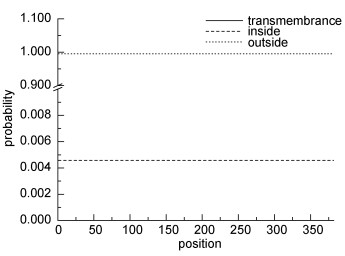 |
| 图 6 Sj-Sp17跨膜区预测结果 Fig. 6 The transmembrane region prediction of Sj-Sp17 |
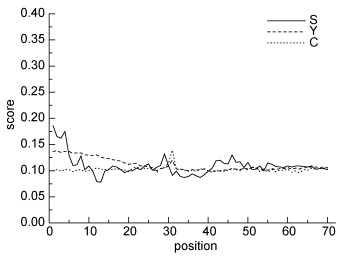 |
| 图 7 Sj-Sp17信号肽预测结果 Fig. 7 The signal peptide prediction of Sj-Sp17 |
 |
| 图 8 Sj-Sp17蛋白的二级结构预测 Fig. 8 The secondary structure prediction of Sj-Sp17 |
通过real-time PCR的方法对Sj-Sp17基因在精巢、脑、储精囊等共14种组织中的表达特异性进行分析, 以曼氏无针乌贼β-actin基因(S. japonica JN564496.1) 作为内参基因, 选取肌肉中的表达量作为参照, 采用2-ΔΔCt方法计算相对表达量, 并用SPSS18软件进行显著性分析。实验结果表明, Sj-Sp17基因在性成熟时期的精巢、储精囊中均有显著表达(P<0.05), 其次在脑、精荚以及输精管中也有一定量的表达, 而在其他组织中表达量极低(图 9)。
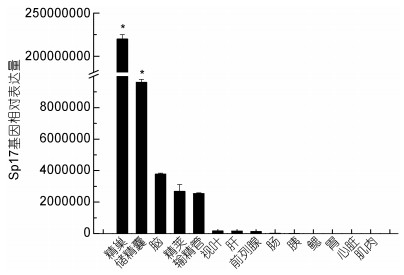 |
| 图 9 Sj-Sp17基因在不同组织的表达特异性 Fig. 9 Distribution of Sj-Sp17 mRNA in various tissues 注:数据为3个重复的平均值±标准误。“*”标注表示有显著差异(P<0.05, n=3) |
精子表面蛋白Sp17是一种高度保守的哺乳动物蛋白, 可能作为结合透明带表面糖基的分子而参与到顶体反应中, 并促进受精作用(Kong et al, 1995; Adoyo et al, 1997)。克隆得到的1463bp的Sj-Sp17cDNA序列, 对其开放阅读框编码的氨基酸分析发现没有跨膜结构, 不存在信号肽, 因此Sp17不属于细胞内分泌蛋白。磷酸化位点分析表明, 其氨基酸序列中存在多个潜在的发生磷酸化的位点, 蛋白质的磷酸化在细胞信号转导中起重要作用(De Castro et al, 2006), 因此我们推测这些磷酸化位点可能是其潜在的完成生理功能的结构基础。保守结构域分析表明Sj-Sp17及其同源蛋白结构中均含有一个DD CABYR SP17结构域以及多个IQ结构域(Cheney et al, 1992)。DD CABYR SP17结构域是一个同时存在于CABYR以及Sp17 N端的结构, 它和依赖于cAMP的蛋白激酶A的R亚基(PKA RⅡ)氨基酸序列高度相似(Frayne et al, 2002), 这一部分结构是形成蛋白二聚化以及与蛋白激酶A锚定蛋白(AKAPs)相互作用所必需的(Taylor et al, 1990), 并且已有实验证明Sp17能够亲和AKAP3 (Lea et al, 2004); IQ结构域含有保守的异亮氨酸以及谷氨酰胺残基, 属于钙调素结合蛋白家族, 钙调素结合蛋白在精子细胞中有大量的表达(Jones et al, 1978), 同时也被证实在例如精子发生(Moriya et al, 1993)、精子运动(Tash, 1989)、精子获能(Adeoya-Osiguwa et al, 1996)、顶体反应(Zaneveld et al, 1991)和精卵融合(Courtot et al, 1994)过程中发挥调节作用, 因此我们推测Sp17作用机理与其他同家族蛋白类似(Wasco et al, 1989; Manjunath et al, 1993; Trejo et al, 1997), 即在钙离子或者EDTA存在下结合钙调蛋白发挥生物学作用。Sp17中IQ结构域还可能与蛋白质磷酸化以及参与钙离子信号转导以调节Sp17蛋白与透明带表面糖基的结合有关(Deloulme et al, 1997)。二级结构预测显示Sj-Sp17氨基酸中IQ结构域部分含有丰富的α-螺旋结构, 钙调蛋白在稳定这一结构的过程中可能起着很重要的作用(Xie et al, 1994; Gerendasy et al, 1995), 而且螺旋结构越丰富, 此区域与钙调蛋白的亲和力也越大(阎虎生等, 1991)。PEST (PEST-FIND Score=11.38) 序列是一段含有丰富的脯氨酸、谷氨酰胺、丝氨酸、苏氨酸组成的短序列, 与泛素化降解有关(Rechsteiner et al, 1996), Sj-Sp17氨基酸序列中317—337aa存在潜在的PEST序列, 在Sp17以及其他含有钙调蛋白结合域(IQ)的蛋白质中均存在这样的结构(Barnes et al, 1995), 实验证实顶体反应开始后Sp17蛋白表达量迅速增多(Richardson et al, 1994), 随着反应进行, 分子量较大的三联体蛋白逐渐减少, 小分子量蛋白增加, 因此, 该PEST序列可能与顶体反应中高分子量的Sp17蛋白剪切掉C端的部分序列以及钙调素结合位点而最终呈现出小分子量的蛋白增加有关。
通过Sp17基因的组织表达特异性分析发现, 它在雄性生殖系统各组织中的表达量较其它组织更高, 尤其是在精巢中的表达量最高, 推测它可能与精子形成过程有关。通过对Sj-Sp17氨基酸序列及同源氨基酸序列的进化分析发现, 它与加州双斑蛸进化关系最近, 其次是太平洋牡蛎、海蜗牛、紫海胆以及扁形动物门的生物, 与人以及狒狒的关系最远。通过对进化关系较近的物种Sp17氨基酸序列比对发现, 同源性最高仅为44%, 说明Sp17在进化中并不保守。
4 结论本文通过RT-PCR以及RACE技术克隆得到了1463bp的Sj-Sp17cDNA全长序列, 并对其编码的长度为382个氨基酸的蛋白质进行了一系列生物信息学分析, 发现该蛋白不含信号肽以及跨膜区结构, 氨基酸同源性最高仅为44%, 说明Sp17在进化中并不是很保守。进化分析表明Sj-Sp17与加州双斑蛸进化关系最近。通过对预测蛋白结构的分析结合前人的研究成果, 我们推测Sj-Sp17可能也参与顶体反应并促进顶体反应的顺利进行, 而组织特异性分析也显示Sj-Sp17在精巢以及储精囊中有显著表达, 因此Sj-Sp17还可能与精子的形成以及成熟有关。Sj-Sp17作为一种重要的与生殖相关的蛋白, 其成功的克隆以及组织表达特异性分析对于深入研究其生理功能以及作用机理具有重要意义, 并为曼氏无针乌贼的种质保护以及育种繁殖研究提供一定的理论依据。
| 吴常文, 董智勇, 迟长凤, 等, 2010. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究. 海洋与湖沼, 41(1): 39–46 DOI:10.11693/hyhz201001005005 |
| 张建设, 夏灵敏, 迟长凤, 等, 2011. 人工养殖曼氏无针乌贼(Sepiella maindroni)繁殖生物学特性研究. 海洋与湖沼, 42(1): 55–59 DOI:10.11693/hyhz201101008008 |
| 李星颉, 戴健寿, 唐志跃, 1986. 曼氏无针乌贼怀卵量及生殖力. 浙江水产学院学报,(2): 1–8 |
| 阎虎生, 何炳林, 1991. 多肽的α螺旋结构对多肽与钙调蛋白亲合力的影响. 中国生物化学与分子生物学报, 7(2): 147–152 |
| Adeoya-Osiguwa S A, Fraser L R, 1996. Evidence for Ca2+-dependent ATPase activity, stimulated by decapacitation factor and calmodulin, in mouse sperm. Molecular Reproduction & Development, 44(1): 111–120 |
| Adoyo P A, Lea I A, Richardson R T, et al, 1997. Sequence and characterization of the sperm protein Sp17 from the baboon. Molecular Reproduction and Development, 47(1): 66–71 DOI:10.1002/(ISSN)1098-2795 |
| Barnes J A, Gomes A V, 1995. Pest sequences in calmodulin-binding proteins. Molecular and Cellular Biochemistry, 149-150(1): 17–27 DOI:10.1007/BF01076559 |
| Bendtsen J D, Nielsen H, Von Heijne G, et al, 2004. Improved prediction of signal peptides:SignalP 3.0. Journal of Molecular Biology, 340(4): 783–795 DOI:10.1016/j.jmb.2004.05.028 |
| Cheney R E, Mooseker M S, 1992. Unconventional myosins. Current Opinion in Cell Biology, 4(1): 27–35 DOI:10.1016/0955-0674(92)90055-H |
| Courtot A M J, Feinberg J M, Schoevaert D A, et al, 1994. Calmodulin during human sperm incorporation into hamster oocyte:an immunogold electron microscope study. Molecular Reproduction and Development, 38(2): 170–177 DOI:10.1002/(ISSN)1098-2795 |
| De Castro E, Sigrist C J A, Gattiker A, et al, 2006. Scanprosite:detection of PROSITE signature matches and ProRule-associated functional and structural residues in proteins. Nucleic Acids Research, 34(S2): W362–W365 |
| De Jong A, Buchli R, Robbins D, 2002. Characterization of sperm protein 17 in human somatic and neoplastic tissue. Cancer Letters, 186(2): 201–209 DOI:10.1016/S0304-3835(02)00350-6 |
| Deloulme J C, Prichard L, Delattre O, et al, 1997. The prooncoprotein EWS binds calmodulin and is phosphorylated by protein kinase C through an IQ domain. Journal of Biological Chemistry, 272(43): 27369–27377 DOI:10.1074/jbc.272.43.27369 |
| Frayne J, Hall L, 2002. A re-evaluation of sperm protein 17 (Sp17) indicates a regulatory role in an A-kinase anchoring protein complex, rather than a unique role in sperm-zona pellucida binding. Reproduction, 124(6): 767–774 DOI:10.1530/rep.0.1240767 |
| Gasteiger E, Gattiker A, Hoogland C, et al, 2003. Expasy:the proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research, 31(13): 3784–3788 DOI:10.1093/nar/gkg563 |
| Geourjon C, Deléage G, Roux B, 1991. Antheprot:an interactive graphics software for analyzing protein structures from sequences. Journal of Molecular Graphics, 9(3): 188–190 DOI:10.1016/0263-7855(91)80008-N |
| Gerendasy D D, Herron S R, Jennings P A, et al, 1995. Calmodulin stabilizes an amphiphilic α-helix within Rc3/Neurogranin and Gap-43/Neuromodulin only when Ca2+ is absent. Journal of Biological Chemistry, 270(12): 6741–6750 DOI:10.1074/jbc.270.12.6741 |
| Grizzi F, Chiriva-internati M, Franceschini B, et al, 2004. Sperm protein 17 is expressed in human somatic ciliated epithelia. Journal of Histochemistry and Cytochemistry, 52(4): 549–554 DOI:10.1177/002215540405200414 |
| Jones H P, Bradford M M, McRorie R A, et al, 1978. High levels of a calcium-dependent modulator protein in spermatozoa and its similarity to brain modulator protein. Biochemical and Biophysical Research Communications, 82(4): 1264–1272 DOI:10.1016/0006-291X(78)90324-8 |
| Kong M, Richardson R T, Widgren E E, et al, 1995. Sequence and localization of the mouse sperm autoantigenic protein, Sp17. Biology of Reproduction, 53(3): 579–590 DOI:10.1095/biolreprod53.3.579 |
| Lea I A, Adoyo P, O'Rand M G, 1997. Autoimmunogenicity of the human sperm protein Sp17 in vasectomized men and identification of linear B cell epitopes. Fertility and Sterility, 67(2): 355–361 DOI:10.1016/S0015-0282(97)81923-1 |
| Lea I A, Widgren E E, O'Rand M G, 2004. Association of sperm protein 17 with a-kinase anchoring protein 3 in flagella. Reproductive Biology and Endocrinology, 2: 57 DOI:10.1186/1477-7827-2-57 |
| Manjunath P, Chandonnet L, Baillargeon L, et al, 1993. Calmodulin-binding proteins in bovine semen. Journal of the Society for Reproduction and Fertility, 97(1): 75–81 DOI:10.1530/jrf.0.0970075 |
| Moriya M, Katagiri C, Yagi K, 1993. Immuno-electron microscopic localization of calmodulin and calmodulin-binding proteins in the mouse germ cells during spermatogenesis and maturation. Cell and Tissue Research, 271(3): 441–451 DOI:10.1007/BF02913726 |
| Rechsteiner M, Rogers S W, 1996. PEST sequences and regulation by proteolysis. Trends in Biochemical Sciences, 21(7): 267–271 DOI:10.1016/S0968-0004(96)10031-1 |
| Richardson R T, Yamasaki N, O'Rand M G, 1994. Sequence of a rabbit sperm zona pellucida binding protein and localization during the acrosome reaction. Developmental Biology, 165(2): 688–701 DOI:10.1006/dbio.1994.1285 |
| Ronquist F, Huelsenbeck J P, 2003. Mrbayes 3:Bayesian phylogenetic inference under mixed models. Bioinformatics, 19(12): 1572–1574 DOI:10.1093/bioinformatics/btg180 |
| Tash J S, 1989. Protein phosphorylation:the second messenger signal transducer of flagellar motility. Cell Motility and the Cytoskeleton, 14(3): 332–339 DOI:10.1002/(ISSN)1097-0169 |
| Taylor S S, Buechler J A, Yonemoto W, 1990. Camp-dependent protein kinase:framework for a diverse family of regulatory enzymes. Annual Review of Biochemistry, 59(1): 971–1005 DOI:10.1146/annurev.bi.59.070190.004543 |
| Thompson J D, Gibson T J, Plewniak F, et al, 1997. The Clustal_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 25(24): 4876–4882 DOI:10.1093/nar/25.24.4876 |
| Trejo R, Delhumeau G, 1997. Calmodulin content, Ca2+-dependent calmodulin binding proteins, and testis growth:identification of Ca2+-dependent calmodulin binding proteins in primary spermatocytes. Molecular Reproduction & Development, 48(1): 127–136 |
| Wasco W M, Kincaid R L, Orr G A, 1989. Identification and characterization of calmodulin-binding proteins in mammalian sperm flagella. Journal of Biological Chemistry, 264(9): 5104–5111 |
| Xie X, Harrison D H, Schlichting I, et al, 1994. Structure of the regulatory domain of scallop myosin at 2.8 Ä resolution. Nature, 368(6469): 306–312 DOI:10.1038/368306a0 |
| Zaneveld L J, De Jonge C J, Anderson R A, et al, 1991. Human sperm capacitation and the acrosome reaction. Human Reproduction, 6(9): 1265–1274 DOI:10.1093/oxfordjournals.humrep.a137524 |
 2017, Vol. 48
2017, Vol. 48


