中国海洋湖沼学会主办。
文章信息
- 明庭红, 初双双, 苏倡, 刘艳, 司开学, 张迪骏, 王朝阳, 周君, 芦晨阳, 苏秀榕. 2017.
- MING Ting-Hong, CHU Shuang-Shuang, SU Chang, LIU Yan, SI Kai-Xue, ZHANG Di-Jun, WANG Zhao-Yang, ZHOU Jun, LU Chen-Yang, SU Xiu-Rong. 2017.
- 缢蛏(Sinonovacula constricta)重组Fe-铁蛋白和Mn-铁蛋白的性质解析
- RECOMBINANT FE-FERRITIN AND MN-FERRITIN FROM CHINESE RAZOR CLAM SINONOVACULA CONSTRICTA
- 海洋与湖沼, 48(5): 1052-1059
- Oceanologia et Limnologia Sinica, 48(5): 1052-1059.
- http://dx.doi.org/10.11693/hyhz20170400103
-
文章历史
- 收稿日期:2017-04-28
- 收修改稿日期:2017-05-29
2. 宁波职业技术学院 宁波 315800
2. Ningbo Vocational and Technical College, Ningbo 315800, China
缢蛏(Sinonovacula constricta)俗称蛏子、海蛏, 属软体动物门(Mollusca)、双壳纲(Bivalvia)、异齿亚纲(Heterodonta)、帘蛤目(Veneroida)、竹蛏科(Solcnidoe)、缢蛏属(Sinonovacula)广泛分布于中国、日本和朝鲜等国的沿海地区。缢蛏营养丰富, 味道鲜美, 是一种高蛋白、低脂肪、低热量的海洋健康水产品(Li et al, 2011; Niu et al, 2012; Tran et al, 2015)。同时, 其对重金属污染的耐受能力也得到广泛关注, 研究表明这与其体内的铁结合蛋白密切相关(Andrews et al, 1992)。
铁结合蛋白(ferritin)简称铁蛋白, 最早于1937年从脊椎动物马的脾脏中纯化分离出来, 是一类广泛存在于动物、植物和微生物中, 由24个亚基组成的450kDa巨大复合体(杜莉利等, 2008; 贺静静等, 2009)。外形结构呈笼子状球形, 由蛋白壳和铁核两部分组成(Crichton et al, 2010), 具有耐稀酸(pH 2.1)、耐稀碱(pH 12.1) 和较高温度(70—75℃)不变性等特点(王群力等, 2004)。
近年来, 鉴于铁蛋白具有良好的抗逆性, 目前对其应用的研究也越来越多, 包括抗肿瘤、磁性材料、电化学传感器、环境治理等多个方面。Martin等(2008)研究发现, 脑组织和肿瘤组织内铁蛋白等含铁磁性物质的变化是肿瘤和神经性疾病的重要诊断标记。Guertin等(2007)对马脾铁蛋白的磁学性质进行了深入研究, 为其在磁共振成像方面的应用打下基础。Abbaspour等(2012)利用去铁铁蛋白构建了一种检测单核苷酸多态性的电化学传感器。王群力等(2004)利用铁蛋白建立了一系列捕获环境中有机磷农药的系统。Li等(2012)的研究发现浙江枝吻纽虫的重组铁结合蛋白具有富集二价重金属离子Cd2+、Pb2+和Fe2+的能力。本研究通过缢蛏重组铁蛋白富集Fe3+和Mn2+制得Fe-铁蛋白和Mn-铁蛋白, 利用扫描电镜和X射线能量色散能谱仪研究铁蛋白形貌和金属元素能量的变化, 并结合MALDI TOF/TOF对Fe-铁蛋白和Mn-铁蛋白肽段进行了肽谱分析, 通过综合物性测量系统探究了两种重组蛋白纳米颗粒的磁学性质。最后比较了Fe-铁蛋白和Mn-铁蛋白与空白组在富集Hg2+、AsO43-和Cd2+三种重金属离子方面能力的差异。
1 材料与方法 1.1 材料缢蛏重组铁蛋白(Sinonovacula constricta ferritin, ScFER), 通过体外表达、纯化方法制备(0.1mg/mL)。氯化铁(FeCl3)、氯化锰(MnCl2)、氯化镉(CdCl2)、氯化汞(HgCl2)、砷酸钠(Na3AsO4)均为分析纯, 购于国药集团上海化学试剂有限公司。BCA总蛋白浓度测定试剂盒购于南京建成有限公司。
1.2 方法 1.2.1 Fe-铁蛋白和Mn-铁蛋白的制备将复性后的缢蛏重组铁蛋白利用透析装置分别在浓度为1mmol/L的FeCl3、MnCl2和CdCl2溶液中透析12h, 然后分别在0.1mol/L的PBS溶液中透析12h, 以除去未被吸附的Fe3+、Mn2+和Cd2+。反应过程中磁力搅拌, 并每隔4h更换一次溶液。富集处理完成后置于4℃保存备用。
1.2.2 蛋白表面形貌观察及能谱检测取富集Fe3+、Mn2+和Cd2+的铁蛋白溶液10 μL, 分别滴在干净的云母片上, 自然干燥后用导电胶将一面粘牢在样品台上, 放入真空蒸发仪中喷金处理, 置于扫描电子显微镜和X射线能量色散能谱仪(S-3400N, SU-70, 东京, 日本)对各处理组蛋白的结构和元素进行定性分析。能谱仪采用Si(Li)固体探头, 探头距离40mm, 样品倾斜30°, 工作距离21mm, 分析时间100s。
1.2.3 蛋白肽分子量的测定取20 μL蛋白溶液, 用终浓度10mmol/L二硫苏糖醇(DTT), 37℃反应1h, 终浓度25mmol/L吲哚-3-乙酸(IAA), 37℃避光反应0.5h, 按酶:蛋白为1:50比例加入胰蛋白酶酶, 酶解过夜, C18除盐冻干。样品用200 μL 50%乙腈, 0.1%三氟乙酸(TFA)溶解, 取出10 μL, 加30 μL 50%乙腈, 0.1% TFA。取1 μL点样在靶板上, 再点1 μL α-氰基-4-羟基肉桂酸(CHCA)基质。利用MALDI-TOF-TOF(AB SCIEX)仪器通过肽质量指纹法(Peptide Mass Fingerprint, PMF)和肽碎片离子鉴定法对肽分子量进行测定(杨倩等, 2015)。
1.2.4 蛋白磁性强度的测定取重组Fe-铁蛋白和Mn-铁蛋白10mL分装于离心管中, 封口后放入冷冻干燥机(ALPHA 1-2LD plus, Christ, Osterode, 德国)内冻干。取冻干的蛋白粉末1mg左右放入综合物性测量系统(PPMS, Quantum Design, San Diego, 美国), 设定外加磁场为3T, 温度为300K进行磁性强度测量。
1.2.5 蛋白富集重金属能力的测定将重组Fe-铁蛋白和Mn-铁蛋白利用透析装置分别在浓度为1mM的CdCl2溶液、HgCl2溶液和Na3AsO4溶液中透析12h, 然后分别在0.1mol/L的PBS溶液中透析12h, 以除去未被吸附的Cd2+、Hg2+和AsO43-, 并设置缢蛏重组铁蛋白为对照组。反应过程中磁力搅拌器, 并每隔4h更换一次溶液。富集处理完成后各取0.1mL, 加入5%的稀硝酸, 摇动使样品分散, 然后装入微波消解系统(MARS, CEM, Boston, 美国)中进行微波消解, 采用电感耦合等离子体质谱仪(X SeriesⅡ, Thermo Fisher scientific, New York, 中国)分析测定富集的重金属含量。
2 结果与分析 2.1 重组Fe-铁蛋白和Mn-铁蛋白形貌特征从图 1(S1)可以看出实验制备得到的缢蛏重组铁蛋白聚集体为球状, 蛋白团之间相互分离, 聚集体直径在1 μm左右, 与标准马脾铁蛋白形状和大小相似。Fe-铁蛋白和Mn-铁蛋白富集Cd2+之后, 蛋白聚集体的表面形貌发生了明显变化。Fe-铁蛋白与空白组相比, 蛋白球体直径增加, 且球体之间出现粘连(图 1, S2)。Mn-铁蛋白组表面形貌变化更加明显, 由原来的蛋白球体变为花团状, 且直径明显增大(图 1, S3)。富集Cd2+后基本为小圆球状单体或聚集体(图 1, S4)。Fe-铁蛋白富集Cd2+后蛋白聚集体表现为小圆球聚集体(图 1, S5)。Mn-铁蛋白Cd2+富集组呈现出花团状球体花瓣散落, 中间还夹杂着数个小圆球的状态(图 1, S6)。
 |
| 图 1 Fe-铁蛋白和Mn-铁蛋白的扫描电镜图 Fig. 1 SEM images of different ferritin treatment groups 注: S1: ScFER空白组; S2: Mn-ScFER组; S3: Fe-ScFER组; S4: Cd-ScFER组; S5: Fe-ScFER富集Cd2+组; S6: Mn-ScFER富集Cd2+组 |
Fe-铁蛋白富集Cd2+后蛋白聚集体由原来均匀分散的小圆球变为聚集成堆的圆球体。推测Fe-铁蛋白在富集Cd2+的同时也受到了Cd2+的影响, 蛋白之间发生聚集。Mn-铁蛋白富集Cd2+后抑制了Mn-铁蛋白聚集体形成花球, 使局部产生片层花瓣。小圆球聚集体边缘模糊, 呈粘连状。不同金属离子对铁蛋白的折叠具有不同的作用, 从而产生不同的表面形貌。
2.2 蛋白的能谱分析利用X射线色散能谱仪(EDS)检测发现:空白组检测出Si、Na、K、Cl、C、N、O、P等8种元素(图 2, S1)。其中Si、Na、K、Cl等元素可能来自于云母片; C、N、O、P等元素可能来自于铁蛋白, 这四种元素是蛋白质的重要组成元素, 未检测出铁、锰和镉三种金属元素。Fe-铁蛋白、Mn-铁蛋白和Cd-铁蛋白均检测出了相应的金属元素, 说明ScFER具有富集Fe3+、Mn2+和Cd2+三种金属离子的能力。同时, 在Fe-铁蛋白富集Cd2+组和Mn-铁蛋白富集Cd2+组中均检测出了铁、镉和锰、镉两种元素, 说明Fe-铁蛋白和Mn-铁蛋白也具有富集Cd2+的功能。
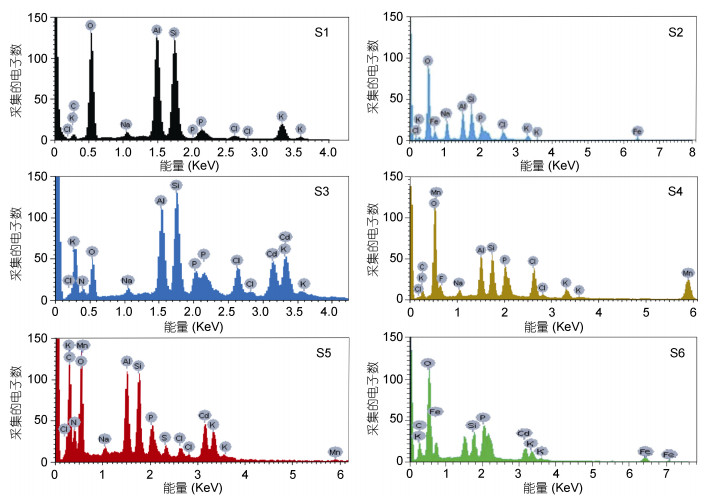 |
| 图 2 铁蛋白富集不同重金属的能谱图 Fig. 2 EDS of ferritins after heavy metals treatments for different groups 注: S1: ScFER空白组; S2: Fe-ScFER组; S3: Cd-ScFER组; S4: Mn-ScFER组; S5: Mn-ScFER富集Cd2+组; S6: Fe-ScFER富集Cd2+组 |
比较各金属离子富集组能谱图发现: Fe3+在0.8keV和6.4keV两处出峰, Mn2+在0.6keV和5.9keV两处出峰, Cd2+在3.1keV和3.3keV两处出峰, 三种金属在不同的激发能级均有出峰, 说明铁蛋白在富集Fe3+、Mn2+和Cd2+三种金属离子的过程中, 金属离子发生得失电子, 从而在能谱图表现出不同的能量级(图 2)。Fe-铁蛋白组富集Cd2+后除在Fe3+检测到0.8keV和6.4keV两处出峰外, 在7.1keV也检测到铁元素。推测铁蛋白在富集Fe3+和Cd2+两种混合金属过程中发生了独特的的化学反应, 从而使铁元素出现新的能量态。
2.3 肽谱分子量利用MALDI TOF/TOF质谱系统对重组Fe-铁蛋白和Mn-铁蛋白胰蛋白酶酶解后的肽段进行检测分析发现:缢蛏重组铁蛋白的肽段在655Da处出现高强度单一峰, 在1.26kDa、1.48kDa、1.81kDa等处出现较小的峰, 这与Peptide Cutter网站预测胰蛋白酶切肽段分子量基本相符。Fe-铁蛋白的肽谱图在655Da处也出现高强度峰与空白组一致, 同时在高分子量段1.32kDa、1.88kDa、1.93kDa等处出现特征峰, 可能与铁蛋白富集Fe3+后肽段分子量发生变化有关(图 3)。Mn-铁蛋白也在655Da处有峰但强度较低, 推测此肽段为铁蛋白一段保守序列, 其肽段的氨基酸序列为DDVALK, 这可能与其富集金属离子的性质无关。Mn-铁蛋白在1.26kDa、1.47kDa、1.53kDa和1.76kDa等处出现特征峰, 且峰强度较高。
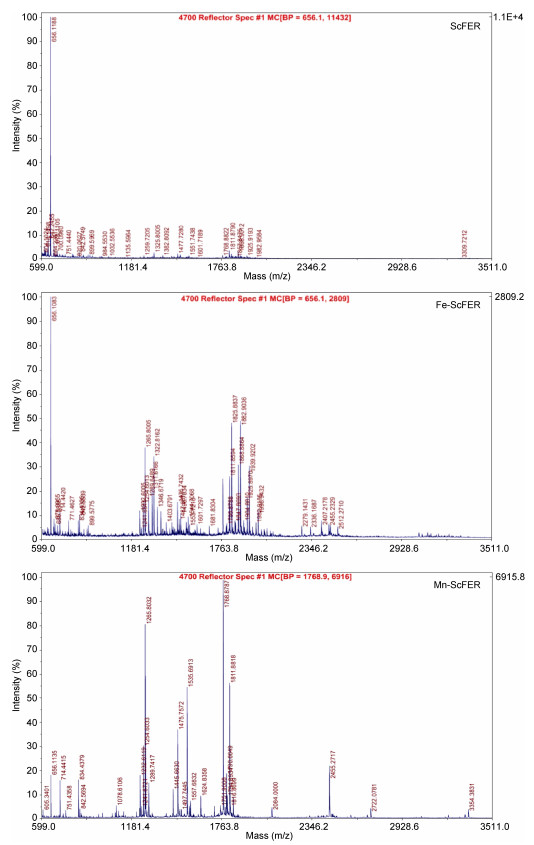 |
| 图 3 Fe-铁蛋白和Mn-铁蛋白的肽谱图 Fig. 3 Peptide mass charts of different ferritin treatment groups |
由图 3可知, Fe-铁蛋白的肽谱图与空白组相比, 除了共有的655Da处的峰外, 在1000—2000Da分子量段出峰明显, 推测为铁蛋白与Fe3+结合所致。根据Fe-铁蛋白的肽段位移推测, 铁蛋白在与Fe3+结合过程中, 肽谱图中1.32kDa、1.88kDa、1.93kDa等处出现的特征峰为其Fe3+结合肽段。同理推测Mn-铁蛋白肽谱图中的1.26kDa、1.47kDa、1.53kDa和1.76kDa等高强度峰为其与Mn2+结合的特征肽段。对比Fe-铁蛋白的肽谱图与Mn-铁蛋白肽谱图可见, 两者在655Da、713Da、1.26kDa等处都出现肽段峰, 推测为铁蛋白在富集Fe3+和Mn2+时均发挥作用的功能肽段。
2.4 蛋白的磁性强度分析利用综合物性测量系统对重组Fe-铁蛋白和Mn-铁蛋白纳米颗粒磁性强度进行检测。图 4中S1为铁蛋白空白组在室温300K, 外加磁场3T下的磁滞回线。如图所示磁滞回线为一条过原点的直线, 呈顺磁特征, 与田兰香等(2010)的研究结果相吻合, 研究发现马脾铁蛋白在室温300K时, 蛋白颗粒呈典型的顺磁特征(Pead et al, 1995)。图 4中S2和S3为重组Fe-铁蛋白和Mn-铁蛋白粒的磁滞回线, 磁滞回线形状与铁蛋白空白组基本相同, 但在相同的外加磁场下, 蛋白颗粒所呈现出的磁场强度明显高于空白组。这可能是由于铁蛋白在富集Fe3+和Mn2+这两种磁性金属时, 形成了某些金属氧化物, 从而增加了蛋白颗粒的磁性强度。
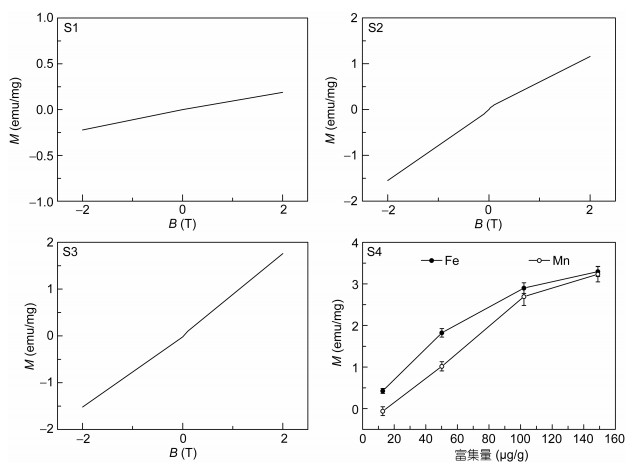 |
| 图 4 Fe-铁蛋白和Mn-铁蛋白的磁滞回线 Fig. 4 Hysteresis loops of different ferritin treatment groups 注: S1: ScFER空白组; S2: Fe-ScFER组; S3: Mn-ScFER组; S4: ScFER在3T下磁性强度随铁锰富集量的变化曲线 |
随着Fe3+和Mn2+富集量的增加, 铁蛋白颗粒磁性强度明显上升, 但当富集量超过100×10-6左右后, 磁性强度增加的幅度减缓(图 4, S4), 可能是因为缢蛏重组铁蛋白催化氧化铁锰两种磁性金属形成氧化物的能力达到了最大限度, 同时铁核的空间也是受限的, Yamashita等(2010)就是利用脱铁铁蛋白空腔的空间限制来控制磁性颗粒的大小。
2.5 蛋白富集重金属量的能力重组Fe-铁蛋白对Hg2+、AsO43-和Cd2+三种重金属的富集能力是铁蛋白空白组的2.4倍、1.7倍和3.7倍(图 5), 这可能是Fe3+对铁蛋白富集重金属的过程起到了促进作用, Ebrahimi等(2013)研究发现铁核内充满Fe3+时会加速金属离子的氧化速率。铁蛋白除了能够富集Fe3+以外, 还能富集许多其他的重金属离子, 这与铁蛋白表面富集重金属的非特异性基团有关, 特异性基团的种类和数量, 以及基团与不同重金属的结合能力都有可能导致铁蛋白对金属的富集能力差异(Yamashita et al, 2010)。由图 5可以看出, 重组Mn-铁蛋白对Hg2+、AsO43-和Cd2+三种重金属在相同条件下的富集能力不同, 分别为铁蛋白空白组的1.8倍、3.0倍和4.6倍。这可能与铁蛋白在富集Mn2+后形成的花团状蛋白聚集体有关, 白德奎等(2010)研究了这种花团状锰氧化物对重金属砷的吸附动力学。
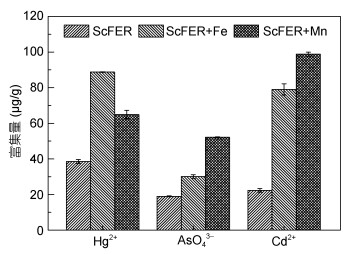 |
| 图 5 Fe-铁蛋白和Mn-铁蛋白对Hg2+、AsO43-和Cd2+的富集差异 Fig. 5 Contents of Hg2+, AsO43-, and Cd2+ in different ferritin treatment groups |
缢蛏重组铁蛋白与马脾标准铁蛋白相比内部没有铁核, 可以更大程度富集Fe3+和Mn2+形成重组Fe-铁蛋白和Mn-铁蛋白。其蛋白聚集体在表面形貌方面与铁蛋白空白组相比发生了明显变化。铁蛋白与金属离子结合的配体和其他氨基酸侧链间存在着相互作用力, 如疏水键、氢键、静电作用和范德华力等(Li et al, 2011), 可能构成蛋白壳的亚基数目, 蛋白壳厚度等的变化。不同金属离子对铁蛋白的折叠具有不同的影响导致其产生不同的表面形貌(Hilton et al, 2012)。Fe-铁蛋白变为直径增大的圆球体, Mn-铁蛋白变为花团状球体, 与Chen等(2015)的研究结果相符合。重组铁蛋白对于Fe3+的储存包括Fe3+的迁移和铁芯矿物的成核和生长, 而重组铁蛋白与Mn2+的相互作用更为复杂, 比较Mn-铁蛋白的表面形貌和XRD结果发现形成的花团状球体为一种生物锰氧化物, 并且其结构近似于水钠锰矿的结晶(Mayanna et al, 2015)。
研究发现重组Fe-铁蛋白和Mn-铁蛋白具有顺铁磁性和富集重金属的功能, 并且其对于重金属Hg2+、AsO43-和Cd2+的富集能力明显高于重组铁蛋白。已有研究表明天然形成的铁氧化物和锰氧化物是重金属离子非常有效的清除剂, 锰氧化细菌(MOB)形成的生物锰氧化物可以有效的吸附Ba2+、Ni2+、Co2+、Cd2+等重金属离子(Mayanna et al, 2015), 其吸附方式为表面吸附, 并且锰氧化物表面电荷的多少也会明显影响吸附效果(Feng et al, 2007)。Mn-铁蛋白的花团状多层结构极大的增加了铁蛋白的比表面积, 有效增强了富集重金属离子的功能。Fe-铁蛋白对于重金属离子的富集主要是与铁蛋白内部的空腔有关。有研究表明, 磷酸可以促进Fe3+进入铁核内, 而当铁核内充满Fe3+时会加速金属离子的氧化速率。铁蛋白的3倍通道表现出柔性结构, 可以允许各种金属离子进出(Bou-Abdallah, 2010)。重组铁蛋白的内部空腔结构为重金属离子的富集提供了空间, 无核铁蛋白捕获重金属离子的机制非常复杂, 位点包括蛋白壳的内外表面、三相和二相隧道及铁核表面和深层, 同一结合位点可以结合不同的金属离子, 而同一金属离子也可以结合不同的位点, 但结合能力存在差异(Treffry et al, 1984)。因此, 通过制备无定形铁氧化物也可以实现对重金属砷的吸附(Youngran et al, 2007)。
重组Fe-铁蛋白和Mn-铁蛋白与铁蛋白相似均呈现顺次特征, 与Cao等(2010)制备的重组人铁蛋白超顺磁性纳米颗粒表现出相同的磁性特征。但相同磁场下Fe-铁蛋白和Mn-铁蛋白的磁性强度是空白组10倍左右, 并且在3T外加磁场下的磁性强度大小与Fe3+和Mn2+富集量有关。磁性纳米颗粒可以作一种重金属离子吸附剂, Xie等(2015)的研究发现磁性四氧化三铁复合纳米颗粒微球(CS/XOREC-Fe3O4)可以实现对Cu2+和Cd2+自发的的吸附, 且符合Langmuir吸附模型, Yue等(2011)利用磁性铁锰氧化物实现了对Pb2+和Cu2+的自发吸附。
4 结论本文通过比较Fe-铁蛋白和Mn-铁蛋白与空白组在富集Hg2+、AsO43-和Cd2+三种重金属离子方面能力的差异, 发现Fe-铁蛋白对这三种重金属的富集能力分别为空白组的2.4倍、1.7倍和3.7倍, Mn-铁蛋白对它们在相同条件下的富集能力也有明显提高。本研究结果表明, 磁性纳米材料在重金属离子的吸附方面有着巨大的优势。重组Fe-铁蛋白和Mn-铁蛋白由于其独特的顺铁磁性和良好的重金属富集能力, 将在重金属污染治理与检测方面发挥效用。
| 王群力, 孔波, 黄河清, 2004. 铁蛋白纳米蛋白壳结构与功能研究新进展. 化学进展, 16(4): 516–519 |
| 田兰香, 曹长乾, 刘青松, 等, 2010. 马脾铁蛋白磁性纳米颗粒的低温磁学性质研究. 科学通报, 55(23): 2312–2320 |
| 白德奎, 朱霞萍, 王艳艳, 等, 2010. 氧化锰、氧化铁、氧化铝对砷(Ⅲ)的吸附行为研究. 岩矿测试, 29(1): 55–60 |
| 杜莉利, 李太武, 苏秀榕, 等, 2008. 可口革囊星虫(Phascoloma esculenta)铁结合蛋白基因的研究. 海洋与湖沼, 39(3): 252–256 |
| 杨倩, 王丹, 常丽丽, 等, 2015. 生物质谱技术研究进展及其在蛋白质组学中的应用. 中国农学通报, 31(1): 239–246 DOI:10.11924/j.issn.1000-6850.2014-0018 |
| 贺静静, 李晔, 李太武, 等, 2009. 泥蚶(Tegillarca granosa)cDNA文库的构建及铁结合蛋白基因(Ferritin)序列分析. 海洋与湖沼, 40(3): 289–295 DOI:10.11693/hyhz200903006006 |
| Abbaspour A, Noori A, 2012. Electrochemical detection of individual single nucleotide polymorphisms using monobase-modified apoferritin-encapsulated nanoparticles. Biosensors and Bioelectronics, 37(1): 11–18 DOI:10.1016/j.bios.2012.04.017 |
| Andrews S C, Harrison P M, Yewdall S J, et al, 1992. Structure, function, and evolution of ferritins. Journal of Inorganic Biochemistry, 47(1): 161–174 DOI:10.1016/0162-0134(92)84062-R |
| Bou-Abdallah F, 2010. The iron redox and hydrolysis chemistry of the ferritins. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(8): 719–731 DOI:10.1016/j.bbagen.2010.03.021 |
| Cao C Q, Tian L X, Liu Q S, et al, 2010. Magnetic characterization of noninteracting, randomly oriented, nanometer-scale ferrimagnetic particles. Journal of Geophysical Research:Solid Earth, 115(B7): B07103 |
| Chen L P, Zhou J, Zhang Y Y, et al, 2015. Preparation and representation of recombinant Mn-Ferritin flower-like spherical aggregates from marine invertebrates. PLoS One, 10(4): e0119427 DOI:10.1371/journal.pone.0119427 |
| Crichton R R, Declercq J P, 2010. X-ray structures of ferritins and related proteins. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(8): 706–718 DOI:10.1016/j.bbagen.2010.03.019 |
| Ebrahimi K H, Hagedoorn P L, Hagen W R, 2013. Phosphate accelerates displacement of Fe(Ⅲ) by Fe(Ⅱ) in the ferroxidase center of Pyrococcus furiosus ferritin. FEBS Letters, 587(2): 220–225 DOI:10.1016/j.febslet.2012.11.029 |
| Feng X H, Zhai L M, Tan W F, et al, 2007. Adsorption and redox reactions of heavy metals on synthesized Mn oxide minerals. Environmental Pollution, 147(2): 366–373 DOI:10.1016/j.envpol.2006.05.028 |
| Guertin R P, Harrison N, Zhou Z X, et al, 2007. Very high field magnetization and AC susceptibility of native horse spleen ferritin. Journal of Magnetism and Magnetic Materials, 308(1): 97–100 DOI:10.1016/j.jmmm.2006.05.010 |
| Hilton R J, Zhang B, Martineau L N, et al, 2012. Anion deposition into ferritin. Journal of Inorganic Biochemistry, 108: 8–14 DOI:10.1016/j.jinorgbio.2011.12.004 |
| Li C H, Li H, Su X R, et al, 2011. Identification and characterization of a clam ferritin from Sinonovacula constricta. Fish & Shellfish Immunology, 30(4-5): 1147–1151 |
| Li C H, Li Z, Li Y, et al, 2012. A ferritin from Dendrorhynchus zhejiangensis with heavy metals detoxification activity. PLoS One, 7(12): e51428 DOI:10.1371/journal.pone.0051428 |
| Martin W R W, Wieler M, Gee M, 2008. Midbrain iron content in early Parkinson disease:A potential biomarker of disease status. Neurology, 70(16): 1411–1417 |
| Mayanna S, Peacock C L, Schäffner F, et al, 2015. Biogenic precipitation of manganese oxides and enrichment of heavy metals at acidic soil pH. Chemical Geology, 402: 6–17 DOI:10.1016/j.chemgeo.2015.02.029 |
| Niu D H, Feng B B, Liu D B, et al, 2012. Significant genetic differentiation among ten populations of the razor clam Sinonovacula constricta along the coast of china revealed by a microsatellite analysis. Zoological Studies, 51(3): 406–414 |
| Pead S, Durrant E, Webb B, et al, 1995. Metal ion binding to apo, holo, and reconstituted horse spleen ferritin. Journal of Inorganic Biochemistry, 59(1): 15–27 DOI:10.1016/0162-0134(94)00050-K |
| Ren Y M, Li N, Feng J, et al, 2012. Adsorption of Pb(Ⅱ) and Cu(Ⅱ) from aqueous solution on magnetic porous ferrospinel MnFe2O4. Journal of Colloid and Interface Science, 367(1): 415–421 DOI:10.1016/j.jcis.2011.10.022 |
| Tran T N, Niu D H, Nguyen H D, et al, 2015. Populations genetic structure of the razor clam Sinonovacula constricta from China, Korea and Vietnam. Biochemical Systematics and Ecology, 61: 429–436 DOI:10.1016/j.bse.2015.07.020 |
| Treffry A, Harrison P M, 1984. Spectroscopic studies on the binding of Iron, Terbium, and Zinc by Apoferritin. Journal of Inorganic Biochemistry, 21(1): 9–20 DOI:10.1016/0162-0134(84)85035-7 |
| Xie M J, Zeng L X, Zhang Q Y, et al, 2015. Synthesis and adsorption behavior of magnetic microspheres based on chitosan/organic rectorite for low-concentration heavy metal removal. Journal of Alloys and Compounds, 647: 892–905 DOI:10.1016/j.jallcom.2015.06.065 |
| Yamashita I, Iwahori K, Kumagai S, 2010. Ferritin in the field of nanodevices. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(8): 846–857 DOI:10.1016/j.bbagen.2010.03.005 |
| Youngran J, Maohong F A N, Van Leeuwen J, et al, 2007. Effect of competing solutes on arsenic (Ⅴ) adsorption using iron and aluminum oxides. Journal of Environmental Sciences, 19(8): 910–919 DOI:10.1016/S1001-0742(07)60151-X |
| Yue Y, Liu P, Zhang Z, et al, 2011. Approaching the theoretical elastic strain limit in copper nanowires. Nano Letters, 11(8): 3151–3155 DOI:10.1021/nl201233u |
 2017, Vol. 48
2017, Vol. 48


